《1.引言》
1.引言
基于细胞球的体外组织模型在组织工程、再生医学以及药物筛选等领域得到了越来越广泛的应用[1–4]。细胞球是一种细胞三维聚集结构,直径从几十到几百微米不等。大量研究表明,与传统二维细胞培养相比,三维细胞球能够更好地模拟体内多种细胞(如MCF-7乳腺癌细胞)的三维微环境,获得与在体更为接近的响应结果[5,6]。而且,与三维支架方法相比,细胞球不需要支架材料,从而避免了可能存在的支架材料生物相容性问题[7]。不同种类的细胞均可形成细胞球,包括正常细胞[8,9]、癌细胞[10,11]和干细胞[12,13],以及这些细胞的混合体系[14,15]。近年来,体外组织模型(如细胞球)和芯片培养技术的结合与发展吸引了众多研究者的关注,有可能极大地促进生物医学的发展[16–18]。
构建细胞球有多种方法,大多基于流动细胞的自组装特性[19],如基于细胞非黏附表面的平板法[20],基于重力的悬挂液滴法[21],基于磁力的磁悬浮法[22]等。其中,微孔板法因其操作简单、实现起来较为容易的优势,得到了广泛的应用。并且,细胞球微孔板作为组织芯片的一部分,可与微流控技术相结合,具备高通量制备体外三维组织的能力,能为高通量药物筛选提供更为便捷的手段。微孔板法的基本原理是利用微孔结构的空间约束和微孔板材料的细胞非黏附特性,促进细胞在生长过程中通过细胞之间的黏附力聚集成球[11]。制备微孔板常用的方法是采用硅或金属材料作为模板,通过倒模形成聚二甲基硅氧烷(polydimethylsiloxane,PDMS)微孔板。但是,硅和金属模具加工过程较为复杂,成本也较高,并且每次使用后清洗困难,重复使用效果差。近些年来,基于琼脂糖、海藻酸盐以及聚乙二醇(polyethylene glycol,PEG)水凝胶的微孔板在细胞球培养方面得到了发展。目前水凝胶微孔板中微孔结构多半是圆柱状,底面为平面,形成的细胞球的尺寸和形状差异较大。研究表明,凹状微孔(如凹面微孔)能够更好地促进细胞聚集生长后形成尺寸均一、形状规则的细胞球[23,24]。但是,仍缺少一种有效的在水凝胶表面构建凹面微孔的方法;并且,目前研究都是在构建微孔板后再人为种植细胞,存在效率低、种植细胞密度不均匀以及培养成球过程中细胞容易流失等问题[25]。
为了克服上述现有方法的缺点,本研究提出一种基于细胞打印和微孔板芯片的细胞球原位构建方法,利用自行搭建的细胞打印平台,在疏水基底上打印形状和尺寸可控的载细胞微凝胶阵列作为模板,在另一种水凝胶芯片上构建凹面微孔阵列并原位形成细胞球。该方法操作灵活、成形效果好、适用范围广,在生物医学领域具有很大的发展潜力和应用前景。
《2.材料和方法》
2.材料和方法
《2.1细胞打印平台的搭建》
2.1细胞打印平台的搭建
为了得到高度可控的明胶液滴,我们参考Moon等的方法搭建了气动式电磁阀喷头生物打印平台,如图1所示。该平台由以下主要部件构成:三轴陶瓷电机驱动平台(其中X、Y轴型号为KDT180-100-LM,Z轴型号为MT105-50-LM;Feinmess Dresden GmbH,Dresden,Germany)、电磁阀喷头(Model G100-150300,TechElan,Mountainside,NJ,USA)、数字信号发生器(Agilent 81101A,Test Equipment Connection,LakeMary,FL,USA)和计算机。该平台的核心部件为数字信号发生器控制的电磁阀喷头和三轴陶瓷电机驱动平台,这两部分由计算机编程进行协调同步。电磁阀喷头最小喷射液滴为25nL,控制喷头的信号发生器产生的最小占空比可达到0.02%;喷头采用气动动力源,保证了细胞的活性;根据单个细胞的大小,理论上只要满足10μm以下的分辨率即可保证细胞打印的空间位置精度,我们选用的三轴陶瓷电机驱动平台的编码分辨率可达50nm,相对偏差约为2μm,可满足需求。
《图1》

图1.细胞打印平台。(a)细胞打印平台照片;(b)信号发生器脉宽为5ms时,在不同喷射气压下打印3%质量浓度明胶液滴体积变化曲线;(c)喷射气压为0.05MPa时,在不同信号发生器脉宽下打印3%质量浓度明胶液滴体积变化曲线。
《2.2利用细胞打印平台制备明胶阵列》
2.2利用细胞打印平台制备明胶阵列
选用明胶作为制备模板的牺牲材料,是因为其具有良好的生物兼容性和成形特性,可以随温度升高和降低而在溶胶态和凝胶态之间可逆变化。将明胶粉末材料(Gel strength 300, Type A, Sigma Aldrich, St.Louis, MO, USA)以3%的质量浓度添加至磷酸盐缓冲溶液(PBS)中,并在50°C下轻轻搅拌至完全溶解,水浴降温到37°C后转移至细胞打印平台的样品针筒中,最后将其打印到内表面贴有聚四氟乙烯(PTFE)薄膜的培养皿盖内,并立即在4°C低温处理5min使明胶交联固化。实验中采用疏水特性和化学惰性较好的PTFE薄膜作为接收基底有利于形成疏水角较大的明胶液滴。另外,打印过程中针筒和喷头温度始终保持在37°C左右,避免因明胶固化引起喷头堵塞。明胶阵列的尺寸可通过调节喷射气压和信号发生器的信号脉宽来调节。
《2.3利用明胶阵列作为模板构建水凝胶微孔板》
2.3利用明胶阵列作为模板构建水凝胶微孔板
采用聚乙二醇二甲基丙烯酸酯(PEG-DMA,MW1000,Polysciences,Inc.,Warrington,PA,USA)水凝胶作为构建微孔板的材料。基于PEG及其衍生物的水凝胶具有良好的生物相容性、易光交联特性以及细胞不黏附的特性,已被成功用来培养形成细胞球[26–28]。室温下将PEG-DMA以20%的质量浓度溶解在PBS缓冲液中,并添加0.1%的质量浓度的2-羟基-2-甲基苯丙酮(2-hydroxy-2-methylpropiophenone)(TCI, Shanghai DevelopmentCo.,Ltd., Shanghai, China)作为光引发剂。将溶液冷却至4°C后均匀覆盖在明胶阵列上,在波长为365nm、强度为2.9mW.cm–2的紫外光(Model XLE-1000 A/F, Spectroline, Westbury, NY, USA)下照射20s使其交联。最后将样品于37°C下放置24h使明胶阵列转化为溶胶,从而形成带有凹面微孔的PEG-DMA微孔板。
《2.4明胶阵列和微孔板的表征》
2.4明胶阵列和微孔板的表征
采用倒置荧光相差显微镜(Olympus IX 81,Olympus,Irvine,CA,USA)观察和获取明胶阵列和微孔板的正面图片和明胶阵列的侧面图片。为了获取微孔的截面图,首先将PEG-DMA微孔板置于PBS缓冲液中使其达到溶胀平衡,取出后用吸水纸将水凝胶表面多余的PBS小心吸除,然后用双面刀片将微孔切开后观察并获取照片,在Image-Pro Plus(IPP, version6.0, Media Cybernetics, SilverSpring, Rockville, MD, USA)中分析图像并计算明胶阵列和微孔的尺寸。
《2.5细胞球原位形成》
2.5细胞球原位形成
选择MCF-7人体乳腺癌细胞验证该方法原位构建细胞球的能力,使用10%的胎牛血清(Gibco,Big Cabin,OK,USA)的RPMI1640培养基(Hyclone,South Logan,UT,USA),在5%CO2和37°C培养箱环境中培养细胞。实验前,使用胰酶(EDTA 1×,Mediatech,Inc.Manassas,VA,USA)将细胞消化后,离心去掉上清液,添加新的培养基制成细胞悬液。在37°C条件下,将细胞悬液与明胶溶液混合制成细胞浓度为5×105~1×106个.mL–1的溶液。按第2.2节和第2.3节所述的方法,利用细胞打印平台制备载细胞的明胶阵列并通过倒模制备PEG-DMA微孔板。培养1h后去掉培养皿盖,每天更换培养基。最后在培养箱中37°C下明胶转化为溶胶态后,细胞沉积到PEG-DMA凹面微孔底部,聚集、生长、增殖,逐渐形成细胞球。在此过程中,利用IX 81显微镜获取细胞相差图片,并使用钙黄绿素乙酰甲酯和双嵌入剂乙锭均二聚物(LIVE/DEAD® Viability/Cytotoxicity Kit,for mammalian cells, Invitrogen, Washington, DC, USA)试剂盒进行细胞染色后,利用共聚焦荧光显微镜(LSM700, ZEISS, NewYork, NY, USA)获取切片图片。通过IPP软件对共聚焦图片进行分析并计算细胞球中细胞的成活率。
《3.结果和讨论》
3.结果和讨论
如图1(a)所示,我们自主搭建的细胞打印平台配备精密微型电磁阀,能够打印微小液滴,保证了打印样品的分辨率;纳米陶瓷驱动平台运动精度高,使液滴打印的位置精确可控。如图1(b)和(c)所示,该打印平台能够通过改变喷头的喷射压力和信号发生器信号脉宽在纳升水平调控打印液滴的体积。明胶溶胶具有一定的黏性,这与温度和浓度均有密切关系。实验发现,在37°C下,明胶的最适宜打印质量浓度为3%。低于该浓度,明胶液滴在固化之后的机械强度不足,倒模过程中变形较严重;高于该浓度,打印过程中容易发生喷头阻塞和积液现象。因此,后续实验均使用质量浓度为3%的明胶。
图2是以通过上述细胞打印平台制备载细胞的明胶阵列作为模板构建PEG-DMA微孔板及原位形成细胞的示意图。使用3%质量浓度的明胶,并通过改变信号脉宽,可以在贴有聚四氟乙烯薄膜的培养皿盖上获得不同大小的明胶阵列,图3(a)~(c)。倒模之后,获得了带有凹面微孔阵列的PEG-DMA微孔板,凹面微孔与明胶阵列尺寸结构基本相同的,如图3(d)~(f)。具体来说,当调控打印的明胶液滴体积在0.1~0.48μL变化时,可以得到与底面接触圆直径为420~530μm、液滴高度为230~550μm的不同大小的液滴(图3(g)),从而通过倒模后获得开口直径为480~530μm、孔深为250~550μm的凹面微孔。可以通过调节打印喷头的喷射气压和打印喷头方波控制信号的占空比调节液滴的体积。由于太高的喷射气压会造成包裹在明胶溶液中细胞的损伤,并可能使液滴接触基底时的冲击力太大而造成液滴变形,因此实际操作中采用能顺利喷射液滴的最小压力0.05MPa作为喷射气压,通过调节方波信号的占空比来调节液滴体积。
《图2》

图2.利用载细胞明胶液滴作为模板制备凹面微孔原位构建细胞球示意图。(a)在35mm培养皿盖内表面贴上疏水的聚四氟乙烯薄膜;(b)在聚四氟乙烯薄膜表面打印明胶和细胞的混合溶液;(c)包裹细胞的明胶液滴在4°C条件下固化;(d)将低温PEG-DMA溶液均匀覆盖在包裹细胞的固化明胶阵列上;(e)紫外交联PEG-DMA;(f)将样品翻转180°后在37°C下使明胶融化并释放细胞从而让细胞沉积;(g)培养过程中逐渐形成细胞球。
《图3》

图3.制备水凝胶凹面孔。(a)在聚四氟乙烯薄膜上打印的不同尺寸的明胶阵列;(b)明胶液滴阵列的俯视图;(c)两种尺寸的固化明胶液滴的侧视图;(d)在PEG-DMA水凝胶上制备的凹面微孔;(e)PEG-DMA水凝胶微孔的俯视图;(f)凹面微孔的截面图;(g)明胶阵列尺寸随明胶液滴体积变化图;(h)微孔尺寸随明胶液滴变化图。标尺:0.5mm。图(g)和(h)中的误差线代表五组样品的标准差。
为了证明该方法可以原位构建不同尺寸的细胞球,我们分别测试了基于0.48μL和0.23μL明胶液滴构建的不通同尺寸的微孔对MCF-7成球过程的影响。结果表明,在初始细胞浓度为1×106个.mL–1时,0.48μL组中的细胞在大约7天后形成紧密的细胞球,如图4(a)和(b)所示。但是在0.23μL组中,细胞聚集后即使在14天后也没有形成如0.48μL组所得到的紧密的细胞球,如图4(c)和(d)所示。图4(b)中所示的荧光染色图像中间存在无染色细胞的暗区,可能是紧实的细胞球限制了死/活细胞溶液的扩散。上述现象在图4(d)中未出现,其可能原因是0.23μL组中形成的细胞聚集成碟形,并没有形成紧密的三维球状结构。由图3(f)和(h)可知,利用0.23μL和0.48μL体积的液滴制成的微孔开口直径分别为480μm与530μm,孔深分别为390μm与550μm,提示凹面微孔的深度可能对细胞球成形能力具有重要影响。
《图4》
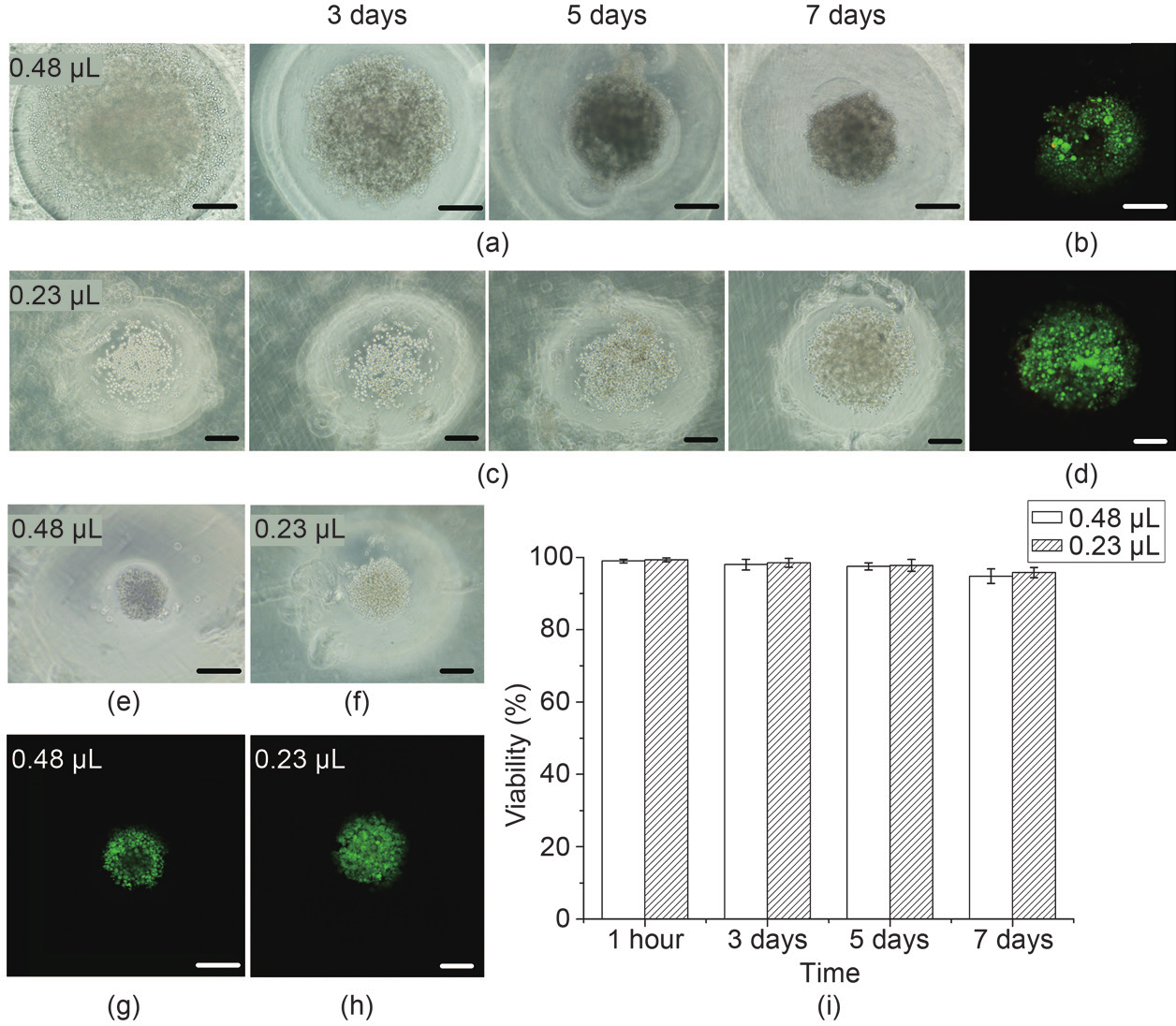
图4.原位形成细胞球。(a)MCF-7细胞原位形成细胞球过程的相差图,构建明胶阵列模板的明胶液滴体积为0.48μL,初始细胞密度为1×106个.mL–1;(b)与图(a)第7天对应的钙黄绿素和溴化乙锭细胞染色结果;(c)MCF-7细胞原位形成细胞球过程的相差图,构建明胶阵列模板的明胶液滴体积为0.23μL,细胞密度为1×106个.mL–1;(d)与图(c)第7天对应的钙黄绿素和溴化乙锭细胞染色结果;(e)和(f)分别为0.48μL和0.23μL明胶细胞混合液滴第7天的相差图,初始细胞密度为5×105个.mL–1;(g)和(h)分别对应(e)和(f)的死活染色的荧光染色图像;(i)为细胞球形成过程中的存活率统计图。标尺:200μm。
初始细胞密度对细胞球成形结构也有重要影响。如图4(e)~(h)所示,相同条件下,初始细胞密度为5×105个.mL–1实验组最终形成的细胞球直径相对初始细胞密度为1×106个.mL–1实验组的明显要小。因此,可以通过调节细胞的初始接种密度来构建不同大小的细胞球。在微孔板构建及细胞培养过程中,细胞的存活率一直维持在较高水平(图4(i))。虽然本文仅测试了MCF-7细胞系,但本方法也适用于原位构建其他种类的细胞球[29,30]。
之前已经有采用明胶材料作为牺牲单元构建微流控水凝胶芯片的报道,本文中我们首次采用微尺度明胶阵列作为模板制备带有凹面微孔的水凝胶微孔板芯片并原位构建细胞球。虽然其他材料如固体树脂、SU-8胶、PDMS以及冰等均可以用来制备模板构建凹面微孔板,但是这些方法有的需要复杂的模具制作过程,有的在脱模的时候容易对模具或者微孔造成损坏[23,31–33]。另外,后续手动进行细胞种植过程容易造成细胞分布不均匀和细胞流失。本文的方法由于利用生物打印制备的载细胞明胶阵列作为模板,操作更为灵活可控。微孔中细胞数量可以通过控制打印明胶液滴的体积和初始细胞密度进行调控,因此细胞分布均匀;并且,由于不需要在构建微孔后人为种植细胞,避免了细胞流失问题。通过与芯片技术的结合,可以进一步拓展本方法在生物医学领域的应用。
《4.结论》
4.结论
本文提出了一种利用生物打印制备载细胞明胶阵列作为模板构建水凝胶微孔板芯片并原位形成细胞球的方法,初步验证了该方法对微孔结构的可控性和MCF-7细胞球的原位成形能力。该方法操作灵活、适用范围广,制备的水凝胶芯片可与其他组织芯片技术相结合,在组织工程、再生医学以及药物筛选等领域有广阔的应用前景。
《致谢》
致谢
感谢国家自然科学基金(11372243,11532009,11522219)、中国博士后基金(2013M540742)、高等学校博士学科点专项科研基金(20130201120071)、陕西省自然科学基础研究计划项目(2014JQ1004)以及中央高校基本科研业务费专项资金(8143051)的资助。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Kai Ling, Guoyou Huang, Juncong Liu, Xiaohui Zhang, Yufei Ma, Tianjian Lu, and Feng Xu declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




