《1.引言》
1.引言
稀土元素(REE)是设计和开发可再生能源技术(如太阳能、风能和热电转换器)、照明和磁性材料等可持续能源相关应用的重要金属[1,2]。除初采外,从寿命末期消费品[如永久磁铁、荧光体和镍-金属氢化物(MH)电池]和工业灰渣(如铝土矿渣和磷石膏)回收REE是确保未来独立供应的最主要的途经[3−5]。相比初采供应,回收的优点主要包括环境影响小、生产周期短、原材料价格低廉[6]。此外,回收可解决“不需要的”REE供过于求的问题,有助于稳定供应更重要的REE[钕(Nd)、镝(Dy)、铽(Tb)],从而缓解所谓的“平衡问题”[7]。
有人研究了如何从废物回收REE,特别是从永久磁铁和荧光体回收REE[4,8−14]。紧凑型荧光灯(CFL)中的绿色荧光体(LaPO4:Ce3+,Tb3+或CeMgAl11O19:Tb3+)富含Tb,Tb是一种极其重要和贵重的元素[15]。湿法冶金是一种传统的、简单的贵重金属回收方法。LaPO:Ce3+,Tb3+可在120~230℃温度内,用高温浓硫酸(H2SO4)进行溶解[16]。采用火法冶金法,在高压釜内强碱条件[35%(质量分数)NaOH,150℃]或有熔融碱[如1000℃下的Na2CO3或950℃下的Ba(OH)2]的条件下将稀土磷酸盐转化成氧化物,氧化物可在温和条件下浸出[4,13,14,16,17]。然而,由于存在细玻璃颗粒,使用碱性熔剂会形成硅酸盐,硅酸盐会阻碍下游REE的分离。最近,研究人员提出了一种可能的绿色替代程序,用真菌实现REE磷酸盐(即独居石)的生物浸出[18]。
稀土磷酸盐或铝酸盐的回收需要大量能源和严苛的化学条件。因此,使用机械应力增强(浸出)反应被推定为一种绿色替代反应途经。该非常规反应途经一般被称为机械化学法(MC),得到了重要金属回收研究人员的关注。MC已成功应用于锂离子电池、碳化钨刀具废物、铟锡氧化物(ITO)和荧光体废弃物[19,20]。MC可增强来自寿命末期材料或工艺废物流的不可溶金属的浸出率。
之前的研究已证明,在浸出前通过研磨进行预处理实现机械活化(MA)可改善磷酸镧(LAP)荧光体废物中REE的回收[21]。假定该预处理使晶格出现缺陷,形成无序的晶体结构,大大加速随后的浸出操作,从而不需热活化。然而,如果高能研磨(即MA)在物理上临时与浸出过程分离,则并非所有激发态(效果)可得到充分利用(图1)[22]。由于部分缺陷不稳定,松弛时间短,所以高度激发的活化状态在浸出阶段开始之前就会衰退[22,23]。因此,MA过程之后的浸出仅利用寿命长的激发态。使用研磨-浸出结合(机械化学)法则可利用所有激发态,包括寿命短的激发态。激活的颗粒外壳可同时浸出,从而使新鲜表面暴露出来,提高浸出性能。
《图1》

图1.MA结束后不同激发态(效果)的持续时间和松弛时间示意图。 浸出过程显示所涉及激发态(效果)之间的区别。(改编自参考文献[22])
本文研究了两种活化-浸出程序以回收LAP荧光体中的REE。第一种程序运用MA和随后的化学浸出确定研磨和浸出时间的影响,并提出最优周期研磨/浸出程序。用高分辨率透射电子显微镜(HR-TEM)确定研磨操作对晶体结构的影响。第二种程序将MA与浸出操作(机械化学浸出)结合成一个步骤,并与之前的活化-浸出持续比较,以加强对寿命长和寿命短的状态重要性以及机械化学回收工艺优点的理解。
《2.实验过程》
2.实验过程
《2.1.化学物品》
2.1.化学物品
OSRAM(德国慕尼黑)提供了纯度为99%的LAP荧光体(LaPO:Ce3+,Tb3+)。用超纯水(18.2 MΩ·cm–1,25℃;德国赛多利斯Arium®pro超纯水系统提供)、浓硫酸(H2SO4,95%~97%;比利时Sigma-Aldrich提供)和浓甲磺酸(MSA)(CH3SO3H,99.5%;比利时Sigma-Aldrich提供)制备酸性溶液。稀土盐[La2(SO4)3,99.9%;Ce2(SO4)3·8H2O,99.9%;Tb2(SO4)3·8H2O,99.9%]从比利时Sigma-Aldrich购得。Ce(SO4)2·4H2O(99%)从比利时Acros Organics购得。电感耦合等离子体(ICP)标准品(丙烯酰胺,1000 mg·L–1)从比利时Sigma-Aldrich购得。
《2.2.仪表》
2.2.仪表
浓度小于10µg·L–1时,用电感耦合等离子体-发射光谱仪(ICP-OES)(Optima 8300;美国PerkinElmer)或电感耦合等离子体-质谱分析仪(Elan 9000;美国PerkinElmer)对沥滤液进行定量分析。样品经微波辅助消解(Speedwave Xpert;德国Berghof Products +Instruments)在王水溶液中充分消解后,通过对溶液(一式三份)进行定量分析确定LAP荧光体中REE的浓度。使用激光粒径分析仪(Mastersizer 3000;英国Malvern Panalytical),采用液体模式下的激光衍射法确定激活样品的粒径分布特点。用X射线粉末衍射仪(D2 Phaser;德国Bruker)记录X射线粉末衍射(XRD)数据。用紫外可见光(UV-Vis)光谱分析仪(Lambda 365;美国PerkinElmer)和10 mm石英瓶测定Ce(IV)浓度。
用HR-TEM调查粉末晶体缺陷和形态。粉末样品沉淀在碳带上,用镀碳机镀一层20 nm厚的碳。用Helios Nanolab 650双束扫描电镜(SEM)/FIB系统(FEI,荷兰埃因霍温)分步骤制备颗粒薄片状横断面,首先通过离子束铂沉淀镀一层2μm厚的铂(Pt)(2μm×12μm)。最后用2 kV FIB能量和23 pA电流使其变薄。在200 kV电压下用FEI Tecnai G2电子显微镜(FEI,荷兰埃因霍温)得到明场透射电子显微镜(BF-TEM)影像和选区电子衍射(SAED)图案。
在200 kV下用FEI Tecnai Osiris电子显微镜完成高角环形暗场像-扫描透射电子显微镜(HAADF-STEM)和能量弥散X射线(EDX)光谱绘图。
《2.3.活化 / 浸出程序》
2.3.活化 / 浸出程序
在空气中用行星式球磨机(Pulverisette 7 premium;德国Fritsch)激活荧光体粉末。按球粉比(B:P)为50:1(质量比)将荧光体样品与球状氧化锆(ϕ=1 mm)混合起来,然后置于氧化锆碗(内部容积为80 mL)中。荧光体活化包括两种模式:(干式)MA和(湿式)机械化学活化。第一种模式下,干样品研磨15~60 min。随后将激活的样品与液固比(L:S)为20 mL·g–1的2 mol·L–1 H2SO4溶液混合,摇动15 min(200 r·min–1)。第二种模式下,样品与L:S为1.0~3.0 mL·g–1的浓H2SO4或浓甲磺酸混合,然后活化15~60 min。湿粉末与Milli-Q水混合,得到L:S为20 mL·g–1的最终溶液。采用循环MA模式,依次研磨样品15 min,然后在2 mol·L–1 H2SO4中浸出15 min,以与机械化学浸出(15 min同时研磨和浸出)进行比较。在有乙二醇的条件下,对粉末进行循环研磨15 min,然后浸出15 min,确定液体对研磨的影响。选择乙二醇是因为乙二醇的黏度与H2SO4的黏度接近。所有活化程序过程中,旋转速度固定为600 r·min–1,研磨15 min采用10 min的中间冷却时间,以避免热累积。
《2.4.测量》
2.4.测量
2.4.1.沥滤液中 REE 的浸出率
浸出率的计算见式(1):

式中的浸出率代表荧光体中各REE的平均浸出率,所有REE[镧(La)、铈(Ce)和Tb]的浸出率都比较接近。
2.4.2.铈离子的氧化
氧化实验中,用UV-Vis吸收光谱仪测量Ce(III)和Ce(IV)的浓度。含2.0 × 10–5 mol·L–1 Ce(III)、La(III)、Tb(III)、Ce(IV)的校正溶液用 2 mol·L–1 H2SO4 进行制备。200 ~ 600 nm光谱范围内的Ce(IV)(315 nm)特征最大吸收波长可运用比尔-朗伯吸收定律,因为该波长范围内与其他REE无吸收重叠。
得到的相关系数大于0.999。Ce(IV)的氧化率[即Yox(%)]定义如下:
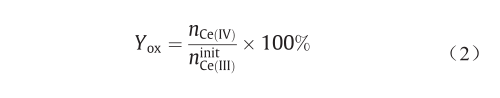
式中,nCe(IV)为氧化铈(IV)的摩尔数,根据UV-Vis测 量计算得到; 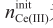 为消解后溶液中Ce(III)的初始摩尔总数,根据ICP-OES分析得到。
为消解后溶液中Ce(III)的初始摩尔总数,根据ICP-OES分析得到。
《3.结果》
3.结果
《3.1.MA LAP 的化学浸出》
3.1.MA LAP 的化学浸出
稀土磷酸盐(如LaPO4 :Ce3+,Tb3+)的单斜晶格结构与独居石相似,难以溶解。这一结构的化学稳定性高,打破其化学键需要的能量输入要求高。因此,晶体对酸侵蚀的耐受性好。室温(25.0 ± 0.5℃)下,用2 mol·L–1 H2SO4 可浸出小于1%的REE(图2)。然而,LAP荧光体对MA的效果很敏感。图2显示,MA样品(活化时间分别为30 min和60 min)在浸出5 min后的REE 浸出率分别为45%和51%。MA的效果十分明显,使浸出率增加了200倍。可以看到,MA样品的浸出由于溶 解机制的变化,成为自发反应,未活化的样品从化学控 制反应变成活化后的扩散控制反应[21,24]。研磨时间对MA样品浸出率具有积极效果(图3),研磨前15 min内的浸出显著增强。随后,该效果大大减弱,这是因为粒 径发生了变化。初始粒径变小(研磨5 min后平均粒径变成0.15 µm)后,受长时间研磨的影响,颗粒开始聚合,导致平均粒径变大,研磨15 min后为0.30 µm,研磨60 min后为0.37 µm。
《图2》

图2.回收LAP中Tb时,Tb浸出率和浸出时间的关系图。化学浸出条件:L:S = 20 mL·g–1,2 mol·L–1 H2 SO4,T = 25 ℃。MA条件:600 r·min–1,ϕ = 1 mm,B:P = 50:1。
《图3》
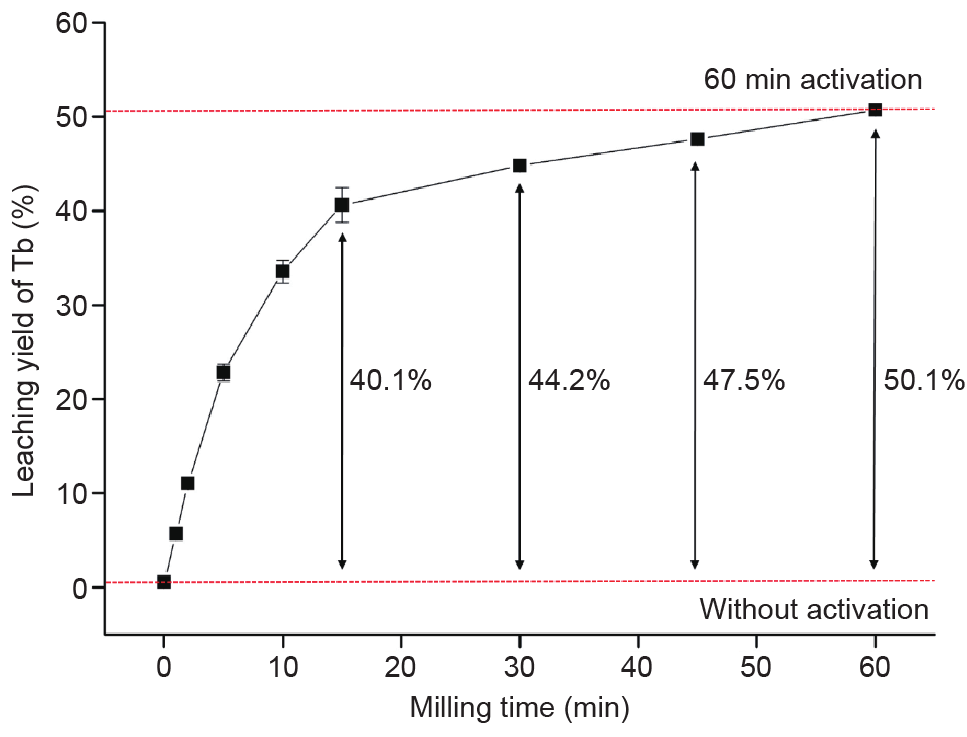
图3. 回收LAP中Tb时,Tb浸出率与研磨时间的关系图。化学浸出条件:L:S = 20 mL·g–1,2 mol·L–1 H2SO4 ,T = 25℃。MA条件:600 r·min–1,ϕ球 = 1 mm,B:P = 50:1。误差条表示标准偏差,标准偏差根据三个复制品的浸出结果计算得到。不可见的误差条小于数据点符号。
《3.2.MA LAP 的物化变化》
3.2.MA LAP 的物化变化
增加固体反应性的常见方法包括物化变化,如改变粒径、比表面积、晶格和化学成分。长时间研磨导致雏晶大小发生变化,诱发晶格的应变[21]。机械力产生晶体缺陷(如点缺陷和错位),导致(基于X射线的)非晶形含量增加(图4)。红色方框内的峰值变化为晶格和应变发生变化的效果。各研究人员提出,峰值强度增加和峰值变宽形成的非晶性增加是改善LAP粉末可浸出性最可能的主要机制[21,24−26]。但尚未得出增强REE浸出性的详细结构变化或MA颗粒中非晶相定位的决定性结果。
《图4》
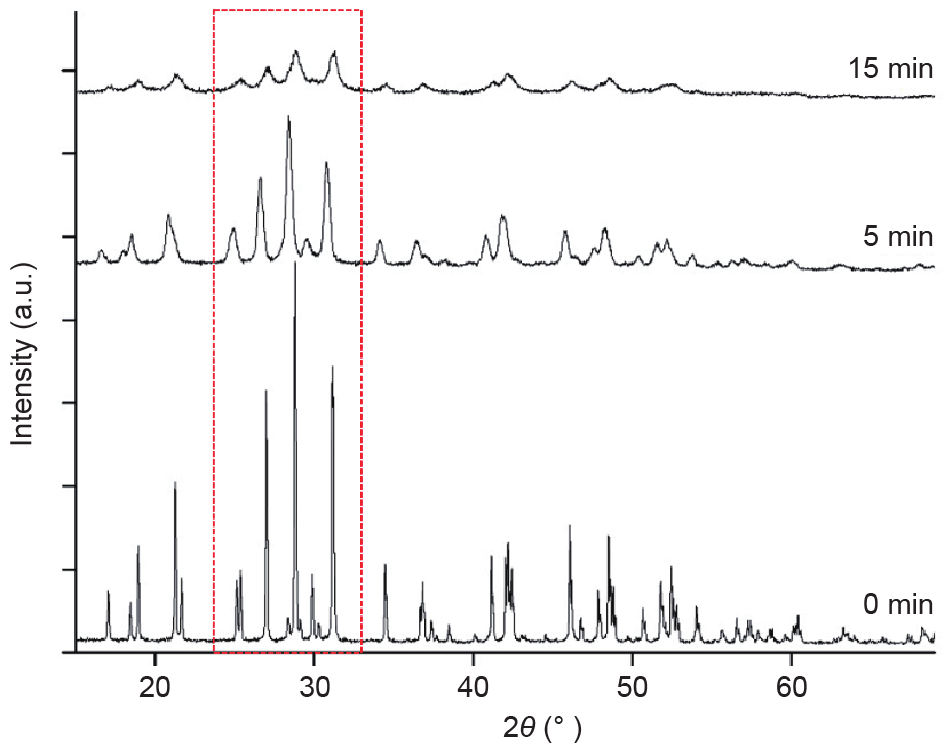
图4. 不同活化时间下LAP荧光体XRD图案的变化(600 r·min–1,ϕ球 = 1 mm,B:P = 50:1)。
为了形象地展示晶体结构变化、缺陷形成和非晶形含量的增加,在不同研磨阶段(0 min、5 min、15 min、60 min)用HR-TEM得到影像。未研磨的LAP粉末为强晶体状材料,具有单斜晶体结构的特点。高结晶度如图5(a)所示,SAED图案如图5(b)所示。SAED图案显示出有序结构,从而表明该材料为完全单晶体材料。紧密的网络和化学结合阻碍浸出过程中既有化学键的破坏和新化学键的形成。
《图5》

图5. (a)未研磨的LAP样品颗粒的BF-TEM影像;(b)未研磨的LAP样品对应的SAED图案;(c)研磨5 min后形成的骨料的TEM影像。
第一阶段研磨使粒径变小。然而,继续研磨使颗粒反应活性增加,导致骨料的形成。研磨5 min内可观察到骨料的形成,如图5(c)所示,该骨料被小颗粒物包围。 研磨5 min后颗粒的BF-TEM影像和SAED图案表明,该材料主要为单晶体材料[图6(a)]。颗粒边缘未见颗粒非晶化[图6(b)]。SAED图案[图6(d)]中的珠状环表明,材料的一部分确实在朝多晶材料方向变化[图6(c)]。随着研磨时间的增加,单晶材料向多晶材料转变。研磨15 min 后,粉末几乎完全转变成多晶材料[图7(a)]。放大的BF- TEM影像显示出材料的颗粒边界和纳米微晶以及对应的SAED图案[图7(b)]。本阶段仍未见颗粒边缘或内部的非晶形含量。未研磨和研磨过15 min的样品密度分别为(2.0120 ± 0.0771)g·cm–3 和(1.8713 ± 0.0680)g·cm–3。因此,实测密度在统计上无差异。
《图6》

图6.(a)研磨5 min后晶粒边界的BF-TEM影像;(b)研磨5 min后晶粒边缘的放大图;(c)研磨5 min后块状粉末的BF-TEM影像;(d)研磨5 min后块状粉末对应的SAED图案。
《图7》

图7.(a)显示颗粒边界和纳米微晶的BF-TEM影像(研磨15 min);(b)研磨15 min后粉末对应的SAED图案;(c)研磨60 min后有大量结晶相的粉末样品表面的BF-TEM影像;(d)研磨60 min后表面有一定程度非晶化的粉末样品的BF-TEM影像。
研磨60 min后粉末样品表面开始显示程度较低的非晶化[图7(c)]。然而,与块状粉末[图7(d)]剩余的颗粒表面相比,非晶形含量可以忽略不计。单晶体材料转变为多晶体材料的过程中,会形成许多含连贯晶体单元(颗粒)的边界(颗粒边界)。固体材料的不规则充填增强扩散,促进化学反应。颗粒边界含大量天然晶体缺陷(即错位和单维缺陷),将成为扩散路径的一部分。因此,晶体结构从单晶体向多晶体的变化可与浸出率的提高联系起来[27]。这些结果首次表明,MA后浸出率的提高是材料结构从单晶体向多晶体的转变造成的,而不是解释机制提出的由非晶体物质的形成造成的。研磨15 min后记录到最高浸出率,这与几乎完全转换为多晶体材料的时间一致(图3)。延长研磨时间可减小雏晶尺寸,形成更多颗粒边界,从而进一步提高浸出率。然而,MA效应逐渐变弱。
除了引发物理变化外,高强度研磨还可引发晶格的化学变化。这种情况下,研究了MA作用下Ce(I-II)~Ce(IV)的氧化,观察到外观颜色由无色Ce2(SO4)3变为黄色Ce(SO4)2(图8)。Munning等[28]已经指出掺钆(Gd)二氧化铈中铈离子的自发应力诱发的氧化。研磨时间为15~30 min时,Ce(III)氧化明显增加,Yox由2.2%提高至14.4%(表1)。继续增加研磨时间不再使Ce(IV)含量发生明显变化。为了证明应力诱发氧化的概念,用氮气(N2)冲洗容器5 min,清除其中的大部分氧气(O2)。在冲洗后的气体中,研磨60 min后,Yox仅达到2.0%。这证明容器中空气的干扰作用,O2起氧化剂的作用。由于三价和四价态REE之间的化学差异,Ce(III)氧化可视为有利于下游REE的分离[29]。
《图8》

图8.对于2 mol·L–1 H2SO4 、25℃、L:S恒定为 20 mL·g–1条件下浸出的LAP荧光体粉末,其研磨时间从左到右递增时沥出物的颜色。黄色代 表存在Ce(IV)。最后的样品表示在N2中研磨60 min的样品。
《3.3.LAP 的化学浸出和机械化学浸出》
3.3.LAP 的化学浸出和机械化学浸出
为了比较LAP荧光体粉末机械化学浸出与MA,分别进行试验。试验过程中,选用沸点和黏度均较高的浓H2SO4(沸点为337℃)或浓甲磺酸[10 mmHg(1 mmHg≈133.322 Pa)下沸点为167℃],因为高能研磨可导致局部温度和压力升高。因此,为了防止研磨容器内压力积聚,酸的选择很重要。此外,甲磺酸被视为一种环保物质[30]。由于此浸出过程中不涉及水,所以此方法可归入溶剂冶金法[31]。为了确定最优L:S,用各种L:S进行了一系列实验,如图9所示。增加液体量可增强LAP荧光体粉末中REE的溶解度,最优L:S为1.5 mL·g–1。继续增加液体量,浸出率随甲磺酸的使用而降低。结果表明,H2SO4对LAP荧光体粉末中REE的浸出效果比甲磺酸的效果更好。L:S比较高时机械冲击力衰减,而L:S较低时液体与固体接触不良,这就轻松地解释了最优L:S。使用H2SO4时的衰减效果不明显,可能是酸的黏度不同造成的。用2.5 mL·g–1H2SO4实现了REE充分回收,而最优L:S(1.5 mL·g–1)条件下,98%的REE在60 min研磨/浸出时间内完成浸出。
《图9》
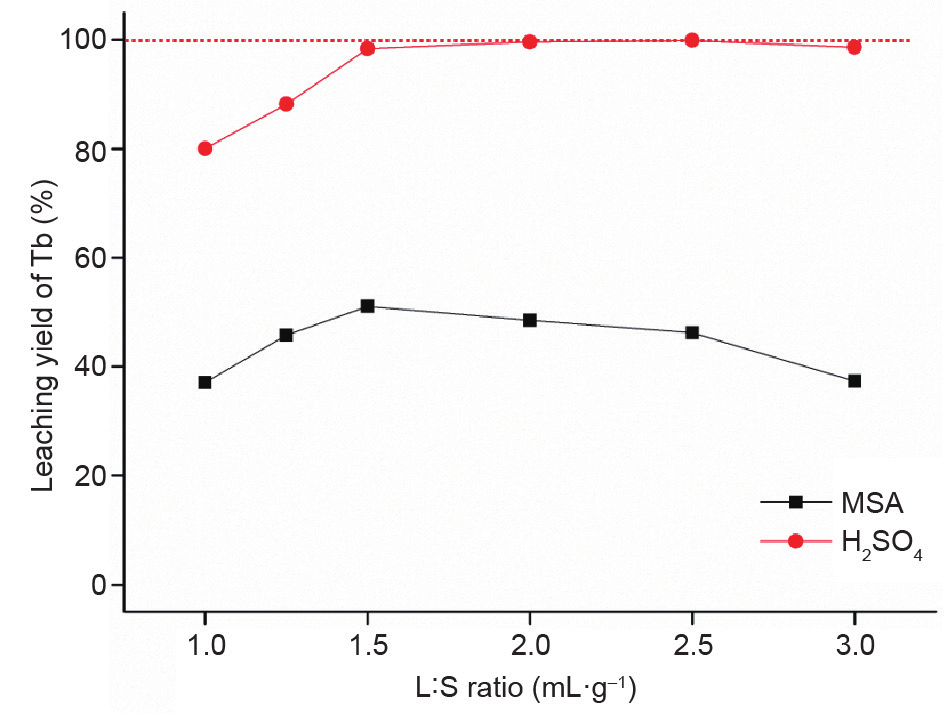
图9. 不同L:S条件下,同时研磨60 min的LAP荧光体粉末的Tb浸出率变化情况(采用浓甲磺酸和浓H2SO4 )。MA条件:600 r·min–1, ϕ=1 mm, B:P= 50:1。
与机械化学浸出(即同时研磨和酸浸)和循环MA样品以及循环湿法研磨样品连续浸出(即同时研磨和浸湿)(图10)进行了比较研究。研究结果证实了相比干式研磨程序,机械化学浸出对回收LAP荧光体粉末中REE具有有利影响。机械化学模式下回收了高达73%的REE,而循环MA模式下从活化15 min的样品中回收了41%,循环湿式研磨模式下回收了10%。研磨60 min后,机械化学样品、循环MA样品、循环湿式研磨样品的浸出率分别为98%、81%、16%。研磨/浸出时间反映了处理总时间,与15 min研磨和15 min浸出时间对应。干式MA对浸出率具有明显的有利影响,而湿式研磨样品浸出的影响不大。这一发现表明,微粒表面积的增大和粒径的减小不是影响浸出率的主要因素。湿式研磨模式下,颗粒浸湿可避免骨料的形成,从而得到极细的纳米颗粒。然而,液体也导致机械力的衰减,从而降低了物理化学效果。机械化学浸出模式下,雏晶大小、晶格和应力的变化也将变小。假定这种模式下,颗粒外壳发生物理化学变化,形成更多的反应活性区。这些反应活性区与容器中的酸发生反应,形成稀土硫酸盐。此外,可能形成大量高激发、短寿命态(如晶格振动、新鲜表面等),这些状态只在研磨与浸出结合(即反应研磨)时才会存在。如果MA与化学浸出统一成单一阶段,所有激发态均可为我所用。因此,这种方法可减小设备尺寸,大大缩短操作时间,具有运行和经济效益。
《图10》
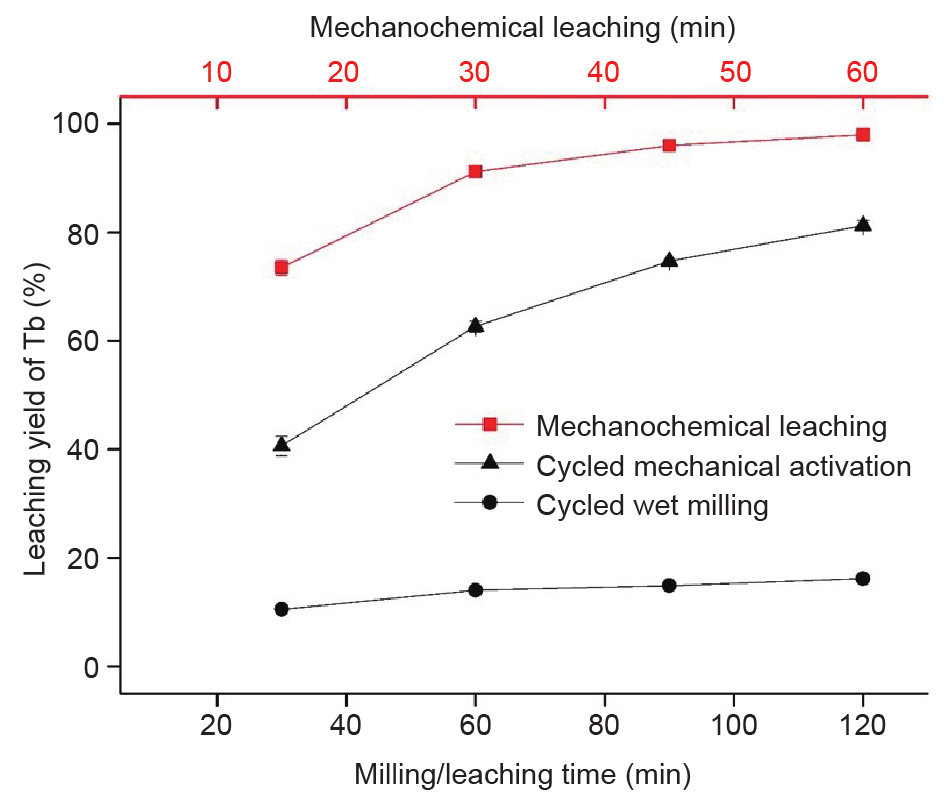
图10. 机械化学、循环MA和循环湿式研磨LAP荧光体粉末REE浸出率的变化情况。MA条件:600 r·min–1, ϕ =1 mm, B:P =50:1。误差条表示标准偏差,标准偏差根据三次重复试验的浸出结果计算得到。不可见的误差条小于数据点符号。
《4.结论》
4.结论
MC是一种从废物流回收重要金属的成熟方法。结果表明,MA和机械化学浸出对荧光体废弃物LAP中REE酸浸均具有有利影响。与未活化材料的浸出相比,在2 mol·L–1 H2SO4溶液中浸出前进行MA可使回收的REE增加200倍。形成的多晶材料(不是普遍认为的非晶形材料)产生包含晶体缺陷的颗粒边界,有助于破坏既有结合。这加快了固体的质量转移,从而提高浸出率。对LAP循环MA和溶剂机械化学浸出的比较研究表明,机械化学浸出的效果更好。通过引入循环MA模式,可去除活化粉末,让其在另外的活化回路中循环,从而提高该工艺的REE总体回收率。提出了整合浸出和MA步骤的溶剂MC,该方法使用少量浓H2SO4作为浸出剂,在室温下可回收高达98%的REE。与循环MA法相比,溶剂MC不仅提高了浸出率,而且使需要的时间缩短至原来的1/6。因此,本文提出的溶剂MC是一种高效、简单的方法,不仅可缩短时间、降低能耗要求,而且可减少酸的消耗和废水的产生。
《Acknowledgements》
Acknowledgements
This research is supported by KU Leuven (GOA/13/008 and IOFKP RARE3). Steff Van Loy thanks FWO-Flanders for a SB PhD fellowship (1S23518N). Koen Binnemans acknowledges the European Research Council (ERC) under the European Union’s Horizon2020 Research and Innovation Programme: Grant Agreement 694078—Solvometal- lurgy for critical metals (SOLCRIMET). The authors would like to extend their gratitude to Alexander Neirinckx and the Electron Microscopy for Materials Science Research Group(EMAT, University of Antwerp) for their support in the HR-TEM imaging.
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Steff Van Loy, Koen Binnemans, and Tom Van Gerven declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




