《1 前言》
1 前言
我国需要一种清洁、安全和可靠的能源来保障经济的可持续发展和人民的生活质量。由于油价飙升、能源多样化和能源供应安全需求,以及全球环境问题,使天然气作为一种全球性的能源,近些年来得到广泛利用。同样的原因,也使H2被视为未来的能源媒介[1~3] 。而目前,工业上H2的大规模生产多采用甲烷的重整。
用化石燃料制 H2能够实现化石能源和可再生能源系统之间的平稳转换。此外,H2可供多种燃料电池发电,这方面优势对于我国实现能源安全、空气质量、温室气体减排和工业竞争等能源相关政策的目标意义重大。H2的主要特征在于它是一种清洁的能源媒体,它与氧结合释放出储存在H—H键中的化学能,而反应产物只有洁净的水蒸气。因此,H2引起了政策制定者、科学家和企业等多方的兴趣。甲烷水蒸气重整(SMR)反应是传统制取富氢合成气的重要途径,目前工业上较成熟的制氢工艺,也是最简单和最经济的制氢方法。在生产氨水、甲醇以及其他化工产品的过程中,所需要的氢均由 SMR 制得。SMR 工艺从 1926 年开发应用至今,工程师们对此工艺做过了许多方面的改进,已经是应用于 H2工业生产的成熟技术。但目前,与固体氧化物燃料电池(SOFC)耦合的SMR过程,尤其是与非传统的微小型反应器匹配的催化剂材料、反应器结构设计、结构与材料一体化的研究都有待深入。
《2 SMR反应过程和机理》
2 SMR反应过程和机理
《2.1 反应过程和操作参数》
2.1 反应过程和操作参数
传统的SMR过程包括原料的预热和预处理、重整、水汽置换(高温和低温转换)、CO的除去和甲烷化[4] 。SMR过程是可逆吸热反应过程,一般需在高温下进行,同时在反应过程中伴随着CO的水汽转换。而催化剂一般采用 Ni/Al2O3,通常在催化剂里添加助剂抑制催化剂上的积碳反应。若要加速碳从催化剂表面的去除,可在反应进料中采用过量的水蒸气[5] 。甲烷水蒸气转化制得的合成气,进入水汽转换反应器,经过高低温变换反应,将把CO转化为CO2和额外的H2,以提高H2产率[6] 。对于SMR过程所涉及的反应比较完整的描述如表1所示。
《表1》
表1 SMR过程的反应
Table 1 Reactions net of SRM process

虽然这组反应并不代表反应机理,但与已知的化学过程是一致的。由于在实际过程中,水蒸气总是过量的,所以避免了反应(6)~(11)的析碳反应。根据 Hou 等[7] 的实验研究与分析,式(4)和(5)的反应速度非常慢,从化学动力学的角度分析,在对过程进行热力学的研究中可以忽略这两个反应。式(3)是式(1)和(2)叠加的结果,所以实际决定反应平衡的是式(1)和(2),即重整反应和转换反应。转换反应是在重整反应的基础之上进一步进行CO的转换并生成H2,所以重整反应是这两个反应中的关键反应。在SMR过程中主要工艺操作参数包括温度、压力、水碳比、空速等。工艺操作不能孤立考虑,不能只估算它们本身对反应的影响,还要考虑到催化剂、经济成本、材料等因素。
1)温度。无论是从化学平衡还是从反应速率考虑,提高温度都对转化率有利,但温度对炉管的寿命影响严重,因此工业上SMR反应温度一般维持在700~900 ℃。
2)压力。甲烷蒸气转化的主要反应是生成 CO、CO2与H2的反应,是物质量增加的反应。从平衡角度来看,增加压力对反应不利。压力越高,出口气体平衡组成中甲烷含量越高,在温度较低时,影响较为显著。为减少出口气体中甲烷含量,在加压的同时,采取的措施是提高水碳比及温度。但只要温度与水碳比均提高,即使压力较高,也可以使出口气体平衡组成中甲烷含量降低。
3)水碳比。从化学平衡角度而言,水碳比的提高对于甲烷转化是有利的,而且对抑制积碳也是有利的。但水碳比的提高就意味着蒸气耗量的增加,多余的水蒸气同样也使炉管中温度上升,致使能耗增加。因此在满足工艺的前提下,要尽可能减少水碳比。工业过程中的水蒸气和甲烷的摩尔比一般为3~5,生成的H2与CO之比大于等于3。
4)空速。空速的提高意味着生产强度的提高,因此在可能的条件下,要用高空速。但是空速过高,气体在反应器中停留的时间过少,甲烷转化率降低。出口气体中甲烷残余量的增加一般需要提高操作温度与水碳比来弥补。
《2.2 SMR反应机理》
2.2 SMR反应机理
有关SMR反应机理的研究在20世纪60至70年代就有不少文献报道,提出的反应机理主要有:类似于热裂解的反应机理,认为甲烷在水蒸气的作用下裂解为H2和CO;两段理论认为甲烷先碳化并放出H2,生成的碳再与水蒸气反应生成CO;还有文献提出在400~900 ℃时,甲烷和水蒸气在催化剂表面离解为CHx (ad)(ad表示“吸附态”)和原子氧,并且被催化剂表面吸附,然后中间产物之间、中间产物与原料气之间进行反应,最终生成 CO、CO2、H2 [8] 。 Hou等[7] 在Ni/α-Al2O3催化剂上对SMR进行了比较详细的动力学研究,认为 SMR 按表 2 中的机理进行。其中,s 为催化剂上的活性中心。根据这一机理,水分子和表面镍原子反应,生成氧原子和氢,而甲烷分子在催化剂的作用下解离,所形成的CH分子片与吸附氧反应生成气态的CO和H2。
《表2》
表2 SRM反应机理
Table 2 Reaction mechanism of SRM

同时Hou等[7] 将得到的动力方程与实验进行关联,结果表明,该动力学模型与实验数据能很好地吻合。不同文献提出的反应机理不同,由此得到的 SMR的反应速率方程也各不相同,这些差别与不同的研究中采用的催化剂及试验条件等不同有关。但从得到的反应速率方程看,都认为转化反应对甲烷是一级反应,反应温度和H2O/甲烷比对产物分布有很大影响。压力对产物分布没有显著影响,高的H2O/甲烷比和低的反应温度对制氢有利。
《3 SMR催化剂研究进展》
3 SMR催化剂研究进展
SMR是可逆吸热反应,从热力学上分析需要在高温、高水碳比及低压的条件下进行,但若不采用催化剂,高温下的反应速率仍然很慢。故SMR反应需要用催化剂进行加速反应。迄今为止,Ni/Al2O3 是该工艺中最常用的催化剂,其甲烷转化率达 90 %~92 %。为防止催化剂表面积碳,通常加入某种助剂,从而抑制催化剂表面碳的形成。因此,制备催化活性高、抗积碳性能强的镍基催化剂已成为该方向的重要研究课题。
甲烷水蒸气转化中催化剂内表面利用率很低,因此转化反应器属粒内传递控制。研究工作与工厂实际操作数据均表明:粒内传递过程不仅对宏观反应动力学速率有严重的影响,而且是控制宏观反应速率的关键步骤。例如,900 ℃,0.01 MPa 下,颗粒粒度由5.4 nm减小到1.2 nm,内表面积利用率由 0.07增加到0.3。工业上若采用减少催化剂粒径、改变催化剂形状、选择合适的微孔结构、开发活性不均匀分布的催化剂等方法以增加孔扩散能力和孔内活性表面的充分利用,可以提高宏观反应速率。
《3.1 催化剂的活性组分》
3.1 催化剂的活性组分
虽然甲烷催化重整反应中的原料各异,但所用催化剂大体相同。催化剂都应同时具有解离活化甲烷分子和活化 O—O 键或 H—O 键的能力。目前研究较多的催化剂主要有以下4类。
1)负载贵金属催化剂。如 Pt、Pd、Rh、Ir 等,一般活性顺序为:Rh>Pt>Pd>Ir,其中Rh和Pt以其优异的反应活性和抗积碳性能而备受国外研究者注目。Tetsuya等[9] 系统研究了一些过渡金属上甲烷部分氧化反应的积碳性能,发现积碳量为 Pd>>Rh> Ru>Pt>Ir。其中,贵金属 Pt 和 Ir 具有非常好的抗积碳性。但贵金属在高的使用温度下,通常会面临由于活性组分容易烧结和流失而造成失活的难题。有研究表明,Pt0 /Ptı+ 和 Ce4+ /Ce3+ 氧化还原对的共同存在可以提高甲烷的转化率和催化剂的抗积碳能力。添加有CeO2的Pt金属催化剂在SMR反应中表现出甲烷的高转化频率(TOF)值,这是由于金属-载体界面上最高的储氧能力使催化剂表面具有高的碳清洁能力,尽管催化剂的金属分散度低。而氧化铝载Pt催化剂的初期严重失活是由于 Pt的烧结造成[10] 。
2)非贵金属催化剂。以 Ni、Co 和 Fe 为主要活性组分,其活性顺序一般为:Ni>Co>Fe。人们对镍基催化剂进行了广泛而深入的研究,发现镍基催化剂具有与贵金属催化剂相当的活性,而且价格便宜,具有很好的应用前景。镍基催化剂也同样面临因积碳、烧结和活性组分流失而失活的问题。 Tokunaga等[11] 将第Ⅷ族非贵金属Fe、Co、Ni负载于载体Al2O3和SiO2上,在不同的温度下研究了催化剂活性,实验结果也说明Ni催化剂活性最好,寿命最长。但非贵金属催化剂则因积碳比较严重的原因而较快失活。Shang 等[12] 采用浸渍法将 Ni 负载于 Si3N4上,用于催化甲烷的CO2重整。研究发现,活性组分Ni的负载和煅烧温度对催化活性有强烈影响,并得到在 400 ℃下煅烧的重量百分比为 7 % 的 Ni/Si3N4 催化剂,在 800 ℃的反应温度下可得到 95 %的甲烷转化率以及 91 %的 CO2转化率。合适的金属与碱性载体间的相互作用提高了催化剂的抗烧结和抗积碳能力。
3)过渡金属碳化物、氮化物催化剂。过渡金属碳化物、氮化物是元素C、N插入到金属晶格中所形成的一类金属间充型化合物。元素C、N原子的插入造成了晶格的扩张,金属表面密度增加,使得过渡金属碳化物、氮化物的表面性质和催化性能与某些贵金属类似,在一些催化反应中可以作为贵金属的廉价替代品。例如,Mo、W的碳化物均具有较好的反应活性和抗积碳性能,高比表面的Mo2C、W2C 表现了良好的重整活性和稳定性,它们的活性和抗积碳能力与贵金属相当[13] 。黄传敬等分别对 Ni/ SiO2、Co/SiO2、Ni-Co/SiO2 这 3 种催化剂进行了考察,发现Ni-Co/SiO2双金属催化剂有更优越的催化活性和抗积碳性能。Chen 等研究了 Cu/Ni/SiO2催化剂的活性,发现Cu(质量百分比为1 %)和Ni(质量百分比为8 %)/SiO2在温度高于760 ℃时,表现出长时间的稳定性,但稳定性会随着Cu负载量的增加而不断下降。
4)活性组分的担载量。金属活性组分的担载量也是影响催化剂活性的重要因素。贵金属催化剂由于活性较高,只需很低的担载量(1 %~5 %), Ni和Co催化剂则需要较高的担载量。Gronchi等[14] 研究了Rh/A12O3催化剂上Rh的担载量对甲烷催化重整反应活性的影响。当采用低的CO2/CH4进料比时,在Rh含量为0.2 %和1.5 %的Rh/La2O3催化剂上反应转化率相近。Ruckenstein等[15] 研究了Ni/Al2O3催化剂Ni含量对反应的影响:发现当Ni含量为1 % 时,催化剂具有很高的初始转化率和CO产率。路勇等的研究表明,当镍含量为 9 %时,NiO 与 Al2O3 载体之间发生强相互作用生成高分散的二维表面化合物,从而获得高催化活性。所以Ni组分含量应有一定的范围,含量低则活性中心少,催化活性低,而含量过高有利于积碳的形成和活性组分的烧结,从而使催化剂失活。
由以上分析可知,从经济的角度来看,贵金属价格昂贵,不适于工业化大批量的生产,而镍催化剂在工业上的应用比较广泛。所以,本文选择了镍催化剂进行重点探讨。
《3.2 催化剂的载体》
3.2 催化剂的载体
载体对催化剂性能起着极其重要的作用,它不仅起物理支撑作用,还可以与活性组分发生相互作用从而影响其结构和性能,有的载体还有可能参与反应。甲烷催化重整反应催化剂主要是负载型金属催化剂,由热力学计算结果可知,甲烷催化重整只有在高温下才能获得较好的催化活性,所以选用的重整催化剂载体必须具有良好的热稳定性。因此一般选择Al2O3、SiO2、MgO、CaO、TiO2、ZrO2、硅石、Si3N4 [12] 、泡沫陶瓷、稀土氧化物以及一些复合金属氧化物如 MgO-Al2O3、ZrO2-Al2O3、CaO-SiO2和分子筛熔点较高的物质作为催化剂载体。载体的差别主要是在分散度上,然而,对于同一种载体,所用制备方法和条件的不同也会导致催化剂催化性能上的差异。
载体结构与性质,载体与金属组分的相互作用以及由此而引起的催化剂体相结构、组成、颗粒大小、分散度的变化构成了对活性组分可还原性以及在一定反应条件下的反应活性、选择性和抗积碳性等可能的影响因素。邓存等认为载体结构性质的差异及金属与载体之间的相互作用的不同可能是导致负载型Ni催化剂活性不同的主要原因。金属与载体之间的相互作用越强,催化剂越难还原,还原后金属在表面的分散度也越大,而且在反应过程中抗烧结能力也越强。姜玄珍等认为催化剂的活性和选择性的高低与载体的相对碱性强弱有关,载体应具有适度的解离活化反应物的能力。王军科等在 NiO/SiO2、NiO/Al2O3和 NiO/La2O3上进行甲烷部分氧化的研究,考察了3种催化剂的催化活性、选择性以及稳定性。结果表明,负载在载体上后,NiO 会与载体发生相互作用,不同的载体与NiO作用也不同,对甲烷部分氧化反应的催化性能也不同,负载NiO的A12O3和La2O3催化剂具有较高的稳定性。
载体的酸碱性对甲烷催化重整催化剂的结构和反应性能有一定的影响。Masaim等[16] 研究了Pd 的催化剂载体 Al2O3、SiO2、MgO、SiO2 · MgO 的酸碱度与反应活性的关系,研究结果表明,Al2O3、SiO2、 MgO载体中的酸中心能够提高Pd的分散度。唐松柏等研究了 A12O3和 SiO2作为载体的差别,由于载体A12O3的表面碱性强于SiO2,所以两种催化剂Ni/ A12O3和Ni/SiO2在相同的条件下使用后发现,前者的稳定性以及抗积碳性明显强于后者。路勇等在 8种不同酸碱性载体担载的Ni催化剂上得到的稳定性和抗积碳研究结果则是 Ni/A12O3>Ni/MgO>Ni/ SiO2。纪敏等在不同载体担载的 Ni 催化剂上进行甲烷二氧化碳重整反应研究,结果表明,几种催化剂上的抗积碳顺序为 Ni/A12O3>Ni/MgO> Ni/SiO2,认为Ni与A12O3之间的强相互作用有利于提高金属的分散度和抗烧结能力。另外,还有载体的抗烧结能力也是载体选择不可忽略的一个重要的影响因素。有研究证实,A12O3 的抗烧结能力明显优于 ZrO2,在多数温度较高的反应,大部分选择A12O3作为载体较好。
载体表面不同的氧化还原性质也会对催化剂的性能产生一定的影响,Wang等[17] 考察了以具有不同氧化性质的载体负载的Rh催化剂在甲烷重整反应的研究。一类是具有氧化还原性的氧化物载体,包括 CeO2、ZrO2、TiO2、Nb2O5、Ta2O5等;另一类是不具有氧化还原性的氧化物载体,包括γ-Al2O3、SiO2、 MgO、La2O3、Y2O3等。实验结果表明,以有氧化还原性氧化物为载体制备的催化剂合成气的收率较低,不适宜作为重整催化剂载体,而γ-Al2O3、MgO是最有应用前景的载体。除此之外,载体的物理特性也是考虑的因素,如载体的比表面积、孔径、导热系数、机械强度等。
《3.3 助催化剂的选择》
3.3 助催化剂的选择
为了提高非贵金属催化剂的活性和抗积碳能力,在催化剂设计时,加入适当、适量的助剂通常是一种有效的方法。在关于CH4催化重整催化剂助剂的众多研究中,常用的助剂主要为碱金属、碱土金属,多采用 K2O、MgO、CaO、BaO 等,还有一些稀土金属氧化物,如CeO2、La2O3和混合稀土等。助剂的作用主要体现在以下几个方面:提高活性组分的分散度,抑制活性组分的烧结;调变催化剂表面酸碱性,改善对反应气体的吸附性能;提高催化剂的还原能力;调整金属原子的电子密度,影响催化剂对甲烷解离的性能等。
《3.4 催化剂的制备方法》
3.4 催化剂的制备方法
固体催化剂的设计和特性是当今化学和化工研究的主要兴趣之一。在许多情况下,催化剂的各种物理特性,如表面积、粒度、孔隙率、孔径大小、孔径分布以及晶体结构,都决定着催化剂的活性、选择性和稳定性等。而这些性能往往同制备方法和条件有很大关系。催化剂的负载过程往往又是制备方法中最关键的一步。负载过程一般有混合法、浸渍法、沉淀法等。混合法是一种比较经典的制造方法,由于其制造方法简易,日前仍有部分催化剂采用这一制造方法。随着石油化工的发展和载体催化剂的广泛应用,浸渍法得到了迅速发展。近年来,沉淀法在催化剂工业上的采用也引起了人们的普遍重视。但无论采用何种方法都有高温焙烧过程,以便使载体与活性组分活载体组分之间更好地结合,使之具有高的机械强度。对于镍基催化剂而言,通常焙烧温度越高,时间越长,形成固溶体程度越大,催化剂耐热性能越好。混合法是基于组成催化剂的各个组分,以粉状细粒径的形态,在球磨机或碾合机内,边磨细边混合,使各个组分的粒子间尽可能达到均匀的分散,以保证催化剂活性组分与助催化剂或载体的充分混合,从而获得用肉眼分辨不出的多组分催化剂混合物。混合法的制造工艺简单,但不能使催化剂各组分高度分散,均匀一致,同样的化学组分,其活性、热稳定性等都不及浸渍法和沉淀法制得的催化剂好。
浸渍法是制备载体催化剂常用的方法,活性组分以盐溶液形态浸渍到多孔性载体上面,并渗透到内表面;经干燥后,水分蒸发逸出,活性组分的盐类遗留在载体的内外表面上。这些金属或金属氧化物的盐类均匀地分布在载体的细孔单,经加热分解后,即得到高度分散的载体催化剂。因活性组分、助催化剂组分及载体是在液相中混合,故分布比较均匀。浸渍法的主要缺点是不能经常保证活性组分的均匀分布,可以采用较稀溶液和几次连续浸渍、干燥、焙烧的方法,来避免这种分布不均匀的现象。
沉淀法制造催化剂首先要配制好金属盐溶液,接着用沉淀剂沉淀,再经过滤、洗涤、干燥、焙烧、粉碎、混合、成型。沉淀法可以得到活性组分分散比较均匀的催化剂,但是生产过程比较复杂,要经过好几道化工单元工序,生产能力不及混合法和浸渍法。一般情况下,用浸渍法能够得到活性组分分散比较均匀的催化剂,在同等的条件下工业上还是优先选用浸渍法,而不用沉淀法。
《3.5 催化剂的失活》
3.5 催化剂的失活
在甲烷催化转化过程中,引起催化剂失活的原因很多。在引起催化剂失活的众多因素中,积碳是引起催化剂失活的主要因素之一,它会引起催化剂活性中心中毒、孔道阻塞,严重的还会引起催化剂的粉化。这是因为催化剂表面会因积碳而造成活性部位的覆盖或孔隙堵塞,从而导致催化剂活性下降乃至丧失。因积碳反应是发生C—H、C—C键断裂后的表面碳聚反应,这种反应需要催化剂表面配位数多或大的活性基团。近年来在许多研究工作中也证实,在烃类转化反应中积碳反应所需活性基团大于烃类转化反应所需的活性基团[18] 。Rostrup等[19] 推测在Ni催化剂表面上可以提供12个相邻的活性基团位,这些基团有利于生成 CO 和 H2,而碳的形成则需要 16 个相邻的活性位。其中惰性碳的生成需要若干而不止一个活性中心的存在,镍中心的数量越多、密度越大,将有利于积碳的生成。傅利勇等认为一般常见的积碳有丝状碳、聚合物碳和石墨碳。
近年来,国外对催化剂失活的研究十分活跃,不仅从催化剂失活原理、原因及数学描述等方面作了详细的论述,而且从其所涉及的反应、反应器动力学及传质动力学等方面进行详细的论述。国内对催化剂失活的机理及动力学的研究尚属起始阶段。催化剂失活给工业生产过程带来了不利影响,如何防止催化剂失活是催化工程中人们最关心的问题。催化剂失活之后能否再生利用,又直接关系到生产过程的经济效益,因此研究催化剂失活是一项长期而具有重大意义的工作。
《3.6 催化剂评价》
3.6 催化剂评价
1)催化剂的活性和选择性评价。催化剂活性测试一般采用气相色谱、热导池检测器(TCD)、 TDX- 01 填充柱来分离 H2、CO、CO2、O2 和 CH4。SMR的重要活性性能特征是CH4的转化率和H2的产率。这些函数的定义由于系统的不同根据研究者本身解释问题的便利而有些变化,没有完全固定的定义。
举例如下[20] ,CH4的转化率通常定义为沿通道某点已转化的CH4和通入的CH4的比值,表示为
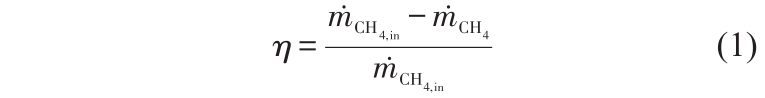
H2的产率描述了反应器的产氢能力,通常定义为产生的H2和H2最大理论值的比值

H2的选择性被定义为产生 H2的摩尔数与输入系统的水和产生H2的摩尔数之和的比值

式(1)~(3)中,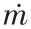 为质量流速,kg/s;M 为分子量, kg/mol。请注意,以上定义没有考虑积碳问题。在与发电系统耦合的SMR系统的实际评价过程中,一般将甲烷转化率、H2产率和CO选择性作为主要的催化剂活性评价指标。
为质量流速,kg/s;M 为分子量, kg/mol。请注意,以上定义没有考虑积碳问题。在与发电系统耦合的SMR系统的实际评价过程中,一般将甲烷转化率、H2产率和CO选择性作为主要的催化剂活性评价指标。
2)催化剂的程序升温还原(TPR)物性分析。一种纯的金属氧化物具有特定的还原温度,所以可用此温度表征该氧化物的性质。固体催化剂多为金属盐或金属氧化物构成,但对某些催化反应,这种状态催化活性小或根本没活性。因此,对这种类型催化剂需予以还原,使它们还原成具有活性状态的金属或低价氧化物,此过程称为催化剂还原。还原介质应是H2或N2- H2混合气,在反应器中于一定温度下完成还原过程。经还原后的催化剂不应再与空气接触,以免被氧化而失去活性。催化剂还原的速度随温度变化,反应速度的相对大小可以通过热导信号的记录而表征出来。因此,通过催化剂的TPR试验可以得到催化剂还原反应随温度变化的信息。
3)X 射线衍射(XRD)。XRD 是鉴定和研究催化剂晶相结构的有力手段,当入射的X射线与晶体的几何关系满足布拉格方程:2 d sinθ=nλ(式中n 为衍射级数;d 为晶面间距;θ 为入射和反射角;λ 为射线波长)时,才能产生X衍射线条。因为对组成相同或相近的原料,由于制备条件的不同,可以产生不同的物相,因此X射线技术广泛应用于催化剂的物相分析上。
4)热分析。热重-差热分析(TG-DTA)是在程序升温条件下,测量待测物质与参比物间的温度差及其质量与温度的关系,可准确测定样品在升温过程中的相变行为,据此可以对待测样品进行鉴定或定量分析。该方法可用于评价催化剂活性、分析制备方法或条件对催化剂活性的影响、确定催化剂组成、考察活性组分与载体的相互作用等。
另外,催化剂的孔结构、比表面积,表面形貌,表面元素的外层电子能级排布以及表面的酸碱性等性质可分别通过 N2 吸附、比表面积(BET)、扫描电镜(SEM)和透射电镜(TEM)、X射线光电子能谱(XPS)和二氧化碳程序升温脱附(CO2-TPD)等测试手段来表征。
《4 传统反应器与微反应器中进行的SMR》
4 传统反应器与微反应器中进行的SMR
天然气制氢微反应器系统的设计焦点问题是避免内部和外部传质阻力。浸渍催化剂粒径必须要足够小,以沉积和固定在通道里以减小内部传质阻力。而外部传质阻力一般采用Mears标准进行研究[21] ,过程分析则也可以像传统反应器那样采用 Aspen Plus商用软件进行模拟和过程分析。一般情况下,在进行实验室操作前,所有的实验条件要先经过分析和模拟[22] 。天然气制氢微反应器系统主要包括板式(叠片式)和管式两种。
对于微型催化重整器的理论研究中[20] ,有两个重要参数气体空速(GSV)和催化剂空速(CSV)。 GSV被定义为流入反应器的气体体积流速 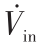 与反应器总体积Vreactor的比值,表示为
与反应器总体积Vreactor的比值,表示为
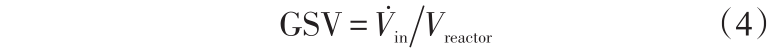
更加特殊的是,CSV被定义为流入反应器的气体体积流速与催化剂的量的比值。实验中,催化剂的量通常被定义为质量。更精确地,它应该量化为催化活性位点ncat。因此,在理论计算研究中CSV被定义为
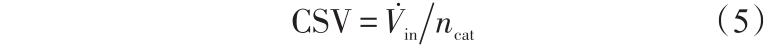
如果重整过程是完全传递限制,反应器性能与 GSV 常数保持一致。如果重整过程是完全反应速率限制,反应器的性能与CSV常数保持一致。但实际上,反应器性能同时依赖于GSV和CSV。但是,同时分析两个参数的影响的文献非常少。
Georgios等[21] 利用化学原理和一种伪2-D反应器模型理论研究了催化板式微反应器中耦合的丙烷燃烧/SMR的两个过程。研究发现,在Rh上运行微尺度的毫秒级接触时间的SMR是可行的。实际上,该过程甚至能够设计成亚毫秒接触时间的操作方式。
该文献理论分析了在微小规模下运行SMR的潜力。为了该目的,研究者采用一种伪2-D 反应器模型模拟了一个具多功能催化板式微反应器,包括被固态壁分隔的丙烷燃烧通道和SMR通道。利用了细微动力学模型和新近发展的集总动力学速率表达式来描述两个过程。计算结果表明在微小规模下的毫秒级接触时间的SMR是可行的,也是与最近的实验报道结果一致的。此外,能够考虑到的操作范围限制包括材料稳定性限制、突破限制和最大功率输出限制。还总结出一个简单的操作策略,绘出了沿突破线(一种接近等流速比率线)变化的功率输出,以保证反应区较好的重叠,提供反应器设计尺寸的指导方针。最终研究结果表明,器壁材料的选择依赖于指标操作的稳定性。在较高壁温和沿壁深的温度梯度下,低传导率材料使CH4转化率和功率输出增长。对接近突破限制的操作和中间传导率的材料如不锈钢,在CH4转化率和壁温之间提供了好的折中。即使没有可恢复的热交换,多功能装置和重整器的热效率也可分别达到65 %和85 %。
文献 [20]中的相关研究计算了催化剂表面位点密度、催化剂的量、反应器半径对壁涂覆催化剂、单通道微反应器进行的甲烷重整过程的影响。径向对称数值区由两个亚区组成,流体通道和热传导通道壁。在界面上,应用基元表面反应机理来描述Rh 催化剂上的甲烷重整。整体对称条件外边界是绝热的。结果表明,催化剂的负载方式强烈影响反应器性能。对于固定的GSV和反应器几何学,催化剂表面位点密度越高,H2产率和CH4转化率越高。但也有出乎意料的结果,如随着CSV的变化,H2选择性显著变化,意味着随着催化剂负载的变化发生化学变化。在富氧区,由于表面吸附CH4的快速裂解,高的催化剂密度提高了H2产出。在缺氧区,高的催化剂密度提高了水的裂解,这是水蒸气重整(SR)的限制因数再一次导致了高的H2产出。如果CSV和反应器几何学保持不变,提高GSV也可以显著提高 H2的选择性。这意味着对不同的GSV有不同的支配反应路线。此外,随着GSV的提高,壁温显著升高。这归因于随着输入体积流速的增长,CH4量可以多被转化。保持CSV和GSV不变,改变通道半径的重整过程,研究结果给出了一种具有最佳催化剂量和最佳通道半径的适宜结构,这也是一个出乎意料的结果。增加催化剂的量和/或减小通道半径不会自动地提高反应器的性能。该文献中的研究结果支持要协调考虑通道半径的选择、输入体积流速和催化剂量这些参数的结论必要性,以得到最好的重整器性能。此外,值得提出的是,在催化反应器中催化剂的量仅仅由CSV表征是不充分的,流体状况仅仅由GSV来表征也是不充分的。为了充分表征催化反应器的性能,综合考虑 CSV、GSV 和几何学是必要的。
Izquierdo等[1] 采用实验比较研究了Ni基 ( 载体为 MgO 和 Al2O3) 和贵金属基 (Pd 和 Pt 负载在 Al2O3) 在传统固定床反应器和叠片式微反应器中的 SMR反应和天然气水蒸气重整反应,他们采用的微反应器是由14片铣有微通道的不锈钢叠片并联而成。结果表明,在同样操作参数条件下,同样空速下,对于Ni基催化剂,SMR反应在传统固定床反应器和微反应器系统中的活性测试结果相近,但对天然气的水蒸气重整反应则不同。贵金属催化剂在传统反应器中没有测试到明显的活性,但在微反应器中均有活性。采用SEM和TEM测试发现Ni基催化剂表面无积碳,而贵金属基催化剂表面却有碳纤维生成。在同样空速下,对所有催化剂,在固定床反应器中得到较低的转化率,而在微反应器中得到较高的转化率和氢产率。
Kuznetsov小组进行的实验研究了SMR的转化率、外部供热和环形微反应器内凸壁上的反应的活化[22] 。发现壁温范围、输入混合物体积流速范围、输出混合物中H2和碳氧化物的含量同时增长,表明随着SMR的减少,CO的SR同时运行。对于外部加热器和微反应器内凸壁上化学反应的热传递分析表明了辐射热通量的重要性。所考虑状态下的热通量是占支配地位的,使在通道带获得高CH4转化率而传递必须的热通量成为可能。在假设CH4是一级反应,沿通道气体流速的线性变化的条件下和在过程实验数据的基础上,得到反应速率常数和活化能。反应过程实施中,考虑了外部扩散限制对狭窄环境下转化速率的影响。
在这些并不多的文献中,系统的研究包括微反应器和活性的、选择性的、稳定和/或便宜的催化模式。确实,SMR过程的改进将给予在过程中扮演关键角色的热传输以更好的优化[23~25] 。同样,对于微小型系统中 SMR 亦有不同的催化剂,但主要仍是 Ni基和贵金属基的Ru、Rh和Pt基催化剂。
当天然气和其他化石燃料的成本保持在一个中等水平时,SMR 将会成为大规模生产 H2 和合成气的可选技术,但目前SMR的小型化仍旧面临技术挑战[26] 。此外,为提高边远或海岛地区应用效率, SMR的改进也是必须的。为了从化石燃料或生物质获得H2,SMR过程的改进(主要是热传输)将是一种可行方式[27] 。目前对分布式和便携电源系统的需求也是明了的[28] 。因此研究微反应器系统中 SMR 制氢过程,把这种先进的反应系统用于天然气的制氢非常具有优势。
《5 耦合型SMR反应系统》
5 耦合型SMR反应系统
《5.1 高温气冷堆CH4蒸气重整制氢系统[29]》
5.1 高温气冷堆CH4蒸气重整制氢系统[29]
在高温气冷堆CH4蒸气重整制氢系统中,其核心部件之一是氦加热蒸气重整器。在传热方式、几何结构及运行工况等方面,它与常规的蒸气重整器不同。
它由高温气冷堆和甲烷蒸气重整制氢系统组成,连接两个部分的氦-氦中间热交换器(IHX)是氦-氦中间热交换器。一回路高温气冷堆向IHX提供950 ℃的高温核热。核热通过IHX由一回路传递到二回路,为二回路制氢反应提供热量。IHX 出口氦气温度为 905 ℃。由于IHX 到重整器入口沿程管道的散热损失,到达重整器入口,氦气温度降至890 ℃。在重整器中发生CH4蒸气重整反应,产生H2。
重整器内部主要由催化管束组成。催化管采用回转型的“三套管”形式,由内向外,依次为中心管、催化管和导管。工艺气从重整器的上部入口进入,沿着催化管与中心管所形成的环形通道向下流动,通道中填充了催化剂颗粒。工艺气在向下的流动过程中一边吸热一边发生重整反应。在通道的最下端,工艺气折头向上进入中心管,在上升的过程中不断向催化管内的工艺气放热,最后从工艺气出口流出。氦气从重整器下部的氦气入口进入,在催化管与导管所形成的环形通道中向上流动,同时向工艺气放热,最后从上部的氦气出口流出。为提高传热效果,通常在催化管外侧采取强化传热措施,如增加环肋等。
《5.2 高温燃料电池CH4水蒸气重整反应[30]》
5.2 高温燃料电池CH4水蒸气重整反应[30]
熔融碳酸盐燃料电池(MCFC)和 SOFC 具有燃料选择面广、无需使用贵金属作催化剂、余热利用价值高、高质量的废热可供热电联供等优点。在以富含CH4的天然气为原料时,一般经过SMR生成H2 和CO,为电池提供燃料。工作于650 ℃的MCFC和工作于 800~1 000 ℃的 SOFC 都处于 CH4 水蒸气反应区内,二者均可实现电池内部重整,即直接在电池的阳极气室内同时进行CH4水蒸气重整SMR、水气变换和电化学氧化等多重反应。SMR反应主要包括产生合成气和水气变换两步(如表1中反应(1)和(2)所示)。反应产生的 H2 与 CO 在 MCFC 与 SOFC 的阳极发生电化学反应。MCFC 阳极的电化学反应方程式为
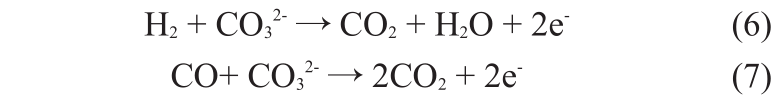
SOFC 阳极的电化学反应方程式为

在阳极气室内,阳极电氧化反应生成的水蒸气可作为重整反应的反应物,重整反应的生成物H2和 CO又可作为阳极电氧化反应的反应物,电极反应阳极消耗氢可打破重整反应热力学平衡,提高CH4转化率和电池发电效率,系统总效率可提高近12 %,实现物质耦合。电化学反应放热,重整反应吸热,二者可实现互补,电池排热负荷减少,实现能量耦合。
由于电池工作时,电化学反应生成水可供重整反应,所以理论上无需向阳极气室通入大量水。但是,在电池开路状态和低电流密度操作时,无电化学反应生成水或生成水量很低,阳极气室处于欠汽状态,重整催化剂很易积碳。积碳聚集在催化剂表面,覆盖催化剂活性中心,堵塞催化剂孔道,使催化剂活性降低。积碳大量聚集后,催化剂失活,反应无法进行。因此,提高SMR催化剂的活性与抗积碳性成为科研工作者的研究目标。
《6 结语》
6 结语
目前,SMR技术在SOFC上还远远没有取得大规模、大范围的应用,微小型 SMR 技术差距更远。除了受系统组件因素限制外,甲烷重整催化剂易积碳导致稳定性下降甚至失活是另一个重要原因。同时SMR反应的强吸热作用导致阳极气体通道入口处大幅度降温,阳极内部温度梯度较大,增加了操作中温度控制的难度。因此,开发新型催化剂,找到最佳操作条件,使其能够有效控制SMR反应过程,以减少催化剂表面积碳;开发高热效率、低内外传质阻力的微小型SMR反应器,实现热平衡,降低重整器系统与耦合的SOFC阳极的温度梯度,以提高电池整体效率与寿命,是SOFC 甲烷水蒸气重整反应的重点研究方向。随着“973”项目“碳基燃料固体氧化物燃料电池基础应用研究”工作的深入,期待在催化剂和反应器系统的研究上取得新的突破,使微小型SMR技术成功应用于SOFC。














 京公网安备 11010502051620号
京公网安备 11010502051620号




