《1 前言》
1 前言
原发性肝癌(以下称肝癌)是我国常见恶性肿瘤,首选手术治疗,然而,在因症状就医的病人中,仅有 20 % ~ 25 % 的病人有手术的可能性。 在非手术治疗的方法中,有经肝动脉介入化疗栓塞(TACE)等,然而对不能手术肝癌的疗效都不够理想。放疗是癌症治疗的三大手段之一,但在治疗肝癌上却没有地位。近 10 余年来,随着计算机技术的发展和其在医学中的应用,放疗的最新技术:3DCRT(3 - dimensional conformal radiation therapy)和 IMRT(intensity - modulated radiation therapy)得以产生和发展。这些新放疗技术能使高剂量照射区域和肿瘤的立体形态完全一致,能给肿瘤很高的放射剂量,而降低对肿瘤周围正常组织的剂量,国外已经应用于前列腺癌等,显著提高了肿瘤局部控制率,放射并发症明显减少。3DCRT 和 IMRT 用于肝癌放疗在国际上还没有成熟经验,笔者等进行此研究的目的是建立肝癌放疗的技术和规范,应用于临床,评价疗效和治疗的毒副作用。
《2 肝癌放疗的基础研究》
2 肝癌放疗的基础研究
《2.1 3DCRT 和 IMRT 照射的基本原理》
2.1 3DCRT 和 IMRT 照射的基本原理
3DCRT 和 IMRT 放疗的基本原理是聚焦式照射:以肿瘤为中心,在 360° 范围内设计多个照射野,放射线从不同方向射入肿瘤,使剂量聚焦于肿瘤,而对肿瘤周围正常组织的剂量分散,所以能给肿瘤很高放射剂量,而正常组织的单位剂量明显减少(见图 1)。但由于肿瘤的立体形态是不规则的,不同照射方向的肿瘤几何形状不同,为减少对肿瘤周围正常组织的放射,每个放射野的几何形状必须和肿瘤形状一致。为此发明了多叶准直器技术(multi leaf collimator, MLC ),MLC 由多排相对的铅条组成,把不同的铅条按照肿瘤的形状按排,就能拼成一个和肿瘤几何形状基本相同的放射野形状(见图 2,来自 Varian Com.)。在计算机控制下,MLC 能形成千变万化的几何形状以适合肿瘤不同的几何形状。因此 3DCRT 和 IMRT 技术能做到:放射的高剂量分布在立体形态上和肿瘤的立体形态基本保持一致,即适形放疗。IMRT 技术比3DCRT 更先进,能对每个放射野实施不均匀剂量照射,计算机按照肿瘤立体形态来设计,能使肿瘤放射的适形性更好,即高剂量照射区域和肿瘤的立体形态完全一致,而肿瘤周围正常组织放射剂量更低,特别适合那些立体形态非常不规则的肿瘤,或肿瘤和正常的重要脏器十分靠近时。
《图1》

注:中央区域为肝癌病灶,7 个放射野聚焦于肿瘤照射;肿瘤中央的剂量为 50 Gy,
其外围的剂量逐步降低分别为 25 Gy 和 10 Gy
图1 肝癌三维适形和调强放疗的基本原理
Fig.1 Principle of 3 -dimensional conformal and intensity modulated radiation therapy
《图2》

注:MLC 共由 40 对铅条组成,每条宽 1 cm,由独立的马达推动,在计算机控制下,停留在不同部位,形成不同几何形状的放射野。图中的 MLC 形成"靴"形放射野
图2 三维适形和调强适形放疗使用的多叶准直器(MLC)
Fig.2 Multileaf collimator used for 3 -dimensional conformal and intensity modulated radiation therapy
《2.2放射物理学研究》
2.2放射物理学研究
两种肝癌放疗技术比较:3DCRT 与 IMRT 的剂量学研究[1]。
1) 目的:比较肝癌用 3DCRT 或 IMRT 放疗的剂量学参数和其优缺点。
2) 方法:对同一个病人的肿瘤分别用 3DCRT 和 IMRT 设计两个放疗计划,比较它们的放射剂量学参数,获得比较合适的放疗计划。
3) 病例:18 例肝癌病人的 CT 定位片。
4) 放疗计划设计:a. 照射靶区的确定。大体肿瘤体积(GTV):依据 CT,MRI 和 TACE 后碘油沉积确定肿瘤范围;临床肿瘤体积(CTV):在 GTV 外均匀扩大 5 ~ 10 mm;体内肿瘤体积(ITV):根据肿瘤随呼吸运动的程度,在 CTV 外加适当边界;计划治疗体积(PTV):在 ITV 基础上,在三维方向向外扩 5 ~ 6 mm 。正常脏器的定位:肝脏、胃、十二指肠、结肠、肾脏和脊髓。b. 肿瘤剂量的要求和正常器官剂量的限制:以等中心处为剂量归一点,剂量处方在等中心点。要求 95 % 处方剂量包绕 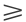 99 % PTV 。剂量计算作不均匀组织校正,PTV 内剂量均匀度为 ±7 %,肿瘤量 50 Gy 。关键器官剂量限制在安全范围内。c. 3DCRT 技术放疗计划:计划设计的原则是尽量降低肝脏剂量,保护一部分正常肝脏不受照射。放射野以共面为主,设置 2 ~ 6 个放射野。d. IMRT 技术放疗计划: 采用逆向调强放疗技术, 复制 3DCRT 的射野数和方向。
99 % PTV 。剂量计算作不均匀组织校正,PTV 内剂量均匀度为 ±7 %,肿瘤量 50 Gy 。关键器官剂量限制在安全范围内。c. 3DCRT 技术放疗计划:计划设计的原则是尽量降低肝脏剂量,保护一部分正常肝脏不受照射。放射野以共面为主,设置 2 ~ 6 个放射野。d. IMRT 技术放疗计划: 采用逆向调强放疗技术, 复制 3DCRT 的射野数和方向。
5) 结果:a. PTV 的剂量覆盖:3DCRT 和 IMRT 计划的剂量覆盖都达到了剂量学要求。IMRT 照射肿瘤的适形性比 3DCRT 更好(见图 3)。b. 肝脏剂量:在给肿瘤 50 Gy 的剂量时,IMRT 计划对肝脏的放射剂量更低(见表 1)。
《图3》
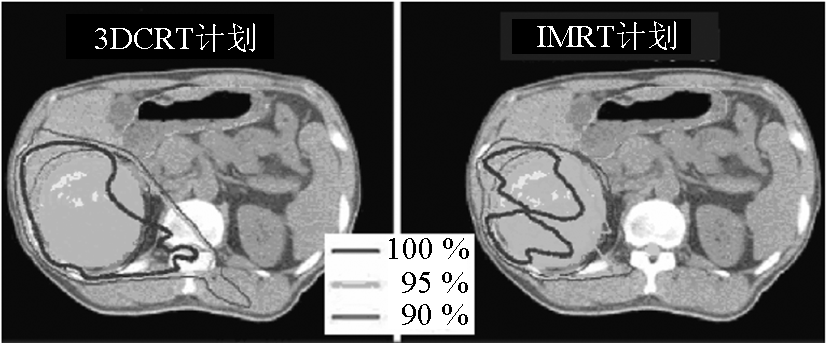
图3 肝癌的 3DCRT 和 IMRT 放疗计划剂量分布的比较
Fig.3 Comparison of dose distribution between 3DCRT and IMRT in hepatocellular carcinoma
《表1》
表1 3DCRT 和 IMRT 照射肝癌时肿瘤和正常肝脏剂量的比较
Table1 Dosimetric comparison between 3DCRT and IMRT for tumor and normal liver in hepatocellular carcinoma irradiation
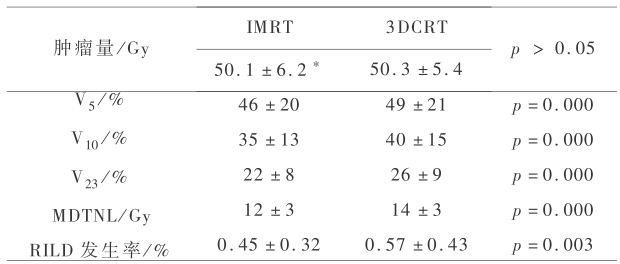
* 均数 ± 标准差;V5 —接受 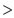 5 Gy 照射的肝脏占全肝 体积的百分比,V10 ~ V23 类推;MDTNL —正常肝脏平均剂量;RILD —放射性肝病
5 Gy 照射的肝脏占全肝 体积的百分比,V10 ~ V23 类推;MDTNL —正常肝脏平均剂量;RILD —放射性肝病
6) 结论:IMRT 放疗技术与 3DCRT 比较,在给予相同的肿瘤照射剂量时,减少了正常肝脏平均剂量,降低了 RILD 发生率。因此 IMRT 技术有增加肝癌肿瘤剂量的潜能。但 IMRT 照射的质量控制要求更高,治疗花费时间更长。因此,如果能达到剂量学要求,应优先考虑使用 3DCRT 技术,但是当达不到剂量学要求时,或正常肝脏受到较大剂量照射,或病人肝硬化严重不能耐受大剂量照射时建议使用 IMRT 。
《2.3 大鼠部分肝照射后正常肝脏再生的实验研究[2]》
2.3 大鼠部分肝照射后正常肝脏再生的实验研究[2]
1) 背景和目的:肝癌放疗不可避免对正常肝脏产生放射损伤,特别是 RILD,死亡率高达 76 %,因此预防 RILD 发生至关重要。 肝脏具有强大的再生能力,在被部分切除后,剩余肝脏可以通过肝细胞的分裂和增生,以代偿肝功能。然而对放射损伤后肝脏再生的研究尚属空白。通过对大鼠的实验,检测未受照射肝脏能否出现再生,它的增殖动力学以及参与的细胞因子。
2) 方法:单次照射大鼠左半肝脏 25 Gy 。大鼠随机分为 6 组:照射前(0 d),照射后 14 d,30 d,60 d,90 d 和 120 d 。分别在照射后不同时间点处死大鼠。取照射区肝脏,进行 TGF - β1 免疫组化染色和三色染色检测肝放射损伤;在非照射区的肝脏检测有丝分裂指数(分裂细胞数/1000 细胞)、增殖细胞核抗原(PCNA)评价肝的再生;用免疫组化检测 TGF - β1 在非照射区的表达情况;检测血清中肝细胞生长因子(HGF)、谷丙转氨酶(ALT)和谷草转氨酶(AST)。
3) 结果:组织形态学、TGF - β1 和三色染色证明,25 Gy 照射使照射区肝脏产生了放射损伤,照射后 60 d,ALT 和 AST 升高至峰值。大鼠血清中 HGF 在照射后 14 d 开始升高,照射后 30 d 升至峰值,与其他时间点的值比较有显著性差异(p < 0.05)(见图 4)。在非照射区的肝脏,每 1000 个肝细胞 PC - NA 强染色的细胞数目也在放射后逐步升高,其峰值出现在照射后 60 d((77 ± 2)/1000 个肝细胞),与照射前、照射后其他时间点相比,其差异均有统计学意义(p < 0.05)(见图 5)。每 1000 个肝细胞有丝分裂的细胞数目峰值出现在照射后的 60 d((5 ± 0.4)/1000 个肝细胞),与在照射前、照射后各时间点比较,差异均显著(p < 0.05)(见图5)。肝脏非照射区肝小叶中央静脉周围也出现了 TGF - β1 阳性表达。
《图4》

图4 大鼠左半肝脏照射 25 Gy 后血清中 HGF 的变化(单位:pg/mL)
Fig.4 The kinetic change of hepatic growth factor in serum after 25 Gy to the left half liver in rat(Unit:pg/mL)
《图5》
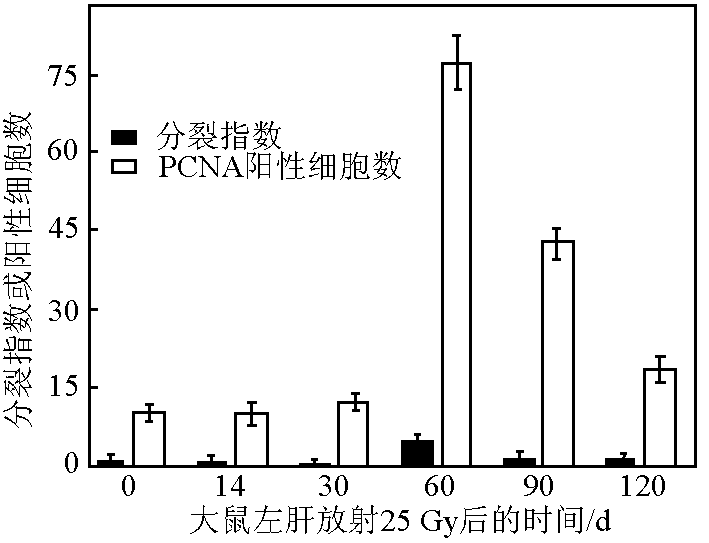
图5 25 Gy 照射大鼠左半肝后右半肝脏有丝分裂指数和 PCNA 阳性的肝细胞数
(1/1000 肝细胞)
Fig.5 Mitotic index and the number of PCNA positive hepatocytes in right half of the liver after 25 Gy to the left half liver (1/1000 cells) in rat
4) 结论:大鼠正常肝脏接受 25 Gy 照射后,在照射区出现了肝脏放射损伤。未被照射的肝脏在放射肝损伤的刺激下出现了肝脏再生,在放射 60 d 后再生最为显著。HGF 和 TGF - β1 参与了照射后肝脏再生的过程。
《3 肝癌3DCRT 和 IMRT 放疗的临床试验》
3 肝癌3DCRT 和 IMRT 放疗的临床试验
《3.1 主动呼吸控制技术(active breath control,ABC)用于肝癌放疗的可行性及剂量学研究[3]》
3.1 主动呼吸控制技术(active breath control,ABC)用于肝癌放疗的可行性及剂量学研究[3]
1) 背景和目的:肝癌在放疗中,会随呼吸在头脚方向运动 1 ~ 3 cm,为了包括运动中的肿瘤,必须扩大放射区域,由此增加了正常肝脏照射。为消除呼吸运动对照射的影响,试验旨在建立用于肝癌放疗的 ABC 技术。
2) 方法:入选病人完成 ABC 呼吸训练后,进行放疗计划设计,摆位验证以及放疗实施。评估 ABC 应用于肝癌放疗的可行性,测量放疗的摆位误差和肝脏位置的重复性,并与自由呼吸(FB)时的放疗计划进行放射物理学剂量比较。
3) 结果:28 例病人入组,病人对 ABC 装置的配合良好,均能全程耐受屏气。 在平静呼吸状态下,横膈在头脚方向运动幅度平均为 15 mm 。使用 ABC 放疗时,一次屏气过程中肝脏上下移动幅度平均为 1.3 mm 。在一次放疗中和分次放疗间,肝脏位置的重复性( 标准差)分别是: 头脚方 向 1.6 mm 和 6.7 mm;前后方向 0.9 mm 和 4.4 mm;左右方向 0.7 mm 和 5.4 mm 。ABC 技术下,PTV 的平均体积由 FB 的(781 ± 527)cm3 减少到(529 ± 320)cm3(p = 0.000);全肝平均剂量(MDTNL) 从(16.9 ± 4.6) Gy 减少到 (14.3 ± 3.7) Gy ( p = 0.000)。ABC 计划和 FB 计划平均的 V23 分别为 30 % 和 41 %(p = 0.000),RILD 发生率分别为 1.0 % 和 2.5 % ( p = 0.009)。使用 ABC 放疗肝癌时,病灶解剖位置的随机误差和系统误差见表 2 。
《表2》
表2 用 ABC 技术放疗肝癌时病灶解剖位置的摆位误差
Table2 Set -up errors of hepatic lesion when ABC device was used in hepatocellular carcinoma irradiation mm

* 均值和范围
4) 结论:ABC 技术用于肝癌放疗是可行的,使放疗中的肝脏处于固定状态,摆位精确性和重复性好。该技术能减少肝脏照射体积,降低平均剂量。在使用 ABC 时,建议从 ITV 扩大到 PTV 的距离为头脚方向 6.0 mm;前后方向 5.7 mm;左右方向 5.0 mm 。
《3.2 肝癌大分割 3DCRT 放疗的临床研究[4]》
3.2 肝癌大分割 3DCRT 放疗的临床研究[4]
1) 目的:分析了用大分割3DCRT 放疗肝癌的疗效和毒性及副作用。
2) 材料与方法: 1999 — 2003 年用 3DCRT 对 128 例肝癌进行大分割放疗。T3 期 83 例,T4 期 45 例,均为 N0 和 M0。 有门脉癌栓 34 例。肝功能Child -Pugh A 级 108 例, B 级 20 例。GTV 为(459 ± 430) cm3,中位肿瘤直径 10 cm 。每次分割剂 量 5 Gy, 隔天照射 1 次, 肿瘤剂量(53.6 ± 6.6)Gy 。
3) 结果:毒性和副作用:RTOG 2 级急性上消化道毒性 8 例,RTOG 3 级后期上消化道毒性 4 例。19 例发生 RILD(15 %),其中 16 例死亡。1,2,3 年生存率分别为 65 %,43 % 和 33 % 。T 分期、GTV 、门脉癌栓和 Child - Pugh 肝硬化分级对生存率的影响有显著意义。多因素回归分析显示,大体积 GTV 和 Child - Pugh B 肝功能的病人生存率明显差于小体积 GTV 和 Child - Pugh A 的病人 (p 分别为 0.044 和 0.015,相对危险度分别为 1.001 和 2.528)。
4) 结论:3DCRT 大分割放疗肝癌是可行的,取得了较好的生存率,T 分期和门脉癌栓对生存率有影响,GTV 体积大和 Child - Pugh B 是 3DCRT 放疗肝癌生存率差的独立预后因子。RILD 是最严重的治疗并发症。
《3.3 肝动脉化疗栓塞(TACE)和放疗联合治疗肝癌的临床研究[5]》
3.3 肝动脉化疗栓塞(TACE)和放疗联合治疗肝癌的临床研究[5]
1) 背景和目的:TACE 是肝癌常用的治疗方法,联合 TACE 和 3DCRT 治疗对肝癌的疗效可能更好,观察联合治疗病人的耐受性和疗效。
2) 方法:50 例肝癌入组,中位肿瘤直径 7 cm 。先用 TACE 2 次, 再进行 3DCRT 放疗,2 Gy/次,1 次/天,5 天/周,平均肿瘤剂量:(43 ± 6.3 ) Gy 。
3) 结果:毒性副作用,5 例发生急性肝脏毒副反应,1 级2 例,3 级 3 例。4 例出现 1 级上消化道急性损伤。10 例出现 1 或 2 级外周血白细胞降低。2 例发生 RILD,最终均死于肝功能衰竭。全组的 1 ~ 3 年总生存率分别是 60 %,38 % 和 28 %,中位生存期 17 个月。1 ~ 3 年的局部肿瘤控制率分别是 74 %,57 % 和 38 % 。1 ~ 3 年的远处转移率分别是 15 %,21 % 和 40 % 。单因素分析表明:T 分期、分期、门脉癌栓、照射剂量和肝硬化 Child - Pugh 分级对生存率的影响有统计学意义。多因素分析显示 T 分期、肿瘤照射剂量和肝硬化 Child - Pugh 分级是预后的独立影响因素。
4) 结论:联合 TACE 和 3DCRT 治疗肝癌的疗效好于历史对照,病人的耐受性好,毒性和副作用可以接受。
《3.4 肝癌的联合 TACE 和 3DCRT/IMRT 放疗的剂量递增临床试验[6]》
3.4 肝癌的联合 TACE 和 3DCRT/IMRT 放疗的剂量递增临床试验[6]
1) 背景和目的:放疗剂量越高,肝癌的局部肿瘤控制越好,提高剂量可能改善肿瘤的控制,但是在文献中尚不知病人能耐受的最大放射剂量(MTD)。此研究为前瞻性临床 I 期试验,以确定联合 TACE 和 3DCRT / IMRT 治疗应用于肝癌,病人的 MTD 。
2) 材料及方法:入组标准,单个病灶,不能手术,无肝内播散和/或远处转移,肝功能 Child - Pugh A 级。按肿瘤最大直径把病人分为 2 组: 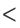 10 cm(第 I 组) 及
10 cm(第 I 组) 及  10 cm(第 II 组)。第 I 组起始剂量 42 Gy,至最大剂量 62 Gy;第 II 组起始剂量 40 Gy,至最大剂量 52 Gy 。常规分割照射:2 Gy/次,每天1 次,每周 5 次。每个剂量点的递增为 4 Gy 。剂量限制性毒性( TLD)为
10 cm(第 II 组)。第 I 组起始剂量 42 Gy,至最大剂量 62 Gy;第 II 组起始剂量 40 Gy,至最大剂量 52 Gy 。常规分割照射:2 Gy/次,每天1 次,每周 5 次。每个剂量点的递增为 4 Gy 。剂量限制性毒性( TLD)为  3 级急性肝脏、胃肠道毒性,任何 5 级的治疗相关性毒性或后期 RILD 。放射前使用 2 疗程 TACE 。使用 ABC 技术控制呼吸运动。
3 级急性肝脏、胃肠道毒性,任何 5 级的治疗相关性毒性或后期 RILD 。放射前使用 2 疗程 TACE 。使用 ABC 技术控制呼吸运动。
3) 结果:2005 — 2008 年,共 40 例肝癌病人入组,第 I 组及第 II 组各 20 例。T2 期 20 例,T3 期17 例,T4 期 3 例。急性治疗相关性毒副作用:第 I 组中发生 11 例(56 %);第 II 组中发生 10 例(50 %)。DLT 仅在第 II 组的 52 Gy 组发生 1 例 RILD,该例 2 周后死于肝功能衰竭。40 例中 25 例治疗失败,失败主要原因是肝内播散,占 84 %(21/25)。1 年和2 年放射体积内肿瘤控制率为 100 % 和 69 %;1 年和 2 年肝内肿瘤控制率为 93 % 和 44 %;1 年和 2 年远处转移率为 6 % 和 15 %;1 年和 2 年总生存率为 72 % 和 62 % 。
4) 结论:联合 TACE 和 3DCRT / IMRT 放疗用于局部晚期肝癌,获得了 MTD:肿瘤 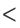 10 cm 是 62 Gy,
10 cm 是 62 Gy, 10 cm 是 52 Gy 。与历史资料相比,肝癌局部控制率明显提高,证明了设计的假设———提高肿瘤放射剂量能改善肝癌的局部控制。
10 cm 是 52 Gy 。与历史资料相比,肝癌局部控制率明显提高,证明了设计的假设———提高肿瘤放射剂量能改善肝癌的局部控制。
《4 肝脏放射性损伤的临床研究》
4 肝脏放射性损伤的临床研究
《4.1 放射性肝病(RILD)和肝脏的放射耐受剂量研究[7]》
4.1 放射性肝病(RILD)和肝脏的放射耐受剂量研究[7]
4.1.1 RILD 发生的危险因素
1) 目的:RILD 是肝癌放疗最严重的并发症,此研究要寻找肝癌 3DCRT 放疗后发生 RILD 的危险因素。
2) 材料:2000 - 2004 年,109 例肝癌病人接受了 3DCRT。Child - Pugh A 级 93 例,B 级 16 例。肿瘤量 54 Gy ( 38 ~ 68 Gy ),每次分割剂量 5 Gy,隔日一次。
3) 结果:RILD 发生率为 16 %(17/109)。单因素分析表明:T 分期、GTV、门脉癌栓、肝硬化分级,TACE 和放疗期间急性肝功能损伤与 RILD 的发生有关(p 值分别为 0.006,0.036,0.037,0.000,0.017 和 0.000)。多因素表明肝硬化分级是独立的影响因子(p = 0.000),Child - Pugh B 的肝脏对放射耐受性差。
4) 结论:在本组病人接受的放射剂量前提下,RILD 发生主要与肝癌病人原有硬化严重程度有关,Child - Pugh B 病人发生 RILD 的危险很大,建议对他们的放射要谨慎。
4.1.2 肝脏放射耐受剂量的研究
1)背景和目的:RILD 是一个高致死性的肝脏放射并发症,关键是预防 RILD 的发生,即在设计放疗计划时,把对肝脏放射剂量限制在能耐受的范围内。但什么是我国肝癌病人正常肝脏的放射耐受剂量?我国的肝癌建立在乙型肝炎导致肝硬化的基础上,欧美提出的正常肝脏放射耐受剂量(30 Gy)适合我国国情吗? 笔者对肝脏放射耐受剂量进行了研究。
2) 材料和方法:用 4.1.1 中的同一组病人进行研究。肝脏耐受剂量应用 Logistic 模型和受试者曲线(ROC)进行估计。109 例肝癌病人中有 93 例的肝功能是 Child - Pugh A,16 例 Child - Pugh B 。
3) 结果:93 例 Child - Pugh A 和 16 例 Child - Pugh B 病人,各发生 RILD 8 例和 9 例,发生率 16 %(17/109),13 例 RILD 死于肝功能衰竭, 死亡率76 % 。在 Child - Pugh A 病人中,发生 RILD 病人的正常肝平均剂量(MDTNL)是(24.9 ± 3.9 ) Gy,而没有发生者是(19.9 ± 5.4) Gy(p = 0.008)。经 ROC对剂量的分析结果,正常肝脏耐受剂量是 MDTNL23 Gy(见图 6)。病人能耐受的肝脏放射剂量,用三维剂量学的剂量体积直方图(DVH)的形式来表示为:V5 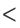 86 %, V10
86 %, V10 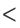 68 %, V15
68 %, V15 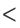 59 %, V20
59 %, V20 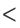 49 %, V25
49 %, V25 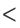 35 %, V30
35 %, V30  28 %, V35
28 %, V35  25 % 和 V40
25 % 和 V40  20 %(见图 7)。用 MDTNL 23 Gy 来预测肝癌病人RILD 的发生率,敏感性 0.875,特异性 0.706,预测的准确率 0.720 。
20 %(见图 7)。用 MDTNL 23 Gy 来预测肝癌病人RILD 的发生率,敏感性 0.875,特异性 0.706,预测的准确率 0.720 。
《图6》

图6 获得肝功能 Child-Pugh A 病人的正常肝脏放射耐受剂量的受试者曲线分析
Fig.6 ROC analysis of liver irradiation tolerance dose in Child-Pugh A hepatocellular carcinoma
《图7》
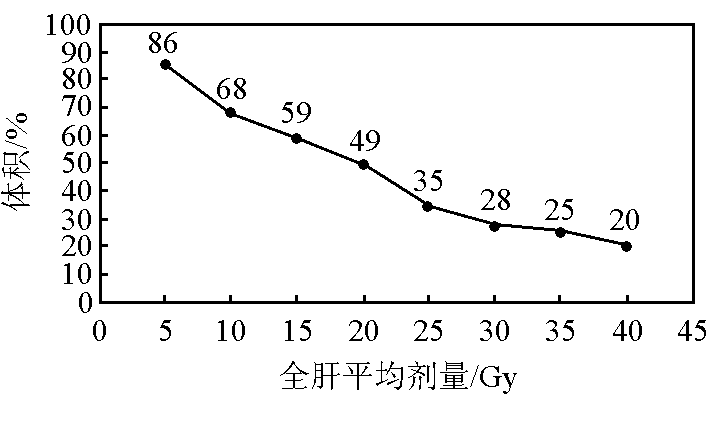
图7 肝功能 Child-Pugh A 病人的正常肝脏能耐受的剂量体积直方图(DVH)
Fig.7 Liver tolerance dose as dose volume histogram (DVH) for Child-Pugh A patients
4) 结论: 在我国肝癌病人放疗中,肝功能差(Child - Pugh B)是发生 RILD 的主要危险因素。对 Child - Pugh A 病人,肝脏能耐受的剂量是:MDTNL23 Gy 。笔者等在文献中第一次提出了能耐受的、用三维放疗剂量学表示的放射剂量(DVH)。我国肝癌病人的肝脏对放射的耐受性明显差于国际上建议的放射耐受剂量 30 Gy,主要原因是我国肝癌病人的肝脏大都伴有肝硬化,由此损坏了肝脏对放射损伤修复和增殖的能力,导致放射耐受性差。因此,国外的肝脏放射耐受剂量不适合我国伴有肝硬化的肝癌病人。
《4.2 放射性肝病预测的数学模型研究[8]》
4.2 放射性肝病预测的数学模型研究[8]
1) 目的:建立肝癌放疗中预测 RILD 的数学模式。
2) 材料和方法:使用 4.1.1 中的 109 例,建立 Lyman 模型,来预测肝功能 Child - A 和 Child - B 患者放疗后发生 RILD 的可能性。
Lyman 的公式如下:
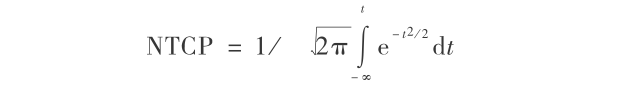
其中

用最大拟然比方法来得出 Lyman 模型参数:n,m 和 TD50(1)。
3) 结果:对肝功能为 Child - A 病人, Lyman 模式的参数为:n = 1.1, m = 0.28, TD50 ( 1 ) = 40.5 Gy(见图 8);对 Child - B 病人,n = 0.7, m = 0.43,TD50 ( 1 ) = 23 Gy(见图 9)。
《图8》

研究的参数:n = 1.1;m = 0.28;TD50 ( 1 ) = 40.5 Gy 密歇根大学的参数 :n = 0.97;m = 0.12;TD50 ( 1 ) = 40.5 Gy
图8 预测肝功能 Child-Pugh A 病人放射性肝病可能性的 Lyman 模型
Fig.8 Lyman model for predicating the RILD possibility of liver function Child-Pugh A patients
《图9》

研究的参数: n = 0.7;m = 0.43;TD50 ( 1 ) = 23 Gy 密歇根大学的参数 : n = 0.97;m = 0.12;TD50 ( 1 ) = 39.8 Gy
图9 预测肝功能 Child-Pugh B 病人放射性肝病可能性的 Lyman 模型
Fig.9 Lyman model for predicating the RILD possibility of liver function Child-Pugh B patients
4) 结论:从我国肝癌伴肝功能 Child - Pugh A 病人资料中,获得的 Lyman 模型与国际上常用的美国密歇根大学模型相比,n 和 TD50 ( 1 ) 相似,但两条曲线的斜率不同,因此在肝脏低剂量照射时,用美国Lyman 模型来预测我国肝癌发生 RILD 的可能性时,存在过低估计发生率的情况。对于 Child - Pugh B 的病人,则大大低估了发生 RILD 可能性。
《5 讨论》
5 讨论
通过肝癌放疗的基础和临床研究,建立了适合我国国情的肝癌放疗经验,包括放射物理学技术参数、操作规范和放疗质量控制及保证系统,并进行了临床试验,证实了用 3DCRT 和 IMRT 放疗新技术对不能手术的肝癌进行治疗,对多数病人有姑息治疗作用,对其中一部分病人有比较好的疗效,可作为不能手术肝癌的一种治疗选择。
1)适应征和疗效。 肝癌放疗的适应征:a. 组织学或细胞学证实的,或符合临床诊断标准的肝癌;b. 单个病灶 ; c. 肝功能分级为 Child - Pugh A;d. 病人一般情况好,如卡氏评分  70;e. 骨髓和肾功能正常。 不宜放疗的病人:a. 已发生远处转移;b. 肝功能Child - Pugh 分级为 B 和 C;c. 肿瘤边界在影像学上无法确认。肝癌病人在 3DCRT / IMRT 放疗后,3 年生存率达到 28 % ~ 33 % 。然而,对更晚期的肝癌,如肝门肿瘤压迫、门静脉和下腔静脉瘤栓等,放疗有姑息治疗的作用。
70;e. 骨髓和肾功能正常。 不宜放疗的病人:a. 已发生远处转移;b. 肝功能Child - Pugh 分级为 B 和 C;c. 肿瘤边界在影像学上无法确认。肝癌病人在 3DCRT / IMRT 放疗后,3 年生存率达到 28 % ~ 33 % 。然而,对更晚期的肝癌,如肝门肿瘤压迫、门静脉和下腔静脉瘤栓等,放疗有姑息治疗的作用。
2) 放疗前使用 TACE 。建议在放疗前使用 TACE,有以下优点:a. TACE 后,由于碘油沉积,使肿瘤边界明确显示,有利于靶区确认,也有助于放疗计划的验证;b. TACE 能显示 CT 不能发现的肝内播散病灶;c. TACE 可能消灭或抑制肝内业已存在的播散灶。
3) 放疗技术问题。a. 使用呼吸控制技术来减少病灶的运动;b. 照射靶区的确定依据 CT,MRI 和碘油;c. 放疗计划设计原则:把正常肝脏的剂量限制在安全范围内,保留一部分正常肝脏不受照射;d. 放疗技术:用 3DCRT 技术,如达不到剂量学要求,则使用 IMRT;e. 放疗分割方法:对局部晚期肝癌,特别是肝功能不够好的病人,使用常规分割照射。能耐受的总量:肿瘤直径 <10 cm,62 Gy, 10 cm,52 Gy 。对体积小的肝癌,或姑息放疗,可用大分割照射。
10 cm,52 Gy 。对体积小的肝癌,或姑息放疗,可用大分割照射。
4) 放疗并发症。最严重的是 RILD,发生的危险因素是原有肝硬化严重程度。预防 RILD 的方法是限制正常肝脏放射剂量在能耐受的安全范围内。美国密歇根大学预测 RILD 的 Lyman 模型不适合我国有硬化肝癌发生 RILD 的预测。建议使用笔者等提出的 Lyman 模型参数。
5) 我国肝癌病人肝脏的放射耐受剂量。肝功能 Child - Pugh A 病人:MDTNL ≦ 23 Gy 和正常肝脏耐 受的 DVH(见 图 7); Child - Pugh B 病 人:MDTNL 6 Gy 。在笔者最早的第一个肝癌放疗临床治疗中(见 3.2),使用国外通用的肝耐受剂量,RILD 的发生率 16 %,笔者等从失败教训中获得了肝硬化病人的耐受剂量,因此在两个前瞻性临床试验中(见 3.3 和 3.4 ),用降低了的肝脏耐受剂量。最终 RILD 的发生率是 4 %(3.3 研究) 和 2.5 %(3.4 研究)。和第一个研究(见 3.2)中的 16 % 相比,RILD 明显降低。国际上对放射耐受的定义是:放射并发症发生率 < 5 %,因此笔者等提出的我国有肝硬化病人肝的放射耐受剂量是正确的。上述认识已经被写入美国放射肿瘤学的经典教科书 Principle and Practice of Radiation Oncology [9] 。
欧美的肝脏放射耐受剂量是从对转移性肝癌放疗经验中获得,那些肝脏一般没有肝硬化背景,而我国的肝癌建立在肝硬化的基础上。由于肝硬化导致了肝脏修复放射损伤能力下降,也损害了肝脏的再生潜力,因此对放射的耐受性差,上述使得东西方在肝脏放射耐受性上形成差异。














 京公网安备 11010502051620号
京公网安备 11010502051620号




