《1. 引言》
1. 引言
研究人员在开发和试验对抗致命疾病的药物方面取得了无数进展。然而,一种药物的完成和获得批准大约需要12年,在这个漫长的过程中可能会有数百万人丧生[1]。此外,在新药的临床前试验阶段使用二维(2D)细胞培养模型和动物模型导致过去10年新药的批准率较低[2‒3]。2D细胞培养未能准确预测药物的原因主要是这些培养物与三维(3D)微环境及其静态培养条件之间缺乏相似性,并且动物模型相对昂贵且在解剖学上与人体不同。因此,最近人们开发了新的体外细胞培养方法,以实现充分和有效的药物试验[4‒5]。
一方面,对器官芯片技术的研究已给细胞培养方法带来了更高的准确性。一般来说,器官芯片可以被定义为包含器官特异性细胞并模拟器官水平功能的微流体装置。它是一种有用的工具,可以被轻松控制和分析,最重要的是,它可以模拟小型器官中的复杂组织。这种新方法可以说比传统的2D单层静态细胞培养方法具有更多优势,在人体组织培养能力、成本以及伦理和公众关注方面,已被证明是动物模型的更好替代方案[6]。器官芯片装置的可行性是另一个促使研究人员将其应用于模拟心脏[7‒10]、肺[11‒13]、肝脏[14‒16]、皮肤[17‒19]、大脑[20‒22]和肾脏[23‒24]等人体器官的主要动力。另一方面,模拟体内器官需要详细了解其功能。人体中最丰富的器官是血管系统,这种血管循环系统将氧气和营养物质输送到身体其他系统,包括呼吸系统、消化系统、肾脏和泌尿系统。血管在维持身体处于稳态和确保器官最佳功能方面起着至关重要的作用。因此,将营养和氧气供应系统(即血管)集成到器官芯片中对于重建器官的微环境和生理功能是必要的(图1)。
《图1》
图1 血管和器官芯片的主要功能,以及它们在血管化的器官芯片上的交集。(a)循环系统(包括毛细血管和血流方向)示意图;(b)器官芯片的基本结构和组成。
本文聚焦于血管化的器官芯片装置的构建。首先描述了血管和器官芯片的制造过程,特别关注了两个关键步骤:芯片结构制造和组织构建。然后,通过描述各种最新的高精度模型,证明了在几种器官芯片和肿瘤芯片装置上应用血管的重要性。这将有助于定义一种新的、有前途的药物筛选手段。
《2. 血管化的器官芯片的制造》
2. 血管化的器官芯片的制造
器官芯片和血管化的器官芯片的制造有几种创新方法[25]。这些方法根据模型中要实现的目标特性而有很大差异。通常,器官芯片的制造分五个步骤完成(图2)。第一步,设计器官芯片平台并对其进行3D建模。第二步,使用基于光刻的方法或能够使用兼容材料的其他方法制造装置的外壳结构。第三步,在制造完装置外壳后,通常使用微流体或生物打印策略来实现组织构建。第四步,由于组织和装置结构的复杂性,器官芯片通常由几层组成;此外,微制造方法在工艺的第二步中存在局限性,这需要一个键合步骤来连接所有部件并形成芯片。第五步,将该装置连接到载有营养物质或药物的流体循环系统,从而可以精确控制整个系统。在一些相关研究[26‒28]中,通过使用不需要键合步骤的生物打印技术可一步完成装置和组织制造,总共只需三个步骤即可实现制造过程。最后完成平台结构的制造和组织的生物打印,这是最具挑战性和最重要的步骤,特别是为器官芯片创建血管化组织,我们在本文会做详细描述。
《图2》
图2 器官芯片装置的制造过程。
《2.1. 设计器官芯片平台》
2.1. 设计器官芯片平台
第一步是预制造步骤,使用计算机辅助设计对装置(包括盖子、组织腔、组织结构和流体通道)进行设计和3D建模。在选择3D打印策略后,器官芯片装置被转换成STL(standard triangle language)文件。值得注意的是,对于构建血管化的器官芯片,此步骤需要对血管进行额外建模[29]。因此,对选择合适的血管网络模型进行初步研究至关重要。本文根据项目研究的目标,如血管网络的几何复杂性或高功能效率来选择血管模型。目前对血管网络建模的研究仍在进行,选择合适的模型可以发挥不同生物制造方法的优缺点,本文稍后将对此进行介绍。
《2.2. 制造装置结构》
2.2. 制造装置结构
目前,人们正在使用如文中所述的各种技术大力开发微制造方法。因此,以下部分将重点介绍最新开发的方法,最常用的是基于光刻的方法(包括软光刻和光刻法)以及其他非光刻方法。
《2.2.1. 软光刻法》
2.2.1. 软光刻法
软光刻法是一种使用预制模具复制结构的方法[30]。名称中的“软”来自材料的弹性。聚二甲基硅氧烷(PDMS)通常被认为是最适合这种方法的材料。软光刻法的主要优点是其高微尺寸精度和成本效益。它涉及再铸模(REM)、微接触印刷、毛细管成模、微传递成模和溶剂辅助成模。
一般来说,REM是最流行的软光刻方法。首先需构建一个母模,该母模将被用于二次交联材料。在这种材料成型后将模具分离,然后反模复制[31]。Zheng等[32]用此方法在芯片上创建微血管,用来研究血管生成活动和内皮化微流体血管的血栓形成性质。此外,Miali等[33]证明了这种方法的多功能性,REM过程被用来创建真正复杂的微血管网络,其灵感来自常春藤(Hedera elix)叶。将新鲜收集的叶子贴在PDMS模具中以获得负片,接下来该复制品用于创建SU8-5模板,形成一个模拟人体血管复杂几何和生物学特性的夹层系统。
同样,Nie等[34]将真实的体内血管网络的复杂结构作为模拟的目标。他们选择在三个不同的层面进行模拟[图3(a)] [34]。首先,为了制造高分辨率模板,将3D打印集成到该过程中。然后使用经典的铸造、剥离和黏合工艺,但有趣的是,他们将该工艺与二次交联策略相结合,获得了一个中空平台来完成最后一步,即特定的细胞加载。
《图3》
图3 血管化平台的微制造方法。(a)软光刻法:使用3D打印和二次交联技术制造多尺度血管芯片的过程。GelMA:明胶-甲基丙烯酰基。(b)光刻法:左边是一种新的光刻技术,右边是标准的光刻技术。(c)非光刻法:采用SMART工艺制造微通道。PC:聚碳酸酯。1 bar = 105 Pa。(a)经Royal Society of Chemistry, ©2020许可,转载自参考文献[
《2.2.2. 光刻法》
2.2.2. 光刻法
光刻[也称为光学光刻或紫外(UV)光刻]是基于将图案从掩模转移到实体或薄膜上的方法[35‒37]。该技术可在几纳米范围内实现高精度,并允许制造相对复杂的结构,是构建血管状微通道准确而强大的工具。然而,这是一种耗时且相对昂贵的方法。在最近的一项研究中,Fenech等[38]提出了一种新的基于光刻技术来制造在几何上接近真实自然血管的脉管系统。该工艺使用背面照明和光学扩散器来创建SU-8光刻胶模具,该模具具有可控的圆形横截面并且高度和宽度成正比[图3(b)] [38]。
《2.2.3. 非光刻法》
2.2.3. 非光刻法
尽管基于光刻的方法有一些局限性,但研究人员从未停止改进它们并提出解决这些问题的方案。在体外血管的微制造中最常遇到的限制之一是重建圆形横截面,这激发Kappings等[39]开发了一种被称为vasQchip的新技术。通常,为了简化机器函数的元素,最好的方法是寻找它的对称性。因此,相同的推理可用于研究真实血管的管状几何形状,以创建简化模型。在这项研究中,研究小组构建了一个带有多孔微通道的半圆形支架。通道的制造过程被称为通过热成型(SMART)技术进行的基板修改和复制。该技术首先用重离子照射聚碳酸酯薄膜,然后使用微热成型工艺形成半圆形来黏合微通道[图3(c)] [39]。然而,最近没有研究能够表明使用SMART技术具有制造多尺度和无处不在的血管结构的能力。
《2.3. 构建血管化组织》
2.3. 构建血管化组织
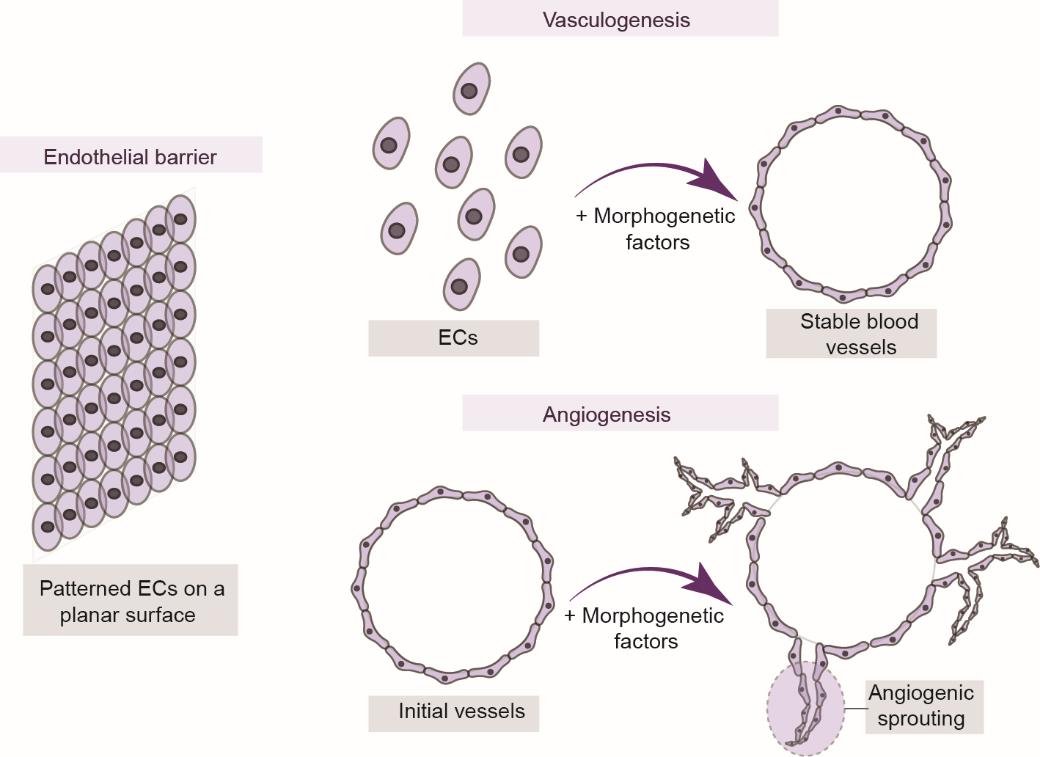
在过去10年中,几个研究团队提出了三种构建血管化组织的模型,包括基于内皮屏障的模型和基于血管生成的模型(血管发生和血管形成模型)(图4)[40‒41]。内皮屏障模型涉及通过在器官芯片装置壁上构型内皮细胞(EC)来创建3D结构[42‒47]。通常,选择该模型是因为它的可行性和可控性,尽管其对于模拟血管发生和血管形成并不可靠。血管生成模型是以内皮细胞的分化与新生血管网络形成为基础。血管生成模型是通过从现有血管中生长和萌发新的毛细血管来构建的[48‒55]。更重要的是,Wang等[54]实现了基于内皮屏障的模型和基于血管形成的模型之间的协同作用,创建了一个能够使动脉/静脉和毛细血管网络之间紧密连接的装置,该装置也可以成为一种用于互连多个器官组织和创建人体芯片平台的有效工具。
《图4》
图4 血管模型(包括内皮屏障模型、血管发生模型和血管形成模型)示意图[
选择好合适的血管模型后,必须为微血管和器官组织选择一种制造策略。有两种主要策略:微流控策略(利用目标细胞在明确定义的微流控条件下的微力学和生化行为来控制它们在装置中的位置);基于直接细胞或组织沉积的生物打印策略。
《2.3.1. 微流控策略》
2.3.1. 微流控策略
在器官芯片装置中集成内皮细胞是确保血管与器官之间相互作用的基础。微流控物理是控制微生理系统中细胞最古老最广泛使用的方法。微流控策略包括对灌注的细胞施加微流控压力,以在某些结构和功能条件下对它们进行封装。有两种主要的微流控方法,即壁面捕获法和微封装法(也称自组装法)。
《2.3.1.1. 壁面捕获法》
2.3.1.1. 壁面捕获法
在器官芯片装置中重建血管,可以通过将内皮细胞捕获在壁面上来实现。壁面捕获法足以构建基于内皮屏障的模型。该方法通过在包含多孔膜、细胞外基质(ECM)或水凝胶的微流体通道中灌注细胞,然后将接种的细胞固定在通道的侧壁以形成内皮屏障。
多孔膜是通过使用前面描述的微制造技术构建的。通常,PDMS是膜材料的合适选择。事实上,多孔膜可以培养不止一种类型的细胞。因此,它可用于研究细胞间相互作用(尽管其部分被膜覆盖而不能保证细胞两侧之间的完全接触)。同样,van Engeland等[56]将膜作为内部弹性层,在微流体一侧培养内皮细胞,并在另一侧培养血管平滑肌细胞(VSMC)。PDMS的弹性使得研究人员可在血流动力学条件下,以及膜的不同机械拉伸和松弛状态下,对EC-VSMC相互作用和信号传导进行研究。探究膜中孔的尺寸和最优数量对于设计多孔膜至关重要。孔径大小对膜的渗透性和纳米粒子迁移有直接影响,因此,会影响药物迁移和其他生物学现象,如肿瘤转移[57]。然而,总的来说,基于多孔膜的壁面捕获法面临明显的限制,因为膜通常是平面的并且缺乏体内血管的中空结构。
除了多孔膜之外,另一种选择是包裹接种细胞的水凝胶。通常,选择胶原蛋白或纤维蛋白凝胶来创建内皮细胞壁(也可使用ECM凝胶构建)。水凝胶的使用有利于创建含腔通道。尽管在不采用生物打印方法的情况下制造中空结构仍然具有挑战性,但管状物体(如针)可以在水凝胶交联后在随后的过程中被去除[58],从而构建中空结构。此外,基于水凝胶的壁面捕获法能够使周围细胞进行充分的相互作用而无需使用中间膜。虽然壁面捕获法主要用于内皮屏障模型,但Pauty等[59]能够将其用于血管生成模型。研究小组使用PDMS芯片来支撑胶原蛋白凝胶,通过插入和拔出涂有牛血清白蛋白(BSA)的针灸针来形成中空的微通道结构。人脐静脉内皮细胞(HUVEC)被注射并保留在微通道壁中。接下来,使用血管生长因子诱导初始的血管化微通道萌芽。除了检测血管生成和血管结构的通透性外,该方法已被证明是研究抗血管生成药物的有效工具。
最后,壁面捕获法可被认为是一种在体外快速重建平面或中空血管的方法,这种方法使用弹性膜或水凝胶来捕获内皮细胞。然而,目前通过支撑水凝胶制造中空结构的方法并不精准,并且无法克服精确的几何和尺寸限制。此外,细胞接种过程会产生高剪切应力,会对被捕获的细胞造成损害。
《2.3.1.2. 微封装法》
2.3.1.2. 微封装法
使用微流控腔或微通道在形态发生条件下封装内皮细胞,是另一种用于在不对细胞施加高剪切应力的情况下重建血管的方法。腔室封装法通常被称为自组装或自形态发生法,因为被封装的细胞在精确定义的微环境条件下自发地开始形成血管。因此,目前的方法足以构建血管发生和血管形成模型。通常,细胞在微封装之后需要注射生长因子以促进血管萌芽和形成。该方法大量使用血管内皮生长因子 (VEGF)以及其他一些因子,包括成纤维细胞生长因子(FGF)。FGF不仅对血管形成有影响,而且对其他对动脉血管形成很重要的所有细胞类型也有影响[60]。尽管如此,FGF的作用仍然没有得到很好的评估,并且很少被用于血管化的器官芯片的形成。血管生成素(ANG)也被用来稳定(ANG-1)或破坏(ANG-2)血管结构。Campisi等[61]在微流控装置中培养了人诱导多能干细胞衍生的内皮细胞(iPSC-EC)。该装置使用了VEGF,从而成功创建了血管化网络,并构建了能够实现iPSC-EC、周细胞和星形胶质细胞的三重培养以模拟血-脑屏障(BBB)复杂结构和微环境的有效平台。在形态发生条件下对内皮细胞的封装通常会产生具有无法预料的萌芽形态的血管网络,这对于构建旨在模拟精准组织结构和功能的器官芯片来说是一个很大的缺点。人们已经尝试通过应用微流控力来实现可控的血管生成方向。更准确地说,通过控制微血管的半径、长度和厚度来塑造新形成的血管,其中主要涉及三种力。这些力包括平行于组织表面并由流动特性如灌注流体的黏度和速度引起的剪切应力、与组织表面相切的周向应力和由腔内压力产生的轴向应力[62]。除了生物力学因素外,许多其他不确定因素也会影响血管发生和血管形成所产生的形状;因此,形态发生法不是重建精确结构的有效工具。
《2.3.2. 生物打印策略》
2.3.2. 生物打印策略
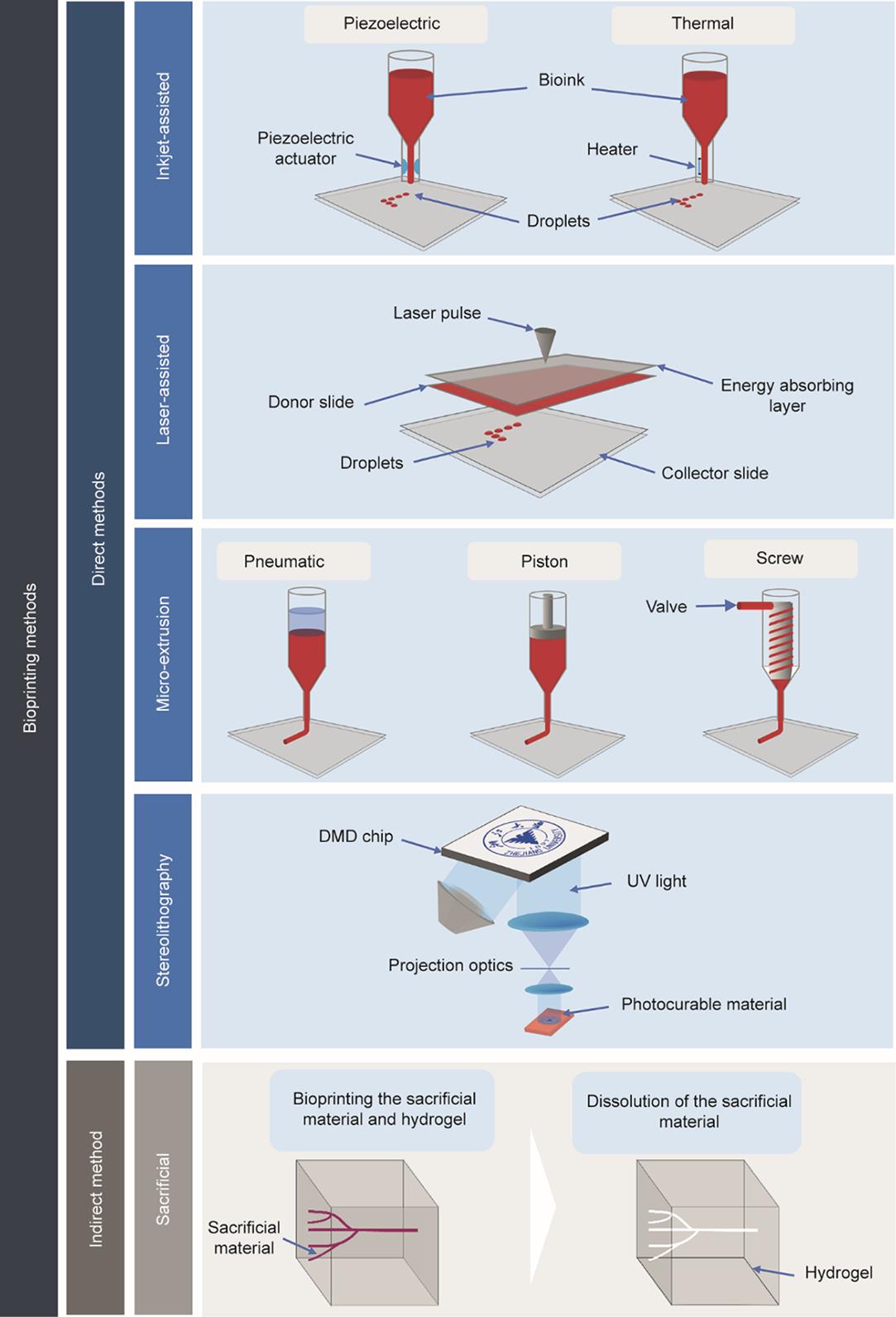
组织的沉积通常由一种被称为生物打印的新兴生物制造技术来实现,这是一种新开发的增材制造过程,可将生物材料以不同的方式层层叠加[63]。生物打印的主要优点在于其成本效益和多功能性,被认为是一种节省时间的技术[64‒65]。因此,使用该技术可以重建整个血管网络的3D结构。生物打印是一种多价策略,可以有效构建前面提到的三种模型。事实上,目前存在五种生物打印方法,每种方法都有其限制和应用(图5)。
《图5》
图5 不同3D生物打印方法示意图。DMD:数字微镜器件。
《2.3.2.1. 喷墨辅助式生物打印》
2.3.2.1. 喷墨辅助式生物打印
喷墨技术是一种按需滴注(DOD)工艺,通过加热或压电驱动喷嘴将液滴置于3D控制的平台上。喷墨生物打印技术是一种具有成本效益的方法,并且因施加在细胞上的低剪切应力(因使用低黏度材料,如纤维蛋白和胶原蛋白),该方法可以保持高细胞活性,因此该技术得到了广泛应用[66]。然而,这种方法获得的精度和结构完整性低。尽管基于液滴的生物打印方法通常难以制造垂直结构,但 Hewes等[67]使用压电喷嘴成功地在纤维蛋白基质中构建了独立的血管结构。然而喷墨生物打印方法不适用于生物制造血管(因其需要高结构稳定性和复杂性)。因此,文献中很少能找到喷墨生物打印的血管化体外模型。
《2.3.2.2. 激光辅助式生物打印》
2.3.2.2. 激光辅助式生物打印
为了实现高速和高分辨率的生物打印,研究人员[68‒70]开发了另一种DOD方法,即激光辅助式生物打印方法。其中能量吸收层带有一层打印的生物材料,由激光源照射来构建所需的结构。然而,与其他生物打印方法相比,激光辅助式生物打印法没有得到广泛使用,原因是它的结构完整性和可扩展性低,并且缺乏足够的生物材料的选择。这种方法一般用于2D细胞打印;因此,当生物制造血管化组织时,DOD方法通常被排除在外。然而,在一项研究中,Xiong等[71]通过创建一个可作为体外血管网络的自由形态分叉管状结构证明了这种方法的多功能性。
《2.3.2.3. 微挤出式生物打印》
2.3.2.3. 微挤出式生物打印
微挤出法基于在压缩条件下将生物材料推出喷嘴。这种压力可以是气动的或机械的[70‒74]。微挤出法具有连续沉积、可行性和与多种生物材料相容性好的特点。选择这种方法是以施加于细胞的高剪切应力为代价的。基于微挤出的生物打印的灵活性体现在其易于被集成到生产过程中,从打印微芯片装置的单个部件到复杂的系统。Lee和Cho [27]创建了第一个一体化制造策略,制造了具有平面内皮屏障的肝脏。打印材料的选择是至关重要的一步;因此,在两个层面上对PDMS与聚(ε-己内酯)(PCL)进行比较。第一个层面是疏水性。研究小组发现,当将这两种材料与水滴并排排列并测量它们的接触角时,两种材料的疏水性几乎相同。第二个层面是蛋白吸附。尽管蛋白吸附对于维持“片上”装置中的介质组成至关重要,但通常被忽略了。PCL具有相对较低的蛋白吸附,因此更适合此类应用(尽管它的光学透明度低)。一体化制造方法能够实现空间异质性,并且不需要像基于立体光刻(SLA)的制造方法那样的二次细胞接种过程。
与标准微挤出式生物打印一样,悬浮式生物打印是一种基于挤出的方法,该方法使用支持浴材料来稳定挤出的结构,并抵消重力以构建空间复杂的架构。Bhattacharjee等[75]使用颗粒凝胶作为生物打印介质,通过尖端注射以追踪微血管的空间路径。注入后,支持浴材料迅速固化以固定悬浮材料。许多材料,如硅胶、水凝胶、胶体和活细胞都可以使用这种方法进行注射;该方法也被认为是结构最稳定的生物制造方法之一。典型的悬浮式生物打印方法是一种新的悬浮式打印法,该方法利用经典方法的结构稳定性,并创建了具有可逆支持浴材料的自由形式结构[76]。这种方法被称为自由形式可逆法或简称为FRESH生物打印法,包括在专门选择的临时、热可逆且可洗脱的支持浴中的组织生物打印。洗脱支持浴材料后,可得到高度复杂且稳定的结构。因此,FRESH生物打印法被认为是构建普遍存在的血管结构的一种可接受且有利的方法[77]。
《2.3.2.4. 立体光刻生物打印》
2.3.2.4. 立体光刻生物打印
SLA是一种基于光固化的策略,于1986年被首次提出,是最早的生物打印方法之一[78]。该过程首先选择一种可紫外固化的材料,随后该材料被逐层交联[79]。传统的SLA方法比其他生物打印方法具有更高的精度和准确度,但也很耗时(因为基于逐点光聚合)。SLA的最新衍生形式是数字微镜器件(DMD)SLA生物打印,也称为数字光打印(DLP),可提供更高的精度。实际上,与使用单镜的标准SLA不同,DMD通常具有数千个可调节镜,从而提供更好的灵活性。这两种方法都是高分辨率生物打印方式,并且比其他方法更昂贵。因为当前文献中可用的选择有限,所以生物墨水是另一个关键选择。Zhang和Larsen [80]采用聚(乙二醇)二丙烯酸酯(PEGDA,分子量为700)来制造可灌注的血管网络。该平台结构相当稳定,灌注寿命至少为7 d。Grigoryan等[81]在最近的一项研究中通过使用DLP证明了这种方法的复杂结构生物制造的潜力,创建了3D血管内拓扑和多血管网络。研究小组在肺泡囊的启发下构建了一个单片式模拟肺灌注系统,该系统被一个功能齐全的血管网络包围,表明此技术的完整性。该研究使用的水凝胶是从优化的无源微混合器中获得的PEGDA和明胶-甲基丙烯酰(GelMA)的混合物。这种方法被认为是构建血管化器官芯片的创新方法。
《2.3.2.5. 牺牲式生物打印》
2.3.2.5. 牺牲式生物打印
另一种生物打印方法,即牺牲式生物打印,被认为是一种间接生物打印方法(因为生物打印后需要用一种技术来去除最初被直接打印的生物墨水,然后由另一种水凝胶基质支撑该结构)[82‒83]。牺牲式生物打印法是构建管腔血管网络的理想方法[63]。Ji等[84]提出了一种新改进的生物打印方法,该方法结合了可光固化水凝胶和牺牲式生物打印法的应用。在整个过程中通过部分固化新打印层并在实现平台的直接打印后立即执行完全固化来进行光固化,该平台随后被浸入磷酸盐缓冲液(PBS)中以溶解牺牲材料。这种方法会对细胞活性造成轻微影响并提高和加强力学性能以制造稳固的平台。
这些不同的生物打印方法各有优缺点(表 1)[64‒82],并且一直在不断地被探索和发展。为目标器官芯片模型选择合适的方法取决于几个参数,包括细胞类型、组织结构,最重要的是器官的主要功能。了解血管化器官芯片的制造过程不足以用目标器官模型认知其完整性。由于器官的每个功能和结构的特殊性及独特性,针对人体组织和器官的生物制造有不同的研究。因此,考虑到血管在真实器官和肿瘤生长中所起的关键作用,为血管化器官/肿瘤芯片选择合适的生物制造工艺是很复杂的。全面了解如何构建有效模型的唯一方法是回顾为每个特定器官模型整合的不同方法。因此,本文有必要强调最近在血管化器官芯片上取得的进展。
《表1》
表1 各种生物打印方法的优缺点
| Bioprinting techniques | Advantages | Disadvantages | Refs. |
|---|---|---|---|
| Inkjet-assisted bioprinting | Medium resolution, medium accuracy, rapid, low cost | Requires low-viscosity materials, low structural integrity, inferior mechanical properties, nozzle clogging | [ |
| Laser-assisted bioprinting | Medium resolution, wide range of printable materials, high accuracy, high cell density, nozzle free | Low structural integrity, inferior mechanical properties, heat harms cells, time-consuming, high cost | [ |
| Micro-extrusion bioprinting | Superior mechanical properties, wide range of printable materials, high cell density, rapid, medium cost | High shear stress, low resolution, low accuracy, nozzle clogging | [ |
| Stereolithography bioprinting | High resolution, high accuracy, no shear stress, nozzle free | Limited range of materials, ultraviolet radiation harms cells, time-consuming, high cost | [ |
| Sacrificial bioprinting | High structural integrity, superior mechanical properties, adequate for hollowed constructs, medium cost | Long fabrication process, low resolution, low accuracy | [ |
《3. 在器官和肿瘤芯片上重建血管》
3. 在器官和肿瘤芯片上重建血管
《3.1. 器官芯片》
3.1. 器官芯片
在体外重建血管对于构建体内类器官至关重要,因为血管在维持组织的特性和功能方面起着重要作用。一些器官芯片已经被成功用于构建血管化的体外器官,主要是肺、肝脏、皮肤、心脏、BBB和肾脏。
《3.1.1. 肺》
3.1.1. 肺
肺是人体氧气的主要来源,其基于隔膜的连续动态运动在外部环境和内部血管系统之间交换气体。在肺部深处,肺泡位于细支气管处,执行气体交换的关键功能。在肺泡扩张过程中,面对吸入空气的一层脆弱的肺泡上皮细胞使氧气通过内皮细胞,然后到达毛细血管。在呼气过程中,二氧化碳被排出。
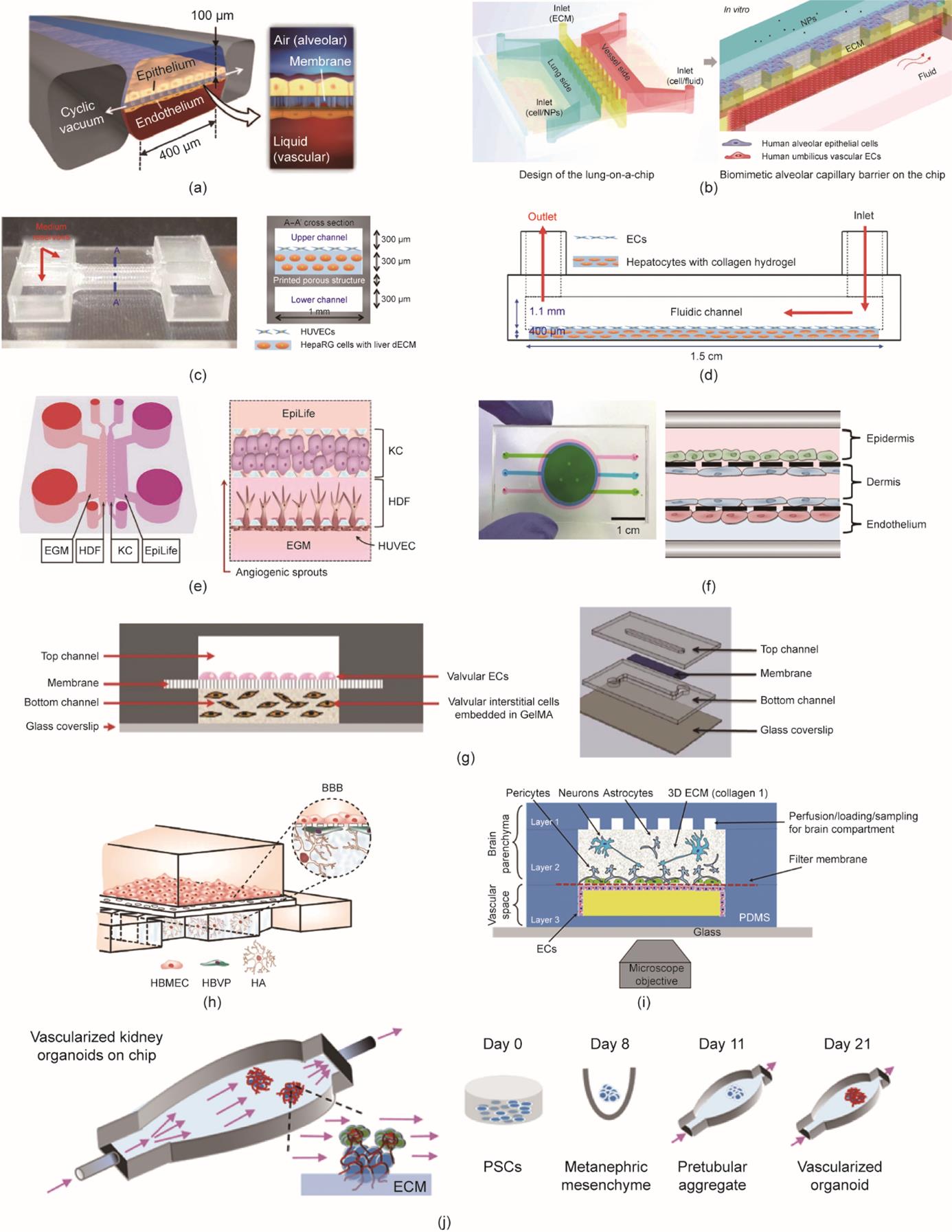
最早的芯片模型是由Huh等[85]开发的肺部芯片模型。该装置可以共培养不同的细胞并模拟肺泡的机械扩张和收缩[图6(a)] [85]。该装置包括双面涂层的多孔膜:上面涂覆内皮细胞,下面涂覆肺泡上皮细胞。血管化模型是在多孔膜上使用细胞接种方法的内皮屏障模型。同时,该芯片用于模拟药物毒性引起的具有呼吸样运动的肺水肿。在另一项研究中,通过在ECM壁上进行细胞接种,证明在肺部芯片中可以实现血管化[图6(b)] [86]。Zhang等[86]制造了一个微流控装置,其中包含三个支持肺泡上皮细胞、ECM和HUVEC的微通道。在含有上皮细胞的肺部一侧,灌注二氧化钛和氧化锌纳米颗粒以测试它们对血管化肺部模型的毒性作用。与基于膜的细胞接种方法相比,基于ECM的细胞接种方法提供了更好的细胞间和细胞基质间相互作用;然而,基于膜的细胞接种方法显示出重建真实肺部的机械动力学的巨大潜力。
《图6》
图6 血管化的器官芯片。(a)动态肺部芯片的示意图。(b)利用ECM壁的肺部芯片示意图。NP:纳米粒子。(c)支持肝脏微环境和胆道系统的肝脏芯片模型。dECM:脱细胞ECM。(d)一体化制造方法制造的肝脏芯片示意图。(e)基于血管生成的血管化皮肤芯片示意图,其中包括内皮生长培养基(EGM)、人真皮成纤维细胞(HDF)、角质形成细胞(KC)和EpiLife培养基[
《3.1.2. 肝脏》
3.1.2. 肝脏
肝脏是一种人体器官,也是人体最大的腺体,执行多种主要功能,调节不同的、必不可少的分泌化学物质和成分(如胆固醇、甘油三酯和胆汁)的比例[87]。肝脏由大小相同的六角形肝小叶组成,由流向中央静脉的来自肝动脉和门静脉的血流供应,胆汁通过肝小叶流向胆管。更具体地说,肝小叶可被简化成一个代表性单元,即肝腺泡。肝脏包含两种不同的细胞类型:肝细胞和非实质细胞,包括肝星状细胞、肝窦内皮细胞和Kupffer细胞。
体外肝脏模型的构建是生物打印方法的一个极具吸引力的应用领域,可以精确沉积未受损的血管化肝脏组织。例如,可以使用基于挤出的生物打印方法,并选择内皮屏障模型来实现血管化的肝脏组织。Lee等[88]构建了一个平台,该平台包含被HUVEC薄层覆盖的含有永生化肝细胞系(HepaRG)的脱细胞ECM [图6(c)]。该装置还具有面向内皮屏障的上通道(履行血管化作用)和模拟胆汁流动的下通道,使芯片装置更加准确。类似地,在前面提到的一体化生物打印装置中,Lee和Cho [27]使用生物打印的PCL 芯片在胶原水凝胶中共培养肝细胞与内皮细胞,形成内皮屏障[图6(d)]。在尿素合成和白蛋白分泌方面,还将血管化的一体化生物打印肝脏芯片与2D体外模型进行了比较,以证明该装置的有效性和效率。在几项研究中,血管化的肝脏芯片也通过使用微流控方法来实现,但细胞总是暴露在剪切应力下,影响了其性能。
《3.1.3. 皮肤》
3.1.3. 皮肤
皮肤作为人体最大的器官,在保护身体免受有害外部因素影响方面起着至关重要的作用。人体皮肤由三层组成。第一层是表皮层,表皮层是皮肤的外层,主要由角质细胞和黑色素细胞组成;第二层是真皮层,由成纤维细胞、巨噬细胞和肥大细胞组成;最后一层是皮下组织,专门用于储存脂肪,并含有高比例的成纤维细胞和巨噬细胞。每一层都有特定的功能,都与血管永久地相互作用[89]。因此,开发有效的体外皮肤模型强烈依赖于体外血管的充分发展。
可以通过血管生成或内皮屏障模型来实现可靠的血管化皮肤芯片装置。Jusoh等[90]通过在释放的促炎因子下结合角质细胞和HUVEC引发血管生成,证明了基于血管生成的血管皮肤模型的可构建性[图6(e)]。因此,微流控平台被证明可用于测试化学刺激物(如十二烷基硫酸钠和硬脂基三甲基氯化铵)对皮肤的影响。Mori等[91]专注于体外皮肤模型中血管通道的灌注能力的重要性;尽管此项研究非常有必要,但可灌注血管模型的构建具有很大的局限性。接着采用内皮屏障模型并使用基于水凝胶的细胞接种方法制造血管。模拟皮肤平台由一薄层角质细胞、载有成纤维细胞的胶原蛋白和起到血管通道作用的圆柱形内皮屏障组成。
此外,在一项有趣的研究中,HaCaT细胞与内皮细胞和成纤维细胞共培养,用肿瘤坏死因子-α进行测试,并引起了皮肤炎症和水肿[图6(f)] [19]。基于细胞屏障模型和基于多孔膜的细胞接种方法培养三层细胞。总体而言,血管集成提供了更有效的药物测试平台,而生物打印方法仍然可以被视为用于几种细胞共培养和精确沉积的一种潜在工具。
《3.1.4. 心脏》
3.1.4. 心脏
心脏是一个泵,将携带营养物质、氧气和代谢废物的血液输送到身体的其他部位。心脏是一种持续活跃的肌肉器官,对能量供应的需求很高,结构紧凑。心壁由以下几层组成:心内膜,是与心腔内泵送的血液直接接触的内层;表层为心包膜;最重要的是心肌层,是最大、最坚硬的层。心肌在产生有氧泵送运动中起着至关重要的作用;因此,氧气供应必须满足足够的能量需求,且需血液供应分布良好。在重建心脏时,通常以心肌为目标,因为它对体外收缩/舒张具有直接作用。
在一项早期研究中,Chen等[92]构建了一个微流控平台,支持嵌入GelMA中的瓣膜内皮细胞和瓣膜间质细胞。该装置通过多孔膜被分成两个通道,收集内皮细胞并形成内皮屏障[图6(g)] [92]。更具体地说,在用新生大鼠心肌细胞接种组织以形成内皮化心肌组织之前,在生物打印的微纤维中发生了HUVEC的血管生成。随后加入灌注生物反应器构建了血管化的心肌芯片模型。
《3.1.5. 血-脑屏障》
3.1.5. 血-脑屏障
BBB是连接中枢神经系统和周围神经系统的高度精确的半透性大脑组分。它由被星形胶质细胞和神经元包围的紧密的内皮细胞层组成。内皮细胞附着在细胞间连接(蛋白质)上,并将连接分为紧密连接、黏附连接和桥粒区域。血液中物质的通过受到内皮细胞的限制,比人体中其他任何毛细血管更具选择性。内皮层被另一层壁细胞、血管平滑肌细胞和周细胞覆盖。毛细血管被两种类型的ECM(由内皮细胞和周细胞分泌的血管基底膜以及由星形胶质细胞分泌的实质基底膜)包围。除了神经元外,星形胶质细胞还用它们的星形足围绕着两层,为这些细胞提供生化支持。
尽管Transwell模型被认为是模拟BBB的一种有效方法,但其仍然是一个静态平台,无法进行细胞的3D动态培养。Ahn等[93]采用血管化的器官芯片的经典结构(一种基于多孔膜的结构)创建了一个微流控BBB芯片平台[图6(h)]。该平台由上通道中的人脑微血管内皮细胞(HBMEC)和下通道中的人星形胶质细胞(HA)支撑。该模型的高精度体现在其分布3D屏幕纳米粒子的能力上。然而,大脑的复杂结构,特别是BBB,不允许将其简化为星形胶质细胞和内皮细胞的共培养。因此,该装置只能作为体内模型的补充。在之前的一项研究中,Brown等[94]尝试用几乎完整的微环境成功重建了BBB [图6(i)]。该平台包含3D ECM中的星形胶质细胞、神经元和周细胞,这些细胞聚集在一个隔室中,而内皮细胞在另一个隔室中。由于多元隔室有助于确保准确的人类BBB的建模,这个新颖的平台提供了潜在的细胞间相互作用的环境。
《3.1.6. 肾脏》
3.1.6. 肾脏
肾脏是一种用于净化从动脉接收的血液以清除废物,并调节氮气、电解质、水和其他有机溶质的重要器官。一个肾脏包含大约一百万个肾单位,包括肾小球和肾小管,它们都有着特定的功能。模拟肾脏的研究已经成功实现了肾小球或肾小管芯片的构建[28,95]。
体外肾脏的实现是基于肾脏内皮-上皮交界面的重建。这种界面的实现是一个巨大的挑战,需要有选择性地挑选材料和尺寸。Rayner等[96]最近开发的一种芯片装置,即人肾脏血管-管状单元(hRTVU),集成了一层胶原薄膜以创建交界面,而不是用传统的PDMS或聚碳酸酯膜,原因是它们在支持将细胞混入大块基质方面存在局限性。该装置使用了细胞可重塑水凝胶和可定制的灌注流模拟了肾脏的体内动态环境。结果,hRTVU显示了对白蛋白选择性重吸收的有效量化。由于缺乏组装精确性,除了相当大的结构问题外,该装置还显示出衰减的流动曲线。显然,装置的简单性是一个必须考虑的关键参数。例如,Homan等[97]使用PDMS开发了一种简化的3D打印装置外壳。研究小组选择了类器官聚集体来重建功能复杂性[图6(j)] [97]。可灌注血管是使用血管生成模型构建的。在本研究之前,灌注流对肾脏类器官血管形成和成熟的影响尚不清楚,需要更多的关注。研究小组发现,流动增强了管状和肾小球隔室中类器官的血管化和成熟。然而,形成的血管并不能确保通过微血管网络的血流灌注,因此需要解决此问题以改进装置。
《3.2. 肿瘤芯片》
3.2. 肿瘤芯片
癌症一直以来是致命的,是人类至今尚未找到治愈方法的少数疾病之一。关于癌症的数据令人震惊[98]。这种复杂的疾病在2017年导致全球956万人死亡,使其成为仅次于心血管疾病(1779万人死亡)的第二大死因[99]。癌症的特征是细胞从其原始部位不受控制的生长和侵袭。传统上,它被认为是由我们仍然不完全了解的一些因素引起的一系列基因组突变导致的。
肿瘤最致命的阶段发生在其在人体中扩散时。为了转移,肿瘤需要与其他器官相连;也就是转移前环境的作用有助于癌细胞培养并促进其转移性生长,最终形成肿瘤环境[100]。肿瘤环境是一种复杂的异质肿瘤微环境(TME),可为癌细胞提供有利的生长条件[101‒106]。肿瘤环境由基质细胞、成纤维细胞和内皮细胞组成。出于这个原因,模拟肿瘤是一项挑战,这迫使科学家创新并将肿瘤环境简化为更易于分析的模型。目前存在四种肿瘤模型:2D单层模型、3D静态模型、肿瘤芯片模型和动物模型。各种研究表明,肿瘤芯片模型与其他模型相比具有多种优势,例如在动态条件下重建易于获得和控制的3D结构。因此,肿瘤芯片模型引起了更多的关注,研究人员利用其试图创建新的、更准确的肿瘤芯片平台[5,107‒109]。
血管是激发恶性细胞血管生成和供应其代谢需求所必需的组织,这表明将血管结合到肿瘤芯片中以实现血管化的肿瘤芯片模型的重要性和实际需要。此外,仅使用内皮细胞网络实现的血管化肿瘤芯片不具备灌注能力[5]。物质运输是活细胞在体内传递营养和氧气以及去除代谢副产物所必需的。此外,3D细胞的聚集可使细胞间和细胞基质间发生相互作用,形成球体或类器官。
《3.2.1. 血管化的肿瘤球体芯片》
3.2.1. 血管化的肿瘤球体芯片
近40年来,球体已被用作肿瘤模型,因为它们和真实的体内肿瘤具有相似的狭窄形状和细胞密度。可以说,制造球体是实现3D细胞结构最可行的方法[110‒118]。此外,不可否认的是,将灌注集成到微流控平台是有利的。这种微流控平台和球体培养方法之间的融合可以产生更有效的平台。
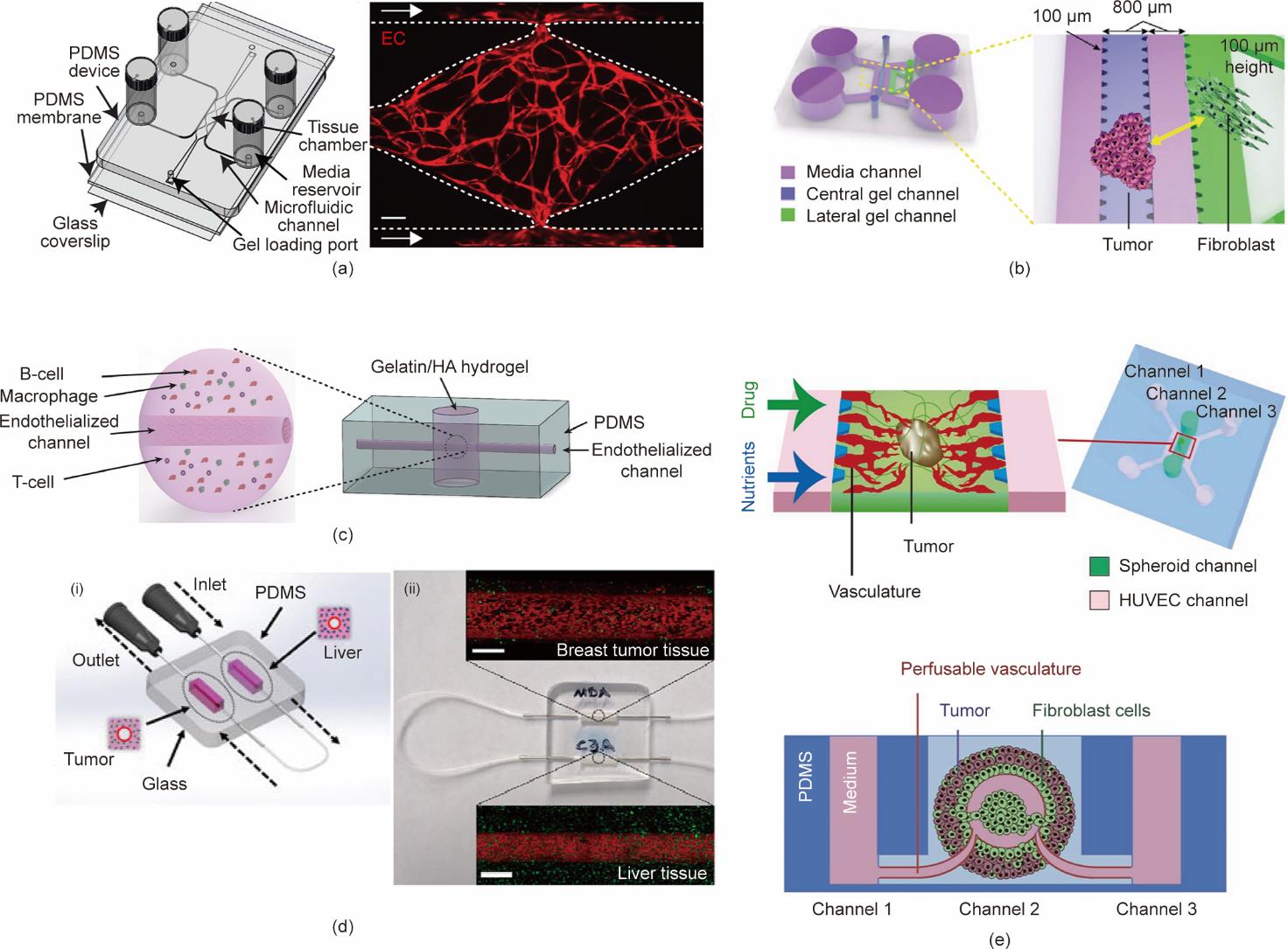
Sobrino等[119]应用这种融合方法,构建了一个简化的体外血管化微肿瘤(VMT)PDMS平台,该平台没有预先图案化的微血管,也不需要任何泵或管道[7(a)]。该平台可通过微血管输送营养,用于乳腺癌和结直肠癌治疗。因此,通过筛选美国食品药品监督管理局(FDA)批准的药物组合进行测试,以分析结直肠癌VMT对标准抗癌疗法的反应。对三阴性乳腺癌系(MDA-MB-231)进行标准化疗治疗,VMT平台显示出对抗血管生成和血管破坏剂的高度敏感性。因此,该平台代表了一种有效的工具,可以直接或间接地通过血管效应识别靶向肿瘤细胞的试剂。
器官芯片的准确性通常与反映真实肿瘤环境的细胞类型以及相互作用的器官的数量有关。因此,Chung等[120]认为仅模拟基质-癌症相互作用的微流控装置过于简单,无法提供对复杂结构的系统洞察[图7(b)]。因此,研究小组提出了一种新方法来模拟TME中的血管生成和淋巴管生成。同样,Mannino等[121]开发了一个体外平台来模拟体内癌细胞、内皮细胞和免疫细胞之间发生的相互作用[图7(c)]。他们针对弥漫性大B细胞淋巴瘤设计了一种易于获得且经济的基于水凝胶的淋巴瘤芯片。这种特殊的制造方法有利于提取淋巴瘤芯片模型的细胞成分以进行治疗后分析。此外,该平台还可以轻松可视化不同组分之间的空间交互。
《图7》
图7 血管化的肿瘤球体芯片。(a)血管化肿瘤芯片装置示意图,以及包含在第七天完全发育的血管网络的代表性组织腔室的共聚焦图像[
Paek等[122]提出了另一种更好的可视化的解决方案,即在一个开放式微型装置上完成细胞培养,以促进其他特定组织与血管网络的结合。此外,制造的微装置包含通过将肿瘤球体结合到体外模型构建的血管化腺癌。该装置的制造过程将微流控3D细胞培养与血管发生相结合,重新形成可灌注血管。
健康组织和致瘤组织之间的相互作用是建立真实环境的另一个关键参数。Ozkan等[123]开发了一个包含两种组织类型的模型,其血管由圆柱形内皮壁形成,分别由第一区的乳腺肿瘤细胞和第二区的肝细胞覆盖[图7(d)]。这两个区域串联连接,以测试每个区域的药物和纳米粒子的运输和发展。该装置成功模拟了几种健康组织与致瘤组织之间的相互作用。
到目前为止,几乎所有已提出的方法都未能在超过24 h后对药物疗效进行评估,而这是模拟施加于肿瘤上的机械应力所必需的。Nashimoto等[124]模拟了通过体外装置中血管网络的压力驱动流的长期灌注[图7(e)]。长期灌注培养增强了肿瘤细胞的增殖并抑制了细胞死亡。同样,Nie等[34]开发了一种基于剥离和黏合工艺的多尺度预制微血管制造方法,并采用双交联策略;结合肿瘤球体以模拟血管和球体之间的相互作用,验证该方法并展示其灵活性。最后,球体芯片模型在多项研究中提供了多种解决方案,显示了其效率,但该模型也可以被视为一种需要模拟实际器官更复杂结构和功能的简化模型。
《3.2.2. 血管化的肿瘤类器官芯片》
3.2.2. 血管化的肿瘤类器官芯片
1907年,Wilson展示了分化硅质海绵并展示了将分化硅质海绵长成相同海绵的能力,被认为是类器官革命的第一步和早期发展阶段[125]。类器官通常被定义为“从干细胞或器官祖细胞发育而来的器官特异性细胞类型的集合,并以类似于体内的方式通过细胞分选和空间受限的谱系定型进行自组织。”在过去10年中,人们对器官芯片和类器官进行了广泛的研究。尽管器官芯片平台被认为是一种过于简化的模型,但器官芯片和体外培养都有望进一步推动临床研究的科学进展。
有趣的是,当将一个或多个类器官合并到微流控平台时,类器官和器官芯片模型之间会发生轻微的交叉(图8)[126‒127]。Lancaster等[128]在一个平台中说明了这些方法之间的协同作用。该平台由人类多能干细胞组成,附着在基于聚(乳酸-乙醇酸共聚物)(PLGA)的微丝上,形成了工程化微丝脑类器官。与单独使用任何一种方法相比,该组合表现出更好的重复性和皮质板形成。
《图8》
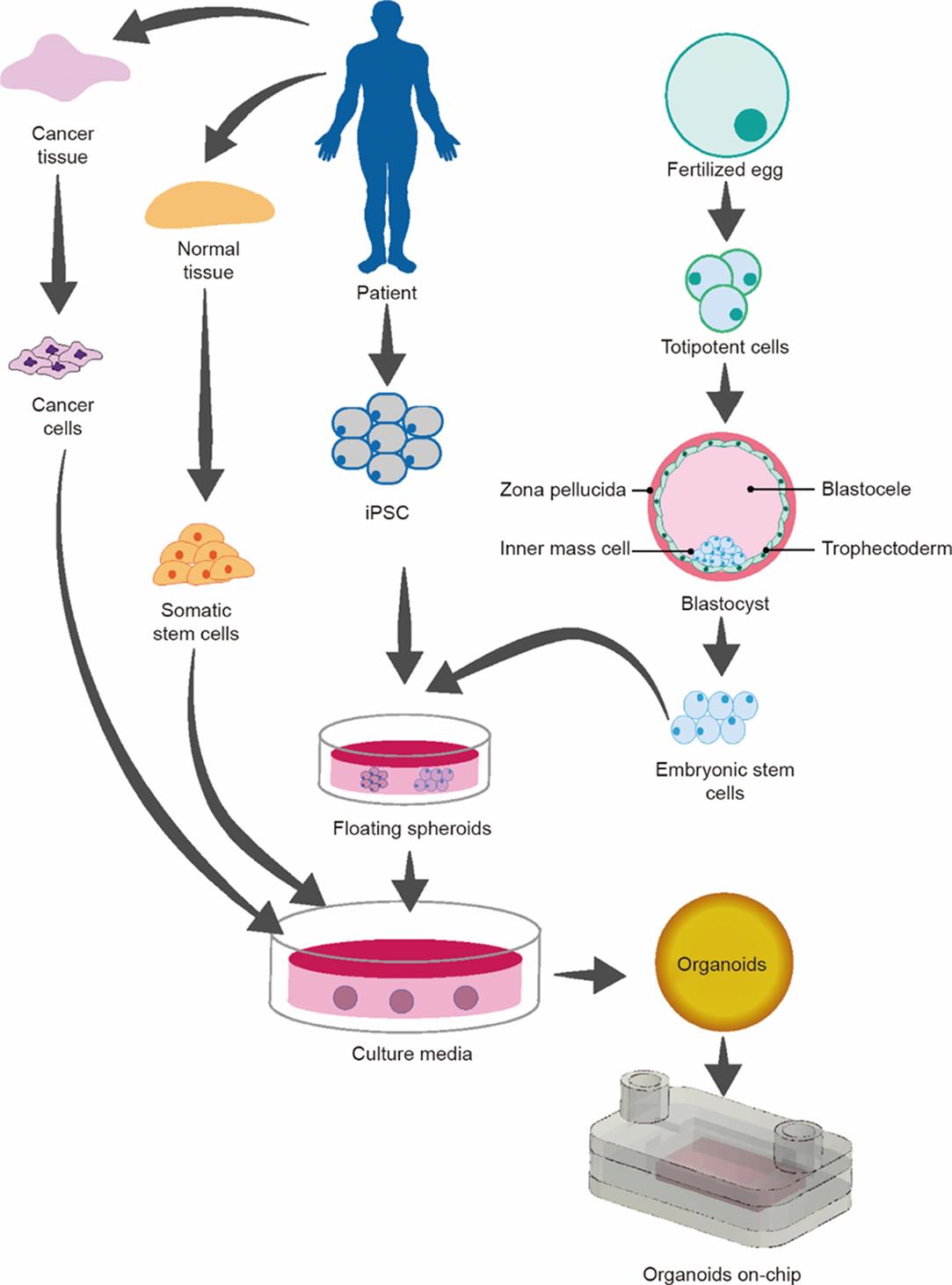
图8 由癌细胞和干细胞构建类器官芯片的示意图[
转移发生在肿瘤的晚期阶段,当肿瘤细胞通过血管从原始位置扩散到身体的另一位置时,就发生了转移。因此,重建血管化模型对于重现转移是必不可少的。将肿瘤类器官芯片与体外血管化方法相结合,可以产生准确的肿瘤代表模型。 Skardal等[129]通过模拟这种具有挑战性的动态现象,设计了一种转移芯片装置。该平台包括相连的PDMS腔室,用于培养结直肠癌类器官和肝脏、肺以及内皮结构。该装置为更好地了解转移机制并帮助确定干预目标提供了一个有前景的机会。
在另一项研究中,Shirure等[51]构建了基于血管生成制造的微血管的原发性乳腺肿瘤类器官芯片模型。该微流控平台包括一个结构稳定的静止血管,能够供养相邻组织腔室中的肿瘤细胞系和人源肿瘤类器官。该装置可以同时检测抗血管生成剂和化疗的影响,可能会对现代临床方法产生重大影响。
《4. 挑战和未来展望》
4. 挑战和未来展望
当前血管化器官芯片的进展为开发新药物测试平台提供了潜力。生物制造方法对于获得所需的物理化学性质仍然至关重要。然而,目前的生物制造技术仍然缺乏空间可控性以及细胞打印分辨率和准确性,然而这对于构建器官型血管化组织至关重要。几种与血管相关的疾病都是基于微观功能障碍的,需要精确的微观重建才能获得有效和高效的体外模型。因此,除了生物打印方法的准确性有限外,精度也可以被视为构建血管化组织的一项重大挑战。
此外,只有少数研究能够使用生物打印技术重建普遍存在的3D血管网络结构。这些限制主要与生物墨水的力学性能不足有关;由于溶胀或相关流变特性,生物墨水通常无法维持所需的形状[130‒131]。组织的结构异质性是模拟体内血管化微环境的另一个基本要求,也是体外模型开发所面临的障碍。基于体素的生物打印方法在构建异构拓扑结构方面非常有效,并且有望克服器官芯片技术中的异质性障碍[132‒133]。因此,开发新的创新生物制造技术以及使标准技术适应工艺和生物墨水是必需且根本的。
对整个制造过程的评估是另一个需要考虑的关键标准。在血管化的器官芯片制造中使用生物打印可以快速构建并将该过程最小化为一个步骤。然而,目前,一体化制造方法无法控制血管的结构复杂性。其他方法通常需要键合步骤,会降低精度并限制仅在2D中创建普遍存在的结构。从2D过渡到3D结构的紧迫性打开了集成智能材料的大门,特别是四维(4D)生物打印材料[134‒135]。
在肿瘤芯片平台中结合人类诱导多能干细胞,揭示了选择这种细胞来源的重要性(为具有高增殖能力的肿瘤疾病建模提供兼容表型)。此外,类器官的最新进展提高了器官芯片装置的准确性。因此,类器官模型和血管化器官芯片的并行以及同步发展可以使两种模型更准确地融合,从而加快个性化医疗的发展。
最后,人体包括一些通常会相互作用的器官,使用标准的体外培养方法很难预测这些相互作用。人体芯片可以控制和实时观察不同器官之间的相互作用[136]。将可灌注的血管和其他器官组织合并到器官芯片装置中,可以提高其在支持多个组织即人体芯片的循环系统中的完整性。除了人体芯片的可灌注结构外,还需要创建一种用于模拟血液的可灌注介质,这也被认为是一项重大挑战。因此,需要开发一种为不同细胞提供营养的通用培养基来支持这项技术。
《5. 结论》
5. 结论
药物检测和疾病分析是全球重要且关键的需求。制造具有模拟真实人体器官的活细胞功能组织的精确装置可以作为克服这些需求的有效解决方案。本文简要介绍了一种用于制造血管和器官芯片的协同方法,证实了其在该领域中的深入研究和发展。
器官芯片通常可以通过五个连续步骤制造。使用软光刻或光刻可以最成功地实现该装置。在器官芯片领域,通常使用生物打印技术构建组织。通过应用以下三种模型中的至少一种,可以将血管集成到器官芯片中:内皮屏障模型、血管形成模型或血管发生模型。这种协同方法的应用已在多个领域得到证实,特别是在肿瘤培养中,表明血管化的肿瘤芯片具有进一步发展的潜力。
最终,许多关于血管和器官芯片的研究不仅表明了它们的重要性,而且还显示出许多局限性。这些应该会激励来自不同领域的科学家开发新的生物制造方法,并以更高的精度和效率实现更好的器官芯片。

















 京公网安备 11010502051620号
京公网安备 11010502051620号




