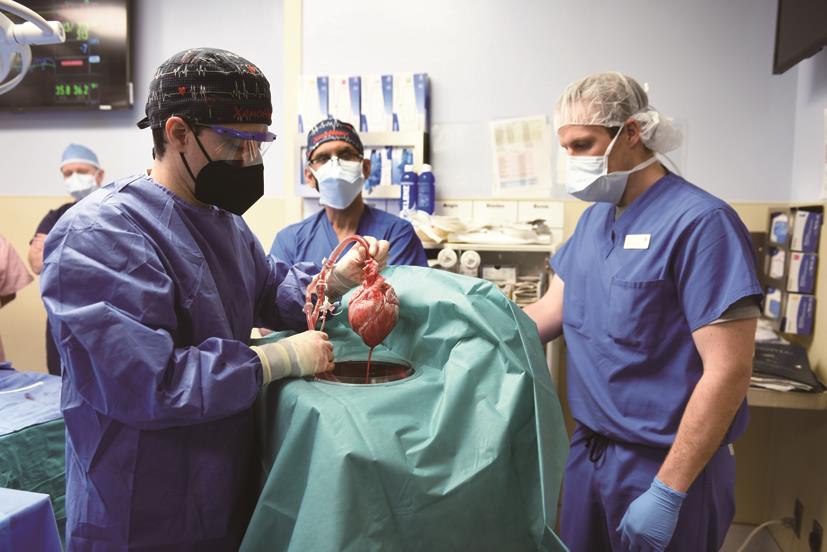
2022年1月7日,在美国马里兰州巴尔的摩马里兰大学医学中心,一名57岁的心脏病晚期患者接受了首例猪心人体移植手术,历经8小时,一颗经过基因编辑的猪心脏成功移植到患者体内(图1)[1]。该猪心脏由生物技术公司Revivicor(位于美国弗吉尼亚州布莱克斯堡)提供,进行了10个基因修改,以提高其移植到人体的成功率。患者David Bennett在移植手术后初期状况良好,移植的心脏也表现良好,未出现器官排斥异常。然而,他的病情之后开始恶化,在距手术约两个月后离世。在2022年4月20日的网络研讨会上,移植外科医生Bartley Griffith表示,该移植心脏似乎受到猪巨细胞病毒感染,这很可能是导致Bennett死亡的原因[2]。
《图1》
图1 2022年1月7日,马里兰大学医学中心(位于美国马里兰州巴尔的摩)的外科医生准备将一颗基因编辑过的猪心脏移植到一名57岁的心脏病患者体内。这是全球首例猪器官移植人体手术。来源:马里兰大学医学中心(公共领域)。
尽管患者的存活时间不长,但专家们仍然认为该手术是异种移植——使用其他物种的器官进行移植——领域的重大飞跃。最重要的是,移植外科医生也希望经过基因编辑的猪供体能够给众多需要器官移植的患者带来新希望。
“多年来,器官移植的需求和捐献器官的供应之间一直存在矛盾”,位于美国弗吉尼亚州里士满的“器官共享联合网络”组织首席医疗官David Klassen表示,“异种移植为器官移植的供应问题提供了新的解决途径。”
猪的妊娠期短,产仔数多,体型与人类相似,是异种移植的理想器官来源。然而,猪器官移植也存在免疫排斥的风险。人类免疫系统通常会对猪体内的一些动物蛋白产生反应。此外,猪的基因组含有内源性逆转录病毒,理论上可转移到受体并被激活[3]。
随着CRISPR/Cas9基因编辑技术的出现[4],研究人员可利用这一新技术来编辑猪的基因组以克服这些风险。近年来,已对猪供体中30种多不同的基因以单独或组合的方式进行改造,以防止免疫排斥、减少传播病原体的风险或控制器官大小[5]。其中一些基因修改敲除了猪的基因,如人体内不存在的糖分子半乳糖-α-1,3-半乳糖(alpha-gal)。另一些修改则包括加入人类免疫基因、灭活猪病毒或敲除猪生长激素受体基因[6]——后者旨在抑制移植后的猪器官在人体内继续生长。
基于多年来将猪器官移植到非人类灵长类动物的广泛研究成果,2022年1月移植到Bennett体内的猪心脏经过了多种基因编辑。移植手术已是该患者最后的选择。他当时只能通过心肺搭桥机维持生命,除了被认为不具备使用人工心脏泵的条件外,也没能进入心脏移植等待名单。他的外科医生获得了美国食品和药物管理局(FDA)紧急使用授权,根据其拓展性使用(同情使用)条款进行异种移植[1]。“这一领域受到严格监管,该手术也并非一夜之间完成的”,Klassen说,“这是一个十分漫长且经过了深思熟虑的过程。”
除了进行猪心脏基因修改测试,在异种心脏移植中还使用了Kiniksa Pharmaceutics公司(位于美国马萨诸塞州列克星敦)生产的实验性抗体药物KPL-404,用于抑制手术后免疫系统B细胞活性[7]。2016年,马里兰大学的移植团队报告称,基因改造的猪心脏移植到狒狒体内之所以能存活两年多的时间,该药物发挥了重要作用[8]。
马里兰大学心脏异种移植项目主任Muhammad Mohiuddin 1月在接受《科学》杂志采访时表示:“这10个(改造)基因发挥了作用,但我的职业生涯中关注重点仍是抗体,我认为它会颠覆这一领域。”[6]
在心脏移植手术之前,2021年年底还进行了其他试验——将经过基因修饰的猪肾脏移植到脑死亡的人类受者体内。在阿拉巴马大学伯明翰分校(位于美国阿拉巴马州伯明翰)进行的一项手术中,外科医生将来自Revivicor公司的两个猪肾移植到一名自然死亡后靠呼吸机维持生命体征的57岁患者体内,研究人员对这两个肾脏进行了与异种移植心脏相同的10种基因改造。结果发现,这两个肾脏保持存活了77小时,能过滤血液、产生尿液,并且没有立即产生排斥反应[9]。
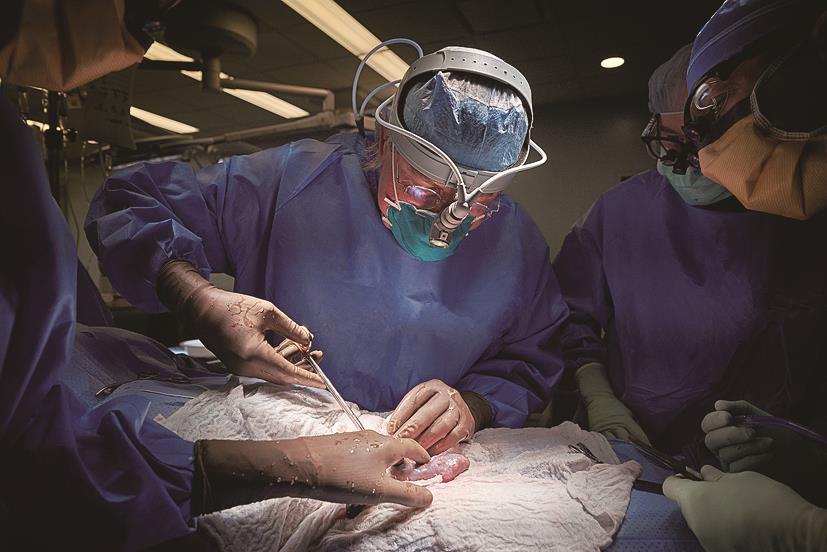
在另一项测试中,美国纽约市纽约大学朗格尼健康中心(Langone Health)的外科团队将猪肾脏移植到两名刚刚去世的患者身上(图2)。该测试的基因改造更为简单,仅修改了一个基因,即敲掉alpha-gal基因。该试验仍产生了相似的结果:这些器官存活了54小时,能够工作良好,且未产生排斥反应[10]。
《图2》
图2 近年来,科学家们对改造猪器官的基因工程方法进行了调整,加入了CRISPR/Cas9技术,以使改造器官与人体更加相容。2021年,外科医生Robert Montgomery将一个基因编辑过的猪肾脏移植到一个刚刚去世的人身上,以测试动物器官在人体内的工作情况。来源:纽约大学朗格尼健康中心(公共领域)。
纽约大学研究团队负责人外科医生Robert Montgomery表示:“这些测试旨在通过证明临床前的灵长类动物模型结果也能用于人体,从而推动这一领域的发展。”至于为什么纽约大学团队较少使用基因编辑,Montgomery解释说,这是因为外科医生在人体器官移植中,已经研究出大量的药物和手段来防止免疫排斥,而这些方法同样适用于异种移植。他表示:“我们觉得少即是多——在几十年的灵长类动物临床前研究中,已经引入了很多不必要措施使其变得更为复杂。”
他的观点与研究和规范异种器官移植的多方面挑战相融。研究人员通过大量不同基因组的修改对不同器官进行测试,所有这些都增加了判断影响特定器官移植成功与否的关键基因的难度。此外,CRISPR/Cas9基因工程的效率还有待提升,这意味着对不同猪的基因编辑水平可能有所不同。到目前为止,研究人员通过培育克隆猪而非饲养猪群的方式提供新器官,因为后者会将改造基因传递给它们的后代。Montgomery表示,多种方法也意味着我们仍能吸取经验教训,反思出最佳方法。“这是一项非常复杂的技术”,他说,“并不会一开始就很完美。”
异种心脏移植手术结果说明了仍然存在的问题。在Bennett接受猪心脏移植后的数天乃至数周内,医生们通过一系列高科技测试密切监测他的健康状况,甚至对他血液中松散的DNA链进行测序,并进行了数百种细菌和病毒的筛查。Griffith说,手术后20天,病原体测验结果显示患者体内可能存在猪巨细胞病毒[2]。尽管医生在术前对猪供体进行了大量的筛查测试,但该病毒可能一直潜伏在猪体内,并存在于动物体内的深层组织中,因此很难检测出来。现在说是猪病毒杀死了Bennett还为时过早,但Griffith说这可能会是个好消息。怎样的好消息?他说:“如果确定病毒感染是主要原因,我们之后就能对此采取预防措施。”[2]
提高对供体猪进行的测试水平,或者严格规定对供体动物的繁殖、饲养和隔离要求,能对此有所帮助。进行基因编辑也提供了另一种可能。2020年,启函生物科技有限公司(中国杭州)的中国科学家杨璐菡及其同事对供体猪的50多个基因组进行了改造——其中大部分使用了CRISPR/Cas9技术来灭活猪的逆转录病毒[11]。
猪心脏和肾脏的人体移植成为常规手术仍有很大距离。但第一例猪心脏异种移植的短期成功预示着在未来这将走向常规。这颗心脏在Bennett体内泵血两个月,没有立即产生排斥反应,这一结果比1967年在南非进行的第一例人体心脏移植(只存活了18天)的结果要更好[12]。FDA或其他国家的类似监管机构批准进行高效的临床试验将是大规模评估猪器官移植可行性的下一步举措。
Klassen说:“从科学的角度来看,我们已经达到了一个临界点,在这一点上我们能够以一种更有针对性、更可能成功的方式进行移植。我认为我们很快就能看到一些初步的临床试验结果。”













 京公网安备 11010502051620号
京公网安备 11010502051620号




