《1. 背景和目标》
1. 背景和目标
目前已出现很多可以避开血脑屏障将药物输注到脑内靶点的新方法[1–5]。增强对流输注(CED)就是一项颇具前景的新技术,其利用导管在脑内靶点局部地输注药物[6–8]。为达到这样的效果,需要在颅骨内的小孔插入至少一个可到达靶点位置的导管。一旦导管被置入,就会产生一个可提供压力驱动流的平稳持续的输注。CED技术已被应用于神经变性、癫痫和肿瘤疾病的治疗[7,9–13]。由于可行输注速率的压力限制,CED通常以缓慢的流速保持几天。相较于可生物降解的多聚体药物输送系统,CED与基于扩散的方法相比可以将输注药物的有效组织穿透力提高超过一个量级,并且不会造成脑水肿[14,15]。这种方法对无法避开血脑屏障并且扩散效率较低的大分子的运送尤其有效,如抗体、化疗药物和免疫毒素等[16–21]。然而,被称为PRECISE研究的第一个利用CED治疗恶性胶质瘤的多中心实验的结果并不符合所需的最小临床结果。Sampson 等进行的回顾性分析表明,导致这项实验失败的原因为:在恶性瘤体及其周围边缘,CED没有实现化疗抗毒素的充分扩散[22]。尽管结果不尽如人意,很多项目组还是试图寻找更好的对策和解决方法以使CED成为可行的临床工具。
增强输注化疗药物穿透力的另一个方法是热化学疗法,这是因为对药液的加热可大幅提高治疗的有效深度[23]。此外,辅助热疗可显著提高许多化疗药物的细胞毒性[24–26]。DeWitt 等证实由于细胞质膜的透化作用,中度热疗也可增强细胞对药物的摄取[27]。该项目组利用新型光纤导管,即光纤微针装置(FMD),设计出一种能够将热化学疗法和颅内CED结合的新技术方法,从而实现药液和激光能量的共传递。装置的设计和制作方法在之前的研究中已有描述[28],包括机械穿透力、光导和液体输注等特征[28–31]。该项目组已证明在啮齿动物体内模型中,通过CED在输注点进行光加热可增强造影剂的体积扩散[28]。
本文试图确定在啮齿动物体内模型中观察到的体积扩散的增强是否也可在琼脂糖模型中出现,如果是,则要对温度介导的体积扩散增强特征进行描述。质量分数为0.6%的琼脂糖组织模型是一个被认可的大脑组织模型,可以直接用来观察输注体积[32,33]。最初的实验模拟了笔者之前利用并行光加热方法将造影剂输注入琼脂糖的体内实验方法。为更好地定量热效应,附加实验在水浴形成的近等温条件下描述了进入琼脂糖模型的输注的特征,以排除光加热的非均匀性因素。这些实验利用简化的导管模型,该模型利用了无光导石英毛细管,其尺寸与笔者之前共输注FMD设计的大小相同 (外径为 365µm;内径为150µm)。进一步的分析集中于描述输注造影剂扩散的热介导变化。
《2. 材料和方法》
2. 材料和方法
《2.1. 光纤微针装置的设计》
2.1. 光纤微针装置的设计
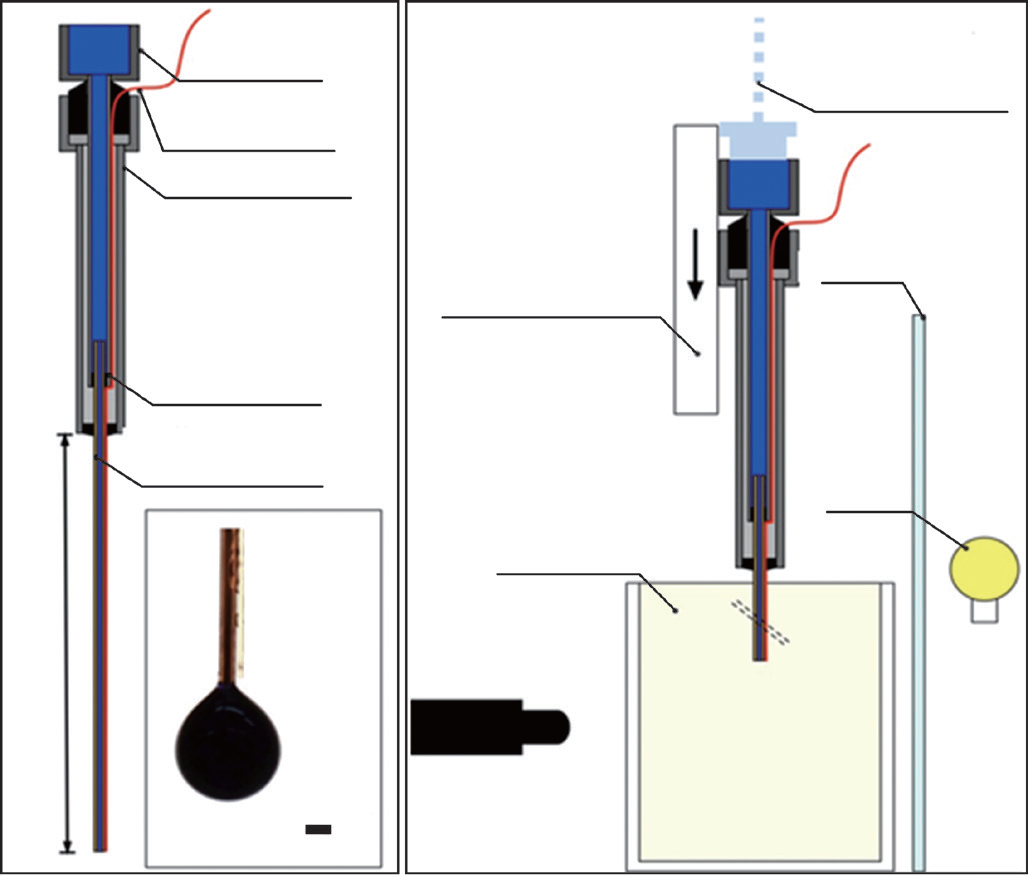
为确定琼脂糖的体积扩散是否表现出热介导的增强,笔者利用双光纤FMD设计进行实验。FMD导管由熔融的石英毛细管 (内径/外径为150 μm/365 μm, Polymicro Technologies, Phoenix, AZ, USA) 与一根多态光纤管 (核心/覆盖层/缓冲区为100 μm/110 μm/125 μm,数值孔径(NA)=0.22, Polymicro Technologies, Phoenix, AZ, USA) 粘合而成。嵌入式注射针头系统可保证液体流入毛细管而不是顺着液体线流入光纤管。毛细管一端用环氧树脂胶合进22G点胶针的顶端,同时输注长度延伸到针头外10cm处。这种装置通过点胶针的鲁尔锁使液体耦合成为可能。毛细管和22G针头沿着光纤管穿进作为壳体的18G针头。光纤管和毛细管端面共同终止于18G壳体顶端2.5cm处。玻璃纤维固定后,用环氧树脂填充壳体,用来保证侧向稳定性。组合装置如图1所示。
《图1》
(a) (b)
图 1. (a) FMD 设计描述;(b) 实验装置。
利用简化的FMD原型进行等温琼脂糖输注,目的是简化加热分布图,从而更好地描述热介导传输的特征。通过将熔融的石英毛细管与2.54cm长的22G不锈钢点胶针(McMaster-Carr, Atlanta, GA, USA)粘合,制作FMD导管。截取一段3.75cm长的石英毛细管,并将它黏附于点胶针内,使毛细管从点胶针的钝端伸出2.5cm。该装置如图2所示。点胶针近端的鲁尔锁液体耦合器确保了其对液体系统的附着。
《图2》

(a) (b)
图 2. (a) 由一个 22G 针头和一段石英毛细管组成的光纤微针装置 (FMD) 导管;(b) 实验装置图:该图已简化为一根针,但在实际实验中用了三根针同时平行输注 ( 从这个角度看 )。DAQ 表示数据采集器。
《2.2. 琼脂糖共输注》
2.2. 琼脂糖共输注
双纤维FMD的共输注概念验证在顶端开放的矩形聚苯乙烯模型(1.7cm×8.1cm×3.9cm)中进行。琼脂糖(分子生物级,Bio-Rad Laboratories, Hercules, CA, USA)溶液与去离子水混合配置成质量分数为0.6%的混合溶液,煮沸,简单冷却后注入模型。模型由固体石蜡包裹,并在使用前冷藏于4°C的冰箱中过夜。使用时,将琼脂糖移出冰箱并使其恢复至室温。在利用HH127数据记录器(Omega Engineering, Stamford, CT, USA)进行测量时可通过T型微热电偶进行适当升温。
笔者利用了之前已发表文章中介绍的自定义阴影成像技术[34]。简单来说,就是将一块光漫射丙烯酸胶片安装在铝窗上。一个附加的测微计(OptoSigma, SantaAna, CA, USA)可以实现对FMD导管嵌入的精确控制。这种结构可以实现背光观察输注物体积以及将双纤维FMD垂直导入琼脂糖模型。该装置示意图如图1所示。输注入琼脂糖的流速控制在1µL·min–1,用一个1064nm的连续二极管泵浦纤维激光器(IPG Photonics, Oxford, MA, USA)提供激光辐照。初步实验确认用500mW激光功率加热琼脂糖装置,使其在两小时内达到4~5°C的稳态增加(实验数据未显示)。利用一个自由空间–光纤耦合器(Newport Corporation, Irvine, CA, USA)将光耦合到FMD多态光纤中。耦合效率在每次输注前用积分球(Newport Corporation, Irvine, CA, USA)得出。毛细管通过micro-IV 延长装置与10mL注射器 (包含5%的FD&CBlue#2) 相连,注射器由PHD Ultra注射泵(Harvard Ap-paratus, Holliston, MA, USA)驱动。
沿着测微计的轨道,手动将FMD迅速插入琼脂糖。这种迅速的导管插入可通过快速克服介质的黏性压缩减少回流[35]。在手动插入琼脂糖约1.25cm后,用测微计精确地将导管尖端定位在距表面1.5cm的位置。最后,依照Martanto等所述,将导管尖端升高1mm,以便移除进入到毛细管的核化琼脂糖[36]。
成功插入后,1µL·min–1的液体输注和500mW的激光辐照同时开始。透过透明的聚苯乙烯模型和琼脂糖,从垂直于导管的角度,每分钟自动拍摄一个画面。利用OPP-M光纤传感器(OpSens Inc., Québec City, Québec, Canada)监测注射器泵的管线压力。若管线压力达到40mmHg (1mmHg≈1.33×102Pa),可认为系统发生堵塞。此时应利用测微计将导管尖端升降1mm以减少导管尖端内的核化。若管线压力达到60mmHg或染料扩散到聚苯乙烯模型表面时,暂停输注并舍弃所有数据。
《2.3. 等温琼脂糖输注》
2.3. 等温琼脂糖输注
为提供可重复的近等温环境,笔者设计了一种在水浴中进行琼脂糖输注的自定义输注装置。在T75烧瓶(Corning Inc., Corning, NY, USA)的窄端钻四个端口以便对其加以改进:其中三个用于FMD插入,另一个用于T型微热电偶(Omega Engineering, Stamford, CT, USA)插入。在插入过程中,为更好地从琼脂糖干扰中隔离热效应,FMD被插入琼脂糖中。用环氧树脂将三个FMD紧密粘合在每个烧瓶的端口处并调整到合适位置。每个FMD有一根聚酰亚胺外壳的熔融石英纤维(外径为125µm),该纤维通过其中心孔插入,以防止在固化过程中由于毛细管作用而导致的琼脂糖液体上升。可移除的热胶插头用来暂时密封热电偶端口。三相T耦合器与每个22G针头的鲁尔锁连接器相连。光纤穿过T耦合器并且伸出顶端。这项装置为琼脂糖模型提供了能浸入水下的外壳。制备琼脂糖并移入上述T75烧瓶中。烧瓶加盖(T耦合器向上放置),使用前应在4°C下冷藏至少24h。在固化过程中,通过每个T耦合器注入少量去离子水,静置T耦合器/FMD以排除空气。
琼脂糖制备完成后,将烧瓶移出冰箱,并将熔融的石英纤维小心地从FMD中移除。由注射泵(Harvard Apparatus, Holliston, MA, USA)保护的注射器(3mL,BD注射器)在烧瓶上通过micro-IV延长装置(Smiths Medical ASD, Inc., Dublin, OH, USA)分别与每个T耦合器连接。与FMD连接前,注射器和延长装置都充满质量分数为5%的FD&CBlue#2染料。染料可在T耦合器中的去离子水中自由扩散,这里染料的稀释程度不足以影响图像的测量。小心地移除热电偶端口上的热熔胶,并且在琼脂糖中插入T型微热电偶。水浴在一个大的透明塑料容器中进行。充满琼脂糖的T75烧瓶和相连的液体线被小心放置在水浴中。水温由热水器/冷水器(Thermo Neslab RTE 7 Chiller, Newington, NH, USA)调节。在四个不同的实验温度下保持近等温环境:15°C、20°C、25°C和30°C。T型微热电偶被放置在水浴的流动液体中,并在外部放置一个装满冰水的烧杯,作为校准的冷端温度。所有T型微热电偶的测量结果都纪录在HH127数据记录器(Omega Engineering Inc., Stamford, CT, USA)中。
一旦达到目标的等温环境,注射泵被激活并提供100min的1µL·min–1的输注速率。琼脂糖内部温度维持在目标温度±2°C内,否则输注装置将被废弃。每个输注物管线压力用湿/湿差压传感器(Omega Engineering Inc., Stamford, CT, USA)监测,该传感器与micro-IV延长装置通过T耦合器平行相连。传感器由与电脑相连的八通道数据采集器(Omega EngineeringInc., Stamford, CT, USA)控制。实验装置的示意图如图2所示。该装置由明灯进行后背打光,通过拍摄琼脂糖装置的侧面采取对比阴影成像测量。利用佳能EOS Rebel T1i/EOS 500D (Canon USA, LakeSuccess, NY, USA)每分钟自动拍摄一次图像。
《2.4. 多孔弹性模型》
2.4. 多孔弹性模型
有研究者改进了Chen 等建立的模型来拟合数据,从而获得温度依赖性对体积扩散率的影响[37]。他们的研究集中于容积分布建模,该分布是输注率的函数。但是本文的等温实验试图确定体积扩散随温度的变化。从容积的连续性和描述多孔弹性的修正的Darcy定律入手,Chen等建立了容积分布(Vd)随孔隙率(φ)、膨胀率(e)和时间(t)变化的函数。琼脂糖多孔架构的变形行为通过修正描述刚性多孔介质的对流运输公式获得。膨胀扩散常数(Dd)被定义为受到琼脂糖Darcy渗透率(k)、材料硬度(λ)、材料压缩率(µ)和模量影响的参数。假设在稳态条件下(t>>r2/Dd),琼脂糖硬度和压缩率的瞬态影响可忽略不计,则孔隙率可以被表示为半径的函数:

式(1)中,A=q/(4πDd),q为体积流率;φ0为初始孔隙率(t=0);r为半径。若经过很长时间,琼脂糖体积等于总输注体积(Vinf=qt),那么琼脂糖内体积扩散的半径R可以通过以下公式计算:

由于琼脂糖是黏弹性介质,其材料性质会随温度发生变化。尽管用这种实验方法分离出Darcy渗透和材料模量的影响不太可能,但它们对总体的贡献能通过参数 Dd 体现出来。在本实验中,笔者直接将 Vd 作为时间和温度的函数进行计算。这是通过对输注的一系列时序图像进行算法后处理加工后获得的。在Chen等分析的100min时体积扩散的先例实验后,笔者通过 Dd 与 Vd(T) 的关系计算了100min时的 Dd(T),并应用指数回归描述这一分布:

式(3)中,a和b是常数,分别为5.739×10–8 和 –0.05678。通过将该回归方程应用到式(2)中,我们可以描述R(T)3和Dd(T)之间的关系,从而直接预测Vd(T):

这种Dd和温度之间的函数关系为随温度而变的体积扩散提供了稳态的经验预测,同时也适用于其他琼脂糖模型,甚至可作为活体组织内分布的一部分。
《3. 结果》
3. 结果
《3.1. 琼脂糖共输注》
3.1. 琼脂糖共输注
共输注实验的体积扩散通过分析采集的图像每分钟计算一次。本项目组此前曾表示这种方法的误差低于5%[34]。图3(a)显示了该数据。每条曲线代表五次实验的平均值。排除标准包括染料接触到琼脂糖边界,温度变化大于目标温度±2°C,以及管线压力超过60mmHg。与单一输注的对照实验相比,共输注显示了大幅度增强的体积扩散。图3(b)分析了每个框架下从导管尖端向前分布的距离。共输注与染料显著加强的前进进度相关。但是,由于光加热具有高度非均匀性且不易被测量或估计,实验使用了均匀加热的琼脂糖模型以更好地建立温度和体积扩散之间的关系。
《图3》
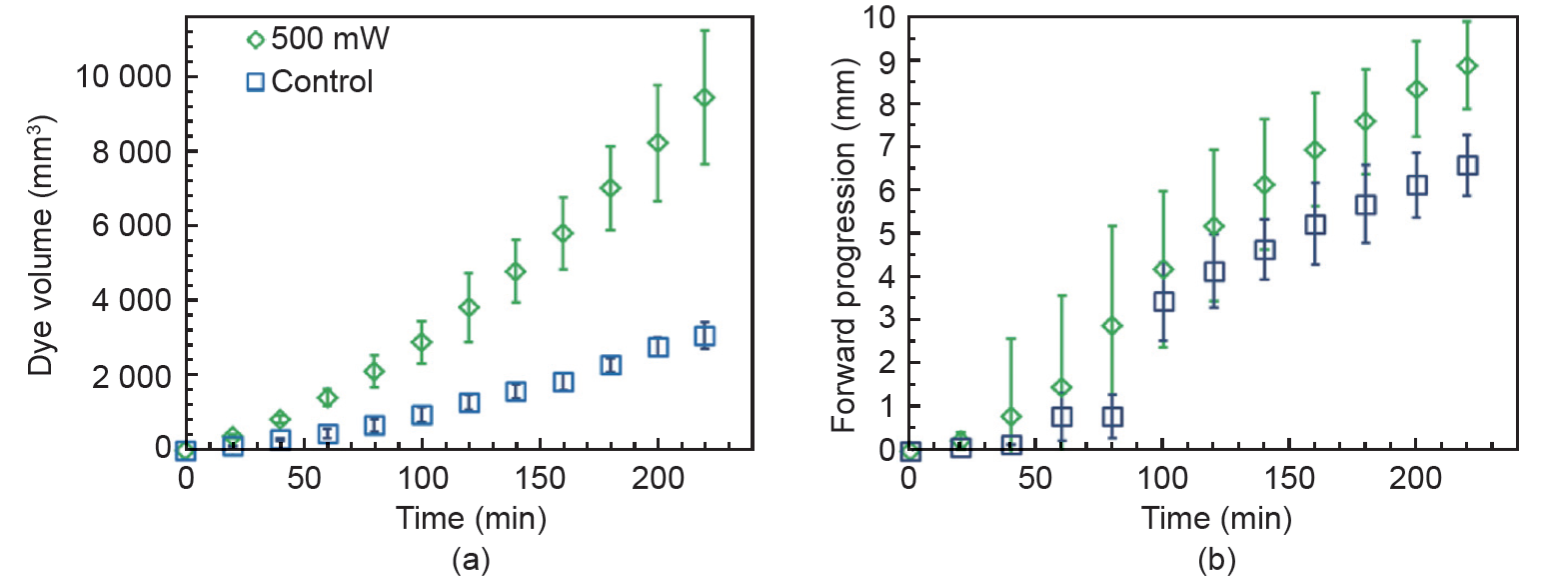
图 3. (a) 共输注实验的体积扩散数据;(b) 500 mW 辐射组和单一输注组的染料的前进进度。误差线表示两个实验中各组数据的标准差。
《3.2. 等温琼脂糖实验结果》
3.2. 等温琼脂糖实验结果
每个温度下至少4组实验被用于容积分布分析。体积扩散率与温度升高呈正相关,100min时30°C下的平均Vd比15°C下的至少高7倍。图4给出了每个温度下体积扩散随时间变化的代表性图,以及在 100min时 15°C和 30°C下实验的典型图像。
《图4》
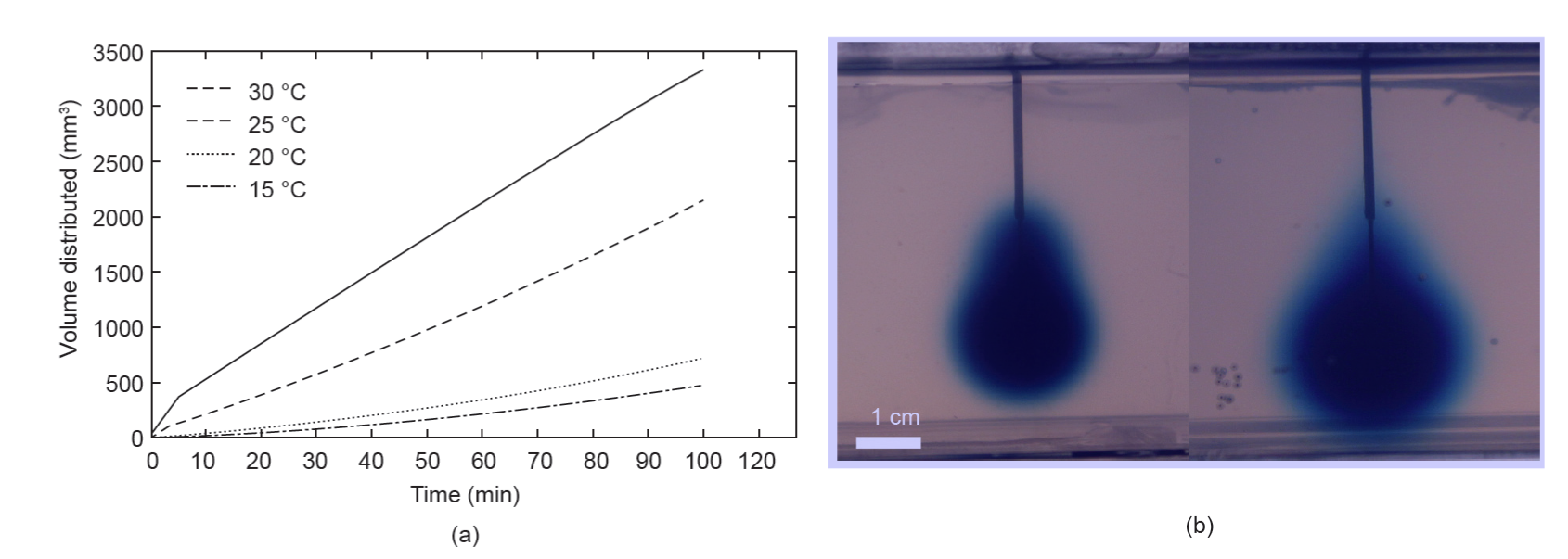
图 4. (a) 每个实验温度下体积扩散随时间变化的图像;(b) 100 min 时15 °C( 左) 和30 °C( 右) 下等温输注的典型图像。
在15°C、20°C、25°C和30°C的实验条件下,管线压力分别为(29.1±11.0) mmHg、(29.3±6.8) mmHg、(20.5±1.0)mmHg和(29.7±5.6) mmHg。这个结果显示体积流率与管线压力无关;这里需要注意的是管线压力对扩散染料体积内的压力可能无参考价值。为确定统计学差异显著性并为下面描述的理论分析提供时间点,选择100min时的体积作为不同群体的比较点。图5是100min时每个温度下容积分布的柱状图。t检验显示每个群体都具有统计学差异(P<0.05)。每组管线压力的标准差之间并没有相关性,这进一步证明了体积扩散与管线压力无关。
《图5》
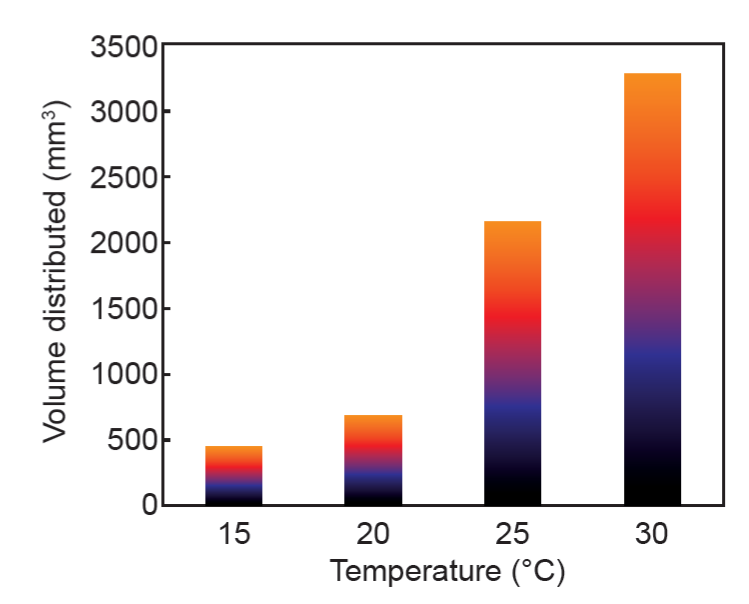
图 5. 100min时每个温度下容积分布数据图。误差线表示计算的标准误差。
《3.3. 模型开发》
3.3. 模型开发
Chen等通过将最小二乘法应用于包括了他们计算和预测的压力值以及体积扩散数据的成本函数,估计了不同常数的值[38]。本项目组利用Chen等推导出的常数和实验测得的Vd来描述每个温度下琼脂糖膨胀扩散常数Dd。通过对MATLAB中二次函数、指数函数和幂函数回归的R2值进行比较发现,指数回归在大多数体积扩散时间点展现出最好的拟合度。该回归方程使体积扩散随温度变化的理论预测成为可能。图6为输注100min后实验数据和理论预测结果。
《图6》
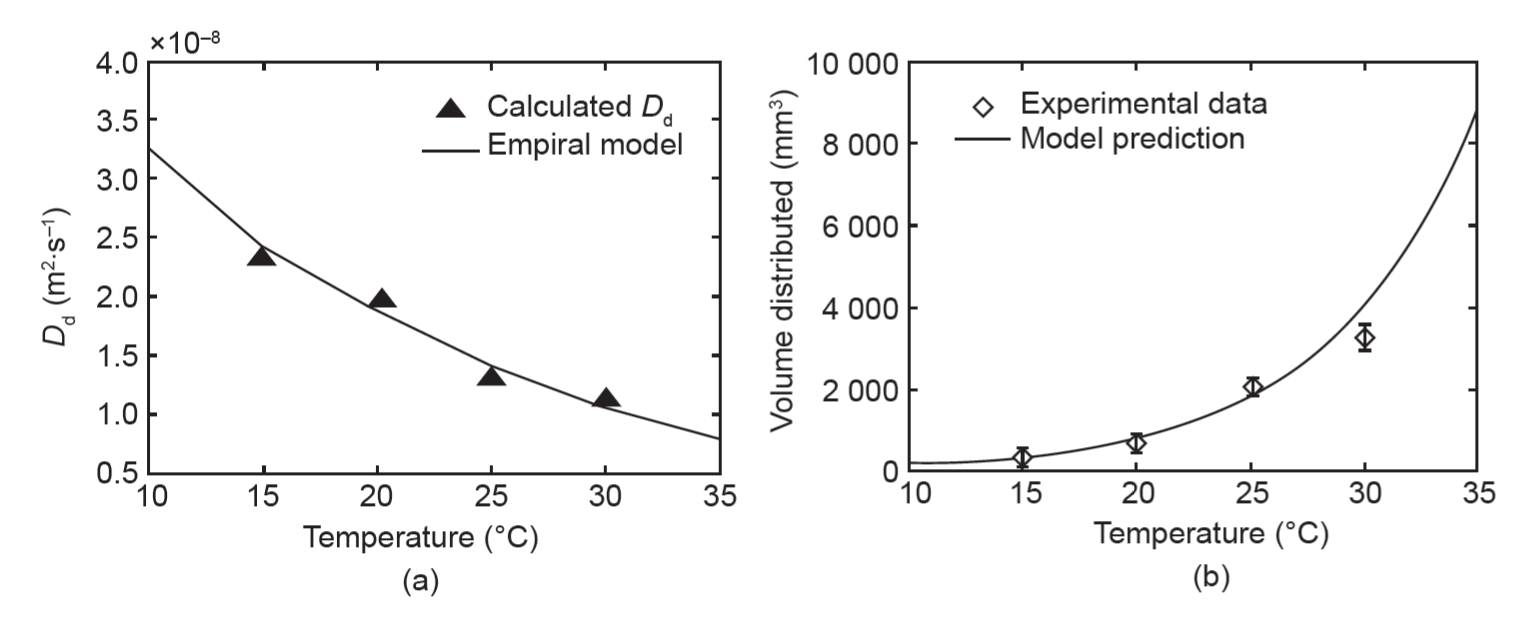
图 6. (a) 指数回归计算的每个温度下的膨胀扩散系数;(b) 100 min 时实验测量的和用经验模型预测的随温度变化的体积扩散值。
《4. 讨论》
4. 讨论
本等温实验试图量化体积增加率与琼脂糖温度之间的关系。15°C、20°C、25°C和30°C时的实验证明上升的温度和体积扩散之间呈正相关关系。实验数据的分析表明,100 min 时30°C下的体积扩散平均值比同等条件15°C下的高出7倍。经验预测模型显示体积扩散率呈指数增长;实验的直观结果是,垂直于输注点的径向输运的增强可能会导致输注体积的立方式增加。相同液体体积在各等温实验间被输注,表明输注体积在较高温度下浓度较低。如果将这种方法应用于如CED这种低速输注治疗,这就是一个需要注意的重要因素。
本项目组先前已证明可通过并行的光加热方法增强输注造影剂体积扩散[28]。本文描述的工作是发展体内情况下全面预测模型的第一步。通过一维系统基于对称性的简化,均匀的琼脂糖模型使经验预测成为可能。虽然这些结果受限于理想化的恒温条件,但每个温度下确定的扩散率为由光加热产生的非对称的、空间可变的温度建模提供了基础。由于颅内治疗费用昂贵且风险相对较高,精确的预介入模拟可以使临床医生根据具体患者和症状更好地调整治疗方案。
共输注的分析与理想化的恒温条件密切相关。量化沿着光路路径行进的输注体积显示出期望的扩散率的提高。输注体积展示出更大的沿着光路的向前分布,但是分析还表明前进进度沿与导管长度垂直的方向增加,但程度较低。这个结果可能与热传导有关。实验中两个组的标准差都随时间增加,但共输注较为明显。这一结果可能归因于手动插入导致的局部染料浓度的细微差异,从而使整个扩散体内热分布发生变化。在体内情况下,包括脑组织在内的大多数组织的高散射系数会迅速降低光的定向性,并产生球形加热体。但是,这种效应对热的影响程度会随着组织类型而变化,并且需要进一步实验加以确认。
等温实验的设计目的是提供一个较简单的视角来看待热介导体积扩散的增强,从而帮助我们分离出温度梯度的影响。理想状态下,注入的液体和琼脂糖温度一样,因此不存在温度梯度和自然对流。考虑到相对较低的注射体积流率以及液体线被插入水槽中,我们可以假设由琼脂糖复合物中液体和输注液的密度差导致的自然对流已被降低到最小程度。在共输注的实验中,这种效应更加复杂。首先,局部加热改变了渗透性,这对通过多孔介质的对流有直接影响。其次,局部加热可能会改变液体密度,由于浮力作用,液体密度的改变会影响流动,尤其当强制对流较弱时。这个因素将会导致光路中的液体上升到针头的顶端。笔者所见的改善的向前分布表明,在笔者的实验研究中,强制对流和自由对流相互抵消。
利用琼脂糖模型模拟活体组织有很多局限性。琼脂糖缺少的血液输注、均匀的成分和细胞结构都使得琼脂糖模型在实质上与活体组织不同。但是Chen等建立的质量分数为0.6%的琼脂糖组织模型可作为脑组织的合理模型,并且经常被用于各种文献[32,39,40]。这可能代表了对体积扩散变化非常保守的估计,因为活体组织中的某些现象,如血液输注,可能会与低水平热疗产生协同作用,从而进一步提高输注液体的分布。本文获得的琼脂糖数据与之前本项目组发表的体内实验高度相关,即在啮齿动物脑内输注时引入亚致死热量能够显著增强体积扩散[28]。输注体积扩散热介导效应的守恒可以进一步支持0.6%的琼脂糖作为组织模型来预测某些体内现象。
《5. 结论》
5. 结论
本文证明在琼脂糖组织模型中,光加热可促进输注造影剂的扩散。通过阴影成像和图像处理技术确定热介导的体积扩散率的增加。在15°C、20°C、25°C和30°C条件下的等温输注显示出温度和体积扩散率呈正相关。100min时,30°C恒温条件下的体积扩散率比15°C恒温条件下高7倍。500mW条件下,进入到室温琼脂糖的光加热共输注与对照组(0mW)相比在4h时提高3.5倍。这些结果将推动并行光加热在化疗药物和其他治疗药剂组织渗透性提升中潜在功用的进一步研究。
《致谢》
致谢
笔者对库尔特基金会 (Coulter Foundation) 和美国国立卫生研究院 (NIH) (NIH/NCI1R21CA156078) 对本项目的支持表示感谢。光纤微针装置的制作方法和应用已在美国专利申请书13/203800 和 PCT/US2012/026968中描述,该专利申请书由佛吉尼亚理工大学知识产权组管理。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
R. Lyle Hood, Rudy T. Andriani, Tobias E. Ecker, John L. Robertson, and Christopher G. Rylander declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




