参考文献
[ 1 ]
Molyneux RJ, Lee ST, Gardner DR, Panter KE, James LF. Phytochemicals: The good, the bad and the ugly? Phytochemistry 2007;68(22–24):2973–85
链接1
[ 2 ]
Surh YJ. Cancer chemoprevention with dietary phytochemicals. Nat Rev Cancer 2003;3(10):768–80
链接1
[ 3 ]
Lampe JW. Spicing up a vegetarian diet: Chemopreventive effects of phytochemicals. Am J Clin Nutr 2003;78(3 Suppl):579S–83S.
[ 4 ]
Fraser GE. Vegetarian diets: What do we know of their effects on common chronic diseases? Am J Clin Nutr 2009;89(5):1607S–12S
链接1
[ 5 ]
Wasserman WW, Fahl WE. Functional antioxidant responsive elements. Proc Natl Acad Sci USA 1997;94(10):5361–6
链接1
[ 6 ]
Hayes JD, McMahon M, Chowdhry S, Dinkova-Kostova AT. Cancer chemoprevention mechanisms mediated through the Keap1-Nrf2 pathway. Antioxid Redox Signal 2010;13(11):1713–48
链接1
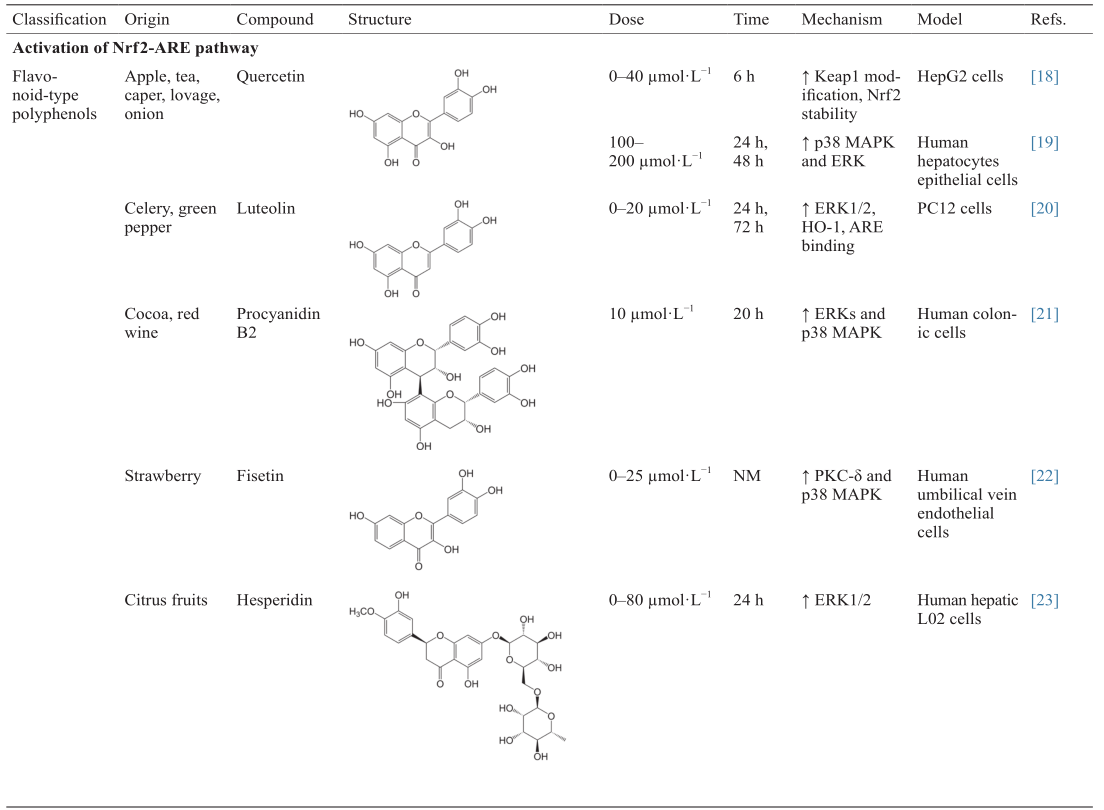
[ 7 ]
Chorley BN, Campbell MR, Wang X, Karaca M, Sambandan D, Bangura F, et al.Identification of novel NRF2-regulated genes by ChIP-Seq: Influence on retinoid X receptor alpha. Nucleic Acids Res 2012;40(15):7416–29
链接1
[ 8 ]
Baird L, Dinkova-Kostova AT. The cytoprotective role of the Keap1-Nrf2 pathway. Arch Toxicol 2011;85(4):241–72
链接1
[ 9 ]
Dinkova-Kostova AT, Massiah MA, Bozak RE, Hicks RJ, Talalay P. Potency of Michael reaction acceptors as inducers of enzymes that protect against carcinogenesis depends on their reactivity with sulfhydryl groups. Proc Natl Acad Sci USA 2001;98(6):3404–9
链接1
[10]
Kobayashi M, Li L, Iwamoto N, Nakajima-Takagi Y, Kaneko H, Nakayama Y, et al.The antioxidant defense system Keap1-Nrf2 comprises a multiple sensing mechanism for responding to a wide range of chemical compounds. Mol Cell Biol 2009;29(2):493–502
链接1
[11]
Zhang DD, Hannink M. Distinct cysteine residues in Keap1 are required for Keap1-dependent ubiquitination of Nrf2 and for stabilization of Nrf2 by chemopreventive agents and oxidative stress. Mol Cell Biol 2003;23(22):8137–51
链接1
[12]
Furukawa M, Xiong Y. BTB protein Keap1 targets antioxidant transcription factor Nrf2 for ubiquitination by the Cullin 3-Roc1 ligase. Mol Cell Biol 2005;25(1):162–71
链接1
[13]
Canning P, Sorrell FJ, Bullock AN. Structural basis of Keap1 interactions with Nrf2. Free Radic Biol Med 2015;88(Pt B):101–7.
[14]
Tong KI, Katoh Y, Kusunoki H, Itoh K, Tanaka T, Yamamoto M. Keap1 recruits Neh2 through binding to ETGE and DLG motifs: Characterization of the two-site molecular recognition model. Mol Cell Biol 2006;26(8):2887–900
链接1
[15]
Komatsu M, Kurokawa H, Waguri S, Taguchi K, Kobayashi A, Ichimura Y, et al.The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1. Nat Cell Biol 2010;12(3):213–23
链接1
[16]
Adam J, Hatipoglu E, O’Flaherty L, Ternette N, Sahgal N, Lockstone H, et al.Renal cyst formation in Fh1-deficient mice is independent of the Hif/Phd pathway: Roles for fumarate in KEAP1 succination and Nrf2 signaling. Cancer Cell 2011;20(4):524–37
链接1
[17]
Jain AK, Mahajan S, Jaiswal AK. Phosphorylation and dephosphorylation of tyrosine 141 regulate stability and degradation of INrf2: A novel mechanism in Nrf2 activation. J Biol Chem 2008;283(25):17712–20
链接1
[18]
Tanigawa S, Fujii M, Hou DX. Action of Nrf2 and Keap1 in ARE-mediated NQO1 expression by quercetin. Free Radic Biol Med 2007;42(11):1690–703
链接1
[19]
Yao P, Nussler A, Liu L, Hao L, Song F, Schirmeier A, et al.Quercetin protects human hepatocytes from ethanol-derived oxidative stress by inducing heme oxygenase-1 via the MAPK/Nrf2 pathways. J Hepatol 2007;47(2):253–61
链接1
[20]
Lin CW, Wu MJ, Liu IY, Su JD, Yen JH. Neurotrophic and cytoprotective action of luteolin in PC12 cells through ERK-dependent induction of Nrf2-driven HO-1 expression. J Agric Food Chem 2010;58(7):4477–86
链接1
[21]
Rodríguez-Ramiro I, Ramos S, Bravo L, Goya L, Martín Má. Procyanidin B2 induces Nrf2 translocation and glutathione S-transferase P1 expression via ERKs and p38-MAPK pathways and protect human colonic cells against oxidative stress. Eur J Nutr 2012;51(7):881–92
链接1
[22]
Lee SE, Jeong SI, Yang H, Park CS, Jin YH, Park YS. Fisetin induces Nrf2-mediated HO-1 expression through PKC-δ and p38 in human umbilical vein endothelial cells. J Cell Biochem 2011;112(9):2352–60
链接1
[23]
Chen MC, Ye YY, Ji G, Liu JW. Hesperidin upregulates heme oxygenase-1 to attenuate hydrogen peroxide-induced cell damage in hepatic L02 cells. J Agric Food Chem 2010;58(6):3330–5
链接1
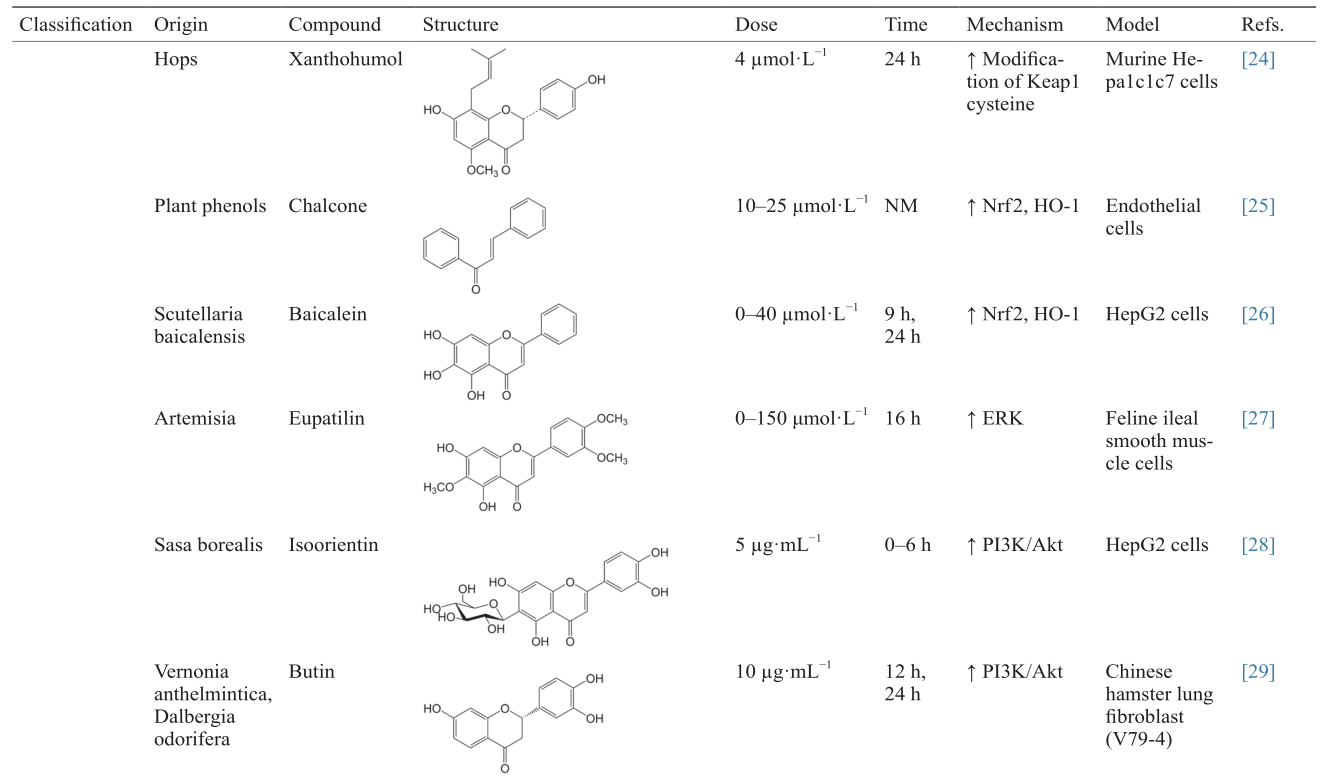
[24]
Dietz BM, Kang YH, Liu G, Eggler AL, Yao P, Chadwick LR, et al.Xanthohumol isolated from Humulus lupulus inhibits menadione-induced DNA damage through induction of quinone reductase. Chem Res Toxicol 2005;18(8):1296–305
链接1
[25]
Liu YC, Hsieh CW, Wu CC, Wung BS. Chalcone inhibits the activation of NF-κB and STAT3 in endothelial cells via endogenous electrophile. Life Sci 2007;80(15):1420–30
链接1
[26]
Qin S, Chen J, Tanigawa S, Hou DX. Gene expression profiling and pathway network analysis of hepatic metabolic enzymes targeted by baicalein. J Ethnopharmacol 2012;140(1):131–40
链接1
[27]
Song HJ, Shin CY, Oh TY, Sohn UD. The protective effect of eupatilin on indomethacin-induced cell damage in cultured feline ileal smooth muscle cells: Involvement of HO-1 and ERK. J Ethnopharmacol 2008;118(1):94–101
链接1
[28]
Lim JH, Park HS, Choi JK, Lee IS, Choi HJ. Isoorientin induces Nrf2 pathway-driven antioxidant response through phosphatidylinositol 3-kinase signaling. Arch Pharm Res 2007;30(12):1590–8
链接1
[29]
Zhang R, Chae S, Lee JH, Hyun JW. The cytoprotective effect of butin against oxidative stress is mediated by the up-regulation of manganese superoxide dismutase expression through a PI3K/Akt/Nrf2-dependent pathway. J Cell Biochem 2012;113(6):1987–97
链接1
[30]
Hwang YP, Jeong HG. Mechanism of phytoestrogen puerarin-mediated cytoprotection following oxidative injury: Estrogen receptor-dependent up-regulation of PI3K/Akt and HO-1. Toxicol Appl Pharmacol 2008;233(3):371–81
链接1
[31]
Thuong PT, Pokharel YR, Lee MY, Kim SK, Bae K, Su ND, et al.Dual anti-oxidative effects of fraxetin isolated from Fraxinus rhinchophylla. Biol Pharm Bull 2009;32(9):1527–32
链接1
[32]
Park EJ, Lim JH, Nam SI, Park JW, Kwon TK. Rottlerin induces heme oxygenase-1 (HO-1) up-regulation through reactive oxygen species (ROS) dependent and PKC δ-independent pathway in human colon cancer HT29 cells. Biochimie 2010;92(1):110–5
链接1
[33]
Andreadi CK, Howells LM, Atherfold PA, Manson MM. Involvement of Nrf2, p38, B-Raf, and nuclear factor-κB, but not phosphatidylinositol 3-kinase, in induction of hemeoxygenase-1 by dietary polyphenols. Mol Pharmacol 2006;69(3):1033–40.
[34]
Wu CC, Hsu MC, Hsieh CW, Lin JB, Lai PH, Wung BS. Upregulation of heme oxygenase-1 by Epigallocatechin-3-gallate via the phosphatidylinositol 3-kinase/Akt and ERK pathways. Life Sci 2006;78(25):2889–97
链接1
[35]
Granado-Serrano AB, Martín MA, Haegeman G, Goya L, Bravo L, Ramos S. Epicatechin induces NF-κB, activator protein-1 (AP-1) and nuclear transcription factor erythroid 2p45-related factor-2 (Nrf2) via phosphatidylinositol-3-kinase/protein kinase B (PI3K/AKT) and extracellular regulated kinase (ERK) signalling in HepG2 cells. Br J Nutr 2010;103(2):168–79
链接1
[36]
Gao SS, Choi BM, Chen XY, Zhu RZ, Kim Y, So H, et al.Kaempferol suppresses cisplatin-induced apoptosis via inductions of heme oxygenase-1 and glutamate-cysteine ligase catalytic subunit in HEI-OC1 cell. Pharm Res 2010;27(2):235–45
链接1
[37]
Bak MJ, Jun M, Jeong WS. Procyanidins from wild grape (Vitis amurensis) seeds regulate ARE-mediated enzyme expression via Nrf2 coupled with p38 and PI3K/Akt pathway in HepG2 cells. Int J Mol Sci 2012;13(1):801–18
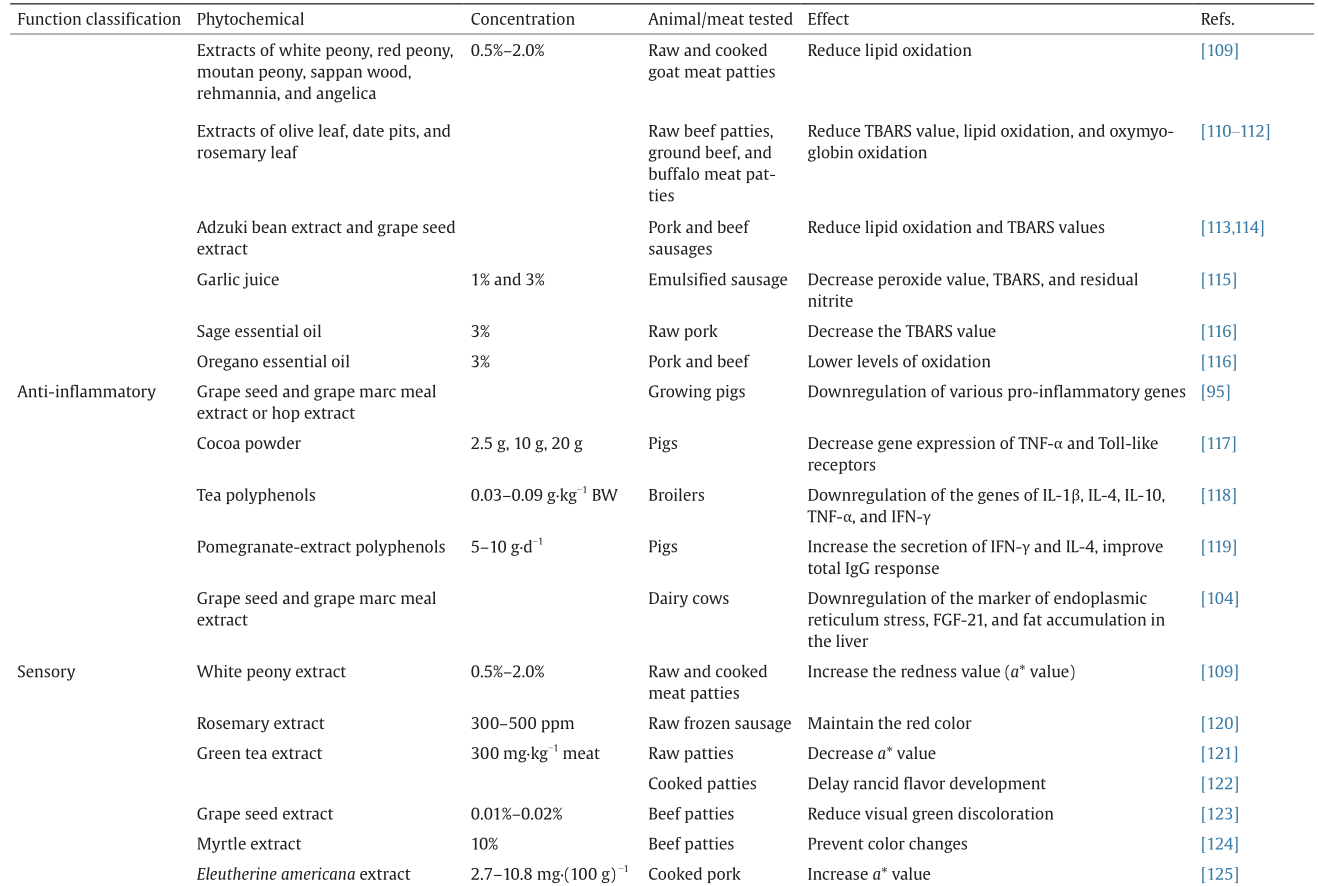
链接1
[38]
Kode A, Rajendrasozhan S, Caito S, Yang SR, Megson IL, Rahman I. Resveratrol induces glutathione synthesis by activation of Nrf2 and protects against cigarette smoke-mediated oxidative stress in human lung epithelial cells. Am J Physiol Lung Cell Mol Physiol 2008;294(3):L478–88
链接1
[39]
Chen CY, Jang JH, Li MH, Surh YJ. Resveratrol upregulates heme oxygenase-1 expression via activation of NF-E2-related factor 2 in PC12 cells. Biochem Biophys Res Commun 2005;331(4):993–1000
链接1
[40]
Tsai CW, Lin CY, Wang YJ. Carnosic acid induces the NAD(P)H: Quinone oxidoreductase 1 expression in rat clone 9 cells through the p38/nuclear factor erythroid-2 related factor 2 pathway. J Nutr 2011;141(12):2119–25
链接1
[41]
Satoh T, Kosaka K, Itoh K, Kobayashi A, Yamamoto M, Shimojo Y, et al.Carnosic acid, a catechol-type electrophilic compound, protects neurons both in vitro and in vivo through activation of the Keap1/Nrf2 pathway via S-alkylation of targeted cysteines on Keap1. J Neurochem 2008;104(4):1116–31
链接1
[42]
Chiou YS, Tsai ML, Nagabhushanam K, Wang YJ, Wu CH, Ho CT.et al.Pterostilbene is more potent than resveratrol in preventing azoxymethane (AOM)-induced colon tumorigenesis via activation of the NF-E2-related factor 2 (Nrf2)-mediated antioxidant signaling pathway. J Agric Food Chem 2011;59(6):2725–33
链接1
[43]
Liao BC, Hsieh CW, Liu YC, Tzeng TT, Sun YW, Wung BS. Cinnamaldehyde inhibits the tumor necrosis factor-α-induced expression of cell adhesion molecules in endothelial cells by suppressing NF-κB activation: Effects upon IκB and Nrf2. Toxicol Appl Pharmacol 2008;229(2):161–71
链接1
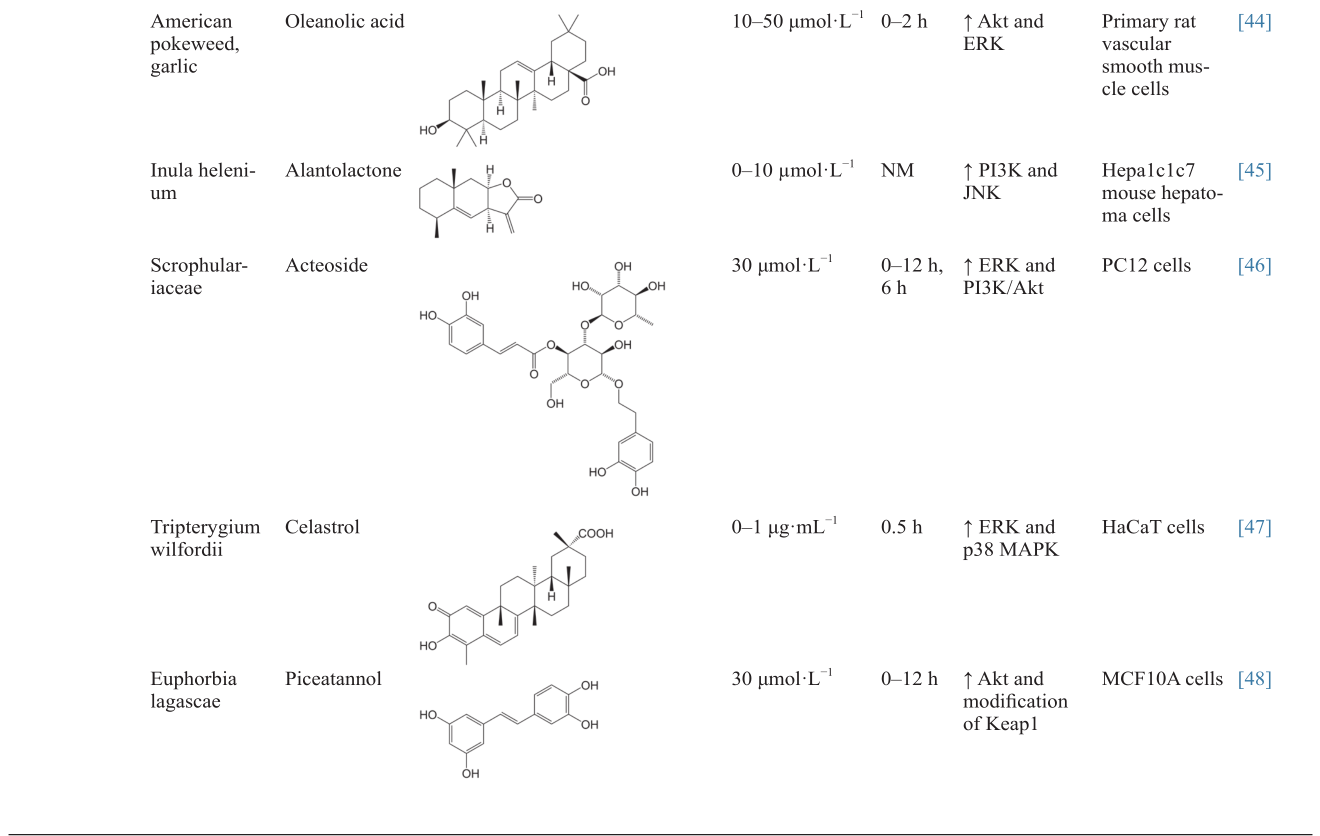
[44]
Feng J, Zhang P, Chen X, He G. PI3K and ERK/Nrf2 pathways are involved in oleanolic acid-induced heme oxygenase-1 expression in rat vascular smooth muscle cells. J Cell Biochem 2011;112(6):1524–31
链接1
[45]
Seo JY, Lim SS, Kim JR, Lim JS, Ha YR, Lee IA, et al.Nrf2-mediated induction of detoxifying enzymes by alantolactone present in Inula helenium. Phytother Res 2008;22(11):1500–5
链接1
[46]
Wang HQ, Xu YX, Zhu CQ. Upregulation of heme oxygenase-1 by acteoside through ERK and PI3 K/Akt pathway confer neuroprotection against β-amyloid-induced neurotoxicity. Neurotox Res 2012;21(4):368–78
链接1
[47]
Seo WY, Goh AR, Ju SM, Song HY, Kwon DJ, Jun JG, et al.Celastrol induces expression of heme oxygenase-1 through ROS/Nrf2/ARE signaling in the HaCaT cells. Biochem Biophys Res Commun 2011;407(3):535–40
链接1
[48]
Lee HH, Park SA, Almazari I, Kim EH, Na HK, Surh YJ. Piceatannol induces heme oxygenase-1 expression in human mammary epithelial cells through activation of ARE-driven Nrf2 signaling. Arch Biochem Biophys 2010;501(1):142–50
链接1
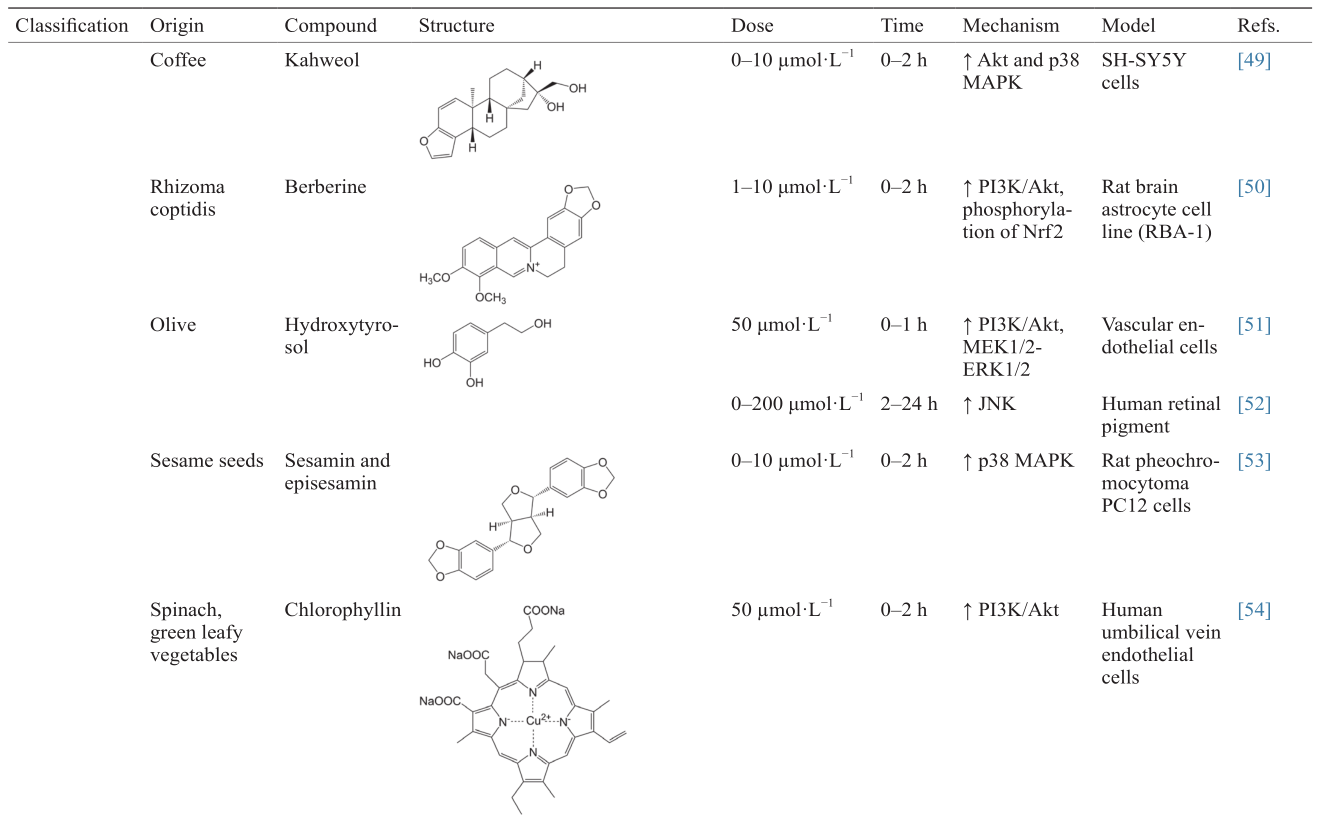
[49]
Hwang YP, Jeong HG. The coffee diterpene kahweol induces heme oxygenase-1 via the PI3K and p38/Nrf2 pathway to protect human dopaminergic neurons from 6-hydroxydopamine-derived oxidative stress. FEBS Lett 2008;582(17):2655–62
链接1
[50]
Chen JH, Huang SM, Tan TW, Lin HY, Chen PY, Yeh WL, et al.Berberine induces heme oxygenase-1 up-regulation through phosphatidylinositol 3-kinase/AKT and NF-E2-related factor-2 signaling pathway in astrocytes. Int Immunopharmacol 2012;12(1):94–100
链接1
[51]
Zrelli H, Matsuoka M, Kitazaki S, Araki M, Kusunoki M, Zarrouk M, et al.Hydroxytyrosol induces proliferation and cytoprotection against oxidative injury in vascular endothelial cells: Role of Nrf2 activation and HO-1 induction. J Agric Food Chem 2011;59(9):4473–82
链接1
[52]
Zou X, Feng Z, Li Y, Wang Y, Wertz K, Weber P, et al.Stimulation of GSH synthesis to prevent oxidative stress-induced apoptosis by hydroxytyrosol in human retinal pigment epithelial cells: Activation of Nrf2 and JNK-p62/SQSTM1 pathways. J Nutr Biochem 2012;23(8):994–1006
链接1
[53]
Hamada N, Tanaka A, Fujita Y, Itoh T, Ono Y, Kitagawa Y, et al.Involvement of heme oxygenase-1 induction via Nrf2/ARE activation in protection against H2O2-induced PC12 cell death by a metabolite of sesamin contained in sesame seeds. Bioorg Med Chem 2011;19(6):1959–65
链接1
[54]
Zhang Y, Guan L, Wang X, Wen T, Xing J, Zhao J. Protection of chlorophyllin against oxidative damage by inducing HO-1 and NQO1 expression mediated by PI3K/Akt and Nrf2. Free Radic Res 2008;42(4):362–71
链接1
[55]
Sumi D, Numasawa Y, Endo A, Iwamoto N, Kumagai Y. Catechol estrogens mediated activation of Nrf2 through covalent modification of its quinone metabolite to Keap1. J Toxicol Sci 2009;34(6):627–35
链接1
[56]
Hong F, Freeman ML, Liebler DC. Identification of sensor cysteines in human Keap1 modified by the cancer chemopreventive agent sulforaphane. Chem Res Toxicol 2005;18(12):1917–26
链接1
[57]
Keum YS, Yu S, Chang PP, Yuan X, Kim JH, Xu C, et al.Mechanism of action of sulforaphane: Inhibition of p38 mitogen-activated protein kinase isoforms contributing to the induction of antioxidant response element-mediated heme oxygenase-1 in human hepatoma HepG2 cells. Cancer Res. 2006;66(17):8804–13
链接1
[58]
Jakubíková J, Sedlák J, Mithen R, Bao Y. Role of PI3K/Akt and MEK/ERK signaling pathways in sulforaphane- and erucin-induced phase II enzymes and MRP2 transcription, G2/M arrest and cell death in Caco-2 cells. Biochem Pharmacol 2005;69(11):1543–52
链接1
[59]
Zhang C, Su ZY, Khor TO, Shu L, Kong AN. Sulforaphane enhances Nrf2 expression in prostate cancer TRAMP C1 cells through epigenetic regulation. Biochem Pharmacol 2013;85(9):1398–404
链接1
[60]
Xu C, Yuan X, Pan Z, Shen G, Kim JH, Yu S, et al.Mechanism of action of isothiocyanates: The induction of ARE-regulated genes is associated with activation of ERK and JNK and the phosphorylation and nuclear translocation of Nrf2. Mol Cancer Ther 2006;5(8):1918–26
链接1
[61]
Saw CL, Cintrón M, Wu TY, Guo Y, Huang Y, Jeong WS, et al.Pharmacodynamics of dietary phytochemical indoles I3C and DIM: Induction of Nrf2-mediated phase II drug metabolizing and antioxidant genes and synergism with isothiocyanates. Biopharm Drug Dispos 2011;32(5):289–300
链接1
[62]
Wu TY, Khor TO, Su ZY, Saw CL, Shu L, Cheung KL, et al.Epigenetic modifications of Nrf2 by 3,3´-diindolylmethane in vitro in TRAMP C1 cell line and in vivo TRAMP prostate tumors. AAPS J 2013;15(3):864–74
链接1
[63]
Chen C, Pung D, Leong V, Hebbar V, Shen G, Nair S, et al.Induction of detoxifying enzymes by garlic organosulfur compounds through transcription factor Nrf2: Effect of chemical structure and stress signals. Free Radic Biol Med 2004;37(10):1578–90
链接1
[64]
Jeon WK, Hong HY, Kim BC. Genipin up-regulates heme oxygenase-1 via PI3-kinase-JNK1/2-Nrf2 signaling pathway to enhance the anti-inflammatory capacity in RAW264.7 macrophages. Arch Biochem Biophys 2011;512(2):119–25
链接1
[65]
Almazari I, Park JM, Park SA, Suh JY, Na HK, Cha YN, et al.Guggulsterone induces heme oxygenase-1 expression through activation of Nrf2 in human mammary epithelial cells: PTEN as a putative target. Carcinogenesis 2012;33(2):368–76
链接1
[66]
Tang X, Wang H, Fan L, Wu X, Xin A, Ren H, et al.Luteolin inhibits Nrf2 leading to negative regulation of the Nrf2/ARE pathway and sensitization of human lung carcinoma A549 cells to therapeutic drugs. Free Radic Biol Med 2011;50(11):1599–609
链接1
[67]
Chian S, Li YY, Wang XJ, Tang XW. Luteolin sensitizes two oxaliplatin-resistant colorectal cancer cell lines to chemotherapeutic drugs via inhibition of the Nrf2 pathway. Asian Pac J Cancer Prev 2014;15(6):2911–6
链接1
[68]
Gao AM, Ke ZP, Wang JN, Yang JY, Chen SY, Chen H. Apigenin sensitizes doxorubicin-resistant hepatocellular carcinoma BEL-7402/ADM cells to doxorubicin via inhibiting PI3K/Akt/Nrf2 pathway. Carcinogenesis 2013;34(8):1806–14
链接1
[69]
Gao AM, Ke ZP, Shi F, Sun GC, Chen H. Chrysin enhances sensitivity of BEL-7402/ADM cells to doxorubicin by suppressing PI3K/Akt/Nrf2 and ERK/Nrf2 pathway. Chem Biol Interact 2013;206(1):100–8
链接1
[70]
Lim J, Lee SH, Cho S, Lee IS, Kang BY, Choi HJ. 4-methoxychalcone enhances cisplatin-induced oxidative stress and cytotoxicity by inhibiting the Nrf2/ARE-mediated defense mechanism in A549 lung cancer cells. Mol Cells 2013;36(4):340–6
链接1
[71]
Hou X, Bai X, Gou X, Zeng H, Xia C, Zhuang W,et al.3´,4´,5´,5,7-pentamethoxyflavone sensitizes cisplatin-resistant A549 cells to cisplatin by inhibition of Nrf2 pathway. Mol Cells 2015;38(5):396–401
链接1
[72]
Kweon MH, Adhami VM, Lee JS, Mukhtar H. Constitutive overexpression of Nrf2-dependent heme oxygenase-1 in A549 cells contributes to resistance to apoptosis induced by epigallocatechin 3-gallate. J Biol Chem 2006;281(44):33761–72
链接1
[73]
Ren D, Villeneuve NF, Jiang T, Wu T, Lau A, Toppin HA, et al.Brusatol enhances the efficacy of chemotherapy by inhibiting the Nrf2-mediated defense mechanism. Proc Natl Acad Sci USA 2011;108(4):1433–8
链接1
[74]
Xia C, Bai X, Hou X, Gou X, Wang Y, Zeng H, et al.Cryptotanshinone reverses cisplatin resistance of human lung carcinoma A549 cells through down-regulating Nrf2 pathway. Cell Physiol Biochem 2015;37(2):816–24
链接1
[75]
Do MT, Kim HG, Khanal T, Choi JH, Kim DH, Jeong TC, et al.et al.et al.Metformin inhibits heme oxygenase-1 expression in cancer cells through inactivation of Raf-ERK-Nrf2 signaling and AMPK-independent pathways. Toxicol Appl Pharmacol 2013;271(2):229–38
链接1
[76]
Do MT, Kim HG, Choi JH, Jeong HG. Metformin induces microRNA-34a to downregulate the Sirt1/Pgc-1α/Nrf2 pathway, leading to increased susceptibility of wild-type p53 cancer cells to oxidative stress and therapeutic agents. Free Radic Biol Med 2014;74:21–34
链接1
[77]
Cavin C, Delatour T, Marin-Kuan M, Fenaille F, Holzh?user D, Guignard G, et al.Ochratoxin A-mediated DNA and protein damage: Roles of nitrosative and oxidative stresses. Toxicol Sci 2009;110(1):84–94
链接1
[78]
Boesch-Saadatmandi C, Wagner AE, Graeser AC, Hundhausen C, Wolffram S, Rimbach G. Ochratoxin A impairs Nrf2-dependent gene expression in porcine kidney tubulus cells. J Anim Physiol Anim Nutr (Berl) 2009;93(5):547–54
链接1
[79]
Arlt A, Sebens S, Krebs S, Geismann C, Grossmann M, Kruse ML, et al.Inhibition of the Nrf2 transcription factor by the alkaloid trigonelline renders pancreatic cancer cells more susceptible to apoptosis through decreased proteasomal gene expression and proteasome activity. Oncogene 2013;32(40):4825–35
链接1
[80]
Boettler U, Sommerfeld K, Volz N, Pahlke G, Teller N, Somoza V, et al.Coffee constituents as modulators of Nrf2 nuclear translocation and ARE (EpRE)-dependent gene expression. J Nutr Biochem 2011;22(5):426–40
链接1
[81]
Tanigawa S, Lee CH, Lin CS, Ku CC, Hasegawa H, Qin S, et al.Jun dimerization protein 2 is a critical component of the Nrf2/MafK complex regulating the response to ROS homeostasis. Cell Death Dis 2013;4:e921
链接1
[82]
Liu GH, Qu J, Shen X. NF-κB/p65 antagonizes Nrf2-ARE pathway by depriving CBP from Nrf2 and facilitating recruitment of HDAC3 to MafK. Biochim Biophys Acta 2008;1783(5):713–27
链接1
[83]
Shankar S, Kumar D, Srivastava RK. Epigenetic modifications by dietary phytochemicals: Implications for personalized nutrition. Pharmacol Ther 2013;138(1):1–17
链接1
[84]
Su ZY, Khor TO, Shu L, Lee JH, Saw CL, Wu TY, et al.Epigenetic reactivation of Nrf2 in murine prostate cancer TRAMP C1 cells by natural phytochemicals Z-ligustilide and Radix angelica sinensis via promoter CpG demethylation. Chem Res Toxicol 2013;26(3):477–85
链接1
[85]
Khor TO, Huang Y, Wu TY, Shu L, Lee J, Kong AN. Pharmacodynamics of curcumin as DNA hypomethylation agent in restoring the expression of Nrf2 via promoter CpGs demethylation. Biochem Pharmacol 2011;82(9):1073–8
链接1
[86]
Paredes-Gonzalez X, Fuentes F, Su ZY, Kong AN. Apigenin reactivates Nrf2 anti-oxidative stress signaling in mouse skin epidermal JB6 P+ cells through epigenetics modifications. AAPS J 2014;16(4):727–35
链接1
[87]
Su ZY, Zhang C, Lee JH, Shu L, Wu TY, Khor TO, et al.Requirement and epigenetics reprogramming of Nrf2 in suppression of tumor promoter TPA-induced mouse skin cell transformation by sulforaphane. Cancer Prev Res (Phila) 2014;7(3):319–29
链接1
[88]
Wang L, Zhang C, Guo Y, Su ZY, Yang Y, Shu L, et al.Blocking of JB6 cell transformation by tanshinone IIA: Epigenetic reactivation of Nrf2 antioxidative stress pathway. AAPS J 2014;16(6):1214–25
链接1
[89]
Zhu J, Wang H, Chen F, Fu J, Xu Y, Hou Y, et al.An overview of chemical inhibitors of the Nrf2-ARE signaling pathway and their potential applications in cancer therapy. Free Radic Biol Med 2016;99:544–56
链接1
[90]
Gessner DK, Ringseis R, Eder K. Potential of plant polyphenols to combat oxidative stress and inflammatory processes in farm animals. J Anim Physiol Anim Nutr (Berl).Epub 2016 Jul 25.
[91]
Burgess TA, Robich MP, Chu LM, Bianchi C, Sellke FW. Improving glucose metabolism with resveratrol in a swine model of metabolic syndrome through alteration of signaling pathways in the liver and skeletal muscle. Arch Surg 2011;146(5):556–64
链接1
[92]
Azorín-Ortuño M, Yañéz-Gascón MJ, Pallarés FJ, Rivera J, González-Sarrías A, Larrosa M, et al.A dietary resveratrol-rich grape extract prevents the developing of atherosclerotic lesions in the aorta of pigs fed an atherogenic diet. J Agric Food Chem 2012;60(22):5609–20
链接1
[93]
Robich MP, Osipov RM, Nezafat R, Feng J, Clements RT, Bianchi C, et al.Resveratrol improves myocardial perfusion in a swine model of hypercholesterolemia and chronic myocardial ischemia. Circulation 2010;122(11 Suppl 1):S142–9
链接1
[94]
Gessner DK, Ringseis R, Siebers M, Keller J, Kloster J, Wen G, et al.Inhibition of the pro-inflammatory NF-κB pathway by a grape seed and grape marc meal extract in intestinal epithelial cells. J Anim Physiol Anim Nutr (Berl) 2012;96(6):1074–83
链接1
[95]
Gessner DK, Fiesel A, Most E, Dinges J, Wen G, Ringseis R, et al.Supplementation of a grape seed and grape marc meal extract decreases activities of the oxidative stress-responsive transcription factors NF-κB and Nrf2 in the duodenal mucosa of pigs. Acta Vet Scand 2013;55:18
链接1
[96]
Wang ML, Suo X, Gu JH, Zhang WW, Fang Q, Wang X. Influence of grape seed proanthocyanidin extract in broiler chickens: Effect on chicken coccidiosis and antioxidant status. Poult Sci 2008;87(11):2273–80
链接1
[97]
Starčević K, Krstulović L, Brozić D, Maurić M, Stojević Z, Mikulec Ž, et al.Production performance, meat composition and oxidative susceptibility in broiler chicken fed with different phenolic compounds. J Sci Food Agric 2015;95(6):1172–8
链接1
[98]
Viveros A, Chamorro S, Pizarro M, Arija I, Centeno C, Brenes A. Effects of dietary polyphenol-rich grape products on intestinal microflora and gut morphology in broiler chicks. Poult Sci 2011;90(3):566–78
链接1
[99]
Eid YZ, Ohtsuka A, Hayashi K. Tea polyphenols reduce glucocorticoid-induced growth inhibition and oxidative stress in broiler chickens. Br Poult Sci 2003;44(1):127–32
链接1
[100]
Sridhar M, Suganthi RU, Thammiaha V. Effect of dietary resveratrol in ameliorating aflatoxin B1-induced changes in broiler birds. J Anim Physiol Anim Nutr (Berl) 2015;99(6):1094–104
链接1
[101]
Liu HN, Liu Y, Hu LL, Suo YL, Zhang L, Jin F, et al.Effects of dietary supplementation of quercetin on performance, egg quality, cecal microflora populations, and antioxidant status in laying hens. Poult Sci 2014;93(2):347–53
链接1
[102]
Yuan ZH, Zhang KY, Ding XM, Luo YH, Bai SP, Zeng QF, et al.Effect of tea polyphenols on production performance, egg quality, and hepatic antioxidant status of laying hens in vanadium-containing diets. Poult Sci 2016;95(7):1709–17
链接1
[103]
Oliveira RA, Narciso CD, Bisinotto RS, Perdomo MC, Ballou MA, Dreher M, et al.Effects of feeding polyphenols from pomegranate extract on health, growth, nutrient digestion, and immunocompetence of calves. J Dairy Sci 2010;93(9):4280–91
链接1
[104]
Gessner DK, Gröne B, Couturier A, Rosenbaum S, Hillen S, Becker S, et al.Dietary fish oil inhibits pro-inflammatory and ER stress signalling pathways in the liver of sows during lactation. PLoS One 2015;10(9):e0137684
链接1
[105]
Winkler A, Gessner DK, Koch C, Romberg FJ, Dusel G, Herzog E, et al.Effects of a plant product consisting of green tea and curcuma extract on milk production and the expression of hepatic genes involved in endoplasmic stress response and inflammation in dairy cows. Arch Anim Nutr 2015;69(6):425–41
链接1
[106]
Luehring M, Blank R, Wolffram S. Vitamin E-sparing and vitamin E-independent antioxidative effects of the flavonol quercetin in growing pigs. Anim Feed Sci Tech 2011;169(3–4):199–207
链接1
[107]
Hou X, Zhang J, Ahmad H, Zhang H, Xu Z, Wang T. Evaluation of antioxidant activities of ampelopsin and its protective effect in lipopolysaccharide-induced oxidative stress piglets. PLoS One 2014;9(9):e108314
链接1
[108]
Nissen LR, Byrne DV, Bertelsen G, Skibsted LH. The antioxidative activity of plant extracts in cooked pork patties as evaluated by descriptive sensory profiling and chemical analysis. Meat Sci 2004;68(3):485–95
链接1
[109]
Hayes JE, Stepanyan V, O’Grady MN, Allen P, Kerry JP. Evaluation of the effects of selected phytochemicals on quality indices and sensorial properties of raw and cooked pork stored in different packaging systems. Meat Sci 2010;85(2):289–96
链接1
[110]
Hayes JE, Stepanyan V, Allen P, O’Grady MN, Kerry JP. Effect of lutein, sesamol, ellagic acid and olive leaf extract on the quality and shelf-life stability of packaged raw minced beef patties. Meat Sci 2010;84(4):613–20
链接1
[111]
Krah DL. A simplified multiwell plate assay for the measurement of hepatitis A virus infectivity. Biologicals 1991;19(3):223–7
链接1
[112]
Naveena BM, Vaithiyanathan S, Muthukumar M, Sen AR, Kumar YP, Kiran M, et al.Relationship between the solubility, dosage and antioxidant capacity of carnosic acid in raw and cooked ground buffalo meat patties and chicken patties. Meat Sci 2013;95(2):195–202
链接1
[113]
Jayawardana BC, Hirano T, Han KH, Ishii H, Okada T, Shibayama S, et al.Utilization of adzuki bean extract as a natural antioxidant in cured and uncured cooked pork sausages. Meat Sci 2011;89(2):150–3
链接1
[114]
Kulkarni S, DeSantos FA, Kattamuri S, Rossi SJ, Brewer MS. Effect of grape seed extract on oxidative, color and sensory stability of a pre-cooked, frozen, re-heated beef sausage model system. Meat Sci 2011;88(1):139–44
链接1
[115]
Choi SH, Kwon HC, An DJ, Park JR, Oh DH. Nitrite contents and storage properties of sausage added with green tea powder. Kor J Food Sci Ani Resour 2003;23(4):299–308.
[116]
Fasseas MK, Mountzouris KC, Tarantilis PA, Polissiou M, Zervas G. Antioxidant activity in meat treated with oregano and sage essential oils. Food Chem 2008;106(3):1188–94
链接1
[117]
Jang S, Sun J, Chen P, Lakshman S, Molokin A, Harnly JM, et al.Flavanol-enriched cocoa powder alters the intestinal microbiota, tissue and fluid metabolite profiles, and intestinal gene expression in pigs. J Nutr 2016;146(4):673–80
链接1
[118]
Li HL, Li ZJ, Wei ZS, Liu T, Zou XZ, Liao Y, et al.Long-term effects of oral tea polyphenols and Lactobacillus brevis M8 on biochemical parameters, digestive enzymes, and cytokines expression in broilers. J Zhejiang Univ Sci B 2015;16(2):1019–26
链接1
[119]
Oliveira RA, Narciso CD, Bisinotto RS, Perdomo MC, Ballou MA, Dreher M, et al.Effects of feeding polyphenols from pomegranate extract on health, growth, nutrient digestion, and immunocompetence of calves. J Dairy Sci 2010;93(9):4280–91
链接1
[120]
Aksu MI, ÖZER H. Effects of lyophilized water extract of Satureja hortensis on the shelf life and quality properties of ground beef. J Food Process Pres 2013;37(5):777–83.
[121]
Han J, Rhee KS. Antioxidant properties of selected Oriental non-culinary/nutraceutical herb extracts as evaluated in raw and cooked meat. Meat Sci 2005;70(1):25–33
链接1
[122]
Bañón S, Díaz P, Rodríguez M, Garrido MD, Price A. Ascorbate, green tea and grape seed extracts increase the shelf life of low sulphite beef patties. Meat Sci 2007;77(4):626–33
链接1
[123]
Rojas MC, Brewer MS. Effect of natural antioxidants on oxidative stability of cooked, refrigerated beef and pork. J Food Sci 2007;72(4):S282–8
链接1
[124]
Akarpat A, Turhan S, Ustun NS. Effects of hot-water extracts from myrtle, rosemary, nettle and lemon balm leaves on lipid oxidation and color of beef patties during frozen storage. J Food Process Pres 2008;32(1):117–32
链接1
[125]
Ifesan BO, Siripongvutikorn S, Hutadilok-Towatana N, Voravuthikunchai SP. Evaluation of the ability of Eleutherine americana crude extract as natural food additive in cooked pork. J Food Sci 2009;74(7):M352–7
链接1
[126]
Jayathilakan K, Sharma GK, Radhakrishna K, Bawa AS. Antioxidant potential of synthetic and natural antioxidants and its effect on warmed-over-flavour in different species of meat. Food Chem 2007;105(3):908–16
链接1
[127]
Rababah TM, Ereifej KI, Alhamad MN, Al-Qudah KM, Rousan LM, Al-Mahasneh MA, et al.Effects of green tea and grape seed and TBHQ on physicochemical properties of Baladi goat meats. Int J Food Prop 2011;14(6):1208–16
链接1
[128]
Wójciak KM, Dolatowski ZJ, Okoń A. The effect of water plant extracts addition on the oxidative stability of meat products. Acta Sci Pol Technol Aliment 2011;10(2):175–88.
[129]
Biswas AK, Chatli MK, Sahoo J. Antioxidant potential of curry (Murraya koenigii L.) and mint (Mentha spicata) leaf extracts and their effect on colour and oxidative stability of raw ground pork meat during refrigeration storage. Food Chem 2012;133(2):467–72
链接1
[130]
Shah MA, Bosco SJ, Mir SA. Plant extracts as natural antioxidants in meat and meat products. Meat Sci 2014;98(1):21–33
链接1
[131]
Nuñez de Gonzalez MT, Boleman RM, Miller RK, Keeton JT, Rhee KS. Antioxidant properties of dried plum ingredients in raw and precooked pork sausage. J Food Sci 2008;73(5):H63–71
链接1
[132]
Nuñez de Gonzalez MT, Hafley BS, Boleman RM, Miller RM, Rhee KS, Keeton JT. Qualitative effects of fresh and dried plum ingredients on vacuum-packaged, sliced hams. Meat Sci 2009;83(1):74–81
链接1
[133]
Ahn J, Grün IU, Fernando LN. Antioxidant properties of natural plant extracts containing polyphenolic compounds in cooked ground beef. J Food Sci 2002;67(4):1364–9
链接1
[134]
Magistrelli D, Zanchi R, Malagutti L, Galassi G, Canzi E, Rosi F. Effects of cocoa husk feeding on the composition of swine intestinal microbiota. J Agric Food Chem 2016;64(10):2046–52
链接1
[135]
Ishihara N, Chu DC, Akachi S, Juneja LR. Improvement of intestinal microflora balance and prevention of digestive and respiratory organ diseases in calves by green tea extracts. Livest Prod Sci 2001;68(2–3):217–29
链接1
[136]
Lahucky R, Nuernberg K, Kovac L, Bucko O, Nuernberg G. Assessment of the antioxidant potential of selected plant extracts—In vitro and in vivo experiments on pork. Meat Sci 2010;85(4):779–84
链接1
[137]
Karre L, Lopez K, Getty KJ. Natural antioxidants in meat and poultry products. Meat Sci 2013;94(2):220–7
链接1
[138]
Surai PF. Polyphenol compounds in the chicken/animal diet: From the past to the future. J Anim Physiol Anim Nutr (Berl) 2014;98(1):19–31
链接1
[139]
Moreno-Indias I, Sánchez-Alcoholado L, Pérez-Martínez P, Andrés-Lacueva C, Cardona F, Tinahones F, et al.Red wine polyphenols modulate fecal microbiota and reduce markers of the metabolic syndrome in obese patients. Food Funct 2016;7(4):1775–87
链接1
[140]
Etxeberria U, Fernández-Quintela A, Milagro FI, Aguirre L, Martínez JA, Portillo MP. Impact of polyphenols and polyphenol-rich dietary sources on gut microbiota composition. J Agric Food Chem 2013;61(40):9517–33
链接1
[141]
Patra AK, Saxena J. The effect and mode of action of saponins on the microbial populations and fermentation in the rumen and ruminant production. Nutr Res Rev 2009;22(2):204–19
链接1
[142]
Neyrinck AM, Etxeberria U, Taminiau B, Daube G, Van Hul M, Everard A, et al.Rhubarb extract prevents hepatic inflammation induced by acute alcohol intake, an effect related to the modulation of the gut microbiota. Mol Nutr Food Res 2017;61(1). Epub 2016 Jun 1
链接1
[143]
You Q, Chen F, Wang X, Luo PG, Jiang Y. Inhibitory effects of muscadine anthocyanins on α-glucosidase and pancreatic lipase activities. J Agric Food Chem 2011;59(17):9506–11
链接1
[144]
Yilmazer-Musa M, Griffith AM, Michels AJ, Schneider E, Frei B. Grape seed and tea extracts and catechin 3-gallates are potent inhibitors of α-amylase and α-glucosidase activity. J Agric Food Chem 2012;60(36):8924–9
链接1
[145]
Dunnick JK, Hailey JR. Toxicity and carcinogenicity studies of quercetin, a natural component of foods. Fundam Appl Toxicol 1992;19(3):423–31
链接1
[146]
Inoue H, Akiyama S, Maeda-Yamamoto M, Nesumi A, Tanaka T, Murakami A. High-dose green tea polyphenols induce nephrotoxicity in dextran sulfate sodium-induced colitis mice by down-regulation of antioxidant enzymes and heat-shock protein expressions. Cell Stress Chaperones 2011;16(6):653–62
链接1
[147]
Hirose M, Hoshiya T, Mizoguchi Y, Nakamura A, Akagi K, Shirai T. Green tea catechins enhance tumor development in the colon without effects in the lung or thyroid after pretreatment with 1,2-dimethylhydrazine or 2,2´-dihydroxy- di- n-propylnitrosamine in male F344 rats. Cancer Lett 2001;168(1):23–9
链接1
[148]
Hagiwara A, Hirose M, Takahashi S, Ogawa K, Shirai T, Ito N. F orestomach and kidney carcinogenicity of caffeic acid in F344 rats and C57BL/6N × C3H/HeN F1 mice. Cancer Res 1991;51(20):5655–60.
[149]
Uruno A, Furusawa Y, Yagishita Y, Fukutomi T, Muramatsu H, Negishi T, et al.The Keap1-Nrf2 system prevents onset of diabetes mellitus. Mol Cell Biol 2013;33(15):2996–3010
链接1
[150]
Hayes JD, Dinkova-Kostova AT. The Nrf2 regulatory network provides an interface between redox and intermediary metabolism. Trends Biochem Sci 2014;39(4):199–218
链接1
[151]
Cardaci S, Filomeni G, Ciriolo MR. Redox implications of AMPK-mediated signal transduction beyond energetic clues. J Cell Sci 2012;125(Pt 9):2115–25
链接1
[152]
Singh A, Happel C, Manna SK, Acquaah-Mensah G, Carrerero J, Kumar S, et al.Transcription factor NRF2 regulates miR-1 and miR-206 to drive tumorigenesis. J Clin Invest 2013;123(7):2921–34
链接1
[153]
Dinkova-Kostova AT, Abramov AY. The emerging role of Nrf2 in mitochondrial function. Free Radic Biol Med 2015;88(Pt B):179–88.
链接1
[154]
Yang CS, Zhang J, Zhang L, Huang J, Wang Y. Mechanisms of body weight reduction and metabolic syndrome alleviation by tea. Mol Nutr Food Res 2016;60(1):160–74
链接1






















 京公网安备 11010502051620号
京公网安备 11010502051620号




