《1.引言》
1.引言
由于锂离子电池具有能量密度高、寿命长、体积小、重量轻、自放电率低、无记忆效应、应用温度范围广和环境友好等特点[1−3],从20世纪90年代开始,锂离子电池就被广泛应用于便携仪器、混合动力汽车和电动汽车等储能领域[3−6]。然而,由于消费电子产品更新换代加快以及锂离子电池在电动汽车领域的持续推广,近年来已经产生了大量的废锂离子电池。据统计,数码产品中锂离子电池的寿命仅1~3年,动力汽车中锂电池的寿命为5~8年[7,8]。据此预测,到2020年我国将有25亿只、约5.0×105 t的废旧锂离子电池产生[9]。锂离子电池由正极、负极、电解质、隔膜等组成,锂离子电池中使用的一些材料不仅含有Cu、Co和Ni等重金属,还含有电解液和隔膜等有机化学品。据报道,4000 t的废旧锂离子电池中含有1100 t的重金属以及超过200 t的有毒电解液[10],这些有毒物质对生态系统和人类健康构成了严重威胁。若采用填埋的方式处理废锂离子电池,可能会导致有毒重金属渗入地下水体,从而造成严重的环境污染。同样,如果将废锂离子电池当作一般固体废弃物烧毁,那么将会产生大量的有毒气体(如HF气体)污染大气。因此,无害化处理废锂离子电池十分必要。另外,废锂离子电池具有很高的经济价值,其中的某些金属含量甚至高于天然矿石中的金属品位[11]。废锂离子电池通常含有5%~20%Co、5%~10%Ni、5%~7%Li、5%~10%其他金属(Cu、Al、Fe等)、15%有机物以及7%塑料[10],不同的制造商其成分可能略有区别。废锂离子电池中的有价金属如锂、镍、钴和锰等金属资源如能实现回收利用,将带来显著的经济效益。
与其他固体废弃物不同,废锂离子电池是一种新的废弃物。回收废锂离子电池的目的一方面是为了减少或消除其对环境的危害,另一方面是实现有价金属资源的循环利用,促进锂离子电池行业的可持续发展和产业升级。虽然国内外对废锂离子电池回收做出了大量的研究,但由于废锂离子电池结构组分复杂,目前对于废锂离子电池的回收利用技术和工艺仍然停留在实验室水平。工业上回收废锂离子电池最常用的方法是火法冶金技术[12],通过火法还原熔炼,可以实现废锂离子电池中的有价金属镍、钴和铜的高效回收,但是锂和铝则进入渣中,造成有价金属的损失[13]。尽管,火法冶金技术避免了废锂离子电池的预处理过程,但其能耗高、设备投资大以及环境污染严重等缺点阻碍了火法冶金技术的工业应用。因此,Accurec、Toxco等公司开发了湿法冶金技术回收废锂离子电池[12,13],其回收过程主要包括:废电池的预处理过程、浸出过程、萃取过程等。湿法冶金技术的能耗低,并且能够实现锂和铝的回收,但是该工艺存在回收流程长等缺点。本文综述了目前废锂离子电池回收处理的主要方法和流程,分析其存在的主要问题,为未来废锂离子电池回收技术的发展提供参考。
《2.锂离子电池的组成》
2.锂离子电池的组成
锂离子电池通常由正极、负极、电解液、隔膜和外壳[5,10,14,15]组成。锂离子电池的正极材料主要是含锂的过渡金属氧化物,主要有LiCoO2、LiNiO2、LiMn2O4、LiFePO4和LiNixCoyMn1−x−yO2等[16−19]。由于三元层状LiNix Coy Mn1−x−yO2正极材料具有成本低、放电容量大、循环性能好、结构稳定等优势,其成为目前最具有前景的锂离子电池正极材料,并在动力汽车领域具有一定的应用。锂离子电池的电解液通常包括溶剂和溶质,所用的溶质通常为LiClO4、LiPF6、LiBF4等[20],有机溶剂为碳酸丙烯酯(PC)和碳酸二乙酯(DEC)等[21],通常为其中的一种或几种的混合物。锂离子的隔膜通常采用单层或多层的聚乙烯(PE)或聚丙烯(PP)微孔隔膜[22]。
与其他电池相比,锂离子电池被认为是绿色、清洁的能源设备,但由于其含有有害材料,锂离子电池依然会对环境和人体造成威胁。因此,无害化回收废锂离子电池是十分必要的。表1列出了锂离子电池中含有的有害物质及其危害。
《表1》
表1 锂离子电池的环境危害

《3.废锂离子电池的回收现状》
3.废锂离子电池的回收现状
锂离子电池自其商业化以来就广泛用于消费电子产品中,由于其具有显著的污染性和资源性的特点,废锂离子电池受到了国内外学者的广泛关注。废旧锂离子电池中既含有回收价值高的有价金属Li、Ni、Co等,也含有Fe、Al、P等回收价值低的元素。由于经济利益的驱使,目前废旧锂离子电池的回收工艺主要针对正极材料中Co、Li以及Ni等价值较高的金属的回收[5,9,10,23]。对于负极材料和电解液的回收鲜有报道。如图1所示,本文依据废锂离子电池回收过程中的处理步骤,将整个回收过程分为三个过程,即预处理过程、金属提取过程以及产品制备过程。其中金属提取过程是整个回收过程的核心,实际应用过程中主要采用的技术有火法和湿法两种方法。
《图1》
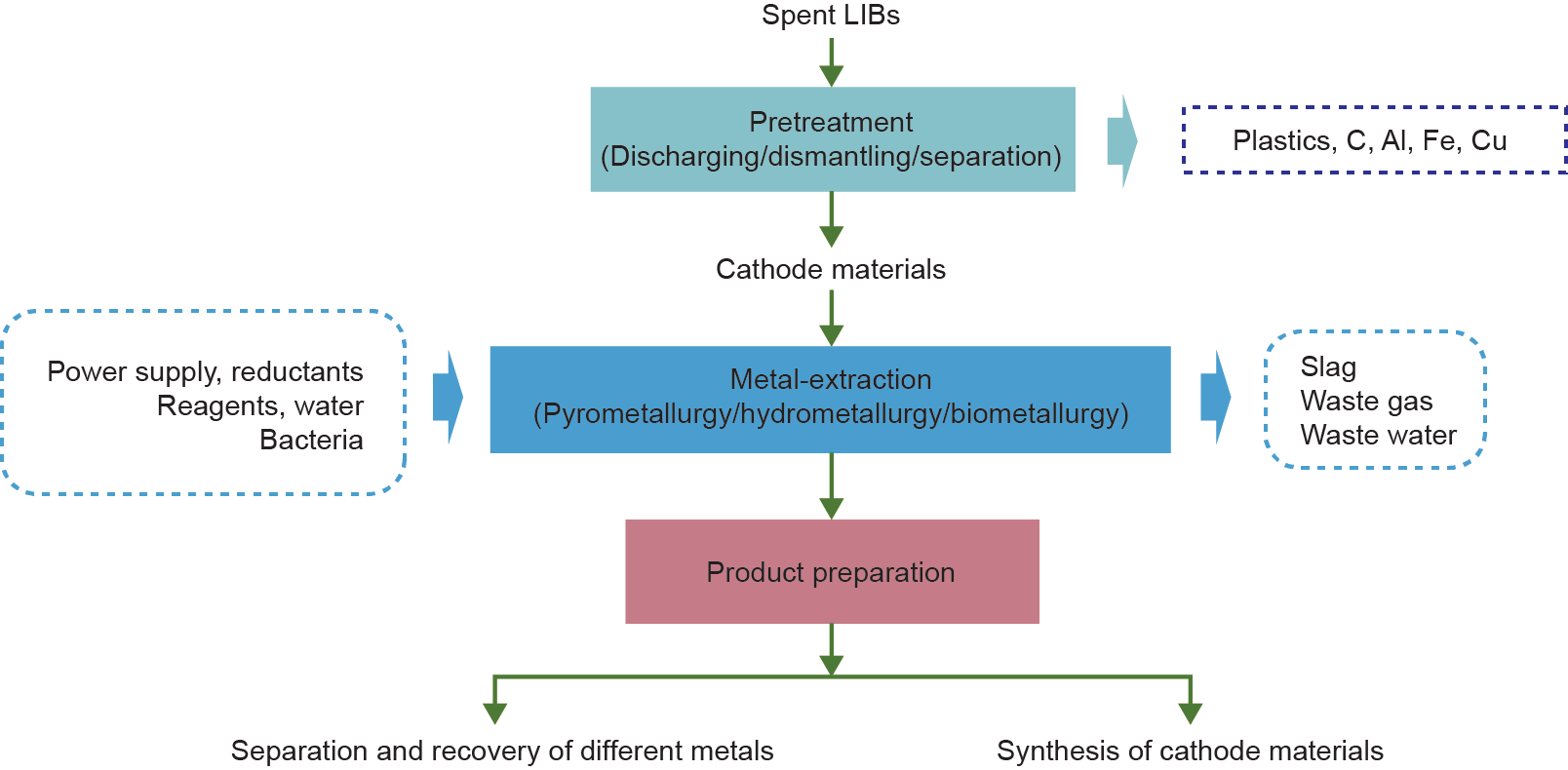
图1. 废锂离子电池回收处理方法和流程总体示意图。
《3.1.预处理过程》
3.1.预处理过程
为防止在处理过程中废锂离子电池短路或自燃,废旧锂离子电池需要进行放电处理,通常采用盐水浸泡将废电池放电[11,24]。放电后的电池一般需要经过人工拆解、分离或者机械处理。人工拆解可以实现电池中组分的分离,分别得到正极片、负极片以及其他组分。人工拆解废旧锂电池过程是首先将电池的塑料外壳去除,然后将其浸入到液氮中以使其中的有害物质失活。之后将废电池固定在车床上,用锯子将电池外壳的端部切除后,将电池纵向开口并去除外壳。最后分离正极、负极以及隔膜并在60℃条件下干燥24 h,得到的正极片和负极片进一步分离进入金属提取过程[9,11]。正极材料一般通过黏结剂[聚偏二氟乙烯(PVDF)或聚四氟乙烯(PTFE)]黏附在铝箔上,由于其较强的黏附力,一般很难将正极活性物质从基体上分离。为了将正极活性物质从集流体铝箔上分离,通常会采用溶剂溶解法[15,25−27]、NaOH碱溶法[28−31]、超声辅助分离[24,32,33]、热处理法[16,34,35]以及机械分选法[36−38]等方法分离正极活性物质与集流体。
3.1.1.溶剂溶解法
溶剂溶解法[15,25−27]是采用对有机黏结剂有较好溶解性的有机溶剂处理正极片,使正极材料从集流体铝箔上脱落,从而排除正极材料回收过程中铝箔集流体的干扰。因此,溶剂溶解法的关键是选择有效的有机溶剂溶解黏结剂。针对黏结剂为PVDF的废锂离子电池正极活性物质的分离,通常采用有机溶剂N-甲基吡咯烷酮(NMP)进行分离。Contestabile等[8]开发了一种实验室回收废旧锂离子电池的工艺,将除去外壳的正极片和负极片用NMP溶液在100℃条件下加热1 h,LiCoO2和石墨可以有效地从集流体上分离并回收,而铝和铜以金属单质的形式回收。尽管这个方法很简单,但LiCoO2的分离效果受黏结剂的种类和电极卷绕方式的影响。Zhou等选择有机溶剂二甲基甲酰胺(DMF)溶解PVDF黏结剂以使LiCoO2正极活性物质从铝箔集流体上有效分离下来。结果显示,DMF在60℃下对PVDF的溶解度可达176 g·L−1。若废锂离子电池中的黏结剂为非极性聚合物(如PTFE),NMP和DMF均不能实现正极材料的分离。针对基于水系黏结剂的废锂离子电池的回收,Zhang等提出了采用三氟乙酸(TFA)分离正极废料中的正极活性物质,当使用的TFA的体积分数为15%、固液比为125 g·L−1,在温度为40℃条件下震荡180 min,正极废料中的正极活性物质能够从铝箔上彻底分离。采用溶剂溶解法可以有效分离正极活性物质和集流体,实现正极材料的富集。但目前的回收方法主要是针对PVDF黏结剂,对于PTFE黏结剂的正极片的研究较少。另外,分离过程所采用的溶剂成本较高,具有一定的毒性,易对环境和人体健康造成威胁。
3.1.2.NaOH 碱溶法
碱溶法是利用单质Al的两性性质,使用NaOH碱溶液将铝箔集流体溶解,而正极活性物质LiCoO2能够稳 定存在,从而实现正极材料和铝箔集流体的选择性分离[27−31]。Nan等[31]在回收废锂离子电池正极材料的 过程中使用NaOH溶液分离正极材料和铝箔,当NaOH 溶液的质量浓度为10%、固液比为1:10,室温条件下浸 出5 h可以使98%的铝箔溶解,从而得到正极材料。当NaOH溶解锂离子电池正极片中的铝箔集流体时,一般 有两种物质溶解,即包覆在集流体表面的Al2O3保护层的溶解以及单质铝的溶解[29]:

虽然这种方法操作简单、效果较好,但铝以离子形式进入溶液中不利于铝的回收。另外,强碱溶液(NaOH溶液)会对环境造成一定的危害。
3.1.3.超声辅助分离
由于黏结剂(PVDF)具有较强的黏结力,废锂离子电池回收过程中很难将正极材料从铝箔集流体上分离下来。因而,超声波处理被认为是一种有效的分离正极活性物质和铝箔集流体的方法[24,32,33]。Li等[33]通过研究搅拌和超声处理法分离正极活性物质时发现,当只使用机械搅拌分离时,大部分电极材料仍黏附于集流体表面。当仅用超声波清洗时,也只有部分正极材料分离。但当同时使用二者时,几乎所有的正极材料都能从铝箔集流体上分离。这可能因为超声波的空化效应使不溶物破坏并分散在水中,而机械搅拌的冲刷效果进一步促进正极材料从铝箔上分离。He等[32]认为超声波清洗法分离正极材料和铝箔集流体的机理归结于PVDF的溶解以及由超声所引起的空穴作用。基于此机理,在以NMP作为清洗液、工艺温度为70℃、超声波功率为240 W、超声波处理时间为90 min的最佳条件下,正极材料的分离效率达到99%。从铝箔上分离下来的正极材料展现出低团聚程度,这有利于后续的浸出工艺。
3.1.4.热处理法
热处理法[16,28,34,35]采用高温分解黏结剂以降低活性材料颗粒之间的黏结力,使活性物质层与铝箔之间的黏结力变弱,进而实现正极活性物质和铝箔集流体的分离。研究表明,PVDF黏结剂一般在350℃以上开始分解,其他组分(乙炔黑、导电碳等)一般在600℃以上开始分解[34]。Sun和Qiu等[35]采用真空热解法来提高正极材料与铝箔的分离效率。在热解过程中,正极片中的电解液和黏结剂等有机物被挥发或分解为低相对分子质量的产物,正极材料和铝箔基体的黏结力降低,进而实现正极材料与铝箔基体的分离。结果表明,当热解温度低于450℃时,活性物质和集流体基本不分离;当热解温度为500~600℃,分离效率随着温度的升高而增大;当热解温度大于600℃时,铝箔开始变脆,使得活性物质和集流体难以有效分离。Yang等[16]在高纯氮气氛下还原热处理正极片时发现,通过控制还原反应温度使其位于PVDF热解温度和铝箔集流体熔化温度之间,可以彻底除去黏结剂和碳质导电剂。另外还原热处理过程也改变了活性正极材料的分子结构,且部分还原了活性正极材料中的过渡金属,这些因素都提高了浸出步骤中过渡金属的浸出效率。热处理法操作简单,易于大规模生产,但缺点是热处理过程黏结剂和添加剂会生成有害气体,需要添加废气处理装置,处理过程能耗较大。
3.1.5.机械分选法
机械分选法被认为是废锂离子电池预处理的一种有效的方法,机械分选法包括筛分、破碎、磁选等方式。Zhang等[37]通过对破碎的废锂离子电池材料的矿物相和化学相分析发现,废锂离子电池具有较好的选择性破碎性质,其破碎产物可分为三个部分:Al富集组分(>2 mm)、Cu和Al富集组分(0.25~2 mm)以及Co和石墨富集组分(<0.25 mm)。矿物相和化学相分析结果揭示了从0.25 mm粒径以下组分中回收的电极材料保持了其在锂离子电池中原有的晶体结构和化学态,但是这些粉末的表面被包覆了一层碳氢化合物,该碳氢化合物的存在对浮选操作造成一定的困难。Shin等[41]提出一种机械分离钴酸锂颗粒及湿法浸出回收钴和锂的废锂离子电池回收工艺。他们将废旧锂离子电池经过破碎、筛分、磁选等一系列过程后得到富集的钴酸锂,然后将富集的钴酸锂进一步地细磨以分离钴酸锂和细小的铝片,最后将细磨产物采用湿法浸出的工艺回收钴和锂。在湿法提取步骤之前采用机械分离的方法预处理。
废锂离子电池可以提高目标金属的回收率。但是机械过程虽然能够一定程度上分离废锂离子电池的组分,但是它不能够使废离子电池中的所有组分完全分离,另外在破碎过程中电解质LiPF6的分解以及有机物PC和DEC的分解也会对环境造成一定的危害。
尽管目前已经开发了很多废锂离子电池预处理的方法,但废锂离子电池的预处理过程仍然面临着巨大的挑战。表2总结了目前预处理技术存在的优缺点。
《表2》
表2 各种预处理技术的优缺点

《3.2.金属提取过程》
3.2.金属提取过程
金属提取过程是整个回收工艺的核心,其目的是将废锂离子电池正极材料中的金属转化为合金形式或者溶液状态,以利于后续金属组分的分离回收。主要采用的方法有火法冶金法、湿法冶金法和生物冶金法等,其中湿法冶金方法由于回收率高、得到的产品纯度高等优点,已经成为目前废锂离子电池回收的主要技术。
3.2.1.火法冶金
典型的火法冶金工艺回收废锂离子电池有价金属是通过高温还原熔炼的方法将有价金属还原并以合金的形式回收[42]。以优美科(Umicore)工艺为例[12],该工艺采用火法和湿法相结合的工艺回收废旧电池。将废电池直接投入熔炼炉中还原熔炼,省去了预处理工艺,电池中的塑料、有机溶剂和石墨燃烧提供热量,而金属组分则被还原熔炼,得到含有Al、Si、Ca、Mn和Fe的炉渣及含有少量Cu、Co、Ni和少量Fe的合金。得到的合金采用硫酸浸出和溶剂萃取的技术制备钴的氧化物和Ni(OH)2。尽管该工艺不需要进行机械预处理,但Li的损失严重。为了解决回收过程中Li的损失问题,很多研究者提出了火法-湿法组合工艺回收废锂离子电池中的有价金属元素。Georigi-Maschler[43]采用了还原熔炼的方法回收废锂离子电池,通过还原熔炼Fe、Co、Ni和Mn以合金的形式回收而Li则进入溶渣或炉尘中,之后可以通过硫酸浸出的方法回收废锂离子电池中的金属Li。此外,Träger[44]提出了在高温条件下采用真空蒸发和选择性载气蒸发的方法从废锂离子电池正极材料中蒸发锂。但是该过程所使用的温度大于1400℃,不可避免地导致高能耗。Li等[1]在氮气保护条件下,将LiCoO2与石墨在1000℃条件下焙烧30 min,得到的焙烧产物为Li2CO3、C和Co,之后将焙烧产物溶于水后通过磁选的方式分离,但是该方法回收得到的锂溶液溶度仅有337.4 mg·L–1,锂的回收难度大。在这一研究基础上,Hu等[45]提出了氩气保护气氛下低温还原焙烧废锂离子电池正极材料,之后采用水浸的方法从焙烧产物中回收Li2CO3。研究结果表明,当实验所采用的还原剂计量为19%时,在650℃条件下还原焙烧正极材料3 h,得到的焙烧产物为Li2CO3、Ni、Co和MnO。之后焙烧产物溶于水并通入CO2,使难溶于水Li2CO3转化为易溶于水的LiHCO3,然后在通过蒸发结晶的方法回收Li2CO3。当液固比为10:1、CO流量为20 mL·min–1、浸出时间为2 h时,浸出液中的Li的浓度可达4.36 g·L–1。
火法冶金工艺处理废锂离子电池工艺简单,但回收过程中能耗高、二次污染严重[4,42,46,47],另外回收过程中锂的损失也是火法冶金工艺需要解决的一个重要问题。
3.2.2.湿法冶金
湿法冶金方法回收废锂离子电池中有价金属主要采用化学浸出的方法,其主要目的是实现固态正极活性物质中的金属组分转移至溶液中,以便后续的分离和回收,浸出过程中主要采用的浸出剂有无机酸、有机酸以及氨-铵盐体系。
废锂离子电池中有价金属的浸出多采用盐酸[14,48−50]、硫酸[11,28,29,31,51]、硝酸[52]以及磷酸[53,54]等无机酸作为浸出剂,配合使用双氧水[11,28,29,51,52,55]、亚硫酸氢钠[56]或葡萄糖[57]等作为还原剂,将固相中的高价态的Co或Mn还原为易溶解的Co2+或Mn2+。浸出过程中,影响金属浸出的主要影响因素有温度、时间、浸出剂浓度、固液比和还原剂浓度等。
Joulié等[49]考察了NCA正极材料在硫酸、硝酸和盐酸中的浸出特性,结果表明酸的特性对金属的浸出率有显著的影响,并且在盐酸溶液中金属的浸出率最高,当浸出条件为4 mol·L–1的盐酸、固液比为5%(m/V)、在90℃下反应18 h时,几乎100%的Li、Ni、Co和Al可以从电极材料中被浸出。由于正极材料中的Co是+3价的,因此在没有还原剂存在时,浸出NCA正极材料需要其自身发生氧化还原反应,而这一过程一般比较难以进行。因此,在硫酸、硝酸和盐酸作为浸出剂未添加其他还原剂时,只有盐酸效果最好,这是由于盐酸具有一定的还原性,对溶解过程具有促进作用。当采用盐酸作为浸出剂时,以LiCoO2为原料,其过程主要发生如下反应[5]:

由式(3)可以看出浸出过程中会有Cl2产生,这可能会对环境造成一定的危害。因而,有研究者研究采用HNO3或H2SO4替代HCl浸出LiCoO2。例 如,Lee 和Rhee等[52]在75℃条件下,以双氧水为还原剂采用1 mol·L–1 HNO3 还原浸出LiCoO2 正极材料。结果表明,当没有H2O2作为还原剂时,钴和锂的浸出效率仅为40% 和75%,当H2O2含量为1.7%(体积分数),钴和锂的浸出效率均达到99%以上。这主要是因为Co2+比Co3+更加 容易溶解,H2O2 的存在可以使LiCoO2 中难溶的Co3+还原为易溶的Co2+。Chen等[28]开发了一种碱浸除铝、还原酸浸、溶剂萃取以及化学沉淀的湿法工艺从废锂离子电池中回收草酸钴。还原酸浸过程采用H2SO4作为浸出剂, H2O2作为还原剂浸出正极材料,结果表明,当液固比为100 g·L–1、浸出时间为120 min,在85 ℃条件下采用4 mol·L–1 H2SO4 和10%(V/V)H2O2 浸出正极材料时,Co和Li的浸出率分别为95%和96%。之后通过调节溶液pH 以除去浸出液中的杂质离子,然后采用P507萃取Co,反 萃后用草酸铵沉淀得到纯度>99%的草酸钴。采用HNO3 和H2SO4还原浸出LiCoO2时,其主要发生如下反应:

在采用无机酸浸出时,能够实现金属的高效浸出但其在回收过程中会产生含酸废水,以及Cl2、SO2和NOx等有害气体,会造成环境污染[25]。因此,许多研究者采用环境友好型的有机酸,如抗坏血酸[24,58−60]、柠檬酸[25,46,60−62]、草酸[63,64]、甲酸[65]、乙酸[46,66]、琥珀酸[67]、酒石酸[68]等,作为浸出剂回收锂离子电池正极材料。Li等[24]提出了一个超声清洗、焙烧和有机酸浸出的组合工艺从废锂离子电池正极材料中回收Co和Li。在该工艺中,抗坏血酸作为浸出剂和还原剂以实现Co的浸出。当抗坏血酸浓度为1.25 mol·L–1、固液比为25 g·L–1,70℃下浸出20 min,Co和Li的浸出率分别高达94.8%和98.5%。在此条件下浸出时,Li-CoO2首先溶解生产易溶的C6H6O6Li2,同时LiCoO2中的+3价的Co被抗坏血酸还原为易溶的+2价的Co,C6H8O6被氧化为C6H6O6。浸出反应如下:

Chen等[61]结合还原浸出和选择性沉淀开发了一种从废锂离子电池正极材料中回收有价金属的原子经济性工艺。该研究分别以柠檬酸为浸出剂,D-葡萄糖为还原剂溶解废正极材料。在柠檬酸浓度为1.5 mol·L–1、固液比为20 g·L–1、还原剂含量为0.5 g·g–1、反应温度为80℃、反应时间为120 min的最佳条件下,约有99%的Li、91%的Ni、92%的Co和94%的Mn被浸出。进而采用选择性沉淀法分离并回收其中的高附加值金属。该研究还发现浸出金属后的残液可以被重新用作浸出剂使用,浸出效果与新鲜浸出剂相当,整个回收过程的原子利用效率高达98%。

Zhang等[69]采用了生物可降解的三氯乙酸(TCA)为浸出剂,H2O2作为还原剂从废正极片中选择性浸出LiNi1/3 Co1/3 Mn 1/3 O2。在TCA浓度为3.0 mol·L–1、固液比为50 g·L–1、4%(体积分数)H2O2、反应温度为60℃、反应时间为30 min的最佳条件下,Ni、Co、Mn和Li的浸出率分别为93.0%、91.8%、89.8%和99.7%,而Al的浸出仅为7.0%,并且根据浸出液的不同用途可以进一步控制铝的浸出。
目前回收主要的研究对象是锂离子电池经人工拆解后得到正极材料或锂离子电池生产废料,这部分材料一般金属组分单一,采用酸浸后溶液中的杂质离子较少。工业上回收的废锂离子电池一般成分比较复杂,预处理得到的正极材料中通常含有复杂金属组分,酸浸正极材料工艺的选择性效果不好,通常浸出液中会含有大量的杂质离子,增加了后续分离纯化步骤。因此,Zheng等[42]采用了氨水-硫酸铵为浸出剂、亚硫酸钠为还原剂,从LiNi1/3 Co1/3 Mn 1/3 O2中选择性浸出有价金属Li、Ni和Co。通过对最佳条件的探索,在氨水浓度为4 mol·L–1、硫酸铵浓度为1.5 mol·L–1、亚硫酸钠浓度为0.5 mol·L–1、搅拌速率为500 r·min–1、固液比为10 g·L–1、温度为353 K、浸出时间为300 min的条件下,Li、Ni、Co和Co的浸出率为95.3%、89.8%、80.7%和4.3%,其中浸出过程中Li、Ni和Co的总选择性大于98.6%。研究还表明,浸出过程中LiNi1/3 Co1/3 Mn 1/3 O2中的Mn先进入溶液中再以(NH4)2Mn(SO3)2形式从溶液中沉淀出来。
3.2.3.生物冶金
由于生物浸出工艺具有回收效率高、处理成本低、所需设备少等优势,被认为是一种最有望取代传统化学浸出的技术。生物浸出的原理是通过微生物代谢产物的无机酸或有机酸实现废锂离子电池中金属组分的溶解[9]。Mishra等[70]在采用氧化亚铁硫杆菌从废锂离子电池中浸出Li和Co时发现,Co的浸出速率比Li的浸出速率快,但即使在最优条件下Co和Li的浸出率依然很低。Xin等[71]研究了硫氧化和铁氧化混合细菌对生物浸出废锂离子电池中的Co和Li的机理。研究发现,Li浸出的机理与能量物质无关,浸出是由于硫酸的溶解作用。与Li不同,Co的浸出是由于酸溶解和由FeS与Fe3+反应生成的Fe2+的还原共同作用,即难溶Co3+首先被氧化还原产生的Fe2+还原为易溶的Co2+之后再被酸溶解进入溶液中。Xin等[72]在固液比为1%的条件下生物浸出LiFe-PO4、iMn2O4和LiNixCoyMn1−x−yO2得到了相似的结论。Li的最大浸出率发生在S-氧化硫杆菌系统,这说明Li的浸出机理是由于微生物释放的H2SO4溶解正极材料中的Li。而Ni、Co和Mn的浸出是受Fe2+还原和酸浸出共同影响。
与火法冶金和湿法冶金相比,生物冶金的缺点是其动力学过程缓慢和处理效率低。为了提高生物浸出过程金属的溶解速率,Zeng等[73]提出了催化浸出废锂离子电池中的Co和Li,生物浸出过程中选择氧化亚铁硫杆菌作为浸出微生物,Cu2+作为催化剂。结果显示,当没有催化剂存在时,浸出10天Co的浸出率仅为43.1%,当Cu2+的浓度为0.75 g·L–1时,浸出6天Co的浸出率可达到99%。Niu等[74]考察了固液比对生物浸出过程的影响,结果表明,当固液比从1%增加至4%时,Co的浸出率从52%减小至10%,Li的浸出率从80%减小至37%。尽管提高浸出温度或者能量物质的剂量能够使Co和Li尽可能地浸出,但是浸出过程金属的溶解速率依旧很低。生物浸出工艺具有成本低、操作方便等优势,但其缺点是浸出所需细菌难以培养、浸出时间长、浸出效率低等。
3.2.4.其他方法
虽然目前实际应用过程中,回收废锂离子电池主要采用的技术是火法冶金技术和湿法冶金技术,但是火法冶金技术能耗高、金属损失率高、环境污染严重。湿法冶金技术回收流程长,回收过程中需要消耗大量的化学试剂,具有一定的环境污染。因此,近年来需要研究者开始探索新的方法回收废锂离子电池。有研究者采用机械化学法回收废锂离子电池中有价金属[3,75,76]。在球磨过程中,由于机械能的作用使反应物的结构和物化性能发生变化,从而促进化学反应的进行。Saeki等[76]采用行星式球磨机将LiCoO2与PVC共研磨,并借助机械化学作用在其产物中形成Co和Li的氯化物,接着将研磨产物分散于水中提取这些氯化物。研磨促进了机械化学反应,随着研磨的进行Co和Li的提取率均得以改善。30 h研磨能够使Co的提取率超过90%,Li的提取率接近100%。此时,PVC样品中约90%的氯已被转变为无机氯化物(脱氯)。这将是回收锂离子二次电池废物中Co和Li的有效方法。研磨过程中发生以下反应:

在此基础上,Wang等[47]提出了采用PVC、Fe与LiCoO2共研磨水浸的方式回收废锂离子电池中的有价金属的工艺。在LiCoO2/PVC/Fe为1:1:2、球料比为50:1、 共研磨时间为12 h的条件下,水浸后Li、Co和Cl的转化率分别为100%、8.1%和96.4%,其中91.9%的Co留在残渣中用于制备CoFexOy。Wang等[3]将从废锂离子电池得到的LiCoO2与不同添加剂进行共研磨,然后Co和Li通过水浸出法进行回收。研究结果表明,乙二胺四乙酸(EDTA)是最合适的共研磨剂,在LiCoO2与EDTA的质 量比为1:4、球磨时间为4 h、转速为600 r·min–1、磨球与粉末的质量比为80:1的最佳条件下,Co和Li的回收率 可分别达到98%和99%。机理研究结果表明,通过固-固 反应EDTA中的两个氮原子和四个羟基氧原子能够进入Co和Li的空轨道,进而形成稳定且水溶性的金属螯合物Li-EDTA和Co-EDTA。此外,可通过化学沉淀法实现Co 和Li的分离。机械化学回收废锂离子电池工艺简单、能 耗较低、消耗的化学试剂少、环境污染较小,但是处理 时间长、处理量少和设备投资大限制了其发展。
3.2.5.金属提取过程各种方法的比较
表3总结对比了前文所述的金属提取过程采用的主要方法,包括各种方法的优缺点和环境影响。火法冶金工艺过程较为简单、处理容量大,有利于实现工业化应用。但是回收过程较为粗放,回收产品附加值低、金属损失率高、能耗高等问题限制了其工业应用。另外,火法回收过程中电池中的有毒电解液和有机物的热解造成了有害气体的释放。因此,在实际应用过程中还需要配备废气处理装置。生物冶金技术采用微生物代谢过程中产生的将废锂离子电池正极材料溶解,得到含有金属组分的溶液。虽然生物冶金技术所需能耗低、处理成本低,但其所需菌种难培养、浸出时间长且处理过程易受污染。湿法冶金工艺湿法具有金属回收率高、得到的产物纯度高等优点,成为目前废锂离子电池回收处理研究的热点。但是湿法冶金过程中采用酸浸提取有价金属,其选择性造成了浸出液中金属组分复杂,使得回收过程复杂、处理成本增加,另外,回收过程中产生的含酸或含碱废水也不容忽视。从表3中可以看出,与火法冶金、湿法冶金和生物冶金方法相比,机械化学法化学试剂消耗量少且可在室温下反应,但是机械化学法反应时间较长、处理过程能耗高、设备投资大等缺陷限制了其工业应用。
《表3》
表3 废锂离子电池金属提取方法比较

《3.3.产品制备过程》
3.3.产品制备过程
产品制备过程很大程度上取决于对净化溶液的进一步处理,如果将溶液中镍钴等元素分步分离,产品可为单一金属盐;若对净化后溶液成分进行调节,可进一步制备相对附加值高的正极材料前驱体。
3.3.1.浸出液中金属的分离回收
正极材料经过酸浸后得到的溶液中通常含有多种金属离子,为实现浸出液中金属盐的制备,通常需要采用溶剂萃取[10,31,77−80]、化学沉淀[5,50,81,82]、结晶[29]等组合工艺以实现金属组分的分离与回收。例如,为了实现硫酸浸出液中的Co回收,Ferreiria等[29]研究了蒸发结晶的方法回收CoSO4。当溶液蒸发量为90%时,溶液中有70%左右的Co结晶,且金属的品味最高(19%)。继续增加溶液的蒸发量,Co的结晶率随之增大,但固相中的杂质铝和锂的含量也相应增大。因此,85%的溶液蒸发量被认为是最适合的条件,且此时固相中的Al和Li的含量低于0.4%和0.6%。Huang等[83]采用浸出—浮选—沉淀工艺逐步分离混合正极材料(LiFePO4和LiMn2O4的混合废物)中的Li、Fe和Mn并以金属盐的形式回收。首先,采用HCl在H2O2的辅助下浸出正极材料中的Li、Fe和Mn离子。然后在浮选步骤浸出液中的Fe3+被选择性漂浮且以FeCl3的形式回收。最后,采用饱和KMnO 4溶液和热的饱和Na3 PO4 溶液将Mn2+/Mn3+和Li+分别依次沉淀并分离为MnO2/Mn2O3和Li3PO4。在最优条件下,Li、Fe和Mn的总回收率分别为80%、85%和81%, 相应的,Li、Fe和Mn的化合物的纯度分别为99.32%、97.91%和8.73%。Chen等[84]采用溶剂萃取和化学沉淀组合工艺从废锂离子电池浸出液中分步分离并回收Cu、Mn、Co、Ni和Li。浸出液经过除杂质离子后,首先采用Mextral® 5640H作为萃取剂选择性萃取分离Cu2+,接着用KMnO4 溶液选择性分离和沉淀Mn2+,约有99.2%的Mn2+以MnO 和Mn O 的形式被去除和沉淀下来。然后然后再以负载Ni的Mextral ® 272P作为新的萃取剂分离回收浸出液中的Co 2+ 。最后,分别使用NaOH和Na 3PO3 溶液相继沉淀浸出液中剩余的Ni 2+ 和Li + ,经过滤和干燥后Ni 2+和Li + 分别以Ni(OH) 2 和Li3PO4 的形式得以回收。在各自的最优实验条件下,Cu、Mn、Co、Ni和Li的回收效率可分别达到100%、99.2%、97.8%、99.1%和95.8%。
由于废锂离子电池金属组分复杂,浸出液中通常含有多种金属离子,虽然采用化学沉淀、溶剂萃取等组合工艺能够实现浸出液中金属组分的分离回收,但是回收过程中需要消耗大量的化学试剂,回收的产品纯度受杂质和回收工艺的影响较为明显,对工艺参数控制要求较高。另外,分离回收金属组分也存在回收工艺流程复杂、金属组分回收率低、处理成本高和环境风险高等缺点。
3.3.2.正极材料的制备
由于溶液中Co、Ni和Mn等过渡金属离子的性质相似、不易分离,因此考虑直接将多种离子重新制备前驱体,再进一步合成电极材料,避免了分离的复杂步骤。 目前,用于前驱体制备的方法主要有共沉淀法[15,85,86] 和溶胶凝胶法[6,25]。
废锂离子电池含有Co、Ni、Mn和Cu等有价金属,为了降低从浸出液中分离Ni、Co或Mn的复杂工艺成本,Qina和Eric等[85]探究了从回收的混合锂离子电池浸出液中合成高性能Ni1/3Mn1/3Co1/3(OH)2前驱体和Ni1/3Mn1/3Co1/3O2正极材料的可行性。Ni1/3Mn1/3Co1/3(OH)2 前驱体是采用共沉淀的方法合成的,且在合成过程中严格控制反应参数。同时对最终产品的倍率容量和循环性能进行测试以评估其电化学性能。结果显示,从回收的混合废锂离子电池中合成的正极材料在0.1 C倍率下的首次放电容量为158 mA·h·g–1,且在0.5 C倍率下循环寿命测试时的首次放电容量为139 mA·h·g–1。经过100个和200个充放电循环后,其放电容量保持率仍然分别高于80%和65%。而Yang等[87]开发了一个采用氢氧化物共沉淀法直接合成LiNi0.8Co0.1Mn0.1O2、LiNi0.5Co0.2Mn0.3O2和LiNi0.33Co0.33Mn0.33O2活性正极材料的高附加值工艺。研究结果表明,再生的正极材料具有层状结构和球形形貌特征,且其颗粒直径范围为9~12μm。电化学测试显示,再生的正极材料具有优良的电化学性能。当x分别为0.8、0.5和0.33时,再生的LiNixCoyMn1−x−yO2的首次放电容量(0.1 C,2.7~4.3 V)相应为197.7 mA·h·g–1、174.3 mA·h·g–1和168.3 mA·h·g–1。所有材料的放电容量均随着放电电流密度的增大而减小,经50次充放电循环(1 C)后LiNi0.8Co0.1Mn0.1O2、LiNi0.5Co0.2Mn0.3O2和LiNi0.33Co0.33Mn0.33O2的容量保持率分别为86.3%、95%和96%。总体而言,再生LiNixCoyMn1−x−yO2的性能可与那些采用纯Ni、Co和Mn化学物质的混合溶液制备的材料性能相媲美。共沉淀法是目前合成三元正极材料最常用的方法,该方法的优点是工艺设备简单,有利于工业化生产,但沉淀过程的影响因素较多,容易产生杂质共沉淀。
溶胶凝胶法是另一种常用的合成电极材料的方法,该方法首先是将原料分散在溶剂中,加入适量络合剂使之发生水解和聚合等过程形成溶胶,进而生成具有一定空间结构的凝胶,最后经过热处理得到产品。Yao等[25]采用溶胶凝胶法从废锂离子电池中回收的有价金属合成LiNi1/3Co1/3Mn1/3O2。在该工艺中柠檬酸既作为浸出剂又作为络合剂使用。首先采用柠檬酸浸出LiNi1/3Co1/3Mn1/3O2正极材料,之后分析柠檬酸浸出液中的金属离子的比例,采用LiNO3、Mn(NO3)2、Co(NO3)2以及Ni(NO3)2调节溶液中Li、Mn、Ni和Co的比例至3.05:1:1:1,然后用适量的氨水调节溶液pH值至8.0。之后采用溶胶凝胶法合成了新的锂离子电池正极材料LiNi1/3Co1/3Mn1/3O2。再制备的LiNi1/3Co1/3Mn1/3O2具有较高的结晶度、良好的层状结构和良好的电化学循环性能。采用溶胶凝胶法再制备的LiNi1/3Co1/3Mn1/3O2首次放电容量可达147 mA·h·g–1,经50次充放电循环后其放电容量保持率为93%。另外,他们还研究了采用D,L-苹果酸作为络合剂的溶胶凝胶法合成正极材料LiNi1/3Co1/3Mn1/3O2的方法[6]。通过调节金属离子比例和浸出液pH值,采用溶胶凝胶法合成了新的锂离子电池正极材料LiNi1/3Co1/3Mn1/3O2,且不需要任何其他螯合剂。电化学测试显示,再生材料的首次充电和放电容量分别为152.9 mA·h·g–1和147.2 mA·h·g–1(2.75~4.25 V,0.2 C)。经100次充放电循环后,其容量保持率为95.06%(2.75~4.25 V,0.5 C)。结果表明,从废锂离子电池中制备的LiNi1/3Co1/3Mn1/3O2具有较好的电化学性能。溶胶凝胶的方法处理温度低、时间短,能够实现各组分原子级的混合,但是其重复性较差,目前主要应用于实验室。
《4.结论与展望》
4.结论与展望
近年来,废旧锂离子电池的回收在全世界范围内得到了广泛的关注,随着电动汽车行业的快速发展,未来将有大量的废旧锂离子电池产生,对其资源化和无害化处理不容忽视。目前废锂离子电池的主要可以分为预处理过程、金属提取过程和产品制备过程中,其中金属提取过程是整个回收工艺的核心,其主要采用的方法有火法冶金、湿法冶金和生物冶金等技术,但这些技术存在着废水、废渣以及废气排放等问题,需要进一步的环境治理。目前废锂离子电池回收处理过程中面临的问题与展望如下:
(1)预处理过程一方面是为了减小废锂离子电池的体积、降低回收过程中的污染问题,另一方面是为了实现有价金属组分的富集。在预处理阶段,如何实现废锂离子电池的安全高效自动拆解成为目前阻碍废锂离子电池产业化回收的重要因素。另外,在预处理过程中会产生大量的污染物,如HF、PF5等有害气体,这势必会对环境造成二次污染。
(2)目前的回收过程主要关注在价值较高的金属组分的回收,对于经济价值低、回收成本高的组分的回收关注较低,尤其是对负极碳材料的回收和电解液的回收处理研究较少,因此,如何系统地对废锂离子电池中各组分进行资源化回收再利用还需要进一步的深入研究。
(3)金属提取过程作为整个回收过程的核心,在实际应用过程中主要采用火法冶金技术和湿法冶金技术,但这些技术存在着废水、废渣以及废气排放等问题,对环境和人体健康存在着威胁。因此,如何减少或避免这些二次污染也是回收需要关注的主要问题。
(4)由于废锂离子电池金属组分复杂,经过金属提取过程之后得到的溶液中金属组分复杂,分离回收金属组分需要采用化学沉淀、溶剂萃取等技术的组合,使回收处理变得复杂;直接合成电池正极材料则需要考虑再制备材料的性能和回收过程中的成本问题。
《致谢》
致谢
感谢中组部“青年千人计划”(孙峙)、国家杰出青年基金(No.51425405)以及国家科技支撑计划(No.2015BAB02B05)对本工作的资助。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Xiaohong Zheng, Zewen Zhu, Xiao Lin, Yi Zhang, Yi He, Hongbin Cao, and Zhi Sun declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




