《1 前言》
1 前言
2006年 ,日本 Yamanaka研究小组通过将逆转录病毒介导的 Oct - 4, Sox2, Klf4及 c - Myc四个基因转入鼠成纤维母细胞 ,将成体细胞重编程为具有多分化潜能的干细胞 ,并将该类干细胞命名为 iPS 细胞 [1]。 2007 年 , 美国 Thom son 实验室报道了 Oct - 4, Sox2,Nanog及 L in28四个基因的转染可将人成纤维母细胞重编程为 iPS细胞 [2]。随后 ,国内外多家实验室利用转基因方法完成了多种类型成体细胞向 iPS细胞的重编程与 iPS细胞向特定组织类型细胞的再分化研究。 iPS细胞在形态学、表观遗传学、全基因表达谱以及细胞类型特异的分化潜能方面与 ES细胞极其相似 ,并且个体特异来源的 iPS 细胞尚不涉及免疫排斥问题 ,所以 iPS具备成为细胞治疗以及组织器官再生最有前景的种子细胞。研究表明 ,一些遗传缺陷性疾病患者的体细胞也可通过转基因方法重编程为 iPS细胞 ,这将对通过体外细胞培养研究某些遗传疾病的发病机制提供了希望。与其他多潜能细胞产生技术不同 (如来源于内细胞团的 ES分离建系、体细胞与 ES细胞融合以及核移植技术 ) , iPS细胞的生成技术不涉及胚胎毁损等伦理学问题 ,因而将成为干细胞研究与再生医学研究领域的热点话题。但目前为止 , iPS的研究可以说才刚刚起步 ,一些重要的科学问题与关键技术问题还没有完全解决 , iPS走向临床应用为时尚早。文章就 iPS研究的现状与今后发展的方向进行综述与展望。
《2 iPS细胞的形成与特征分析》
2 iPS细胞的形成与特征分析
《2.1 iPS与 ES细胞的比较及体细胞重编程为 iPS 的机制》
2.1 iPS与 ES细胞的比较及体细胞重编程为 iPS 的机制
成体细胞通过去分化途径重编程为 iPS细胞是一个缓慢的过程 ,需要 2~4周的时间。重编程过程中 ,细胞依次发生以下等级性的分子事件 ,首先是碱性磷酸酶活性的激活 ,其次是成体细胞特异基因表达的静息 , SSEA - 1表达 ,最后是导入的逆转录或慢病毒基因的沉默与内源性 Oct - 4和 Nanog等多潜能因子的激活。依据功能及分子表型特征 , iPS细胞可分为两种 ,部分全能的 iPS细胞与全能 iPS细胞 ,Oct - 4等重编程因子转导只能使少数成体细胞成为全能 iPS细胞 (0. 01 % ~0. 1 % )。以 Fbx15全能相关转录因子的激活作为筛选标记 ,通过逆转录病毒介导的重编程因子转染 , Yamanaka研究组将鼠成纤维母细胞去分化重编程为 iPS细胞 ,尽管该筛选方法获得的 iPS细胞克隆在形态上具有 ES细胞克隆的特点 ,表达 ES细胞特征性分子标记 ,并可形成畸胎瘤 ,体外培养形成拟胚体 ,出现三胚层分化的分子标记 , iPS注射入胚细胞团后也参与胚胎发育 , 但该方法获得的 iPS细胞克隆在全基因表达谱与多潜能转录因子 DNA甲基化谱方面与 ES细胞还存在较大的差异 ,另外 ,也不能形成嵌合小鼠与生殖细胞 [1]。相反 ,当采用 Oct - 4或 Nanog基因激活系统进行筛选时 ,便可以获得全能的 iPS细胞 ,除形态特征、多能干细胞的分子标记表达与 ES细胞几乎一样之外 ,其全基因表达谱以及 DNA 甲基化谱也与 ES细胞几乎一致。在功能上 ,全能 iPS细胞与 ES 细胞几乎对等 ,不仅参与胚胎发育 ,而且可以形成嵌合体小鼠 ,并传递到生殖细胞 [3, 4]。在没有选择标记与选择压力条件下 ,依据 ES细胞克隆形态学特征标准选择 iPS克隆 ,并将其继续在标准的 ES培养体系中培养 ,可以将小鼠体细胞起源的部分全能 iPS细胞进一步重编程为全能 iPS细胞 [5]。
人 iPS细胞缺乏基因敲入的筛选标记 ,所以目前判断人体细胞起源的 iPS细胞是否具有全能性主要是依据 iPS克隆是否具有 ES细胞克隆的形态学特点 ,是否具有 ES细胞的多能干细胞分子标记及类似于 ES细胞的全基因组表达谱 ,形成拟胚体能力及三胚层的分化特征 ,注射免疫缺陷鼠后生成畸胎瘤的能力 ,但更重要的证据是是否有内源性重编程转录因子的激活 (如 Oct - 4与 Nanog等 )与导入的病毒基因的沉默 [6]。
重编程因子只能诱导少数的体细胞通过中间状态的部分全能 iPS细胞 ,再到全能 iPS细胞 ,属于随机发生事件 ,而该事件依赖于体细胞中 Oct - 4等干性转录因子随机发生的“渗漏表达”与随机性的表观遗传学变化 [7, 8]。MacArthur等通过计算机模拟分析后认为 ,重编程因子可能只诱导有 Oct - 4等干性因子“转录噪音”的体细胞重编程为 iPS细胞 [7]。利用鼠成纤维母细胞与 B 细胞重编程获得的部分全能 iPS细胞及全能 iPS细胞 ,Mikkelsen等比较了它们与起源细胞及 ES细胞之间在全基因表达谱、染色质状态谱 (组蛋白 H3 K4me3 和 K27me3 与 DNA结合状态 )和 DNA甲基化谱之间的差异 ,发现全能 iPS与 ES细胞的基因表达及表观遗传学状态高度相似 ,而部分重编程 iPS细胞则显示了不同类型的干细胞相关基因的再激活、系列特异性转录因子则处于不完全的抑制状态。另外 ,全能相关转录因子位点的 DNA处于高甲基化状态。抑制部分全能 iPS细胞中系列特异转录因子的表达水平不能有效提高其形成全能 iPS细胞的能力 ,但 DNA甲基化抑制性药物 5 - azaC处理部分全能 iPS细胞可以将其继续重编程形成全能 iPS细胞的能力提高近 200 倍 [8]。
体细胞重编程为 iPS需要足够的起始动力克服系列特异性分化因子表达环境形成的阻力 ,从而逐步地将细胞内环境塑造成为多潜能转录因子维持的干性环境。Yamanaka研究组与 Thom son实验室通过设计精巧的筛选 [1, 2] ,确定了 6个重编程因子 ,近期大量的研究结果提示了 6个因子中的 Nanog, Sox2 或 Klf4与 c - Myc并非体细胞重编程为 iPS细胞绝对所必需 ,而 Oct - 4与 Sox2或 Klf4的组合式外源转染对启动体细胞重编程、塑造多能干性环境则是必需的。能否通过特异或非特异的非转基因方法较持久的激活体细胞中内源性的 Oct - 4与 Sox2表达对诱导安全有效的形成 iPS具有重要的意义。研究表明蛋白酶体在 ES细胞中具有清除分化相关转录因子的转录起始复合体并减灭其“转录噪音”的重要作用 [9] ,而 Wnt信号途径也具有过滤分化相关蛋白转录噪音的作用 [10] ,所以是否可以通过增加体细胞中蛋白酶体的表达量与激活 Wnt信号活性的非转基因方法制造 iPS细胞是非常值得探索的课题。
目前 ,体细胞重编程为多潜能干细胞的分子机制尚不完全清楚 , iPS的形成过程为深入研究该机制提供了很好的细胞模型 ,该分子机制的阐明与涉及的信号通路的识别将为更安全和更有效地制造 iPS以及为临床治疗提供坚实的理论基础。设想通过改变细胞的外环境 ,可以将随机性事件改造为必然性事件 ,不仅可以增加 iPS的形成效率 ,而且可能实现通过非转基因途径诱导 iPS形成以及将来方便的临床应用。
《2.2 体细胞重编程为 iPS的效率与非转基因方法制造 iPS细胞的可行性》
2.2 体细胞重编程为 iPS的效率与非转基因方法制造 iPS细胞的可行性
评估体细胞重编程效率与效能 ,将为利用少量病人特异的细胞制造 iPS细胞提供依据。目前已证实逆转录病毒 (包括慢病毒 )介导的 Oct - 4等 4个因子共同转染 ,几乎可以将各种类型的体细胞重编程为 iPS细胞 ,包括成纤维母细胞、肝细胞、胃上皮细胞、胰腺细胞、脑膜、神经前体细胞、肾上腺、肌肉细胞、小肠上皮、间充质干细胞、表皮干细胞、造血细胞以及终末分化的 B细胞等 ,但不同组织类型的体细胞重编程为 iPS对外源基因诱导水平的要求有差别 ,其形成 iPS的效率及效能也不一样。从鼠或人多种组织类型中分离的成纤维母细胞重编成为 iPS 的效率一般只有 0. 007 % ~0. 039 % ,形成全能 iPS 细胞的时间在 3~4周之间 ,外源的重编成因子需要 10~16 d的表达 ,而内源性全能干细胞转录因子一般在 12 d时被激活 [1, 2, 11]。通过 6个重编程因子共转染成纤维母细胞可将其 iPS重编程效率提高约 10 倍 [12] ,而抑制 p53表达或共转 UTF1基因可使其重编程效率增加 100倍 [13]。肝细胞的重编程中外源基因的转入量只需要成纤维母细胞的 1/50 [14]。鼠神经干细胞表达足够的 Sox - 2, Klf4与 c - Myc,因而在重编程形成 iPS细胞时只需要导入 Oct - 4与 Sox2或 Klf4两个基因即可 [15, 16]。从 mRNA水平可以检测到人角质层起源的表皮干细胞中表达 Klf4 与 c - Myc,Oct4, Sox2以及 Klf4三个基因导入可以诱导 iPS形成 ,其效率与效能与成纤维母细胞类似 , 但四个因子可以将表皮干细胞形成 iPS的效率增加 100倍 ,并使其形成周期缩短至 10 d,病毒基因的随机整合位点也明显少于成纤维母细胞 [17]。将一个 30 岁妇女的一根头发培养后 , Aasen等将从发根鞘部位生发的角质层表皮干样细胞通过四个重编成因子导入的方法诱导成 iPS细胞 [17] ,这一结果令人叹服 ,因为他正将我国《西游记》小说中描述的孙悟空拔根毫毛变出一个小猴子的神话故事变成现实。与上述细胞类型不同 ,因为存在基因组 DNA的缺失与重排 , 单纯四个因子转导并不能有效地将终末分化的 B 细胞重编程为 iPS细胞 ,另外还需要导入髓系转录因子 C/EBP或抑制 B细胞转录因子 Pax5 [18]。综合以上已有报道的结果 , 笔者认为以表皮干细胞为原始材料高效高能的制造 iPS细胞应具有很好的临床应用前景。
逆转录或慢病毒介导的重编程因子转染体细胞 ,存在随机的多位点的基因组 DNA 整合 ,另外 , Klf4与 c - Myc具有癌基因活性。事实证明 ,病毒介导的 c - Myc的再次激活增加了 iPS起源嵌合鼠发生肿瘤的机会 [4, 19]。因此 ,寻找新的通过转基因 ,限制性转基因 ,甚至是非转基因的方法诱导 iPS 形成对将 iPS推向临床应用非常重要。近期有报道显示 ,除逆转录病毒外 ,通过非基因组整合的腺病毒介导的重编程因子或质粒 DNA瞬时转染也可使体细胞转变为 iPS细胞 [14, 20] ,这一结果不仅消除了由于外源基因在靶细胞基因组中插入突变形成 iPS细胞的疑虑 ,而且为建立新的安全性更高的基因导入系统的研究奠定了基础。在限制性转基因制造 iPS 细胞的研究中 ,科学家们发现组蛋白去乙酰化转移酶抑制剂 VPA不仅可将只有 Oct - 4与 Sox2两个转录因子转染的成纤维母细胞诱导成 iPS细胞 ,而且可以将其重编程率提高到 1 % [11]。采用 G9a组蛋白甲基转移酶抑制剂 BIX - 01294处理鼠神经干细胞 ,在只有 Oct4与 Klf4两个基因转染的条件下就能将其重编程为 iPS细胞的效率达到相当于四个基因转染的重编程水平 [20]。与之相似 ,在只有 Oct - 4 与 Klf4两个外源因子转导条件下 ,加入 MEK通路抑制剂 PD0325901, GSK3抑制剂 CHIR99021及 LIF 培养 ,可以将神经细胞重编编程为真正的全能 iPS 细胞 [21]。W nt3a处理的成纤维母细胞重编程为 iPS 细胞时只需要 Oct - 4 /Sox2 /Klf4,而不需要 c - Myc 基因的导入 [22]。BIX - 01294 及钙离子拮抗剂 BayK8644处理时 ,可有效的将只有 Oct - 4及 Sox2 转染的成纤维母细胞重编程为 iPS细胞 [23]。上述小分子化合物参与的体细胞重编程研究为采用非转基因方法诱导 iPS的形成提供了一定可行性。尽管目前还没有通过非转基因方法成功诱导体细胞重编程为 iPS细胞的报道 ,但 Durcova - H ills等发现利用组蛋白去乙酰化酶抑制剂 TSA, FGF2,L IF及 SCF刺激鼠胚胎生殖细胞可以使其去分化重编程为多能干细胞 [24]。另外 ,利用 ES细胞提取物处理透化的 NIH3T3细胞系可以使其去分化演变为具有多系列分化的多能干细胞 [25] , 处理 293T细胞可以使其表达部分全能干细胞特异的分子标记 [26]。这些事实不仅提示了体细胞重编程需要的动力因素 ,而且提示只要给成体细胞提供合理的体外培养环境 ,就完全有可能通过非转基因方法将成体细胞去分化重编程为全能干细胞———iPS细胞 ,尤其是利用合适的成体干细胞作为重编程起始细胞 ,极有可能通过改变如图 1 所示的细胞信号途径在不远的将来完成非转基因方法的 iPS细胞诱导。
《图 1》
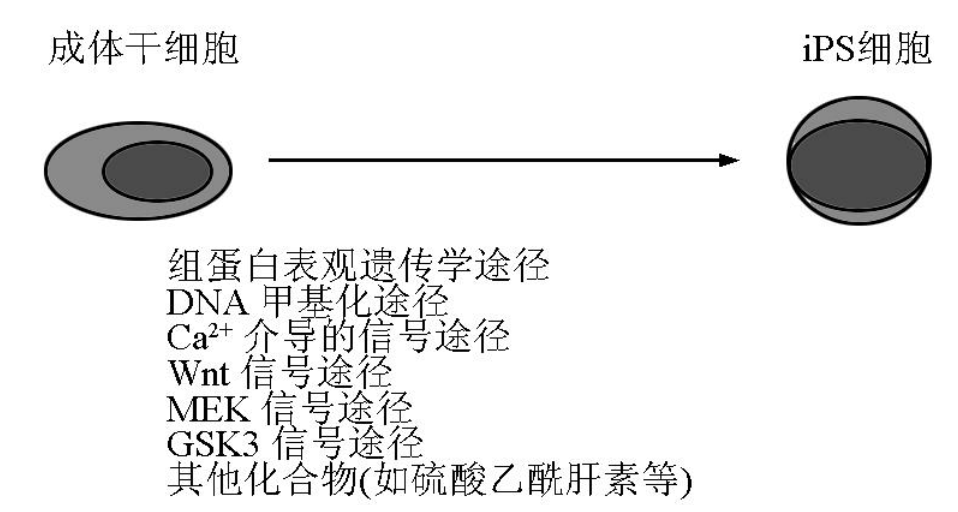
图 1 通过针对这些信号途径的一些小分子化合物的组合以及与 LIF /SCF等细胞因子的联合应用 ,可能将某些成体干细胞重编程为 iPS细胞
Fig. 1 Certain adult stem cells may be reprogrammed into iPS cells by the combined application of small molecules involved in the indicated signaling pathways and LIF /SCF cytokines
笔者早在 2001年就发现 ,已分化的表皮细胞在EGF等生长因子作用下 ,在损伤后修复的皮肤局部可以去分化为表皮干细胞 [27] ,之后的研究发现通过热激活与 EGF等因子处理可以将已老化的表皮细胞重编程为表皮干细胞 [28] ,这些研究为进一步以非转基因方法将表皮干细胞诱导成为 iPS细胞奠定了基础。
《3 患者特异性 iPS细胞制造与细胞治疗及再生医学》
3 患者特异性 iPS细胞制造与细胞治疗及再生医学
与 ES细胞不同 ,利用 iPS细胞制造技术可以将任何个体已分化的体细胞诱导成全能干细胞 ,有足够的理由相信在制造出病人特异的 iPS细胞后 ,再将其按特定的程序诱导 ,会产生出病人治疗所需要的任何组织细胞 ( 见图 2 )。由于没有免疫排斥问题 ,所以在将来疾病的细胞治疗研究领域与再生医学研究领域中 ,针对 iPS细胞的研究会占据主导地位。
《图 2》
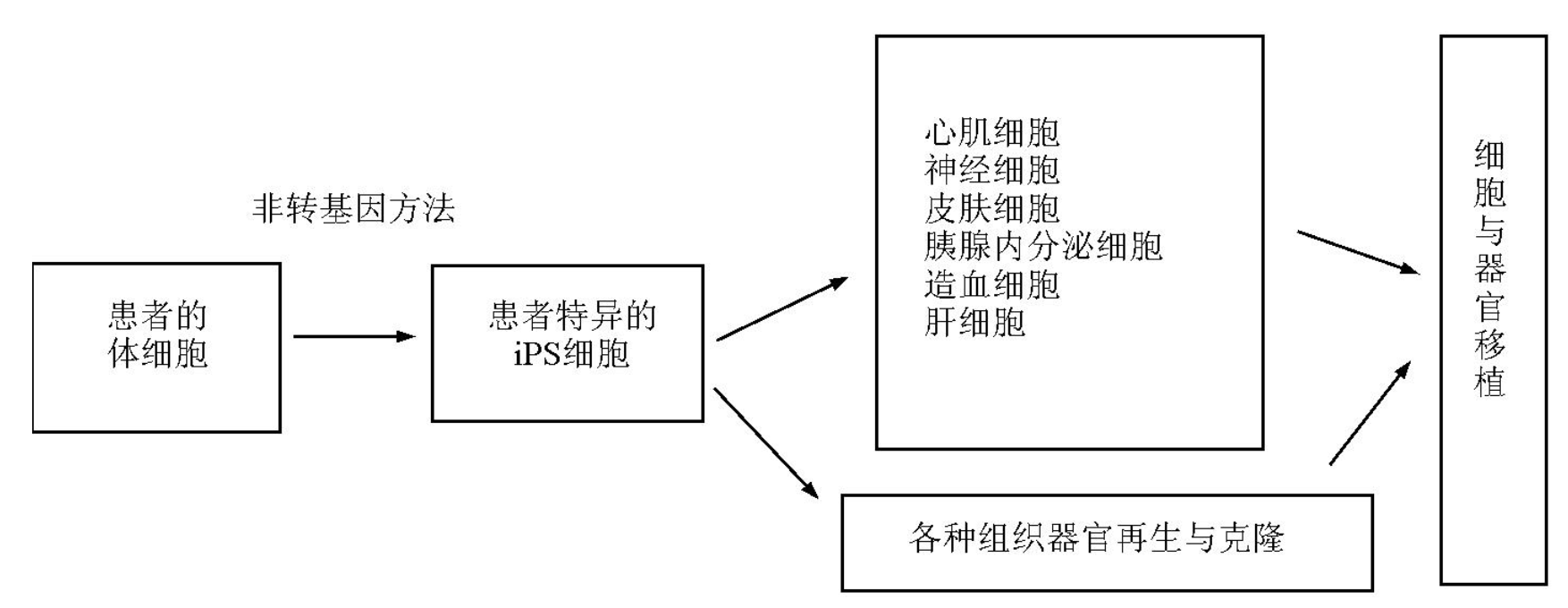
图 2 患者特异 iPS制造技术在细胞治疗与组织器官再生医学发展中的模式
Fig. 2 Schematic illustration of the potential use of patient-specific iPS cells in cell replacement therapy and regenerative medicine
不同的人 ES细胞系在特定系列方向的分化潜能方面存在显著的差异 [29] ,长期保存与体外培养的人 ES细胞存在染色体不稳定等问题 [30]。另外 , ES 细胞分化的特定组织中由于可能残存少量的未分化 ES细胞 ,从而不能排除在组织移植后诱发畸胎瘤的风险。对于疾病个体起源的人 iPS细胞是否与人 ES细胞一样也存在这样那样的问题与疑虑 ,在今后针对人 iPS的研究中是需要明确回答的。尽管如此 ,近期科学家利用 iPS细胞进行的一些诱导分化与疾病治疗性研究工作的突破性进展依然值得关注 ,并为今后利用 iPS的治疗性研究工作以及大规模建立个体特异性 iPS细胞库的论证提供了强有力的科学依据。
镰刀型细胞贫血是血红蛋白链中单个氨基酸突变所引起的溶血性疾病 , Hanna等通过转基因方法将具有该疾病小鼠的成纤维母细胞重编程为 iPS细胞 ,再通过同源重组技术将 iPS细胞中异常 DNA序列进行置换 ,并将病毒源性 c_Myc去除 ,获得正常基因型的 iPS细胞 ,在特定的预设条件下 ,该方法产生的 iPS细胞可定向分化成为造血前体细胞 ,移植给致死量照射处理后的小鼠 ,结果发现不仅重建了小鼠的造血系统 ,而且将红细胞形态由原先的镰刀状修正为圆盘状 [31]。另外 , Dimos等利用一例营养不良性侧索硬化症老年妇女的皮肤成纤维母细胞诱导产生了 iPS细胞 ,并继续将其成功诱导成为运动神经元 [32] ,这一结果不仅为研究该疾病的进展提供体外模型 ,而且提示了 iPS细胞在诸如该类退行性疾病中的治疗潜能。
在将 iPS细胞诱导成为具有胰岛素分泌能力的细胞时 ,研究者们发现 ,不同 iPS克隆存在差异 , 4个克隆中只有 2个可以被诱导成功 [33]。这一结果提示进一步比较 iPS细胞克隆间诱导分化潜能的差异 ,并鉴定其差异特征对未来利用 iPS细胞进行有效的细胞治疗具有重要意义。
总之 ,将实验室培养的 iPS细胞应用到临床治疗中还有相当长的路要走 ,其中最为重要的应是对不同组织来源、不同疾病个体来源的 iPS细胞的诱导分化潜能及安全性进行重点评估。
《4 利用 iPS细胞研究疾病发生的病理过程》
4 利用 iPS细胞研究疾病发生的病理过程
细胞培养是生物医学研究最基本的手段 ,是对通过动物模型进行人类疾病研究的必要补充。 iPS 技术问世之前 ,很难想象在培养皿中对一些遗传性疾病或退行性疾病发展的病理学过程进行准确观察 ,而 iPS技术的出现使这些不再是难事。近期 , Park等利用 iPS技术成功建立了 10 种人类遗传性或退行性疾病起源的干细胞系 ,其中包括腺苷脱氨酶缺乏相关的重症联合免疫缺陷病 ( ADA - SCID )、亨廷顿病 ( HD )、帕金森病 ( PD )与青少年发生的 I型糖尿病 ( JDM )等。这些疾病特异的 iPS细胞携带有疾病本身的遗传学缺陷 ,但可有效地正常化地向多种细胞类型进行分化 [34]。这些细胞系为在体外条件下比较正常与病理组织的形成提供了物质基础。另外 ,也为疾病治疗药物的测试与筛选提供了细胞模型。鉴于 iPS在疾病研究中的重要作用与潜能 ,哈佛大学干细胞研究所在 2008年启动了建立疾病特异 iPS细胞库的计划 ,同样日本也在四所大学 (京都大学、庆应大学、东京大学和理化研究所 )成立了 iPS细胞研究中心。面对这些快速的发展 ,由于我国人口众多 ,具有极其丰富的疾病资源 ,针对我国特有的疾病人群建立疾病特异的 iPS细胞库应尽快提到议事日程上来。尤其对一些稀有的或特有的遗传性疾病 ,保存可以进行分化研究的细胞种子远远比保存 DNA有价值的多。
同样 , iPS技术对肿瘤发生机理的研究也将产生推动作用 ,可能体现在以下几个方面 : a. 遗传学突变积累与表观遗传学异常是肿瘤发生与进展内在的因素。将携带肿瘤易感基因或具有形成肿瘤倾向遗传背景的正常细胞重编程为 iPS细胞 ,诱导再分化为特定组织类型的细胞 ,通过在培养皿中观察肿瘤的发生 ,鉴定关键的肿瘤内环境形成的抑制因素与促进因素。b. 既往通过核移植技术的研究结果显示 ,将肿瘤细胞本身重编程为干细胞具有相当的难度 ,即肿瘤细胞对重编程具有抵抗性 [35] ,而 iPS 技术的出现为这一操作带来希望。c. 肿瘤细胞具有特定的遗传学背景 ,如果能通过 iPS技术将其重编程为干细胞 ,将清除掉肿瘤特有的表观遗传学状态 ,通过诱导分化成对等的正常表现型细胞 ,比较性的研究在该遗传学背景条件下表观遗传学变化与肿瘤发生的关系。d. 近年肿瘤研究领域一个重要的突破是对肿瘤干细胞的识别与鉴定 ,然而目前仍不能高效地高纯度地对肿瘤干细胞进行体外扩增与长期培养 ,这样就障碍了对肿瘤干细胞生物学特有特征的分析 ,并使针对肿瘤干细胞的治疗性研究发展缓慢 ,如果能通过 iPS技术将分化的处于短暂维持状态的肿瘤细胞重编程为肿瘤干细胞 ,将会给肿瘤研究领域带来巨大的发展机会 [36]。
《5 结语》
5 结语
iPS技术策略问世之前人类不敢想象由一种体细胞到另外一种体细胞的演变 , iPS的出现使这一设想变成现实 ,并使细胞治疗与再生医学领域的发展具有更为广阔的前景。 iPS技术使人类的视野与想象力得到拓展 ,为什么不考虑在不经过 iPS阶段的情况下 ,利用转基因或非转基因的方法将一种来源方便的体细胞直接重编程为另一种体细胞 ,以直接用于人类疾病的治疗呢。其实 ,这一话题并非遥不可及 ,已有体内研究证据表明通过特定转录因子的导入可以将胰腺外分泌细胞直接重编程为内分泌细胞 [37]。另外 ,许多低等动物组织或器官损伤后出现的再生也有类似的生物学过程。因此 ,继续关注和深入研究 iPS产生的理论与关键技术 ,将给正常发育模式的构建、肿瘤研究、组织修复与再生以及生物制药等诸多生物医学领域带来新的发展机会 [38]。













 京公网安备 11010502051620号
京公网安备 11010502051620号




