由于资源枯竭和环境恶化,21世纪的治金工业应以节能、降耗和发展与环境友好的绿色工艺技术为目标。为实现此目标,有必要把应用基础理论究深入到原子层次,以便从原子结构特征认识治金反应规律。贵金属冶金可分为提取富集与精炼提纯两个阶段。关于精炼提纯,笔者根据原子结构特征已归纳总结出许多规律[1-5],本文主要讨论贵金属的提取富集过程。
《1 贵金属与贱金属的原子结构特点》
1 贵金属与贱金属的原子结构特点
《1.1 贵金属及共生贱金属在周期表中的位置》
1.1 贵金属及共生贱金属在周期表中的位置
贵金属处于周期表下部的中间位署,属第二、第三过渡系中接近填完d电子层的部位。
贵金属在自然界多呈元素态或合金态, 如砂铂矿、砂金矿;也有相当多的贵金属赋存于硫化铜镍矿及硫化铜矿中,如南非的麦伦斯基矿、俄罗斯的诺里尔斯克矿、美国的斯蒂尔瓦特矿、加拿大的芮德伯里矿以及我国的金川硫化铜镍矿。这些矿中大量存在的贱金属恰恰就是周期表中位于贵金属上方的第一过渡系的Fe、Co、Ni、Cu(见图1)。不含或少含镍的硫化铜矿则主要只赋存有金、银。这种现象应与成矿规律有关,本文不作讨论。

《图1》
图1 VII及IB族贵金属与贱金属的划分
Fig.1 The distinction of precious and base metal elements of group VII and IB
早期的化学家按地球产出状态进行元素分类时,曾把金及铂族归入亲铁元素,因为地壳中的金及铂族元素象陨铁及地核中的Fe、Co、Ni一样多以金属相或合金相存在。而银和铜多以硫化物相存在,因此银则被划入亲铜元素。其实,从图1来看,铂族与铁族共生,银、金与铜共生,可认为出自原子结构相似,以下主要讨论这12个元素的原子结构及特性,本文讨论用的参数列入表1、表2。
(1)过渡系元素从左到右,其原子核中的质子数不断增加,外电子层则是不断填充d电子。开始时(n-1)d电子轨道的能级高于ns轨道,n为主
《1.2 按周期表位置横向考察时的原子结构差异》
1.2 按周期表位置横向考察时的原子结构差异
《表1》
表1 VII及IB族元素的一些物理参数
Table1 Some physical parameters of the elements in group VII and I-B

《表2》
表2 VII及IB族元素的原子电离势(eV)
Table2 The atomic ionization potential of the elements ingroup VII and IB

量子数。随着d轨道不断收缩,能量逐渐降低,在最后填满10个4电子时,(n-1)d轨道能级已低于ns轨道。
(n-1)d与ns轨道能级的交叉点恰恰出现在第Ⅷ族中[9],因此出现了Ni-Cu、Rh-Pd和Ir-Pt之间d电子的不规则变化。此事实意味着表1中各元素的d电子和s电子能量比较接近,因此它们变价比较容易,价态比较复杂。、
(2)由于(n-1)d电子对ns电子屏蔽不够好,d电子相互之间的屏蔽更差,因此从左到史元素切层s和d电子感受到的有效核电荷逐渐增大,其外电子的轨道半径将逐深收缩,电子的电离势逐渐增大。表1中列出了Waber等计算的s轨道的最大半径,作为原子半径,其值逐渐降低。金属半径因从左到有的原子,结合为金属态时,成键电子数逐渐降低[10, 11],结合力减少,因此金属原子间距离增大,从而使半径略为增大。但作者用金属密度计算的摩尔体积,对Fe、Co、Ni已有递降规律,对铂族元素则仍然略有增大。
(3)从表2看,Fe、Co、Ni、Cu的第一、二电离势明显低于第三电离势,因此它们都易形成正二价离子。它们及4d贵金属的一至三电离势之和都是从左到右递增,5d贵金属Os、Ir、Pt、Au目前只能查到第一电离势。上述数据表明,这些元素从左到右越来越难失去电子,理论上抗氧化能力顺序应为Fe<Co<Ni<Cu,Ru<Rh<Pd<Ag ,Os<Ir<Pt<Au, 还原能力顺序则与之相反。
《1.3 纵向考察时原子结构差异》
1.3 纵向考察时原子结构差异
(1) 表1第一过渡系元素的原子结构又可写为(Ar)3d6~104s1~2,第二过渡系的四个元素为(KD)4d7~105s0~2,第三过渡系的为(Xe)4f145d6~106s0~2。从Ar为原子实到Kr为原子实的原子多了一层18电子层,体积明显增大。从Kr为原子实到Xe为原子实的原子多了32个电子,体积也应增大。但由于塔充4f层14个稀土元素引起的“镧系收缩“,导致Os、Ir、Pt、Au的原子体积基本上与Ra、Rh、Pd、Ag一致,也就是说对于原子半径和体积存在着3d<44=~5d的关系。
(2) 3d贱金属与4d贵金属之间,由于上述“壳层效应“,金属的性质差异明显。如Fe、Co、Ni都具有磁性,何和磁矩分别为2.2、1.7和0.6玻尔磁子[12],但贵金属都没有磁性。Fe、Co、Ni的熔点很接近,但贵金属从左到右不断降低。贱金属氧化价态主要是2、3,Cu为1、2,贵金属则比较复杂,Ru、Os的最高稳定氧化态为8,如RuO4、OsO4; Rh、Ir的最高氧化态为6,如RhF6、IrF6;Pd、Pt的稳定氧化态为2、4;Ag、Au的稚定氧化态为1、3。贵金属的氧化物比硫化物稳定,贵金属的硫化物则易分解且硫化物在硫气氧中比氦化物在氧气氧中相对稳定。贱金属在水溶液中主要昌水合阳离子存在,贵金属除Ag外,在水溶液中都以络合物存在,即便是[Rh(H2O)6]3+,它也是一个配离子而不是水合离子。
5d贵金属虽然与对应的4d贵金属电子层中多了一个32个电子的电子层,但它们不仅外电子层相似,而且原子半径也相近,所以化学性质基本接近[1-5]。
(3) 从原子的电离势看,3d贱金属略高于4d贵金属。但对氧化物的形成,电离势不是唯一的决定因素,还要看金属原子的体积是否有利于与氢键合。氧的原子半径很小,它与3d贱金属比与4d、5d贵金属原子体积的差别要小一些,因此Fe、Co、Ni、Cu的氧化物要比贵金属氧化物稳定,而5d贵金属因有效核电荷高,以现代“相对论效应“的观点看外电子更不易失去,因此5d贵金属的氧化物比4d贵金属更不易形成[13]。硫化物的情况与氧化物类似,贵金属的硫化物也比贵金属的硫化物稳定。
《表3 》
表3 氧化物及硫化物的熔点或分解温度('C)
Table3 The melting point or decomposition temperature of oxides and sultides('C)

(加*号为分解温度)
表3贵金属的氧化物和硫化物都是人工合成的,文献中贵金属硫化物缺乏更多数据,只有三种给出了具体分解温度或熔点。表中贱金属的氟化物和疏化物除CuO和CuS外,都存在熔点,表明它们是稳定的。这些贱金属由于价态易变,其天然的或冶金过程中的硫化物或氧化物几乎都是非化学计量(或称不定组成)化合物,如FeS晶体组成是\(\mathrm{Fe}_{1-3\delta }^{2+} \mathrm{Fe}_{2\delta }^{3+} \mathrm{S}^{2-}\),δ是一小数,表示Fe+氧化为Fe3+的份量。贵金属除AgaS有熔点外,其他氧化物或疏化物都属无熔点的非化学计量化合物,表中标出了开始分解或分解完毕的温度,详见文献[12],其中Au2O3在110℃开始放O2,逐深转变为AuO,并在250℃失去全部O2,太阳光也能分解此化合物。Au2S3在197一200℃分解出元素Au。AgO在温度>>100℃时分解为Ag和O2,都是相当不稳定的化合物。
在天然矿物中,银有负离子体积较小的辉银矿(Ag2S),甚至角银矿(AgCI),但金只有负离子体积更大的碲金矿(AuTe2)及脆锑金矿(AuSb2),也是对本文观点的佐证。
(4)体现上述观点的元素电负性及热力学数据。以反应热,即分子的键能为基础的鲍林的元素电负性,表征着该元素原子在分子中吸引键电子的能力大小。其他各种各样的电负性标度定义蛮不同,但均与鲍林电负性有线性关系。在周期表的全部金属元素中,贵金属除银外是电负性最高的一组元素,其中金又是货金属中电负性最高的元素。这标志着贵金属是最不易失去外电子的金属。有关电负性值见表4,除Pd、Ag外,表4数据也存在从左到有增加的趋势。
《表4》
表4 VII及IB族元素的电负性*
Table 4 The electronegativity of the elements ingroup VII and IB

*数据取自文献[7]
标准电极电位E值是判断氧化还原反应进行难易的热力学数据。有关元素的电极反应的标准电位E°值列入表5。
《表5》
表5 VII及IB族元素的一些还原电位E°值 *
Table5 The reduction potential value(E°) of the elements ingroup VII and IB

*数据取自文献[14]
表5表明,贱金属除Cu外E'均为负值,数值大小表明氧化能力顺序为Fe>Co>Ni>Cu。贵金属E°值均为正值,均易从离子还原为金属。由于价态不相同,难于合理地列出还原难易的顺序,但在大量化学反应中,还原能力也是Ag>Pd>Rh>Ru,Au>Pt>Os≥Ir,Ir难于还原是因其络合物特别稳定[15]。此外还可看出5d贵金属比相应4d贵金属E°值更高,更易还原,昆Au是最易还原的元素,这也是为大量化学反应证实了的事[5]。
《2 贵金属在提取富集方法中的行为》
2 贵金属在提取富集方法中的行为
为节省篇幅,仅以最具代表性的硫化铜镍矿的处理为例进行讨论。
《2.1 火法过程》
2.1 火法过程
硫化铜镍矿中,铂族金属存在形态有砷铂矿(PtAs2)、硫铂矿(PtS)、硫镍钯铂矿(Pd、Pt、Ni)S和其他更为稀有的矿物,当然也有合金态的贵金属存在。铂与钯的含量在加拿大矿中仅为1.5一2.0g/t,在我国金川矿中则更低到总和仅0.3一0.5g/t。
从硫化铜镍矿经浮选获得的镍精矿或镍铜混合精矿都经过烫烧一还原熔炼一氧化吹炼一高锍磨浮分选一粗镍或硫化镍电解等富集贵金属的过程。
焙烧 焙烧起到烧结和脱硫的作用。烫烧过程中大量的硫化铁矿被氧化为氧化铁,脱疏率可达40%一50%,可以使含硫量从22%一24%降低到10%。在1000一1100℃下烙烧时,锇、钌的硫化物可能会被氧化为固态氧化物,锇和钌可能有5%一15%随气相挥发损失。采用沸腾炉烙烧时,氧化过程激烈,镁、钌损失更为显著。
还原熔炼 烧结料进电炉熔炼以产出初锍(低冰镍),此过程的脱疏仅仅依靠氧化物的氧和硫化物的分解作用来进行,因此过程处于还原状态。初锍的成分为20%一24%(Ni+Cu),50%Fe,约25%S。显然,在初锍中存在有Cu、Ni、Fe等的金属相。还原熔炼过程是初锍捕集贵金属的过程,Pt、Pd、Ir、Rh的提取率可达99.0%以上,微量损失是熔渣相中有微量锍细珠造成的。不希望产出Cu+Ni含量高于25%的初铭,因为那样会增大镣和货金属随渣的损失。
氧化吹炼 吹炼通常在转炉中进行,目的是氧化除去初锍中的大量铁,吹炼进行到含0.2%一0.3%Fe时为止。矿石中所含的钴在吹炼中转入铁渣,过度的吹炼产出高锍(高冰镍),组成因原料而异,通常为Nid5%一48%,Cu25%一30%,Fe0.8%一2%,S22%一23%。
吹炼温度近1200℃,转入熔渣相的贵金属为Pt<0.5%,Pd<0.5%,Rh<1.0%,Ir<1.0%。Ru和Os的损失明显,Ru约5%,Os约10%[16]。
高锍中还含有约10%的铜镍合金相,约95%的贵金属被捕集到此份合金中,它具有磁性。高锍磨细后可用磁选分出,然后浮选分离出镍精矿和铜精矿。
吹炼过程贵贱金属的行为完全符合本文观点,被氧化入渣的贱金属顺序是Fe>Co>Ni,损失于熔渣中的贵金属是Os、Ru>Ir、Rh>Pt、Pd。质金属的硫化矿物、砷化矿物由于分解温度低,在吹炼过程,甚至可能在电炉熔炼过程分解为金属态或合金态,因此被捕集于铜镍合金相。
《2.2 湿法过程》
2.2 湿法过程
电解富集 高锍磨浮后获得镧精矿和铜精矿,铂族金属和大部分金进入镍精矿,银及部分金进入铜精矿。镍精矿可熔炼为镍锍阳极或粗镍阳极然后进行电解,以便使贵金属进一步富集于阳极泥中。
铂族金属以形成置换晶格而均匀地分布在镍锍或粗镍金属相中。阳极电化溶解时,铂族金属的行为取决于阳极电位、溶液组成及阳极合金的组成,
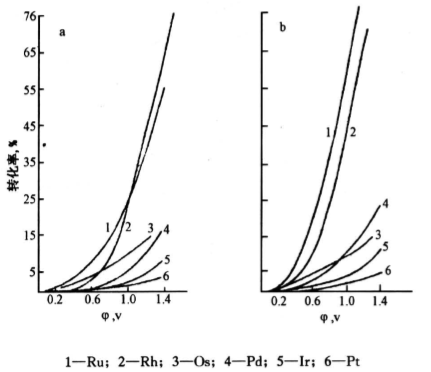
《图2》
图2 铂族金属在硫酸盐中(a)和氯化物中(b)溶解率与阳极电位的关系
Fig.2 The relationship between the solubility and anode potential of platinum group elements insulfate (a) and chloride (b) solutions

改变阳极电位和溶液组成可以获得电化溶解时铂族金属的完整行为。前苏联学者在这方面进行了深入的研究。图2是他们用人工合成含铂族金属的镶的二元合金在硫酸盐(图2a)和氯化物(图2B)中阳极溶解时,铂族金属的溶解率与阳极电位的关系[16]。
从图2看出铂族金属进入氯化物溶液中的折失率顺序在不同电位下完全符合Ru>Rh>Pd,Os>Ir>Pt。在硫酸盐中的损失率顺序也基本吻合。而且在固定电位下,转入溶液中的损失率与铂族金属在司金中的含量变动(0.01%,0.05%,0.1%,0.2%,0.5%,1.0%)无关。此外,[CL-]对粗镍电解和粗铜电解的影响以及电流密度的影响均征合本文观点。
在实际生产过程中,粗镍电解在硫酸盐-氯化物电解液中进行,电流密度约350A/mz,阳极电位处在0.2一0.4V范围。此时约有0.3%的铂和钯,将近1.0%的铱和铑,将近3%一5%的钌和锇转入溶液,这些数据也都完全符合本文的推断。
阳极泥硫酸化处理及浸出 经镍电解后,阳极泥中的铂族金属品位可以提高到干分之几至百分之几。苏联早期工艺曾在高于150℃温度下用浓硫酸处理,可以使大量Cu、Ni转为可溶盐。浸出渣再在250一300℃下进行疏酸化烫烧后漫出,但硫酸化温度高于200℃后,95%以上的IF、Rh、Ru都转入溶液。在250~260℃浓硫酸处理时,加入20%的K2SO4,则除Pt和Au基本上不硫酸盐化,全部留在渣中外,25%的Pd和约90%的Ru、Rh、Ir、Ag进入硫酸浸出液,Os则大部分挥发[17]。
硫酸化温度对贵金属溶解率的影响见表6。温度高于300℃后,Rh、Ir溶解率降低,估计是部分已转化为氧化物所致。
《表6》
表6 硫酸化温度对贵金属溶解率的影响
Table6 The temperature impact on the solubility of precious metals in sulfating process

我国金川冶炼厂也系统考察过硫酸化时硫酸盐用量对从硫化镍二次电解阳极泥中分离贱金属的效果,见表7[17]。
以上列举的数据,基本上也都能用本文观点解释。
湿法氯化浸出 阳极泥或铜镣合金用盐酸浸出时,只能溶解其中的镍。欲分离铜则需加入氧化剂。通常是向溶液中鼓入氯气,但若溶液体系电位高于400mV后,贵金属亦将部分转入溶液,其溶解的数量同样符合上述趋势。控制电位氯化浸出法我国从80年代初已在贵金属冶金中普遍使用,报导资料较多。
表7 硫酸用量对金属浸出率的影响
Table7 The influence of the usage of sulfur acid on the leaching rate of precious metals
 *300℃派硫脱处理后,120g/L硫酸溶液浸出,液固比6,温度80一90℃,搅拌2h、Os在硫酸化时已大部分挥发
*300℃派硫脱处理后,120g/L硫酸溶液浸出,液固比6,温度80一90℃,搅拌2h、Os在硫酸化时已大部分挥发
加压氧化浸出 在氧压下升温浸出贱金属也是提高贵金属品位的有效方法。浸出过程中货金属的溶解损失与温度、氧压、介质酸度、氯离子浓度等因素有关,一般来说仍然是存在Os、Ru>Rh、Ir>Pt、Pd、Au的趋势[17]。
选择性还原 对于贵贱金属的混合溶液,可以用一种还原剂进行选择性还原贵金属,常用的还原剂有锌粉、镁粉、活性铜粉、水合肼等,贵金属的还原顺序与其络合阴离子的稳定性有关,超出了本文讨论范畴。但在盐酸介质中还原时,其顺序为Au>Pd>Pt>Rh>Ir[18],基本上也仍然还体现出贵金属原子的稳定性影响。
《2.3 金的火法氯化》
2.3 金的火法氯化
高温氯化是在粗金熔融状态下,吹入氯气。贱金属和银将生成熔融氮化物漂浮于熔融金的表面,部分贱金属氯化物挥发除去。此法可以使含Au88%一90%,Ag7%一11%的物料提纯到99.5%一99.6%的纯金,适用于货币和首饰,进一步提纯用电解法或其他化学法。
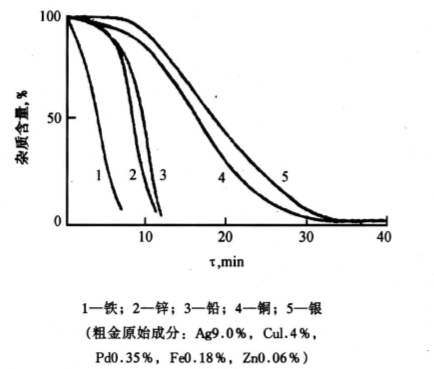
火法氯化提纯金除杂过程的动力学曲线绘于图3。
《4 结语》
4 结语
(1)从原子结构特征论述了用族及IB族的Fe、Co、Ni、Cu贱金属与其他8个贵金属元素化学性质的差异,以及8个贵金属中4d贵金属Ru、Rh、Pd、Ag与5d贵金属Os、Ir、Pt、Au化学性质的差异。
(2)横向过渡时原子的化学稳定性顺序是
《图3》

图3 氯化粗金时除杂动力学曲线
Fig.3 The dynamic curve of eliminating impurities in the chloridizing roasting of crude gold
Fe<Co<Ni<Cu, Ru<Rh<Pd<Ag, Os<Lr<Pt<Au。因此在火法或者湿法冶金过程中,金属元素的氧化反应能力是从左到右降低,还原能力是从左到右增高。纵向的稳定性是3d贱金属≤4d贵金属<5d贵金属,贱金属与贵金属比较容易分离,贵金属之间比较难于分离。
(3)可将贵金属的治金原理概括为:火法还原熔炼过程中,贵金属疏化物将先于贱金属硫化物分解或还原,未分解的疏化物可被贱金属硫化物(初锍)捕集,分解为金属或司金态的贵金属将被贱金属锍中的金属相捕集。氧化吹炼过程中贱金属硫化物先于贵金属被氧化,顺序为Fe>Co>Ni>Cu。产出的高冰镍中有产率约10%的铜镍合金,它捕集了95%的贵金属,若大幅度降低合金产率,则高冰镍磨浮分选时,铂族及一部分金被捕集在含镍锍的镍精矿中,Ag及一部分Au将捕集在含铜锍的铜精矿中。
在湿法冶炼过程中,如使用阳极电溶、控制电位氯化、加压酸浸等氧化反应的方法时,贱金属将先于贵金属被氧化迹入溶液,货金属的损失量符合原子稳定性顺序。如使用从混合溶液中还原反应的方法时,贵金属则优先被还原。
贵金属正是通过一系列火法湿法反应,不断排除贱金属,而使品味从矿石中的百万分之几,达到最后贵金属精矿中的百分之几十,才进入相互分离的精炼工段。















 京公网安备 11010502051620号
京公网安备 11010502051620号




