《1. 引言》
1. 引言
穿心莲[Andrographis paniculata (Burm.f.)]是一种知名的爵床科亚洲药用植物(图1)。穿心莲在泰国被称为Fa-Tha-Lai-Jone[1];在阿育吠陀医学中被称为kalmegh;在印度、中国和泰国还有chiretta或“苦味之王”之称[ 2,3 ]。《中国药典》中收载了中药穿心莲的药材标准,记载其煎剂具有“清热、解毒、消肿”的作用[4]。该煎剂的传统适应症包括上呼吸道症状,如普通感冒、支气管炎、鼻窦炎、咽喉炎、百日咳、肺炎和中耳炎。此外,穿心莲对腹泻、肠炎、下泌尿系感染、皮炎和肺结核的活性也有报道[4–6]。
《图1》

图1. 穿心莲。
世界卫生组织(WHO)的穿心莲专论报道中的临床数据也支持其对感冒、咽扁桃体炎、非复杂性鼻窦炎、支气管炎、急性腹泻和泌尿系感染等具有活性[7]。
穿心莲的主要活性成分是具有γ-内酯的双环二萜,其主要包括穿心莲内酯(AG,图2)及其类似物、14-脱氧穿心莲内酯、新穿心莲内酯和14-脱氧-11,12-二脱水穿心莲内酯[8]。尽管AG具有从抗炎到抗糖尿病、从神经保护到抗肿瘤活性、从保肝到抗肥胖等一系列潜在活性[9],但其水溶性差,限制了给药后其在体内的分布和积累。此外,AG在胃肠道介质中不稳定,且其半衰期非常短(约2 h)[10]。
《图2》
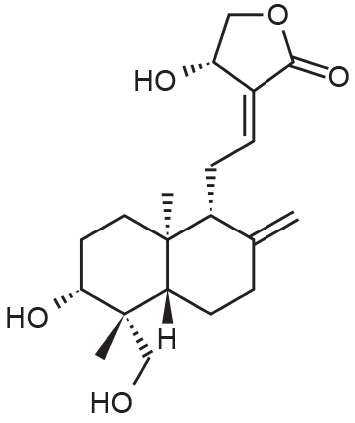
图2. 穿心莲内酯(AG)——穿心莲中的主要特征性二萜内酯。
《2. 载有 AG 的微粒和纳米颗粒》
2. 载有 AG 的微粒和纳米颗粒
AG是一种非常有前景的天然产物,具有各种潜在疗效。然而,由于其以常规剂型给药时生物利用度较低,因此尚未实现其里程碑式的治疗潜能。开发合适的AG给药系统对于开发该化合物的有效治疗方法迫在眉睫。在为提高AG水溶性和渗透性而采用的各种策略中,技术途径是开发合适的给药系统最有用的方法。其中一种提高分子溶解度的极简单方法是通过微粉化和纳米化技术改变粒度,这可以提高总表面积,从而改善溶解性。人们常使用微粒(MP),即包含在厚度和渗透性可变的天然或合成聚合物中的固体或小液体液滴,以获得胶囊药物的受控释放。有机和无机纳米平台(图3)也可大幅度提高溶解度并提高光稳定性、化学稳定性、生物利用度和组织分布。这些纳米载体可克服多药耐药现象,并跨越包括血脑屏障(BBB)在内的生物屏障。有机纳米颗粒(NP)包括聚合物和脂质NP。在脂质NP中,关于囊泡、微乳液(ME)、纳米乳液(NE)和固体脂质NP(SLN)的研究最为广泛。此外,提高AG溶解度的另一种方法为仅使用粒度为10~1000 nm的纳米粉末,主要是由于与相似质量的大型材料相比,较大的表面积将增加溶解性。对于此类主要适用于口服或肠胃外给药的制剂,应在研磨过程中加入表面活性剂或亲水性聚合物,以使表面稳定,从而抑制聚集物形成。
《图3》
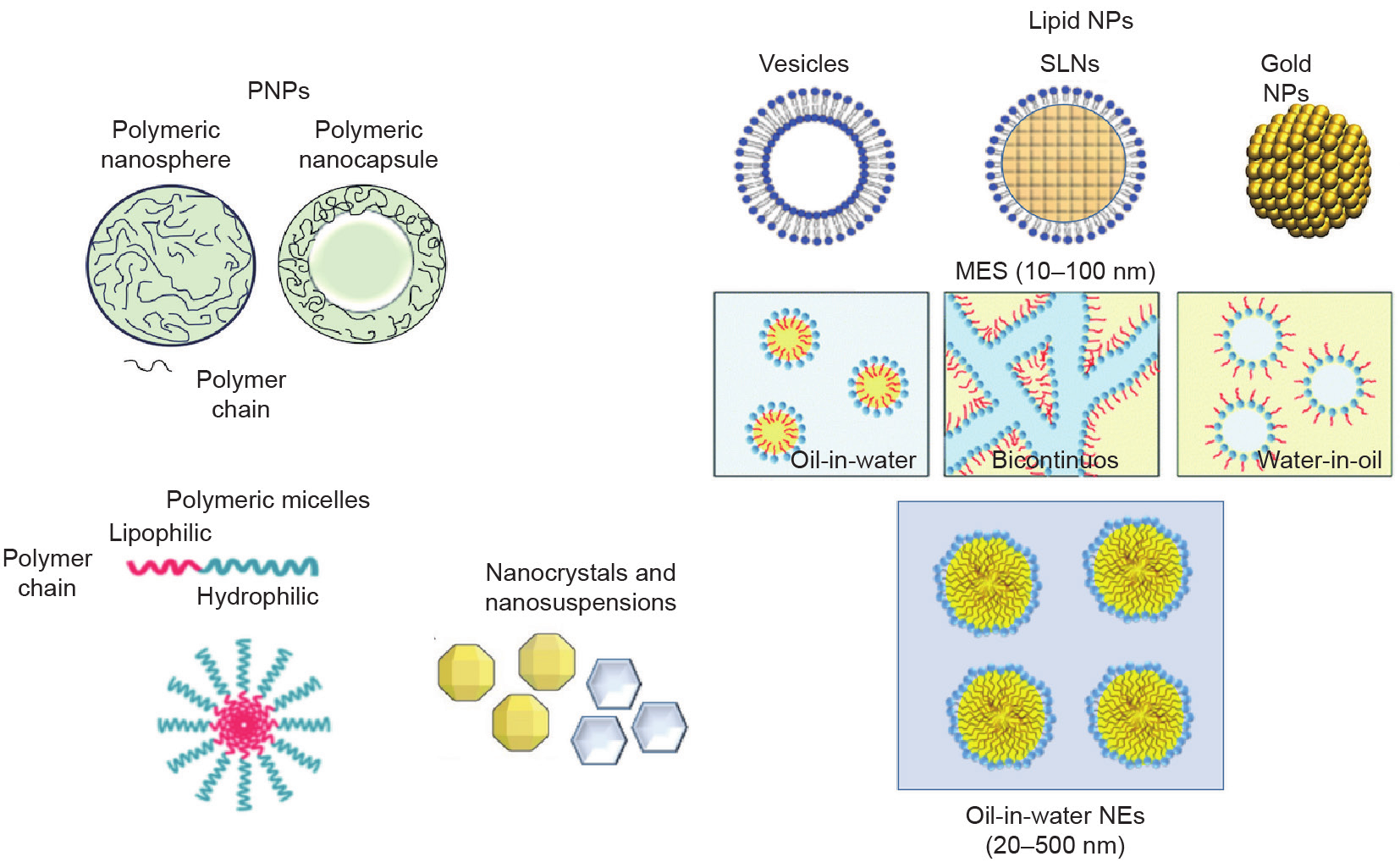
图3. 已开发了纳米载体来提高AG(即苦味之王)的生物利用度、靶组织分布和功效。NP:纳米颗粒;PNP:聚合物NP;SLN:固体脂质NP;ME:微乳液;NE:纳米乳液。
《2.1. 微粒(MP)》
2.1. 微粒(MP)
MP包括微球和微胶囊。微胶囊的特征在于内核和外壳,内核可为液体(即油或水)或固体,且通常含有活性成分,而外壳通常是聚合物或蜡;微球是固体基质颗粒。活性成分通常在基质中溶解或融化。
一项研究调查了基于乳酸和羟基乙酸-聚乳酸-羟基乙酸(PLGA)获得并载有AG的共聚物的缓释微球的开发。通过乳液溶剂蒸发法制备PLGA共聚物微球。该制剂使用响应面方法优化,用于确定工艺变量的最佳水平,该水平对粒度和包封率(EE)具有显著影响。该研究的重点是开发平均粒度为(53.18±2.11)μm的球形微球。EE为75.79%±3.02%,载药量为47.06%±2.18%。释放动力学遵循Korsmeyer-Peppas模型,初始爆发低,随后连续延长释放(长达9 d)。MP肌内给药后,发现AG血浆浓度在一周内达到较高水平[11]。
人们普遍认为高剂量的AG有保肝功效。然而由于AG极其苦涩,容易引发恶心不适。为解决此问题,研究人员采用不同的AG∶藻酸盐比(即1∶2、1∶1和2∶1),用藻酸钠和钙离子制备无苦味微粒。所开发的MP释放动力学与Korsmeyer-Peppas方程非常符合:MP在酸性(pH值为1.2或4.0)环境下释放,4 h释放约15%;然后在pH值为7.4的条件下完全释放剩余的AG。所开发的MP对于AG的口服给药非常有用,且具有良好的EE,释放达到86%[12]。在另一研究中,同一作者研究了凝胶对AG的包封机制。研究人员在交联MP中发现AG稳定[13]。还使用天然多糖、硬葡聚糖开发了用于干粉吸入器(DPI)的微粉化制剂。MP显示的平均空气动力直径为(3.37±0.47)μm。在体内研究中观察到适当的AG肺沉积,且在24 h后未发现炎症或毒性。此外,研究显示该制剂可改善肺动脉高压中的活性[14]。
《2.2. 纳米颗粒(NP)》
2.2. 纳米颗粒(NP)
2.2.1. 聚合物纳米颗粒
聚合物纳米颗粒(PNP,图3)是运用最广泛的给药系统,纳米球是基质系统,其中药物均匀分布,而在纳米胶囊中,药物置于由外壳包围的核心当中。用于制备PNP的聚合物分为合成和天然聚合物(即生物聚合物),且通常分为可生物降解和不可生物降解。聚合物的生物降解涉及导致聚合物侵蚀的聚合物中水解或酶键的裂解。大多数天然存在的聚合物会经历酶降解,因此是制药技术中使用的首种可生物降解的生物材料。天然聚合物包括蛋白质(如白蛋白、明胶、大豆蛋白水解物和酪蛋白)和多糖(果胶、纤维素、淀粉、阿拉伯树胶、角叉菜胶、藻酸盐、黄原胶、结冷胶和壳聚糖)[15]。
Roy等[16]开发了载有AG并涂有壳聚糖的PLGAPNP,用于抗肿瘤治疗。与未配制的AG相比,PNP无毒,并且在MCF-7细胞系和使用Ehrlich腹水癌(EAC)细胞的体内研究中将抗癌活性提高了3倍。测试了其他PNP中加载的AG的抗癌活性有无特异性靶标。Kim等[17]使用从苯硼酸获得的聚合物配制用于全身给药的水溶性PNP。该纳米载体在体外和体内均显示出优异的靶向属性,并明显抑制了体内肿瘤生长。Roy等[18]制备的载有AG的PLGA PNP (50∶50)中,用聚乙烯醇(PVA)进行稳定。该研究的重点是将AG送到感染了利什曼原虫的巨噬细胞中。PNP平均粒度为173 nm,表面电荷为–34.8 mV。当PNP含有4% PVA(34 μmol· –1 IC50 )时,其剂量是纯AG的四分之一(160 μmol·L–1 IC50 ),此时对感染的巨噬细胞的活性显著。同一作者最近制备了具有保肝活性、用于肝毒性环境的PNP。载有AG的阳离子修饰的PLGA PNP与纯AG相比具有优异的溶解性,并且在肝组织中有利于细胞因子的调节,从而快速恢复小鼠肝脏[19]。此外,Das等[ 20 ]于2017年研究了包容于PLGA PNP中的纯AG对砷诱导小鼠肝损伤的有效性。PNP的平均直径为65.8 nm,EE为64%。NP增加了还原型谷胱甘肽和抗氧化酶(包括超氧化物歧化酶和过氧化氢酶)的水平。PNP中载有的AG的保护效率大约是未配制的AG的5倍。NP给药改善了肝组织结构,表明其对砷诱导的肝毒性有益。据报道,AG还可改善神经退行性疾病。为克服其低脑分布,Guccione等[10]将AG载于由白蛋白(ANP)和氰基丙烯酸乙酯(ENP)制成的NP中。研究使用体外BBB模型hCMEC/D3研究了两种PN渗透BBB的能力。虽然AG无法大幅度地穿过BBB模型,但ANP将AG的渗透率提升了两倍。此外,细胞层的完整性得到保持。相反,虽然ENP增加了AG的穿过特性,但BBB会暂时失调。另一种经测试的纳米载体涉及基于阳离子聚甲基丙烯酸酯共聚物(Eudragit® EPO)的pH敏感性聚合物纳米颗粒。优化的配方由Pluronic®F-68 (0.6% w/v)和 Eudragit ® EPO (0.45% w/v)组成。它具有非常高的EE(93.8%±0.67%)、均匀的粒度[(255±9)]nm和良好的表面电荷值[(29.3±3.4)]mV。研究人员在雄性白化大鼠体内施以10 mg·kg–1 的剂量来研究AG和载于NP中的AG的体内吸收情况。与未配制的AG相比,载于PNP中的AG导致曲线下面积AUC0–∞ 和Cmax 显著增加(分别约2.2倍和3.2倍)。此外,与纯AG相比,相对生物利用度增加了121.53%(P<0.05)。其他参数受到NP中AG负载的有利影响:观察到较短的T max(4.0倍)和降低的Cl/F(2.2倍)[21]。
2.2.2. 聚合物胶束
聚合物胶束(图3)是两亲聚合物的自组装胶体,可在特定溶剂(通常为水)中自发聚集。AG包埋于基于D,L-乳酸、乙醇酸和乙二醇[聚(丙交酯-共-乙交酯)-嵌段-聚(乙二醇)-嵌段-聚(丙交酯-共-乙交酯)(PL-GA-PEG-PLGA)]的两亲性三嵌段共聚物的胶束配方中,然后评估体内生物利用度和体外细胞毒性。研究针对人乳腺癌MAD-MD-231细胞测试了细胞摄取和细胞毒性,包括细胞周期停滞、增殖抑制和促凋亡作用。胶束的负载效率约为92%,粒度为(124.3±6.4)nm。与未配制的AG相比,胶束表现出更高的增殖抑制。在使用胶束的MAD-MD-231细胞中发现了G2 /M期细胞摄取和细胞内转运、促凋亡特性和细胞周期停滞的最高效率。在大鼠身上进行了药代动力学研究,与未配制的AG相比,平均停留时间和血浆AUC0–∞ 均增加了近3倍[22]。
在进一步的研究中,从乙二醇和D,L-乳酸(mPEG-PLA)获得一系列共聚物合成为微胶囊AG,所述共聚物具有各种比例的亲水部分和疏水部分。胶束的尺寸为(92.84±5.63)nm,高EE为91.00%±11.53%,负载量为32.14%±3.02%(w/w)。研究发现载有AG的mPEG-PLA具有良好的抗盐解离、蛋白质吸附和阴离子取代的稳定性。与未配制的AG相比,AG和AG衍生物(14-脱氧-11,12-二脱水穿心莲内酯)在胶束中的溶解度在水中增加了4.51倍和2.12倍。载有AG的mPEG-PLA在不同的溶出介质中显示出相同的释放曲线。体外细胞毒性实验表明,载于mPEG-PLA中的AG在小鼠乳腺癌4T1中表现出比游离AG更高的细胞活力抑制[23]。
2.2.3. 囊泡
囊泡(图3)是双层的胶体载体,可载亲水性和疏水性化合物。脂质体主要由天然磷脂和胆固醇组成,而类脂质体则是基于非离子表面活性剂的囊泡[24]。
Kang等[25]的一项最近研究表明,AG和多柔比星的脂质体同载可抑制乳腺癌的生长和转移。用穿膜肽制备脂质体能够抑制4T1细胞的体外增殖。该研究完成了两项特别测试:伤口癒合分析和肿瘤细胞迁移及侵袭实验。研究发现,脂质体提升了肿瘤中AG的积累量,并导致乳腺肿瘤小鼠模型中的高肿瘤内渗透。研究还发现多柔比星和AG的协同作用。在另一项研究中,制备了载有AG的类脂质体。这些类脂质体改善了小鼠体内AG的组织分布和生物利用度。特别是载有AG的类脂质体在肝脏中的积累量远超游离药物。HepG2细胞中的抗肝癌(HCC)功效的体外研究表明游离药物和载有AG的类脂质体之间并无显著差异[26]。进一步研究发现,与未配制的AG相比,在天然大豆-磷脂酰胆碱混合物中所载的AG的吸收性和保肝活性均有所提升。该研究使用由四氯化碳诱导的大鼠肝毒性模型证明了AG的保肝潜力。结果显示,与未配制的药物相比,载于囊泡中的AG的吸收、生物利用度和保肝潜力明显增加。载有AG的囊泡所产生的效果与用作标准药物的水飞蓟素相当[27]。Maiti等[ 28 ]从在大鼠身上使用相同配方的研究中获得了类似结果。与未配制的AG相比,该制剂具有更佳的生物利用度和保肝活性。该配方非常有助于解决因AG半衰期短而引起的快速清除和低消除问题。在另一项研究中,Sinha等[29]报道了包封于脂质体中、用甘露糖基或岩藻糖基(作为巨噬细胞的主动靶向)修饰的AG降低肝肾毒性的功能。此外,研究发现与采用未配制的AG或载有AG的常规性脂质体的治疗相比,在仓鼠模型和脾组织结构中的实验性利什曼病的寄生负荷有所降低。在进一步的研究中,Li等[30]开发了用于肺部给药的载有AG的脂质体干粉吸入器(LDPI),用于治疗由金黄色葡萄球菌[Staphylococcus (S.) aureus]诱导的肺炎。研究人员将载有AG的脂质体冷冻干燥,以配制LDPI,并发现其适合肺部给药。当采用10倍剂量时,该制剂与未配制的AG或盘尼西林相比能够在体内产生更强的抗金黄色葡萄球菌肺炎功效。LDPI显著减少了肿瘤坏死因子α(TNF-α)和白细胞介素1(IL-1)促炎细胞因子。IκB-α在核因子-κB途径中的氧化磷酸化作用也在相当大程度上得到抑制。
Piazzini等[31]通过单独添加吐温80或与双十烷基二甲基溴化铵组合改变囊泡表面,从而开发出AG的中枢神经系统(CNS)给药的脂质体。通过平行人工膜渗透性测定(PAMPA)和hCMEC/D3细胞评估脂质体提升AG渗透性的能力。脂质体尺寸范围为(96.4±9.5) nm至(82.1±9.3)nm,EE范围为44.7 %±3.2 %至47.5%±3.3%。脂质体作为悬浮液或冻干产品显示出优异的稳定性。PAMP和hCMEC/D3运输研究表明,与游离AG相比,所有开发的脂质体均增加了AG的通透性。未发现细胞活力发生改变。主要摄取机制是细胞膜穴样内陷介导的内吞作用,且制剂的细胞内化增加与正电荷有关[31]。
2.2.4. 固体脂质纳米颗粒(SLN)
SLN(图3)用生理脂质配制,分散于水中或表面活性剂水溶液中。SLN通常呈球形,平均直径在10 nm和1000 nm之间。通过表面活性剂(乳化剂)稳定固体脂质核心,并使用脂肪酸、甘油单酯、甘油二酯、甘油三酯、类固醇和蜡配制。各类乳化剂均可用于稳定脂质分散,从而更有效地防止颗粒聚团[15]。
研究发现,包封于SLN中的AG增强了Balb/c小鼠的抗肿瘤活性,因与未配制的AG相比,AG的曲线下面积和Cmax得到了改善,从而提高了生物利用度。载有AG的SLN的持续释放模式通过增加的Tmax 值来显示[32]。
研究开发了平均直径为286.1 nm、电动电位为–20.8 mV、载有AG的SLN,以提高AG生物利用度。AG的EE为91.00%,载药量为3.49%。通过增加AG在胃肠道中的稳定性和溶解度,改善了载有AG的SLN的生物利用度和抗高血脂药效。与未配制的AG相比,载有AG的固体脂质纳米中的生物利用度增加至241%[33]。
研究中使用Compritol 888 ATO和Brij 78配制载有AG的SLN,EE为92%。储存一个月后,AG在4 ℃和25 ℃的温度下表现出优异的物理和化学稳定性。当分散在人血清白蛋白和血浆中时,SLN也是稳定的。在生理pH值下,载有AG的SLN的体外释放得到了延长和持续。通过平行人工膜渗透性测定和hCMEC/D3细胞在体外评估了SLN穿过BBB的能力,以预测被动跨细胞渗透性。与游离AG相比,SLN改善了AG的渗透性,两次测试的数据是可比较的。在血管外的脑实质中检测到了静脉内给药的荧光SLN,从而确定了其穿过BBB的能力[34]。
2.2.5. 纳米乳液(NE)和微乳液(ME)
NE和ME(图3)都是纳米级乳剂,其特征为具有高稳定性和透明度。但是,术语ME和NE不可互换:ME是各向同性的液体混合物,自发形成,且从热力学角度来说是稳定的;而NE通过机械力获得,且为仅在动力学上稳定的纳米级分散体。NE和ME的两相可以呈水连续或油连续性。此外,可存在双连续系统(也称为海绵状系统)[ 15,35 ]。研究配制了载有AG的NE,以改善其口服生物利用度和针对炎症性肠道疾病的保护作用。载有AG NE由水、乙醇、α-生育酚和聚氧乙烯蓖麻油制成。经过优化的载有AG的NE在4 ℃和25 ℃的温度下可以持续稳定3个月,液滴尺寸为(122±11)nm,黏度为28 cP。用外翻大鼠肠囊的离体实验表明,空肠是NE中加载AG的最佳位点。AG的活性相比用AG悬浮液和AG乙醇溶液获得的值分别高8.21和1.40倍。当载有AG的NE与AG悬浮液比较时,药代动力学结果显示相对生物利用度为594.3%。此外,通过预处理载有AG的NE,小鼠体内吲哚美辛诱导的肠道病变的溃疡指数和组织学损伤评分显著降低[36]。
研究使用肉豆蔻酸异丙酯、吐温80、乙醇和水制备载有AG的水包油(O/W)ME。平均液滴尺寸为15.9 nm,AG的溶解度为8.02 mg·mL–1 。该制剂稳定,具有比AG片剂更高的抗炎作用和生物利用度,且未表现出急性口服毒性 [37]。
研究使用逐层技术,通过超声波处理,在藻酸盐结壳的水包油NE上静电沉积壳聚糖,以制备载有AG的特殊NE。超声处理20 min后获得最佳稳定性。测得多层NE的粒度在90.8~167.8 nm范围内,电动电位在22.9~31.01 mV之间。当在各种模拟生物液体中进行体外评估时,NE显示出策略性释放模式。在对半乳糖胺-脂多糖-中毒小鼠进行体内评估时,NE在肝功检查[丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)、胆红素(DBIL)和肝糖原]和细胞因子(IL-β、TNF-α、IL-10和IL-6)中显示出重大的调节作用,其肝保护作用也因此显著提升[38]。
2.2.6. 金纳米颗粒
功能化金NP(图3)是生物医学应用的智能载体,可控制几何和光学性质。可在该粒子的大表面涂上不同的分子(即靶向剂、药物和防污聚合物),使其成为通用的载体。尤其是,金NP可提供具有针对性地给药,这一点的确振奋人心[39]。
研 究 开 发 了 载 有AG的 工 程 金NP, 几 何 形 状为 直 径14 nm的 球 形, 多 分 散 性 指 数(PDI) 值 为0.137。它们表现出弹性抗利什曼原虫活性,对抗野生型[IC50 为(19±1.7) µmol·L–1 ]和葡萄糖酸锑钠[IC50(55 ± 7.3 ) µmol·L–1 ]/巴龙霉素[IC50 为(41 ± 6 )µmol·L–1 ]的耐药菌株。在暴露后2 h内完成巨噬细胞对AG金NP的摄取,细胞毒性显著低于两性霉素B[40]。
2.2.7. 纳米晶体和纳米混悬液
Ma等[41]设计了一种快速溶解的基于纳米晶体的固体分散体,以提升AG的溶解性。使用各种比例的羟丙基甲基纤维素(HPMC)和3种超级分解质赋形剂配制纳米分散体:羧甲基淀粉钠、甘露醇和乳糖。具有最高HPMC浓度的分散体表现出的AG溶解性最快,这可能是由于润湿性有所增强。研究测试了20%的超级崩解剂与25%的HPMC的组合性能。用15%羧甲基淀粉钠、15%HPMC和10%乳糖研制的制剂改善了溶出度(药物负载量高达67.83%±1.26%)。体内药代动力学研究表明,与未配制的AG相比,生物利用度得到了显著提升。制备纳米分散体并测试其性能。与未配制的AG相比,纳米分散体的溶出度(85.87%)、Cmax [(299.32 ± 78.54 ) ng·mL–1 ]和AUC0–∞[(4440.55 ± 764.13)mg·h·L–1 ]明显更高。曲线下面积高出3倍[42]。含有甘草甜素的AG纳米混悬液的平均粒度为487 nm,与海藻糖中获取的AG相比,具有更加优异的性能。与未配制的AG(42.35%)相比,这些AG纳米混悬液的溶出百分比(99.87%)显著增加[43]。
在另一项研究中,研究人员使用D-α-生育酚聚乙二醇1000琥珀酸(TPGS,一种抑制P-糖蛋白功能的表面活性剂)和月桂基硫酸钠制备了AG纳米混悬液。其平均粒度为(244.6±3.0)nm,再分散性指数为113%±1.14%(n=3),研究发现溶解性有所增加。此外,Caco-2细胞单层测试表明,纳米混悬液中AG的膜渗透性(Papp )显著高于未配制的AG或无TPGS的AG纳米混悬液(P<0.01)。此外,含有TPGS的纳米混悬液显示出的Cmax 和AUC0–∞ (P<0.01)明显更高。一项关于角叉菜胶诱导的爪水肿的研究表明,与未配制的AG相比,含有TPGS的AG纳米混悬液效果更佳,且产出的NO、IL-1和TNF-α(P < 0.01)的血清水平以及超氧化物歧化酶(SOD)活性(P < 0.05)提升更多。
纳米悬浮液用3%AG、5%泊洛沙姆188、0.1%牛磺酸脱氧胆酸钠或0.05%脱氧胆酸钠与0.4 mm氧化锆珍珠配制。这些纳米悬浮液显示出六边形形态,粒度为300 nm,但结晶状态没有变化。研究发现,饱和溶解度明显增加,0.25 h内即可完全释放。使用甘露醇(5%)作为冷冻保护剂的冻干制剂在6个月的储存期间具有可观的物理和化学稳定性。药代动力学和组织分布研究表明,AG主要分布于肝脏中,并迅速从血液中清除[45]。
《3. 结论》
3. 结论
微载体和纳米载体是生物活性成分研究中极重要的领域,包括天然产物和草药提取物。通过对某些基本药物(主要是抗肿瘤和抗寄生虫药物)进行适当的治疗处理,这些技术的运用已对众多医学领域产生了重大影响。AG是穿心莲的特征成分,除了众多的潜在活性外,其生物利用度较低,生物分布和定位有限,在胃肠环境中缺乏稳定性且生物半衰期极短。通过使用基于AG的微纳米制剂改善AG的生物利用度、靶组织分布和功效的研究已取得显著成果。这些成果对于确立AG在现代临床治疗中的重要地位来说十分关键。
在比较本文中所述配方时,总的来说,纳米载体给药系统与微型给药系统相比具有一定的优势:它们更稳定,可提供更多的表面积,并且能够克服解剖学障碍和生理清除机制。因此,采用纳米载体时,穿心莲活性变得更强,更易于检测且持续时间更长。每种NP都有自身的优缺点和特征。
使用纳米粉末是增强AG溶解度最简单经济的技术。该方法通常不含载体,且对于Papp <10–5 的高熔点和高剂量化合物(如众多天然产品)而言是最合适的技术。该方法的优点包括可以改善口服、黏膜给药和肠胃外给药后的吸收,具有控制药物吸收速度和程度的能力,低成本,且容易大规模生产。然而,该方法的局限性也很多。因为这些纳米制剂无法增强光稳定性或化学稳定性,难以克服多药耐药性现象或赋予被动和主动靶向。
脂质和PNP均可克服纳米粉末的所有限制,特别是,PNP可解决生物相容性和低生物降解性,尤其是在长期给药后产生的安全性问题。SLN的主要限制是其在存储期间的低负载能力和泄漏。通过使用新的经优化的脂质纳米载体(即所谓的纳米结构脂质载体)可克服这种限制。由于这种脂质混合物更加复杂,且在疏水核心内环境温度下同时存在固体(脂肪)和液体(油)脂,其在分散体中具有更高的负载能力和更少的水。目前,尚未有文献报道这些纳米载体用于AG的用途,然而,它们可能是进一步改善AG功效的合适工具。
囊泡是通用的纳米载体,优点众多:由于亲水性区室和亲脂性栅栏层的存在,亲水性和疏水性药物均可很容易地包封于囊泡之中。因此增加了生物利用度、延缓了新陈代谢并延长了其循环寿命。此外,使用囊泡可以实现被动和主动靶向。囊泡的缺点和局限性包括其渗漏性质,这会导致药物过早释放、包囊效率低、价格昂贵且口服给药的效用低下。
ME和NE都是有趣的纳米载体,因为它们能够加载高剂量的药物(高达20% w/w),并且与其他纳米系统相比具有许多优势。它们可通过各种途径给药,药物吸收速度和程度可控,溶解度和生物利用度更高,光稳定性和化学稳定性更强,并能够克服多药耐药现象。此外,由于成本低且易于批量生产,ME和NE优于纳米载体。
《Acknowledgments》
Acknowledgments
The authors thank the Fondazione Cassa Risparmio diFirenze for kindly supporting this review study.
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Marta Casamonti, Laura Risaliti, Giulia Vanti, Veri Piazzini, Maria Camilla Bergonzi, and Anna Rita Bilia declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




