《1. 引言》
1. 引言
急性B淋巴细胞白血病(B cell acute lymphoblastic leukemia,B-ALL)可通过异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)治愈[ 1,2]。血液病复发是allo-HSCT后B-ALL患者治疗失败的常见原因,且这些患者的临床结果也不甚理想。allo-HSCT后,B-ALL复发的成年患者的中位生存期为5.5月,而对于allo-HSCT后B-ALL复发的儿童患者而言,其无事件生存率(event-free survival,EFS)为15%,总生存率(overall survival,OS)为20%[3,4]。
HSCT后,一旦出现微小残留病(minimal residual disease,MRD),血液病必然会复发,因此可作为抢先治疗的标记[5–7]。通常,allo-HSCT后防止B-ALL患者复发和出现阳性MRD的主要方法是减少/停用免疫抑制药、使用干扰素以及供者淋巴细胞输注(donor lymphoblastic infusion,DLI)[8–10]。多项研究已探讨了干扰素和供体淋巴细胞输注对治疗allo-HSCT后B-ALL MRD的有效性。对于allo-HSCT后B-ALL复发,DLI是一项非常重要的方案。然而,DLI的响应率却很低。Yan等[11]发现,在半相合造血干细胞移植(haploidentical hematopoietic stem cell transplantation,haplo-HSCT)后急性白血病复发的患者中,约64%的患者在接受DLI后可以达到完全缓解(complete remission,CR),且其一年无疾病存活率(disease-free survival,DFS)为36%。Yan等[12]还发现,相较于对照组,以MRD和移植物抗宿主病(graft-versus-host disease,GVHD)为导向的多种巩固化疗与供体淋巴细胞输注降低了累计复发率(cumulative incidence of relapse,CIR),增加了无白血病存活率(leukemia-free survival,LFS),并增加了急性白血病haplo-HSCT后复发患者的存活率。但是,约三分之一对供者淋巴细胞无反应的患者预后恶化,亟需创新方法来提高这些患者的总体存活率。
通过分化簇(cluster of differentiation,CD)19导向嵌合抗原受体(chimeric antigen receptor,CAR)修饰T细胞(CART19)可以有效地消除化疗后复发患者的白血病细胞,而且对于进行HSCT的患者而言,CART19s也起着重要的作用。一般来说,CART19s可来自患者或供者。尽管自体CART19s在未出现GVHD的HSCT前患者中可能显示出有效的抗白血病活性,但是却难以从已经进行过HSCT的患者、当前接受化疗的患者以及出现疾病复发的患者身上获取足够的高质量T细胞。供体来源的CART19s表现出有效的移植物抗白血病(graft-versus-leukemia,GVL)活性,且不影响来自CART19s的细胞毒活性[13];供体来源的CART19s的安全性和有效性是本研究的关注焦点。Brudno等[14]从形态学角度评估了CART19s对于复发患者的效果,这些患者接受了人类白细胞抗原相合的同胞供者及无关供者的异基因血液或骨髓移植,且并未出现GVHD。随后,在haplo-HSCT后对DLI无反应的B-ALL复发患者中,在接受供体来源的CD19靶向T细胞输注后,多数患者MRD阴性缓解[15]。
这些临床研究表明,供体来源的CART19s可消除HSCT后复发患者的白血病细胞,甚至对DLI无反应的患者也是如此。初步结果也表明,供体来源的抗CD19 CAR T细胞输注对于HSCT后B细胞恶性肿瘤复发患者也是安全的。目前尚未确定供体来源的CAR T细胞输注是否是治疗HSCT后B细胞恶性肿瘤MRD的有效干预手段。在本研究中,我们评估了供体来源的抗CD19CAR T细胞输注对DLI无效的B细胞恶性肿瘤MRD阳性患者的临床干预结果。
《2. 方法》
2. 方法
《2.1. 患者》
2.1. 患者
本研究纳入了2014年9月至2018年2月在北京大学血液病研究所接受CAR T细胞输注且符合下列标准的患者:①诊断患有B-ALL;②allo-HSCT后出现被定义为形态学上缓解的MRD,并且对任何MRD检测[包括流式细胞术、WT1表达、可检测融合基因患者所做的实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)的融合基因检测]均呈阳性结果;③对一次或多次DLI无反应(无反应定义为DLI后25~30天骨髓穿刺液检测显示MRD阳性);④白血病细胞的CD19表达经流式细胞测量予以确定。
该方案经北京大学人民医院审查委员会评估,并得到批准。所有参与本研究的患者均根据《赫尔辛基宣言》在知情的情况下给予同意。
《2.2. haplo-HSCT 程序》
2.2. haplo-HSCT 程序
之前的报道[16]中描述了haplo-HSCT程序,包括预处理、GVHD预防、干细胞收集和支持性疗法。预处理期间使用了以下药物:阿糖胞苷(2天,每天4 g·m–2 )、白消安(busulfan,Bu)(3天,每天3.2 mg·kg–1 )、环磷酰胺(cyclophosphamide,Cy)(2天,每天1.8 g·m–2 )、司莫司汀(1天,250 mg·m–2 )、抗人胸腺细胞免疫球蛋白(4天,每天2.5 mg·kg–1 ;美国马萨诸塞州波士顿健赞公司的兔抗胸腺细胞免疫球蛋白)。所有患者均接受了粒细胞集落刺激因子动员骨髓干细胞及外周血干细胞治疗。所有移植受者均接受了使用环孢素A(cyclosporine A,CsA)、霉酚酸酯和短期甲氨蝶呤(methotrexate,MTX)来预防移植后急性移植物抗宿主病(acute graftversus-host disease,aGVHD)。
《2.3. 同胞全合的 HSCT 程序》
2.3. 同胞全合的 HSCT 程序
所有患者均采用改良BuCy2方案治疗,包括:羟基脲(在输注前第10天口服两剂80 mg·kg–1 )、阿糖胞苷(在输注前第9天每天静脉注射2 g·m–2 )、白消安(在输注前第8天至第6天每天静脉给药3.2 mg·kg–1 )、环磷酰胺(在输注前第5天至第4天每天1.8 g·m–2 )和司莫司汀(在输注前第3天给予250 mg·m–2 )。至于aGVHD预防,则同上所述使用了CsA;骨髓恢复之日停用霉酚酸酯,在第1、3、6天给予甲氨蝶呤[17]。
《2.4. DLI 程序》
2.4. DLI 程序
本研究中,DLI包括在化疗后输注粒细胞集落刺激因子动员外周血干细胞一次,并在输注后为了预防GVHD给予免疫抑制药[18]。单核细胞的中位剂量为1×108 kg–1 。DLI后,所有患者均按照主治医师的建议接受了4~6周的CsA等免疫抑制药治疗(通常取决于DLI后患者的GVHD情况),以预防GVHD。CsA的初始剂量为2.5 mg·kg–1·d–1,对剂量进行了调整,使血浆浓度保持在150~250 ng·mL–1 。对DLI无反应定义为DLI一个月后检测出MRD。
《2.5. 细胞生产》
2.5. 细胞生产
我们通过外周血分离从每个患者的异基因移植供体的外周血单核细胞(peripheral blood mononuclear cell,PBMC)中生产抗CD19 CAR T细胞。CAR T细胞的产生时间为5~15天。激活与修饰T细胞,以表达获取外周血单核细胞后的4SCAR19基因。在输注前5~7天,4SCAR19慢病毒转导后,激活外周血单核细胞并使其富集于T细胞中。输注CART19s前,每个患者的CART19s均进行了转导效率的荧光活化细胞分选(fluorescence-activated cell-sorting,FACS)分析以及体外细胞毒性检测。此外,CART19s培养期间,还评估了可能存在的真菌、细菌、支原体、衣原体和内毒素污染。有关CART19s的其他详情请见附录A。
《2.6. CAR T 细胞输注方案》
2.6. CAR T 细胞输注方案
患者接受了目的在于清除淋巴细胞的淋巴细胞消减治疗。大多数患者根据肿瘤负荷与主治医生的建议接受了基于氟达拉滨或环磷酰胺的化疗(详情请见第3.2节)。在未进行术前用药的情况下,CART19s直接被输入患者体内;第3.4节给出了输入的细胞剂量与特征。当满足下列其中一个标准时,患者接受第二剂CAR T细胞输注:①第一次输注后患者MRD检测结果呈阳性;或②患者出现了形态学复发情况。
《2.7. CAR T 细胞输注和 GVHD 的毒性》
2.7. CAR T 细胞输注和 GVHD 的毒性
采用细胞因子释放综合征(cytokine release syndrome,CRS)的通用标准对CAR T细胞输注后的毒性进行了分级[19,20]。在获得合适的培养物并开始经验性抗生素治疗后,对所有表现出CRS的患者的感染可能性均进行了考虑。
根据受感染器官的临床特征确诊GVHD为急性或慢性,且根据先前发布的标准对aGVHD进行了分级[21]。当无法排除GVHD时,采用了包括甲泼尼龙或地塞米松的初始疗法。静脉注射1剂1~2 mg·kg–1 ·d–1 的甲泼尼龙。对GVHD不受控制的患者给予CsA,随后进行了剂量调整,使血浆浓度保持为不低于150 ng·mL–1 。
《2.8. 反应评价》
2.8. 反应评价
在CAR T细胞输注后的第15和(或)第30天进行了骨髓检查,以评估临床效果,或者如果有临床指征,则会尽早进行。其后,每1~3个月均进行了骨髓检查。对所有患者均采用流式细胞测量进行了骨髓涂片和微小残留疾病检测,采用qPCR进行融合基因检测,并测量了WT1表达水平。
MRD阴性完全缓解定义为所有MRD检测有形态学缓解,并呈阴性结果,这些检测包括WT1表达、流式细胞测量以及可检测融合基因患者的qPCR融合基因检测。
《2.9. 统计分析》
2.9. 统计分析
采用描述性统计评估了患者特点。使用Fisher精确检验比较了微小残留病率,使用Student t 检验评估了定性变量。所有分析均使用SPSS软件(版本19,SPSS公司,芝加哥,伊利诺伊州,美国)进行。
《3. 结果》
3. 结果
《3.1. 患者特点》
3.1. 患者特点
本研究包括6名allo-HSCT后出现MRD的B-ALL患者(3名女性,3名男性,年龄范围:12~46岁),其中,4例接受haplo-HSCT,另两例接受人类白细胞抗原相合同胞供者HSCT。所有患者均出现了MRD,且对至少1疗程供体淋巴细胞输注无反应(表1)。其中,5名患者接受一次以上输注(总输注次数:15),且中位CAR T细胞输注剂量为1.51×108 个细胞·kg–1 (范围:2×107 ~3.66×108 个细胞·kg–1 )。对所有患者的观察持续到2018年2月。
《表1》
表1 患者特点
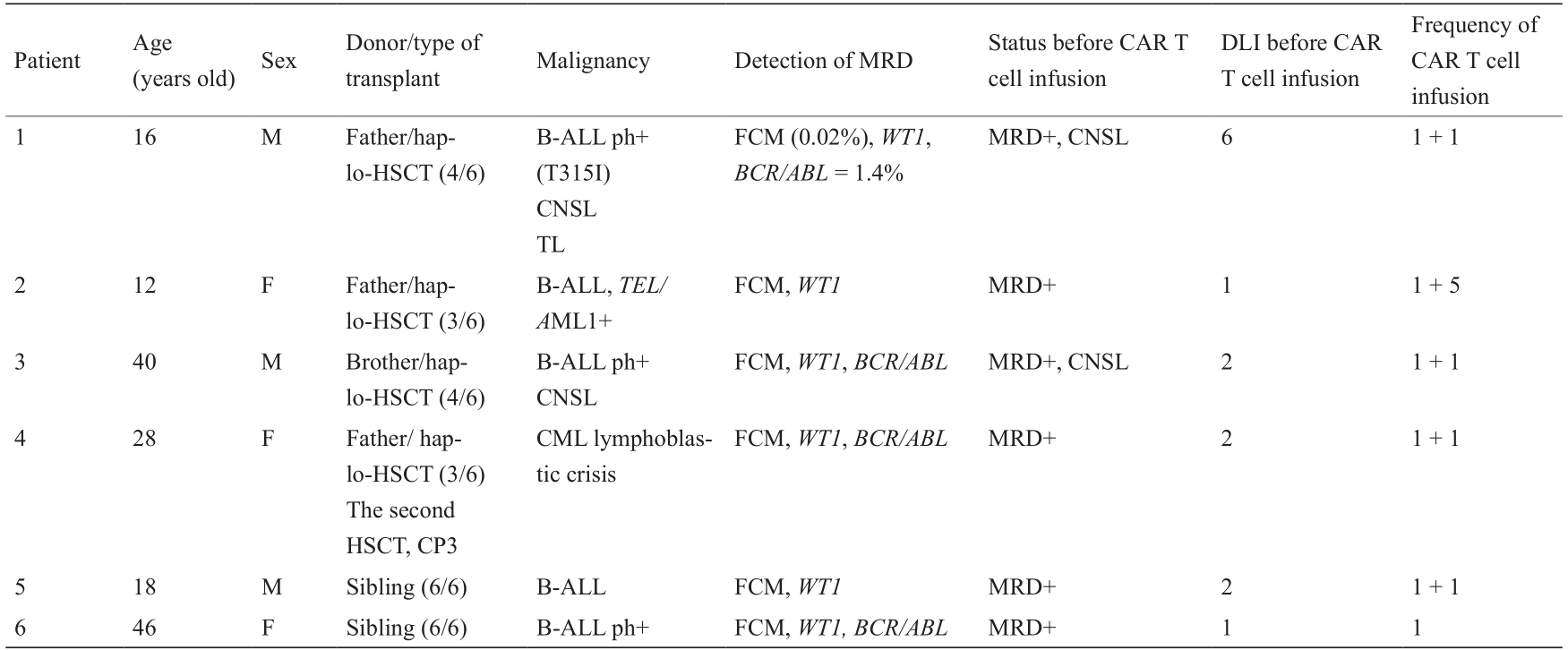
CML: chronic myelogenous leukemia; CNSL: central nervous system leukemia; F: female; FCM: flow cytometry; M: male; ph+: philadelphia chromosome-positive; sibling: HLA-matched sibling donor; TL: testicular leukemia.
《3.2. 完全缓解率与临床结果》
3.2. 完全缓解率与临床结果
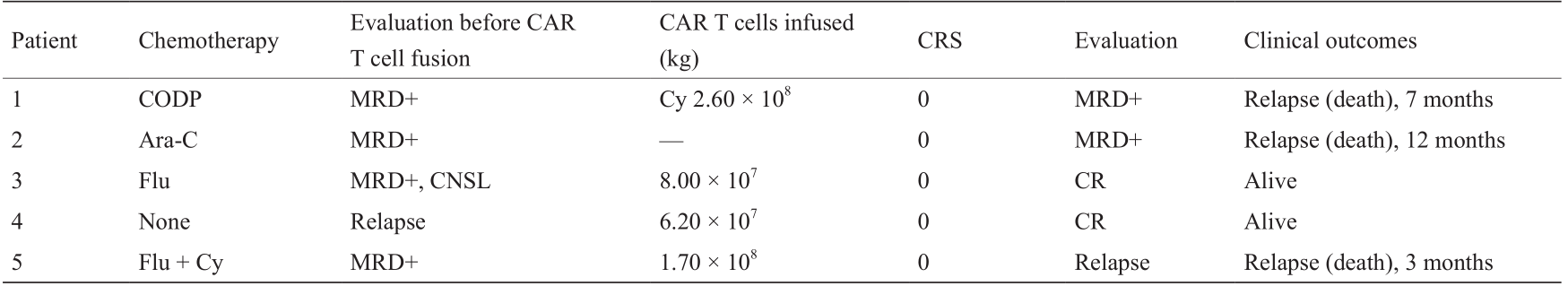
6名患者中,有5名(83.33%)在首次输注后达到了MRD阴性完全缓解,其中5名患者在CAR T细胞输注后平均健康生活了3个月(2~17个月不等)。患者1~4出现了MRD复发。患者1接受了第二次输注,但未得到缓解。患者2接受了第二次输注且得到缓解,但两个月之后出现MRD复发。随后,患者2接受了四次CART19s输注,但未得到缓解。患者3和4接受了第二次输注,摆脱了白血病继续生存。患者5对第一、第二次CAR T细胞输注无反应,出现形态学复发,并于其后死于白血病。患者6情况出现缓解,继续无病生存。所有详情总结在表2和表3中。
《表2》
表2 CAR T细胞首次输注与患者结果

Bas: basiliximab; CHOP: cyclophosphamide (750 mg·m–2 on day 1) + vincristine (1.4 mg·m–2 on days 1, 8, 15, 21) + adriamycin (50 mg·m–2 on day 1) + prednisone (60 mg·m–2 on days 1–21); CODP: cyclophosphamide (750 mg·m–2 on day 1) + vincristine (1.8 mg·m–2 on days 1, 8, 15, 21) + daunorubicin (40–60 mg·m–2 on days 1–3) + prednisone (60 mg·m–2 on days 1–21); COMP: cyclophosphamide (400 mg·m–2 on days 1, 8) + vincristine (1.4 mg·m–2 on days 1, 8) + mitoxantrone (5 mg·m–2 on days 1–4) + prednisone (60 mg·m–2 on days 1–21); Cy: cyclophosphamide (500 mg·m–2 on days 1–3); Flu: fludarabine (30 mg·m–2 on days 1–3); Glu: glucocorticoid; MR: molecular remission. NR: no response
a Patient 6 required medication intervention (tocilizumab × 2 on days 8 and 9).
《表3》
表3 CAR T细胞第二次输注与患者结果
《3.3. GVHD》
3.3. GVHD
后续CAR T细胞输注期间,无患者出现aGVHD。
《3.4. 细胞因子释放综合征》
3.4. 细胞因子释放综合征
CAR T细胞输注之后观察到的毒性包括发烧、低血压、低血氧、谷丙转氨酶(alanine transaminase,ALT)升高,在排除其他原因后,被归为CRS。根据修订后的分级制度对CRS进行评分[21]。每名患者出现的毒性列于表4中。6名患者出现5次CRS事件(83.33%),且这5次事件均发生在第一次输注之后(1级:2次;2级:1次;3级:2次)。
一名患者需要药物干预(妥珠单抗):患者6在输注后第8天出现皮疹、发烧和低血压症状,并于输注后第8天和第9天接受了两次托珠单抗治疗。
《3.5. 外周血 CART19s》
3.5. 外周血 CART19s
在4个输注疗程期间,通过qPCR于输注后第7天、第14天、第21天分别测量外周血中的CART19s。外周血中的CART19s于输注后第7天达到峰值,并于第21天减少(表4)。
《表4》
表4 输入的细胞特性和相关毒性
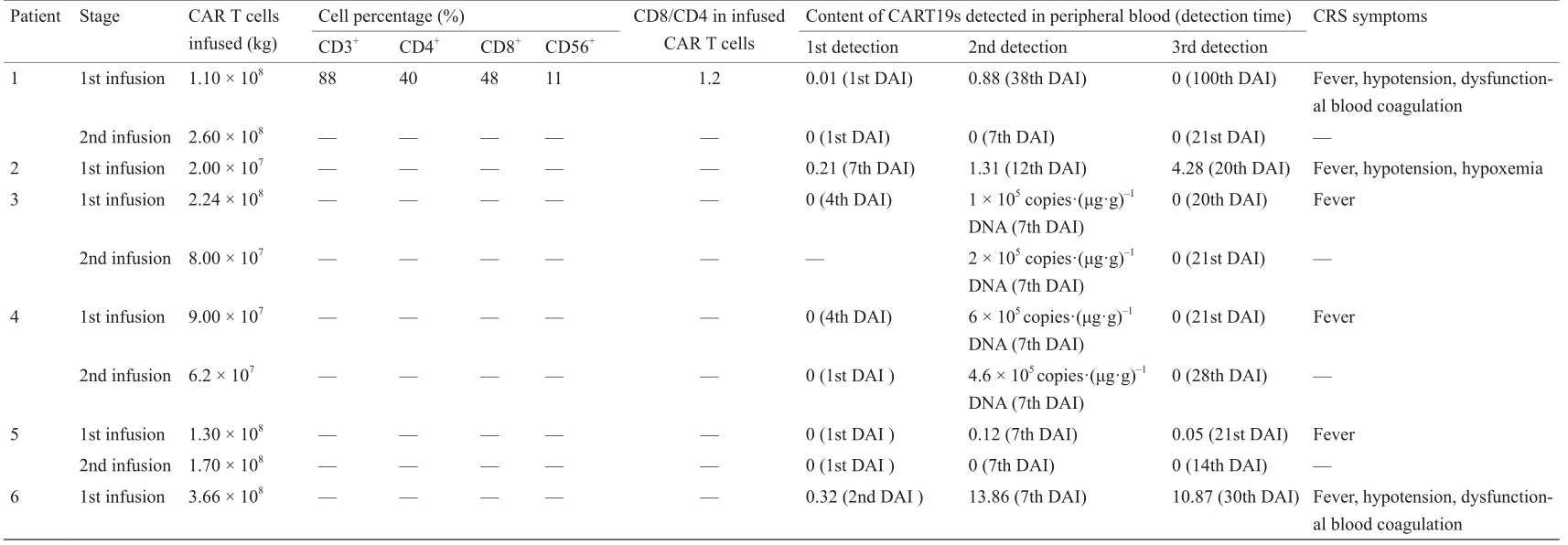
DAI: day after infusion.
《4. 讨论》
4. 讨论
MRD是HSCT后预测血液病复发的好方法[22,23],消除MRD可以预防复发。采用了多种方法治疗MRD。DLI后给予干扰素疗法和化疗是HSCT后对复发急性淋巴细胞白血病的重要干预手段。Mo等[24]表示,对HSCT后出现MRD的急性淋巴细胞白血病患者的DLI结果和α型干扰素(IFN-α)治疗结果对比,抢先的IFN-α疗法是HSCT后无法接受DLI的MRD阳性患者的一种替代疗法。本次对比表明,实施干预后,IFN-α组和DLI组患者的一年无疾病存活率分别为68.2%和60.0%。Yan等[12]表示,与对照组相比,以MRD和GVHD为导向的多种巩固化疗加DLI可以减少累计复发率,增加无白血病存活率以及allo-HSCT后急性白血病复发患者的存活率。三年累计复发率、无白血病率与移植后存活率分别为32.4%、50.3%和51.4%。Ma等[25]报道,采用DLI治疗了allo-HSCT后复发的19名高危疾病患者,并监测是否出现MRD。其中,6名患者(31.58%)在DLI后未出现白血病进展。由此可知,DLI方案对于治疗急性淋巴细胞白血病的疗效有限,且可能导致危及生命的GVHD。此外,约三分之一的MRD患者可能对DLI无反应,且预后可能恶化。这些患者应采用创新方案予以治疗。
CAR T细胞代表一种新型的、有发展前景的免疫疗法[26]。我们探讨了人类白细胞抗原相合同胞供者/无关供者移植后供体来源CART19s输注;在患B-ALL的5名患者中,其中,4名(80%)出现了缓解,且未复发aGVHD[14]。我们还开展了供体来源的CD19靶向T细胞输注临床研究,发现此种治疗使在haplo-HSCT后对供体淋巴细胞输注无反应的B-ALL复发患者出现了MRD阴性缓解。6名患者中,有5名(83.33%)出现了MRD阴性缓解;此外,CRS和GVHD也均得到了控制[15]。总之,供体来源的CD19靶向T细胞输注似乎是治疗allo-HSCT后B-ALL复发患者的有效方法。然而,目前尚不清楚CAR T细胞输注对造血高细胞移植后对供体淋巴细胞输注无反应的MRD患者来说是否有效。本研究结果表明,供体来源的CART19s也是HSCT后治疗MRD患者的有效方法。就我们所知,本研究包括allo-HSCT后B-ALL复发患者接受供体来源的CART19s输注的最大研究。本研究结果提供了供体来源的CART19s输注可有效消除MRD的初步证据。
一直以来,人们都很关心供体来源的CAR T细胞输注的安全性。在体外实验中,供者CART19s可在不破坏GVHD活性的情况下增加移植物抗白血病活性,同时不影响细胞毒活性[27]。本研究中还从aGVHD与细胞因子综合征两个方面评估了供者来源的CAR T细胞输注对HSCT受体的安全性。无患者出现主要令人担心的并发症——aGVHD。本研究中的GVHD的发病率与程度低于因先前用于治疗复发患者的CAR T细胞输注而导致的GVHD的发病率与强度[15]。这种临床现象与Jacoby等[28]报道的结果一致。在体外,鼠类异基因CD19 T细胞表现出有效的抗白血病活性,但也表现出潜在的致命性GVHD。然而,CAR引起的GVHD仅在有白血病细胞的情况下才会发生。另一种主要担忧是CRS。在本研究中,无患者直接死于CRS。此外,本研究尽管有中枢神经系统白血病(CNSL)患者参与,但并未出现与CRS相关的脑水肿病例。因此,供体来源的CAR T细胞输注对于HSCT后B-ALL的MRD是安全的。
本研究中,在接受CAR T细胞输注之前,6名MRD患者中,有5名患者(83.33%)在第一次输注后达到了分子完全缓解,有3名患者至今仍在人世。我们先前的研究中,有反应的5名患者中,有4名患者在2~7个月后复发血液病[15]。尽管本研究纳入的病例较少,但确定MRD治疗对复发患者是否有足够的效果值得评估。
《5. 总结》
5. 总结
根据临床观察,我们提出供体来源的CAR T细胞输注是HSCT后可消除B细胞恶性肿瘤患者MRD的一种有效与安全的干预手段。而让人印象更深刻的是,本研究观察期间无患者出现GVHD。但是,尚不清楚这种情况出现的机制。需要进一步的实验和更大规模的临床试验来确认CAR T细胞输注是否可以用作消灭对DLI无反应的患者和MRD患者的MRD的一线干预措施。
《致谢》
致谢
本工作得到了首都医学发展科研基金 (2018-2-4084)的支持。
《Author contributions》
Author contributions
Yifei Cheng and Yuhong Chen analyzed the material and wrote the paper. Shasha Wang collected the data. Xiangyu Zhao, Chenhua Yan, Yu Wang, Yao Chen, Wei Han, Lanping Xu, and Xiaohui Zhang performed the research. Lungji Chang and Lei Xiao contributed to cell production. Kaiyan Liu designed the research. Xiaojun Huang designed the research and edited the manuscript.
《Compliance with ethics guidelines》
Compliance with ethics guidelines
The present protocol was evaluated and allowed by the Peking University People’s Hospital review board. All enrolled patients gave informed consent in accordance with the Declaration of Helsinki.
Yifei Cheng, Yuhong Chen, Chenhua Yan, Yu Wang, Xiangyu Zhao, Yao Chen, Wei Han, Lanping Xu, Xiaohui Zhang, Kaiyan Liu, Shasha Wang, Lungji Chang, Lei Xiao, and Xiaojun Huang declare that they have no conflict of interest or financial conflicts to disclose.
《Nomenclature》
Nomenclature
aGVHD acute graft-versus-host disease
allo-HSCT allogeneic hematopoietic stem cell transplantation
ALT elevated alanine transaminase
B-ALL B cell acute lymphoblastic leukemia
Bu busulfan
CAR chimeric antigen receptor
CART19 CD19-directed chimeric antigen receptor-modified T cell
CD cluster of differentiation
CIR cumulative incidence of relapse
CR complete remission
CRS cytokine release syndrome
CsA cyclosporine A
Cy cyclophosphamide
DLI donor lymphoblastic infusion
EFS event-free survival
FACS fluorescence-activated cell-sorting
GVHD graft-versus-host disease
GVL graft-versus-leukemia
haplo-HSCT haploidentical hematopoietic stem cell transplantation
HLA human leukocyte antigen
HSCT hematopoietic stem cell transplantation
LFS leukemia-free survival
MRD minimal residual disease
MTX methotrexate
OS overall survival
PBMC peripheral blood mononuclear cell
qPCR quantitative real-time polymerase chain reaction
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2018.12.006.














 京公网安备 11010502051620号
京公网安备 11010502051620号




