《1. 背景介绍》
1. 背景介绍
蛋白质吸附现象在不同领域中普遍存在并发挥着或积极或消极的作用。在废水处理和食品工程中,蛋白质在反应器和管路内表面的吸附会造成生物污垢[1–4]。这些吸附的物质在增加设备的运行和清洁成本的同时,还降低了设备的运行效率和产品质量。因此,如何解决蛋白质在这些生产设备的核心组件中的结垢问题已成为一项研究热点。然而,在另外的一些领域则期望增强蛋白质的吸附。例如,在污泥脱水处理过程中增加蛋白质的吸附可以破坏水与污泥之间的相互作用力,从而帮助污泥脱水[5–7]。增加蛋白质吸附可以减弱药物的纳米基底在动物体内的生物排异性[8–10]。另外增加目标蛋白质的吸附也可以提高蛋白质纯化处理中的回收率[11,12]。因此,深入地了解蛋白质吸附机理可以针对不同的环境与用途,对蛋白质的吸附效率进行有效地调控[1,2,4,13,14]。
已有很多实验工作对蛋白质吸附机理进行了深入探索。这些实验一般通过监测固体表面性质的变化研究蛋白质特殊的吸附片段[15,16]和整体的吸附过程[11,17]。然而,吸附环境中任何一点细微的变化,尤其是溶液的pH值和离子强度的变化,可能会显著改变蛋白质的分子结构和受力情况[1,11,17–20]。由于对吸附机理缺乏了解,这些改变造成的吸附动力学的变化难以预测,这也为研究对象的拓展带来了困难。由于蛋白质的吸附动力学目前难以实现实时监测,当吸附系统引入一个新的变量时,所有的实验需要重新设计[11,12]。这种实验上的重复会大幅度地减缓研究进度并且耗费更多的科研经费。因此,需要开发一种经济可靠并且能实时监测蛋白质吸附过程的方法,对蛋白质吸附机理开展研究。
数值计算是一种适用于不同生物材料吸附机理的研究手段。这项技术可以追踪并采集不同条件下蛋白质的移动轨迹[21–27]。通过数值计算,可以很容易地确定蛋白质在固体表面的特异性吸附片段[21,27–29],并且可以对溶液中蛋白质吸附的驱动力进行量化研究[23,30]。然而,现行最常用的全原子分子动力学模型由于其计算繁杂,能处理的分子数量有限。因此在有限的时间内,分子动力学模型通常只能对一个蛋白质分子进行计算[21,27–29]。然而在现实环境下,溶液中存在众多相互作用的蛋白质分子。吸附在固体表面时,这些蛋白质会发生变性或是与其他蛋白质团聚[19,31–34]。因此单蛋白质分子计算结果不足以解决实际问题。
为了能研究更大的多蛋白质系统,将原子粗粒化以减少计算的颗粒数量是一种广泛使用的方法[25,35–44]。在目前已有的力场中,Martini粗粒化力场使用较为广泛。它针对大型生物分子体系开发[25,41–44]并且已经被用于蛋白质聚集[45]、双脂层的空洞形成[46]、有机分子在金属纳米颗粒上的吸附[47]和微纤维的结晶[48]等研究。然而,这个力场基于分子动力学计算方法。它的运行速率同样受限于繁杂的分子动力学模型[49,50]。蒙特卡洛(Monte Carlo, MC)计算相比于分子动力学计算可以实现更长的计算时间[40,51]。Pandey和他的研究团队设计了一种将整个氨基酸残基进行粗粒化的模型[35,36,40,52–55]。同时,他们使用晶格蒙特卡洛模型(lattice Monte Carlo, LMC),有效地计算了多条肽链的吸附密度[40,53,56–58]、聚合物折叠[36,39,54,55,59]、结合能[40,52,53,60]和超分子团聚[35,58,61]。然而,这种对于整个氨基酸残基的粗粒化过程完全忽视了所有氨基酸残基的空间结构。对于小分子蛋白质,特别是短肽而言,氨基酸残基的空间结构十分重要。另外,这种方法的拓展还受限于它针对特定系统所设计的独特的计算参数[40]。因此,将Martini粗粒化力场和晶格蒙特卡洛运算的优势结合起来有望实现快速且精确的分子计算。
基于以上分析,将Martini粗粒化力场和晶格化蒙特卡洛运算融合为一种新的计算模型[51]。此模型已初步用于单条肽链的吸附过程研究,并展现出了其模拟多条肽链系统的潜力。因此,本研究使用这种计算方法对多条肽链的聚集和吸附过程进行探索。作为多蛋白质吸附系统的基础研究,本工作从一个相对简单的体系着手。计算体系的溶液中包含多条疏水的丙氨酸十二肽,以高度稳定的金表面作为吸附基底。通过分析每一条肽链的移动轨迹,对多条肽链的吸附机理进行深入探讨。
《2. 计算方法》
2. 计算方法
在本研究中,我们使用一种特殊的粗粒化晶格蒙特卡洛模型研究多条肽链在金表面的吸附过程。模型的细节可以参见参考文献[51]。在计算区域(7.5 nm × 7.5 nm× 7.5 nm)的x和y方向使用周期性边界条件。在z方向,固定不动的金颗粒和水颗粒分别填充在计算区域的底部和顶部1.2 nm的范围内,从而为系统提供固体表面和稳定的水相环境。计算中的粒子使用四归一的Martini粗粒化方法[42,43]。极化、带电和电中性的颗粒有着各自不同的带电位点[42,43]。每四个水分子粗粒化为一个带有等量异种电荷的极性电中性粗颗粒[41]。由于金的化学稳定性和已知的作用力参数,金表面在蛋白质/肽链的吸附机理研究中得到了广泛应用[23,30,40,63]。因此本工作也使用金表面作为研究对象,每个金原子为一个颗粒[62]。本研究中使用的线性肽链由12个在脊椎动物体内高含量的丙氨酸[64]组成(A–A–A–A–A–A–A–A–A–A–A–A)。根据Martini粗粒化法,丙氨酸残基被简化为一个P4类型的无侧链颗粒。粗粒化后的丙氨酸颗粒与水颗粒为同种粒子。十二个颗粒连接后成为一条线性肽链。这种简单的线性结构可以有效地加速多条肽链聚集与吸附的计算。
颗粒之间相互作用力的计算截止半径rcut-off 为1.2 nm。非键作用力包括从0.9 nm到1.2 nm平滑处理后的Lennard-Jones势能和从0到1.2 nm进行平滑处理后的电场能[23]。计算参数来自于Martini粗粒化力场,通过Lorentz-Berthelot混合法进行力场拓展[24,25,41–43]。粒子之间的键能替换为Bond-Fluctuation模型[37,65,66]。颗粒的移动接受概率取决于Metropolis算法基于移动前后能量变化计算得到的概率[37,40,65]。
构建计算系统的初始结构。固体金颗粒放置在计算区域的底部且其厚度大于计算截止半径[51]。金颗粒的位置在计算过程中固定不变。之后,预定数量的肽链以随机结构放置于距离表面2 nm之外的位置。在这个位置上,肽链无法和电中性的固体金表面或金表面上的两层聚集水层发生相互作用。值得一提的是,固体表面和水颗粒之间的相互作用是形成金表面聚集水层的主要原因。这两层水层的位置分别在距金表面0.375 nm和0.875 nm处[51]。将肽链溶解在水颗粒中,水颗粒个数适当调整,以确保金表面2 nm之外的水相对密度在298 K、1.01×105 Pa时为1。在初始系统平衡阶段,肽链的位置保持不变直到相隔25 MC步之间的系统能量差小于500 kJ·mol–1 。
在计算过程中,一些肽链会逐渐聚集,形成聚集体。定义两条肽链之间的距离为它们中最接近的两个颗粒间的距离。当三条肽链两两相距0.5 rcut-off = 6 Å之内时,此三条肽链即形成一个聚集体(图1)。依据这一准则,当一条新的肽链移动到一个聚集体的任意两条肽链的6 Å范围之内时,它即成为此聚集体的一员。由于此肽链的长线性结构,一条肽链可能是溶液中聚集体的一员的同时,也是吸附的聚集体的一员。因此,为了明确每条肽链的分类,在以上判定标准的基础上加了以下标准:只有当肽链吸附于表面时它才属于吸附的聚集体,否则此肽链属于溶液中游离的聚集体。
《图1》
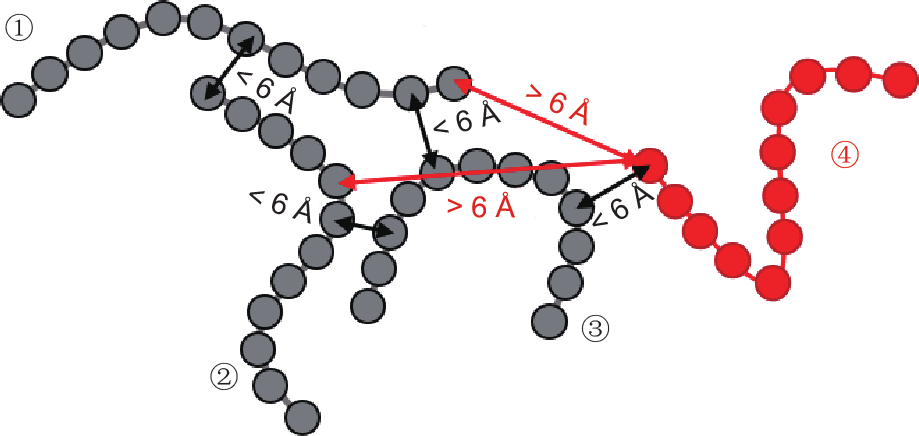
图1. 肽链聚集体(灰色)和单条肽链(红色)的定义图示。三条灰色肽链①、②、③之间的相互距离小于6 Å,因此它们属于一个聚集体。红色肽链④仅与肽链③之间的距离小于6 Å,因此它不属于此灰色聚集体。
从所有颗粒的移动轨迹中获取以下三种信息用于吸附和聚集过程的分析。
(1)肽链所有颗粒距固体表面的平均纵向距离。
(2)回转半径(radius of gyration, Rgyr )显示了所有颗粒相对于肽链/聚集体中心的聚集程度。较高的Rgyr值体现了较低的聚集程度。针对肽链的计算公式为Rgyr = ,针对聚集体的计算公式为
,针对聚集体的计算公式为 。公式中的
。公式中的 是颗粒
是颗粒 距离肽链或聚集体中心的距离;
距离肽链或聚集体中心的距离; 是颗粒j 距离肽链或聚集体中心的距离;N 是肽链内的颗粒数,丙氨酸十二肽的N 值为12;m 是聚集体中的肽链个数[67]。
是颗粒j 距离肽链或聚集体中心的距离;N 是肽链内的颗粒数,丙氨酸十二肽的N 值为12;m 是聚集体中的肽链个数[67]。
(3)每个颗粒受到环境施加的在z 方向上的分力[51]。肽链或聚集体所有颗粒在z方向受力的总和即为其在竖直方向上的总受力。其中包括了Lennard-Jones作用力和电场力。当此力为负值时,力的方向指向固体表面。当力为正值时,力的方向背向固体表面。
《3. 结果与讨论》
3. 结果与讨论
《3.1. 吸附和聚集过程的表征与分析》
3.1. 吸附和聚集过程的表征与分析
此节通过分析16条肽链的移动轨迹研究它们的吸附和聚集过程(图2)。第10号肽链首先吸附在金表面[图2(b)],之后第2, 16和第4号肽链分别实现吸附[图2(c)~(e)]。溶液中的其他肽链在第75 000 MC步之后逐渐分为两组,它们分别包括:①第1, 3, 7, 9, 12, 13和15号肽链(图2中以实心圆标号);②第5, 6, 8和14号肽链(图2中以空心圆标号)。组1在第270 000 MC步时形成了一个大的聚集体,组2的肽链虽然在第113 000 MC步时形成了一个聚集体,却由于分子的抖动,之后逐渐解散。
《图2》

图2. 16条肽链聚集与吸附过程中的代表性步骤图。(a)~(f)分别为第0, 75 000, 113 000, 175 000, 215 000, 270 000 MC步。图中标号的彩色线段代表了丙氨酸十二肽。在计算区域底部规则排列的黄色颗粒为金颗粒。可以与固体表面直接作用的水颗粒用蓝色显示。深蓝色颗粒显示了可以直接与金表面发生作用的水颗粒的最远位置。隐藏所有位于金表面1.20 nm范围之外的水颗粒。每个代表性步骤包含了计算区域的主视图、左视图和俯视图。
因此,通过对肽链在计算终点,即第270 000 MC步时的位置和构型分析,系统中的肽链可以分为以下三个类别[图2(f)]。
(1)由多条肽链组成的聚集体。此聚集体由7条肽链组成,包括第1, 3, 7, 9, 12, 13和第15号肽链(图 2中以实心圆标号)。
(2)吸附的单条肽链。包括第2, 4, 10和第16号肽链。
(3)溶液中的单条肽链。包括第5, 6, 8, 11和第14号肽链。
重复20次计算,每次时长为270 000 MC步,肽链在计算终点的构型分布总结为以下几类:溶液中的聚集体,31.3%;溶液中的单条肽链,33.4%;吸附的聚集体,15.3%;吸附的单条肽链,20.0%。
下文将分别对图2溶液中的聚集体,吸附的第10号肽链和独自在溶液中游离的第11号肽链进行分析。
3.1.1. 单条肽链的吸附过程
初始状态中,第10号链靠近第5号链[图2(a)]。从其移动过程可以看出(图3),它用7400 MC步离开表面之后再返回并向金表面移动[图3(a)]。虽然第10号链被距离表面0.875 nm的第二聚集水层物理阻隔了14 400 MC步,之后还被距离表面0.375 nm的第一聚集水层物理阻隔了8500 MC步,但它最后还是完成了在金表面的吸附。当它到达第二聚集水层时,只受到略微向下的引力[图3(c)]。当它在第75 000 MC步完全被吸附在金表面时,受到了明显向下的引力。在吸附过程中,因为一条肽链只包含了较少的颗粒数,因此它的回转半径没有明显的变化[图3(b)]。
《图3》
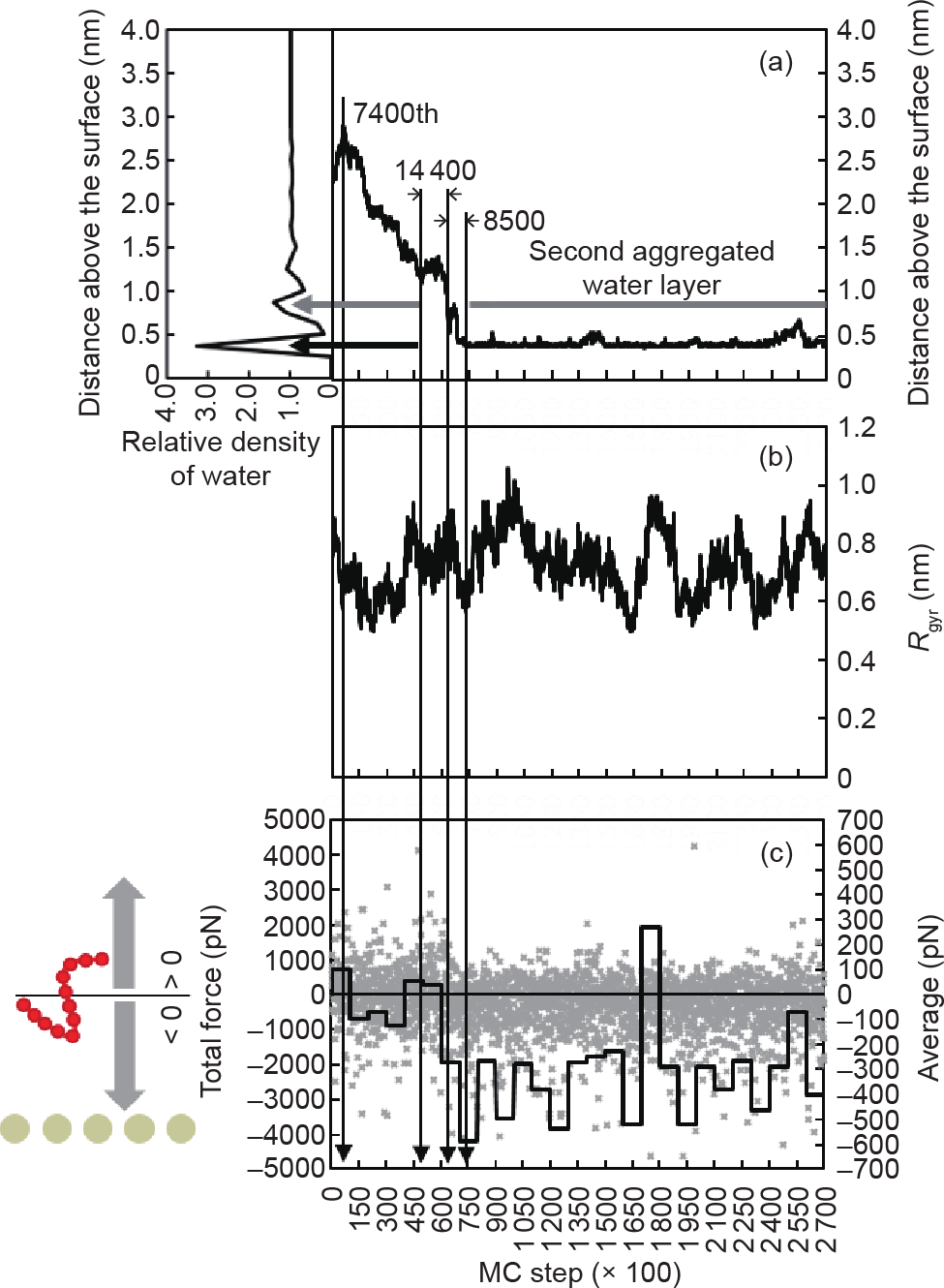
图3. 第10号肽链吸附过程中距离表面的平均距离(a)、回转半径(b)与纵向总受力(c)。(a)中黑色和灰色的横向箭头分别显示了第一和第二聚集水层的位置。(c)中灰点显示了吸附过程中的实时总受力,黑线显示了每10 000 MC步的平均总受力。其中负值说明力方向指向固体表面,正值说明力方向背向固体表面。
3.1.2. 溶液中的独立肽链
在计算的结尾,除了第5, 6, 8和14号链短暂地形成了聚集体后由于分子振动而松开,第11号链是溶液中唯一独立存在的单链,一直在溶液中振动[图2(f)]。在初始时,它位于肽链聚集区的外围[图2(a)]。随着时间的流逝,第11号链逐渐移动并与第1和第13号链形成聚集体[图2(b)、(c)]。然而,由于第3号链以一个更为合适的位置和构型靠近聚集体,第11号链被其取代并且离开,最终独自在溶液中游离[图2(e)]。
通过数值分析(图4),我们可以发现,第11号链在第62 000和第243 800 MC步先后两次尝试突破金表面的聚集水层[图4(a)]。在第一次尝试中,第11号链更靠近第1和第13号链。虽然它可以直接与聚集水层相互作用,但是它无法与作用力更强的金表面直接作用[图2(b)、图4(a)]。在下一次尝试前,第11号链在大约第160 000 MC步时移动至表面最远距离[图4(a)]。此时,肽链距金表面的平均距离为3 nm,远远位于两层聚集水层的作用范围之外。第11号链受到的纵向总力即将从排斥力转变为朝向表面的吸引力[图4(c)]。
《图4》
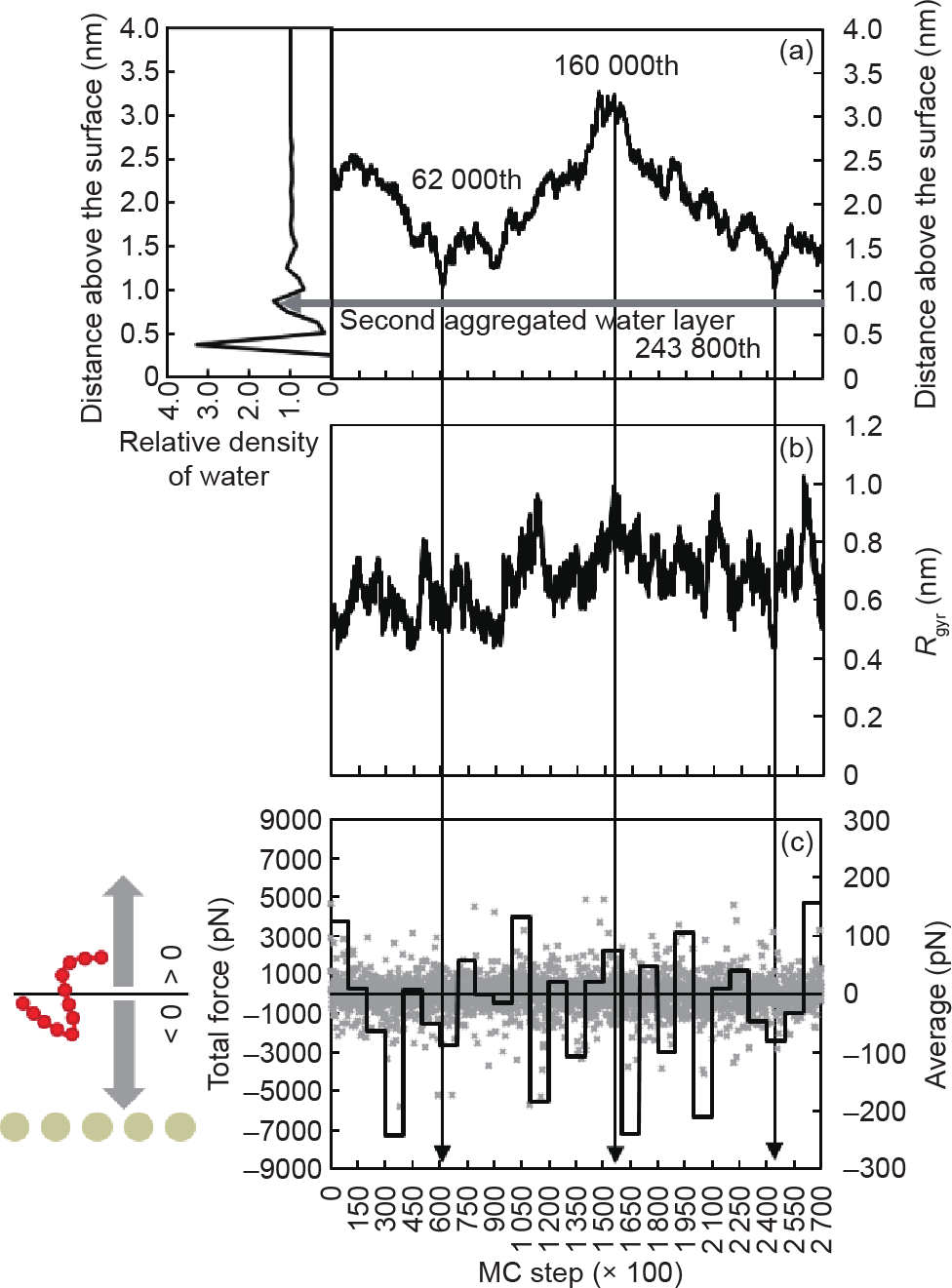
图4. 第11号链距离表面的平均距离(a)、回转半径(b)和纵向总受力(c)。(c)中,灰点显示了过程中的实时总受力,黑线显示了每10 000 MC步的平均总受力。负值表示其受力方向指向固体表面,正值表示其受力方向背向固体表面。
值得注意的是,此时第11号链同时也位于距离计算区域顶端的3 nm之外。因此,总力在第160 000 MC步时发生的改变并非由于计算体系的限制。这一向下的作用力可能来自于位于肽链下方的其他肽链对它产生的吸引作用。在第243 800 MC步,第11号肽链进行了第二次吸附尝试。此次尝试只花费了不到60 000 MC步[图4(a)]。经过短暂的尝试,肽链不足以调整至合适的构型去突破两层聚集水层的阻拦,因此最终无法到达表面。
由于单条丙氨酸十二肽的颗粒个数相对较少,图3(b)和图4(b)中单条肽链的回转半径不能显出明显的变化趋势。然而,这些数据可以与下一部分聚集体的回转半径进行比较。
3.1.3. 多肽链聚集体
在本研究中,三条肽链的任何部分互相位于对方0.5rcut-off 之内时,这三条肽链即生成一个聚集体(图1)。依此判定准则,在计算终点的第270 000 MC步,有一个由七条肽链聚集而成的聚集体形成[图2(f)]。本节将对这个聚集体的聚集过程加以详细分析。
图2显示了聚集体的形成过程。在初始状态,所有的肽链平均距离表面2.2 nm之外[图2(a)、图5(a)]。第1, 2, 7, 8, 9, 11, 12, 13和16号肽链之间的初始距离较近而第3和第15号肽链距它们较远[图2 (a)]。随后,第1,3, 8, 11和13号肽链相互靠近并聚集[图2(b)]。由于第8号和第11号肽链距离核心较远,它们之后逐渐脱离,而第1, 3与13号肽链形成一个小聚集体[图2(b)、(c)]。与此同时,第9, 12, 15和第16号链也形成了另一个较为稳定的小聚集体,第2和第7号链位于与它们相近的地方[图2(c)]。随着反应的进行,以上两个小聚集体和第7号肽链聚并为一个大的聚集体[图2(d)]。在聚集的过程中,第2和第16号肽链离开了聚集体并且成功地吸附在固体表面[图2(c)、(d)]。虽然聚集体中的第9号链的位置临近吸附在表面的第2和第16号链,这两条链对聚集体的吸引力不足以在有限的时间内将聚集体拉至固体表面[图2(e)、(f)]。
进一步对聚集体的移动轨迹加以量化分析。在第113 000 MC步之前,聚集体的回转半径Rgyr 逐渐从2.3 nm减少至1.7 nm [图5(b)]。回转半径在第48 900和第50 000 MC步的两次突增都是由于第3号肽链跨越计算区域边界所致[图2(a)~(c)]。在第113 000~130 900 MC步之间,回转半径Rgyr 的骤减预示着聚集体的生成[图2(c)、 (d)]。在此之后,整个聚集体以稳定的聚集程度(回转半径Rgyr 等于1.5 nm)略微远离表面。因为聚集体中有众多肽链颗粒,这一远离表面的移动不易在图5(a)中观察到。但可以从第225 000 MC步之后高概率的排斥力中推断得到[图5(c)]。
《图5》
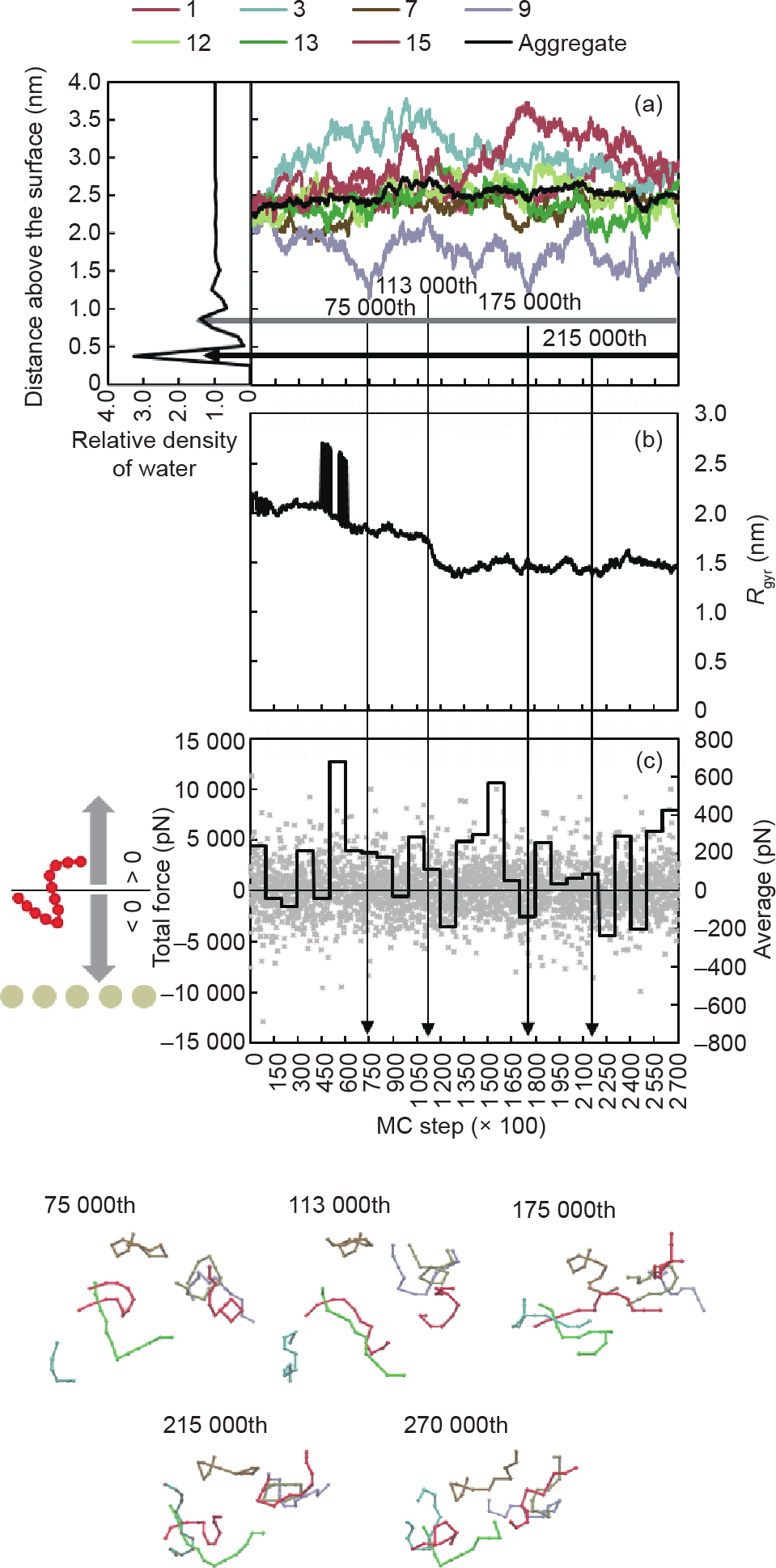
图5. 聚集体距离表面的平均距离(a)、回转半径(b)和纵向总受力(c)。(a)显示了聚集体中所有肽链的中心高度。黑色和灰色的横向箭头分别显示了第一和第二聚集水层的位置。(b)中,回转半径Rgyr在第45 000和60 000处的两次突增是由于第3号肽链跨越计算区域的边界所致。(c)中灰点显示了过程中的实时总受力,黑线显示了聚集体每10 000 MC步的平均总受力。负值显示聚集体受力指向固体表面,正值显示聚集体受力背向金表面。聚集体的聚合过程在图下方展示。
在整个聚集体的形成过程中,除了第3, 9和第15号肽链,聚集体内其他肽链距金表面的距离相对稳定。第3号肽链对于整个聚集体来说是新的加入者。它从第175 000 MC步开始受到了显著向下的作用力后[图5 (a)]才加入聚集体[图2(d)、(e)]。在此之后聚集体逐渐稳定[图5(b)]。第15号肽链位于聚集体的边缘,比起聚集体内的其他肽链,虽然它仍位于聚集体的作用范围内,但它有更高的可移动性。与此同时,第9号肽链位于聚集体的底部[图5(a)]。在它被临近的肽链吸离表面之前,经历了三次失败的吸附尝试。
与成功在表面吸附的第2和第16号肽链相比,吸附失败的第9号肽链体现出了环境对于吸附的影响。在初始阶段,第2, 9, 16号肽链都位于聚集体的底部[图2(b)]。第9号肽链以竖直的结构接触到表面[图2(b)]。由于这种竖直构象的质心过高,不利于肽链在短时间内实现吸附。相比于第9号肽链,第2号肽链的尝试开始得更晚。由于它的质心位置更低,它的两端可以很快地吸附在表面[图2(c)]。
对比单条肽链和单个聚集体的移动轨迹,单条肽链的移动速度明显快于聚集体[图3 (a)、图4 (a)、图5 (a)]。因此单条肽链有更多的机会穿透聚集水层,实现在表面的吸附[图3(a)、图4(a)]。图5(a)中无法观察到明显的大聚集体向表面移动的趋势。这一计算结果预示着金属表面的第一垢层很可能由单条肽链吸附而成,而非聚集体吸附而成。相似的结果在Jimenez等[17]的实验研究中也有报道。他们认为,经过一分钟的吸附,不锈钢表面均匀地覆盖了变形的β-乳球蛋白而非较大的蛋白质聚集体。值得注意的是,因为第一层吸附的物质能改变固-液界面的性质,所以对第一层吸附物质的了解是开发抗垢方法的基础。
至此,对单条肽链和多条肽链组成的聚集体的吸附和聚集过程已经进行了详细的对比。因为聚集体是蛋白质沉淀物的常态,聚集体的生成、移动和吸附机理会在下文中进一步讨论。
《3.2. 聚集体的生成机理》
3.2. 聚集体的生成机理
3.2.1. 溶液中聚集体的移动
正如前文提过,溶液中形成的聚集体会在回转半径Rgyr 降至最低值之后略微地远离表面[图5(a)、(b)]。但是这一现象在大聚集体的移动轨迹中不易观察到。为了更好地研究聚集体的移动,本节将对另一个四条肽链的体系进行计算与分析(图6和图7)。除了其初始状态只含有四条肽链,此处的计算环境和之前的十六条肽链的计算环境相同。从图7中可见,单独游离的肽链于第141 000 MC步时与另外三条肽链组成的小聚集体合并之后,大聚集体的回转半径Rgyr 达到了稳定的最小值[图7(b)]。这说明它们达到了最大的聚集程度。保持着稳定的1.00 nm的回转半径[图7(b)],聚集体有明显远离表面的移动[图6和图7(a)]。聚集体的总受力分析印证了这一移动趋势[图7(c)]。在第140 000 MC步之前,聚集体的平均受力在0 pN上下浮动,这意味着聚集体受到的吸引和排斥力基本相当。在140 000 MC步到240 000 MC步之间,总受力显出大比例的正值。而总受力在280 000 MC步之后显示出大比例的负值,使得聚集体停止了继续远离的移动[图7(a)、(c)]。
《图6》
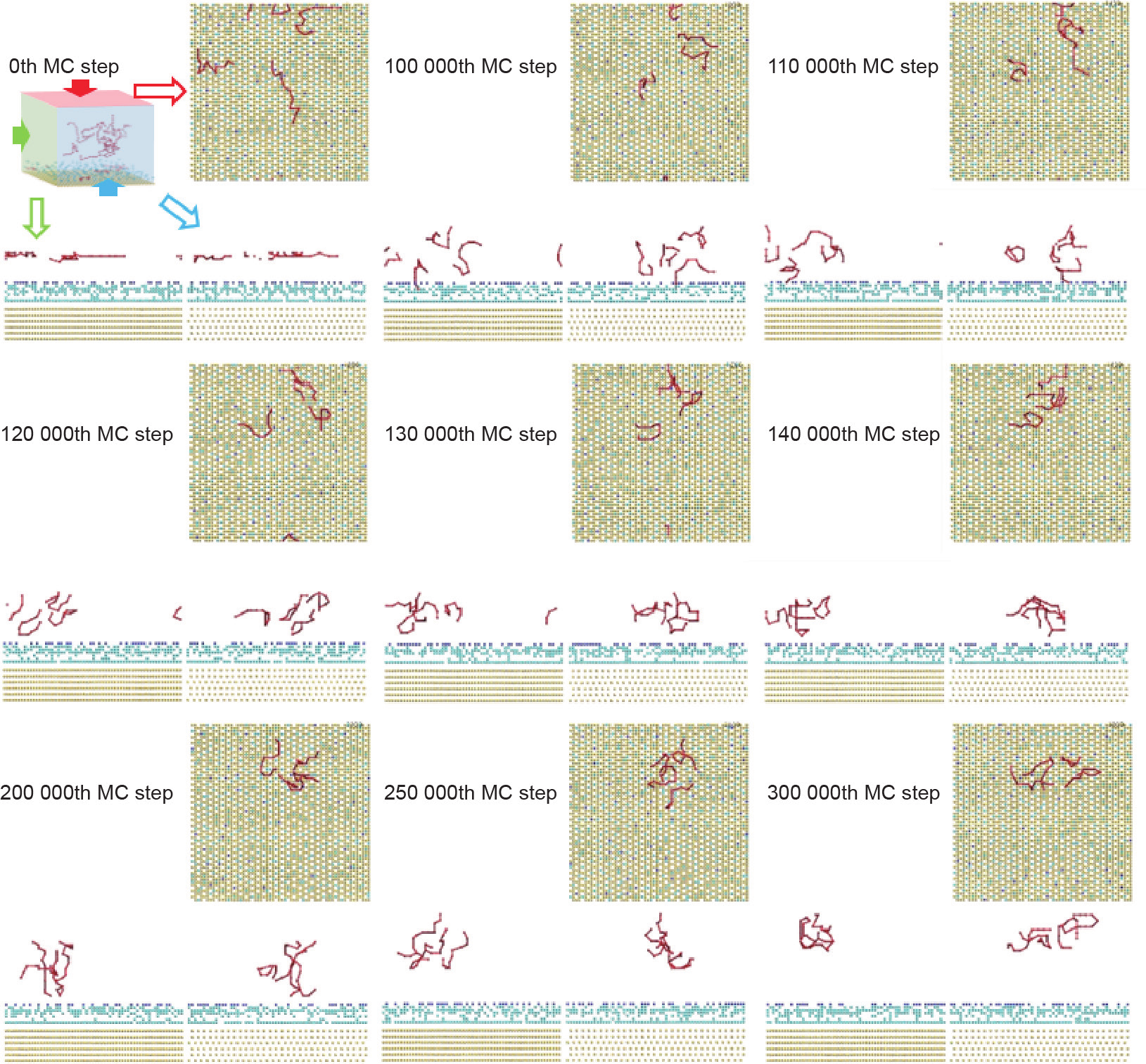
图6. 四条肽链的聚集过程。红线代表了丙氨酸十二肽。计算区域底部排列规律的黄色颗粒为金颗粒。可以与固体表面直接作用的水颗粒用蓝色显示。深蓝色颗粒显示了可以直接与金表面发生作用的水颗粒的最远位置。隐藏所有金表面1.2 nm之外的水颗粒。每一个代表步骤包含了计算区域的主视图、左视图与俯视图。
《图7》
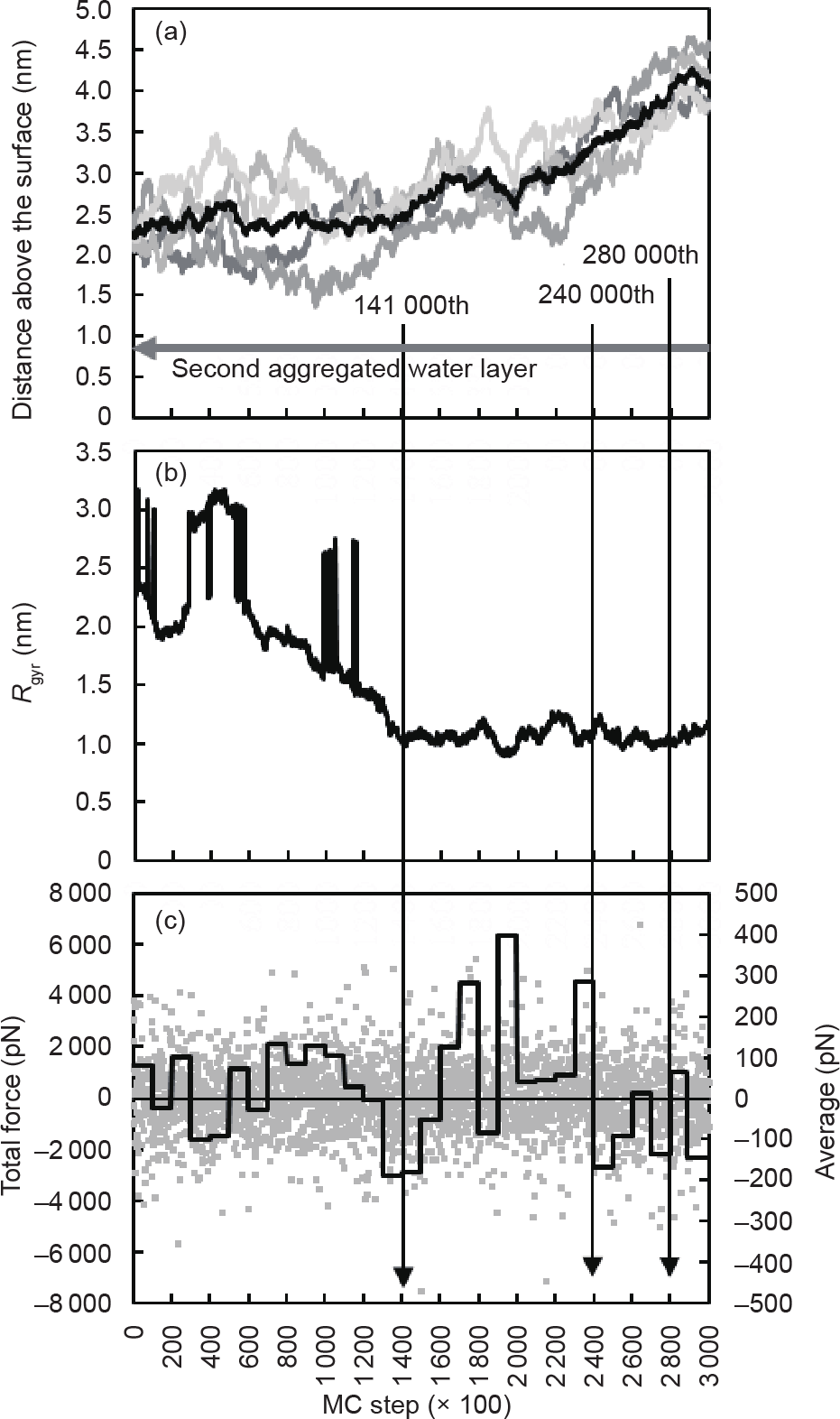
图7. 聚集体距离表面的平均距离(a)、回转半径(b)和纵向总受力(c)。(a)中各条肽链的中心高度以灰线显示,聚集体的中心高度以黑线显示。(b)中回转半径在第45 000到第60 000步之间的突增由肽链在移动过程中跨越计算区域边界造成。(c)中灰点显示了过程中的实时总受力,黑线显示了每10 000 MC步的平均总受力。负值表示其受力方向指向固体表面,正值表示其受力方向背向固体表面。
3.2.2. 吸附聚集体的形成过程
吸附的聚集体形成过程由此八条肽链进行说明(图8)。与之前的计算环境相同,在计算初始,所有肽链平均高度位于表面2.2 nm之外。之后,三条肽链分别在第34 500, 44 300和152 000 MC步被吸附在金表面(图8)。在第220 000 MC步之前,它们在金表面独自移动直至其中的两条在220 000 MC步时相互接触。两条肽链最终在第三条肽链加入时停止移动。与此同时,在距离表面一定高度的位置生成了溶液中的聚集体(聚集体在图8中用绿色突出)。这一现象在之前的十六条肽链和四条肽链的例子中已经分别加以讨论,此处不多加赘述。肽链在金表面的爬行阶段在其他的分子动力学计算结果中也偶见报道[30]。它也印证了实验中金属表面第一层为均匀的变性蛋白质的现象[17]。在单条肽链以相对更高的移动能力吸附在金表面之后,它们在固体表面继续爬行直至形成稳定的吸附聚集体。与在溶液中形成的稳定聚集体相比,固体表面吸附的聚集体由于是在固体的强吸引力下形成的,因此它有着相对更高的结构均一性。溶液中稳定的聚集体由于距表面较远,受到的吸引力弱,因此它们有着相对疏松的空间结构。
《图8》

图8. 吸附聚集体的形成过程。线段代表了丙氨酸十二肽。其中,红线代表吸附的肽链,灰线为独立游离的肽链。从第185 000到290 000 MC步的绿线突出了溶液中形成的聚集体。在计算区域底部规则排列的黄色颗粒为金颗粒。可以与固体表面直接作用的水颗粒用蓝色显示。深蓝色颗粒显示了可以直接与金表面发生作用的水颗粒的最远位置。隐藏所有金表面1.2 nm范围之外的水颗粒。每一个步骤包括了计算区域的主视图、左视图和俯视图。
《4. 结论》
4. 结论
本工作开发了多尺度的粗粒化模型用于研究多条肽链在与水有强相互作用的电中性金表面的聚集和吸附过程。通过量化分析,揭示了分子尺度的聚集和吸附机理。这些机理可以为将来研发更为有效的抗垢方法提供理论指导。本文结论如下(图9):
《图9》
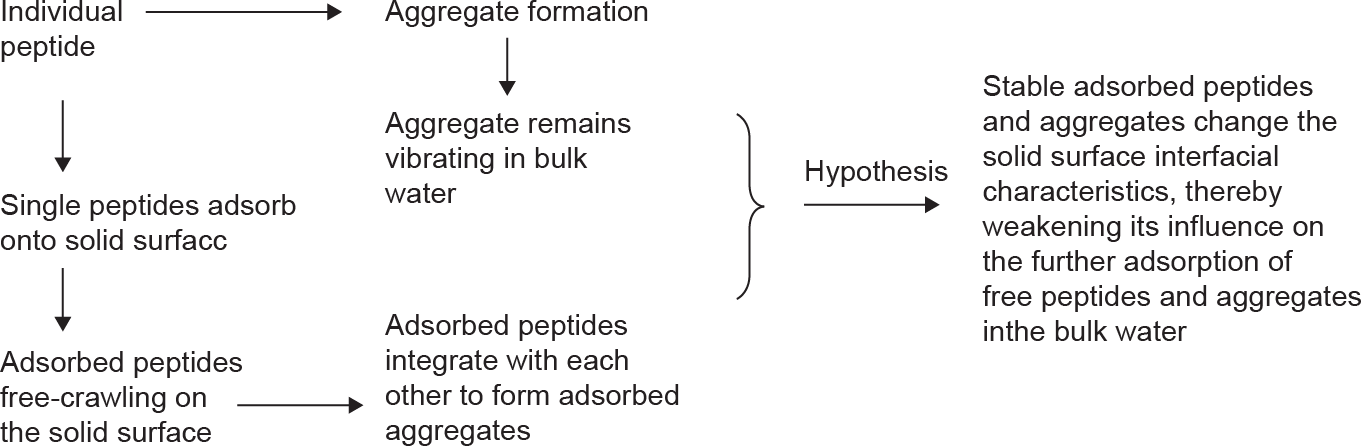
图9. 多肽链的聚集与吸附过程。
(1)对于单条肽链,它的移动性高于聚集体。它在吸附的过程中会被金表面的聚集水层阻挡。适当调整构型后才能实现在表面的吸附。
(2)溶液中由疏水肽链组成的聚集体会在聚集完成后趋向于离开金属表面。
(3)吸附的聚集体很有可能由单独吸附的肽链组成。单独吸附的肽链可以形成稳定的聚集体并且可能改变固体表面的界面特性,减弱原表面对溶液的影响,从而进一步影响其他肽链与聚集体的吸附。
多尺度粗粒化模型成功地对线性多肽链在金表面的聚集和吸附过程进行了模拟与分析。未来的深入研究可以包括对侧链、颗粒亲疏水性、溶液特性(如pH和离子强度)以及金以外的其他类型表面的探索。
《致谢》
致谢
感谢国家重点研发计划(政府间国际科技创新合作重点专项,中澳乳品未来技术联合研究中心,2016YFE0101200)、江苏省自然科学基金优青项目(BK20170062)、国家自然科学基金(21406148)和江苏省高校优势学科计划(PAPD)的资助。同时感谢江苏省双创计划以及江苏特聘教授计划的支持。作者亦十分感谢胡开元帮助文本润色。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Ruosang Qiu, Jie Xiao, and Xiao Dong Chen declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




