《1. 引言》
1. 引言
地下水处理厂污泥来源于反冲洗废水,沉积在滤池之中,成分复杂,其中含有铁氧化物絮体、破碎的滤料和其他矿物晶体[1]。通常情况下,一个日处理5 t废水的污水厂每天会产出约20 000 m3 的污泥[2]。污泥的颗粒微小,富含Fe/Mn氧化物[3]。长期以来,污泥一直被作为废弃物直接排放到深井和下水道,而其中的Fe/Mn氧化物也随之流入到附近的河域[4]。随着监管部门的治理,目前地下水处理厂污泥一般采用机械脱水或者无害化处理后再进行填埋处理。整个过程十分复杂且需要额外的成本[5]。
将污泥中Fe/Mn进行回收是一种处理方法,但需要向污泥中添加外源酸和Mn化学试剂,因而限制了该方法的应用[6,7]。近年来,污泥被直接应用于吸附磷酸盐和重金属,如Ni2+ [7]、Cu2+ 、Zn2+ 和Cd2+ [8]。但是将吸附后的污泥与水分离的过程十分烦琐,其中包括离心、混凝和过滤[4,8]。因此,将弱磁化污泥转化为磁性吸附剂是快速将污泥从水中分离出来的一种方法。
污泥中的铁氧化物可以通过添加木炭和FeS [9],或H2 [10]和CH4 [11]再经过600 ℃以上的焙烧后转化为磁铁矿。也可以通过简单的水热法,以乙二醇[3]或抗坏血酸[5]作为还原剂,在160 ℃下进行转化。通过还原剂的加入,污泥中的Fe3+ 还原溶解为Fe2+ ,然后再氧化形成磁铁矿或磁赤铁矿[3]。在不添加还原剂的情况下,Fe氧化物的还原溶解被中断[5,6],产物被弱磁化。
污泥废料合成的低成本吸附剂具有良好的磁响应[12],在废水处理中具有广阔的前景[13]。MA的表面官能团( ≡ Fe–O–H)对废水中的阳离子和阴离子污染物均表现出良好的吸附能力[14–16],尤其是对于重金属和带负电荷的胶体。此外,MA可用于碳和硅材料的合成[17,18],以增强使用后的磁分离性能[19,20]。
本研究报道了一种新的方法,该方法无需添加还原剂即可将污泥转化为MA。通过对带有正电荷的污染物四环素(TC)的吸附来评估吸附剂MA的吸附容量。
《2. 材料和方法》
2. 材料和方法
《2.1. 处理地下水处理厂铁泥》
2.1. 处理地下水处理厂铁泥
地下水处理厂污泥来自于中国吉林省磐石市污水处理厂。将污泥放在50 ℃真空干燥箱内过夜,然后按照Sandroni和Smith [21]的方法进行湿化处理。干燥的污泥主要成分是Fe(33.2%)、Si(6.2%)、Mn(4.9%)、Ca(2.1%)、Al(1.4%)、K(0.3%)和Mg(0.2%)。
《2.2. 磁性吸附剂的合成》
2.2. 磁性吸附剂的合成
以地下水处理厂污泥为原料合成磁性吸附剂(magnetic adsorbent, MA)。将1 g干燥的污泥溶解在盛有20mL去离子水的50 mL烧杯中,将烧杯放入超声清洗仪(KQ5200E,中国昆山舒美)超声分散5 min,然后加入10 mL NaOH溶液。之后以250 r·min–1 的转速搅拌5min,形成悬浊液移入50 mL 聚四氟乙烯反应釜中。反应釜在160 ℃程序升温箱内反应10 h并自然冷却至室温。收集反应釜内胆底部的沉积物并用去离子水洗涤5次,然后放在50 ℃真空干燥箱内过夜。按照上述方法进行对照实验,在对照实验中,NaOH溶液浓度的变化为0.6 mol·L–1 、1 mol·L–1 、2 mol·L–1 和4 mol·L–1 ,所制得的MA表示为“MAx ”(x表示NaOH浓度)。
《2.3. 吸附剂的表征》
2.3. 吸附剂的表征
使用X射线粉末衍射仪(X-ray powder diffraction, XRD; RAPID-S; Rigaku, Japan)分析了原始污泥和MA的晶型结构,其中 Cu Kα为激发源,扫描范围为 20°~50°。在室温下用透射Mössbauer光谱仪(MP500; Oxford, UK)研究了含铁污泥和MA中Fe氧化物的晶态。室温下利用磁学测量系统(SQUID-VSM; Quantum Design, USA)分析了含铁污泥和MA的磁性特征。通过X射线能谱仪(X-ray photoelectron spectrometry, XPS; VG-ADES, UK)和Mg Kα辐射检测污泥和MA表面上Mn的价态。通过场发射扫描电子显微镜(scanning electron microscopy, SEM; FEI Co., USA)表征污泥和MA的表面形貌 。
《2.4. 滴定实验》
2.4. 滴定实验
使用自动电位滴定仪检测MA的总表面电位浓度(ZDJ-4A,中国雷磁)[5]。首先,将0.2 g干燥的MA样品溶解在50 mL去离子水中,然后使用N2 曝气去除水中的O2 和CO2 。然后,使用0.2 mol·L–1 的HCl将溶液滴定至pH = 3,使用0.2 mol·L–1 的NaOH将溶液滴定至pH =11。在没有添加MA的情况下,对空白溶液进行同样的滴定实验。在滴定过程中,金属间发生了以下反应,阳离子和H + 被吸附在MA的表面位置上[22]。

式中,≡SO– 是表面位,如≡FeO– 、≡SiO– 和≡AlO– ;Me是金属阳离子,如Na+ 、Mg2+ 和Ca2+ 。MA的Hs 由原位Gran图确定。首先,Gran函数值(G)通过以下计算获得:

式中,V0 、V1 和V2 分别是初始溶液、加入的HCl溶液和加入的NaOH溶液的体积(mL)。在4个公式中,公式(2)表示NaOH消耗的体积,通过绘制Gran图,从G 值与NaOH体积的线性部分的交点计算出点Veb1 和Veb2 。
使用以下等式计算MA的Hs (mmol·g–1 ):

式中,CNaOH 为NaOH浓度(mol·L–1 );m1 为MA的用量(g)。
《2.5. 批量吸附实验》
2.5. 批量吸附实验
在制备的4种MA中,MA2表现出最佳饱和磁化强度(8.15 emu·g–1 , 1 emu=10–3 A·m–2 )和Hs(0.75 mmol·g–1 ),故用其作为吸附TC的吸附剂。首先在pH为3~11下进行吸附实验,检测溶液的pH值对MA2吸附TC速率的影响。制备浓度为30 mg·L–1 的TC储备溶液,并用5% HCl或5% NaOH调节溶液的pH。将储备液与0.2 g MA2混合在50 mL锥形烧瓶中。将锥形烧瓶用封口膜密封并放入恒温摇床(THZ-98A,中国一恒)中室温下以150 r·min–1下震荡。30 h后,从振荡器中使用磁铁将MA2与溶液进行分离。使用pH计(E-201-C,中国雷磁)测定上清液的最终pH,使用高效液相色谱仪(LC-16, Shimazu, Japan)结合C18分析柱(4.6 mm×150 mm,5 μm粒度)检测上清液中TC的浓度。流动相为0.1%磷酸和甲醇的混合液,其体积比为60 ∶ 40。检测波长为268 nm,检测时间为5 min。吸附量(qe , mg·g–1 )计算公式如下:

式中,C0 和Ce 是初始浓度和平衡浓度(mg·L–1 );V 是溶液体积(L);m2 是MA2剂量(g)。
在pH = 5、TC浓度为30 mg·L–1 的条件下,对MA2吸附TC的吸附动力学进行了研究。等温吸附实验在pH = 5时,TC的浓度为0~2000 mg·L–1 ,平衡时间为30 h下进行研究。本研究中的所有吸附实验都进行三次,吸附数据选取平均值。
《3. 结果和讨论》
3. 结果和讨论
《3.1. Fe 氧化物的相变》
3.1. Fe 氧化物的相变
采用Mössbauer和XRD证明了经水热处理后污泥中Fe氧化物的相变。如图1所示,污泥的XRD曲线在2θ= 33.1°呈现弱峰,属于赤铁矿(JCPDS No. 33-0664)。污泥的Mössbauer [图2(a)]显示出了强烈的双峰和较弱的六重峰。该二重峰显示出0.26 mm·s–1 的异构体位移(isomer shift, IS),并表现出0.71 mm·s–1 的四极分裂(quadrupole splitting, QS),其归因于水铁矿。而IS= 0.41 mm·s–1 ,QS = 0.36 mm·s–1 的六线谱拟合峰属于赤铁矿。在计算了次谱的相对面积后,计算出污泥中Fe氧化物中的水铁矿的含量约为91.2%(Supplementary data, Table S1),表明水铁矿在污泥中占主导地位。
《图1》

图1. 污泥、MA0.6、MA1、MA2和MA4的晶型(XRD)。
随着NaOH的加入,赤铁矿的衍射峰变得尖锐,MA 0.6曲线在2θ = 35.6°时出现一个新的峰,属于磁赤铁矿(JCPDS No. 39-1346)。MA0.6的Mössbauer中观察到三个谱图[图2(b)],其中两个分别属于水铁矿和赤铁矿,第三个则为一个新的谱图其IS = 0.32 mm·s–1 ,QS= 0.23 mm·s–1 ,属于磁赤铁矿。
随着NaOH浓度从0.6 mol·L–1 升高到4 mol·L–1 ,赤铁矿和磁赤铁矿的衍射峰(图1)增强。此外,赤铁矿的百分比从9.3%增加到17%,磁赤铁矿的百分比从2.1%增加到13.3%(Supplementary data, Table S1),而水铁矿百分比则从88.6%稳步下降至69.7%。这个现象表明,污泥中的水铁矿转变为磁赤铁矿和赤铁矿。当温度高于150 ℃时,水铁矿迅速转化为赤铁矿[23],但在Si、Al和P等杂质存在时转化的速率会降低[23,24]。Liu等[25]报道了磷与铁比在0.03时的磷酸铁水合物的产物,在150 ℃下反应120天后产物是磁赤铁矿,以及赤铁矿和残留的水铁矿的混合物。通过Mössbauer谱也确定了含有三种Fe氧化物的混合物MA(图2)。Sidhu [26]报道,在500 ℃下经过3 h,磁赤铁矿可以完全转化为赤铁矿,当有杂质(如Si和Al)存在时则需要更长的加热时间。因此,在污泥中,水铁矿向赤铁矿的转化是两步法,磁赤铁矿是中间体。
《图2》

图2. Mössbauer谱。(a)污泥; (b)MA0.6; (c)MA1; (d)MA2; (e)MA4。
随着NaOH浓度的升高,水铁矿的转化速率得到明显的提升。随着NaOH的加入,污泥中Si/Al氧化物发生了溶解。如图1所示,铁泥中结晶良好的Si/Al氧化物是石英和钠长石,随着NaOH浓度增加到4 mol·L–1 ,衍射峰逐渐消失,这种现象表明Si/Al氧化物进行了溶解。污泥中的Si/Fe和Al/Fe比例分别为0.37和0.09,而在MA4中分别降至0.17和0.04(图3)。由此可见,水铁矿MA4的转化效果最好(图2和Table S1)。同时这种现象证明污泥中Si/Al杂质的损失促进了水铁矿的转化。污泥中含有丰富的水铁矿,水铁矿以四面体的配位的形式存在(即铁离子由6个氧/羟基配位)[27]。羟基在高pH下脱羟基后表现出配位不饱和,从而水铁矿颗粒与大的赤铁矿颗聚集起到连接的作用[28]。然而,污泥中的杂质,如Si和Al与不饱和配位点结合形成Fe–O–M(M代表Si和Al)表面层,它阻断了小水铁矿颗粒的连接并抑制了水铁矿转化[29]。当在水热过程中引入NaOH时,不饱和配位点上的 [28,30,31]和
[28,30,31]和 的中的Si/Al物质被OH– 通过离子交换取代[32]。这一现象导致了MA中Si/Fe和Al/Fe的比例较低,促进了水铁矿的转化。
的中的Si/Al物质被OH– 通过离子交换取代[32]。这一现象导致了MA中Si/Fe和Al/Fe的比例较低,促进了水铁矿的转化。
污泥中的Mn含量低于Si,可以与水铁矿不饱和配位点形成Fe–O–Mn。与Si/Fe和Al/Fe的比例不同,污泥中的Mn/Fe比例为0.16,在水热处理前后保持不变(图3),这是由于锰在高pH条件下不溶解所致。通过XPS对污泥MA中Mn的价态进行了表征。如图4所示,污泥的光谱在641.5 eV处有一个不对称峰(峰A)Mn 2p3/2,在646.3 eV处有一个弱峰(峰B),分别与MnO2 [33]中的Mn4+ 和Mn–O [34]键中的Mn2+ 匹配良好。当NaOH浓度升高到1 mol·L–1 时,峰B消失,表明Mn2+被液相中的溶解氧氧化[35]。在Mn2+ 氧化过程中,水铁矿中的Fe3+ 作为电子转运体,接受Mn2+ 的电子并将其转移到O2 [36]。水铁矿在这一阶段发生还原性溶解和再结晶,从而导致磁赤铁矿和赤铁矿的形成。
《图3》
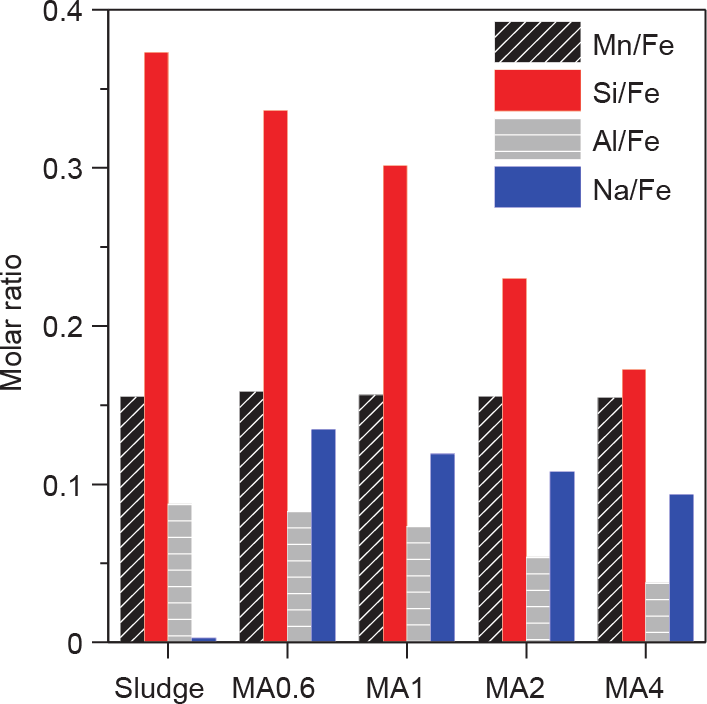
图3. 污泥和MA中Mn、Si、Al和Na与Fe的摩尔比。
《图4》

图4. 铁泥和MAs的高分辨率Mn 2p XPS光谱。
《3.2. 磁分离》
3.2. 磁分离
MA中磁赤铁矿所占的百分比随着磁性的变化而改变。如图5所示,由于缺少磁赤铁矿而表现出弱的磁响应,由水铁矿向磁赤铁矿转化,在水热处理后污泥的磁化强度表现出来。当NaOH浓度从0.6 mol·L–1 升高到4 mol·L–1 时,MA的饱和磁化强度从MA0.6的0.43 emu·g–1上升到MA1的1.1 emu·g–1,MA2为8.2 emu·g–1 ,MA4为10.9 emu·g–1 。该增长与磁赤铁矿百分比的增长一致,如图2和补充材料中的Table S1所示。
《图5》

图5. 污泥、MA0.6、MA1、MA2、MA4的磁滞曲线。H:磁场强度。1 Oe = 79.5775 A·m–1 。
《3.3. 形态学》
3.3. 形态学
图6显示了污泥和MA的SEM图像。 污泥是由直径为200~500 nm的小颗粒覆盖的非晶态聚体组成。经过水热处理后,MA表面变得粗糙[图6(b)、(c)],这是由于Si/Al氧化物随着pH值的升高发生了溶解。
《图6》

图6. 污泥(a)、MA1(b)和MA2(c)的SEM图像。
《3.4. 吸附》
3.4. 吸附
吸附剂表面的表面官能团是决定吸附剂吸附容量的重要因素,可通过Hs 原位颗粒图测量。如图7所示,当NaOH浓度升高时,MA样品Hs 的值:MA0.6下降到1.03 mmol·g–1 ,MA1下降到0.96 mmol·g–1 ,MA2下降到0.75 mmol·g–1 ,MA4下降到0.51 mmol·g–1 。这种下降趋势与MA中的水铁矿百分比相似。MA的官能团作为配位点能使Mg2+ 、Ca2+ 和Na+ 等阳离子配位。在水热过程中,Na+ 被整合到配位位点,但随着NaOH浓度的升高,Na/Fe的摩尔比从MA0.6的0.13降至MA2的0.11,MA4降为0.09(图3)。这种下降与Hs 和水铁矿百分比的下降一致。铁矿在污泥中占主导地位,平均配位数为5.4,高于具有高结晶度的Fe氧化物(如赤铁矿)[28]。因此,水铁矿的相变表明MA样品的Hs 值降低。Sajih等[37]报道在水铁矿转变为针铁矿和赤铁矿后,新的水铁矿颗粒对镭的吸附从100%降低至约20%。MA2的Hs 为0.75 mmol·g–1 ,饱和磁化强度为8.2 emu·g–1 。因此,该方法是一种理想的有效吸附方法,其次可以进行高效的磁性分离。
《图7》

图7. MA0.6、MA1、MA2、MA4的格兰图。
以TC为目标污染物,对MA2的吸附性能进行了研究。初始pH对MA2吸附TC的影响如图8所示。对于TC而言,当初始pH值为3~9时,MA2的qe 约为13 mg·g–1 ,而在初始pH为11时,qe 下降至5.2 mg·g–1 。可见qe 的下降与吸附TC后的最终pH值有关。在初始pH值为9,最终pH值低于7.4时,TC为阳离子形式,这是由于酚二酮基失去质子所致[38]。阳离子TC与MA2表面配位点相结合,并且与配位阳离子(如Na+ )之间发生交换反应[39]从而导致TC的去除率较高。当初始pH增加到11,终止pH增加到8.5时,这种情况下,TC表现为一价阴离子,因为其失去了来自三羰基系统和酚基二酮基[38]的质子。因此,MA2表面上的阳离子交换反应被中断,从而导致TC的去除率降低。
《图8》

图8. 在初始pH值为3~11时TC的吸附情况和最终pH值。
使用伪一级模型和伪二级模型模拟TC在MA2上的吸附[图9(a)、(b)]。伪一级动力学模型的方程列举如下:

式中,qe 和qt 分别是TC在平衡和任何瞬时时刻t 的吸附容量(mg·g–1 );k1 是伪一阶模型的速率常数(L·h–1 )。伪二级动力学方程表示如下:

式中,k2 是伪二阶模型的速率常数(×10–3 g·mg–1 ·h–1 )。
《图9》

图9. 吸附TC的三种动力学模型的线性图。(a)拟一阶动力学模型; (b)拟二阶动力学模型; (c)颗粒内扩散模型(TC的初始浓度为30 mg·L–1 ,MA2的剂量为0.01 g,初始pH为5)。
根据每个线性图的斜率和截距计算动力学参数,如表1所示。qe 的实验值与伪二阶模型的计算值非常一致,但与伪一阶模型计算值不吻合。吸附数据与伪二阶模型拟合较好,相似度(R 2 )为0.998。这种现象表明TC和MA2之间为电子交换,两者发生的是化学吸附[40]。因此,MA2吸附TC主要受化学反应吸附控制。
《表1》
表1 伪一阶和二阶动力学模型及颗粒内扩散模型参数(TC的初始浓度为30 mg·L–1 ,MA2的剂量为0.01 g,初始pH为5)

R 2 is the regression coefficient.
引入Weber的颗粒内扩散模型来分析吸附数据,以确定哪种扩散是吸附过程中的决定步骤。Weber的模型表达如式(9)所示:

式中,k3 为颗粒内扩散速率常数(mg·g–1 ·h–1/2 );C为吸附的临界层效应。
如图9(c)所示,qe 对t 0.5 的曲线由初始部分和第二部分组成。第一部分为粒内扩散控制的逐渐吸附阶段,第二部分对应最终平衡阶段,此时由于溶液中TC浓度极低,粒内扩散开始减慢[41,42]。第一部分未通过零点,这表明颗粒内扩散是速率控制步骤。
MA2吸附TC的吸附等温线如图10(a)所示。采用Langmuir [式(10)]和Freundlich方程[式(11)]对吸附数据进行分析。

式中,qm 为最大吸附容量(mg·g–1 );KL 为Langmuir 常量(L·mg–1 );KF 为Freundlich常量(mg1–1/n ·L1/n ·g–1 ,n与吸附强度有关)。
表2列出了Langmuir和Freundlich模型的参数。吸附数据与Langmuir模型拟合良好,回归系数值(R 2 )为0.996,高于Freundlich模型。这表明MA2吸附TC为单层吸附[43,44]。MA2对TC的最大吸附量为362.3 mg·g–1 ,低于昂贵的碳材料[45],高于其他合成的MAs(表3)[45–53],如磁性聚丙烯腈纳米纤维[46]、磁性树脂[47]和高岭土/ CoFe2O4 复合材料[48]。因此,MA2吸附TC具有很大的潜力。从MA2解吸的Na+ 的量与MA2吸附TC的量呈正相关[图10(b)],证实阳离子交换是MA吸附TC的主要机制。
《图10》

图10. (a)TC在MA2上的吸附等温线; (b)受TC吸附影响的Na+ 解吸量(MA2的剂量为0.01 g,初始pH为5)。
《表2》
表2 等温线模型参数及回归系数(MA2的剂量为0.01 g,初始pH为5)

《表3》
表3 TC对MA2的吸附能力与其他吸附剂的比较

《3.5. 环境应用》
3.5. 环境应用
通过对地下水污泥的处理,开发了一种简便的水热法合成MA的方法,但该方法不适用于赤泥。污泥中弱结晶的水铁矿转变为结晶良好的磁赤铁矿,所制备的吸附剂具有良好的磁响应。与污泥相比,赤泥中仅富含结晶良好的赤铁矿和钙铁榴石[10],这需要通过添加还原剂并形成磁性物质来还原溶解[11]。非还原性的MA制备方法可以节省污泥的处置成本。MA对TC和其他阳离子污染物表现出理想的吸附能力[54,55],并且在碱性条件下再生后可重复使用[56]。在五个周期结束时,TC的去除率为60.9%,略低于第一轮的63.2%。这些优点表明,制备的MA在环境污染控制中具有潜在的应用价值。
《4. 结语》
4. 结语
地下污泥是包含水铁矿和其他杂质的混合物,如Si、Al和Mn。通过添加NaOH后简单的水热法将污泥转化为MA。用碱性水热处理,经三步反应生成MA:污泥中的Si/Al氧化物溶解到液体中;水铁矿和溶解氧在催化作用下氧化残留的Mn2+ ;促进水铁矿向磁赤铁矿和赤铁矿的相变。当NaOH浓度为2 mol·L–1 时,合成完美的MA是MA2,MA2的饱和磁化强度为8.2 emu·g–1 ,对TC最大吸附容量为362.3 mg·g–1 。阳离子交换是MA2吸附TC的主要机制。这些优点表明,MA2是一种很有前景的去除废水中TC的吸附剂。
《致谢》
致谢
本工作得到了国家自然科学基金(51578118, 51678273, 51878134, 51878133)、中央高校基本科研基金(2412017QD021)和吉林省科技计划(20190303001SF)的支持。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Zhan Qu, Yaqiong Wu, Suiyi Zhu, Yang Yu, Mingxin Huo, Leilei Zhang, Jiakuan Yang, Dejun Bian, and Yi Wang declare that they have no conflicts of interest or financial conflicts to disclose.
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2019.06.001.














 京公网安备 11010502051620号
京公网安备 11010502051620号




