《1. 引言》
1. 引言
由于非法药物对水生生物和生态系统的毒性作用,它们逐渐成为令人关注的新兴污染物。据报道,它们存在于各种环境中,包括地表水[1–4]、饮用水[5–9]、地下水[10–12]、水生生物(鱼类或其他)[13–15]和污水污泥[16–20]。然而,关于它们可能存在于生物固体中的信息却非常少[21,22]。这里的“生物固体”是指通过废水处理厂(wastewater treatment plant, WWTP)处理后的污泥产物[23]。
在全球范围内,使用活性污泥类型工艺的二级废水处理率不断提高,导致了污泥和生物固体产量的增加。最近,全球生物固体生产率近似于每年2.5×107 ~6.0×107 t 干固体[24],其中大部分被用于土壤[25]。澳大利亚和新西兰生物固体合作伙伴关系(Australian and New Zealand Biosolids Partnership, ANZBP)[26]报道,2017年澳大利亚生产了约3.3×105 t干燥生物固体,其中75%用于农业,与美国和欧盟农业应用(约占45%)相比[25],占比相对较高。由于生物固体中含有丰富的养分,因此将其作为肥料进行土地利用是可持续的土壤养分管理和碳汇的一个很好的选择[27,28]。除了其农业养分和其他改良土壤的成分外,生物固体中还包含许多令人关注的污染物,特别是持久性有机污染物,包括药物[11,21,29]、农药、多氯联苯(polychlorinated biphenyl, PCB)或多环芳烃(polycyclic aromatic hydrocarbon, PAH)[30–33],以及(可能有)非法药物残留。有证据表明,某些滥用药物可能对水生生物群有毒,而关于其对陆生生物群潜在影响的研究却少之又少。例如,Parolini等[34]检测了斑马贻贝暴露于混合滥用药物(可卡因、苯丙胺和吗啡)后的氧化状态,并报道了抗氧化剂活性的显著增加对贻贝的健康构成了潜在威胁。
辛醇-水分配系数lgΚOW 值高(> 4)到中等(2.5~4)的疏水性化合物具有相对较高的吸附势,因此更可能在固体和污泥馏分中积聚[35,36]。相反,lgΚOW 值(< 2.5)较低的化合物具有相对较低的吸附势,更有可能保留在水相中[35]。在废水固体处理过程中未能有效清除的化合物可通过生物固体再利用项目被运输到环境中,通过植物和农作物的吸收,它们可能会进入食物链。例如,过去的研究表明,在富含生物固体的土壤中生长的农作物(如白菜、生菜和菠菜)对某些抗生素的吸收会增加[37–39]。因此,描述和了解生物固体中其他药物污染物(包括滥用药物)的水平十分重要。
有几篇已发表的文章详细介绍了在废水环境中滥用药物的情况[40–42]。然而,迄今为止,相关滥用药物在生物固体中存在情况的国际数据有限,且几乎没有关于澳大利亚的数据。例如,Govindarasu [43]从澳大利亚废水处理厂的污泥中检测到了甲基苯丙胺(2 μg·kg–1 ),而Jones-Lepp和Stevens [21]报道了美国生物固体中相近的甲基苯丙胺水平(4 μg·kg–1 )。几项研究都报道了来自美国(未检出到约328 μg·kg–1 )[23,44,45]和加拿大(2.9~110 μg·kg–1 )[46–48]的生物固体中可待因的存在情况。生物固体数据的可用性有限很可能是由于污水流行病学作为一个研究领域而出现的,这也反映了一个事实:该研究大部分集中在原废水分析上,目的是为估计人口药物消耗率[40],而不是了解废水处理厂处理过程中的药物去除和分配。
因此,本研究的目的是调查澳大利亚污泥和生物固体中几种滥用药物的存在情况。选择甲基苯丙胺和3,4-亚甲二氧基甲基苯丙胺(3,4-methylenedioxy meth-amphetamine, MDMA)作为非法兴奋剂的例子,可待因和吗啡作为具有潜在环境风险的药物,并选择苯甲酰爱康宁作为可卡因消费量的指示剂(即代谢产物)(图1)。本研究针对的化合物是根据澳大利亚以前的研究工作选择的,该研究表明这些药物在废水(进水和出水)中的浓度相对较高,并指出其中某些化合物有潜在的环境风险[40,49]。因此,本研究的目的是寻找一种方法来确定特定的滥用药物在生物固体中的存在情况,并研究污泥或生物固体处理过程不同阶段中这些药物的水平。
《图1》
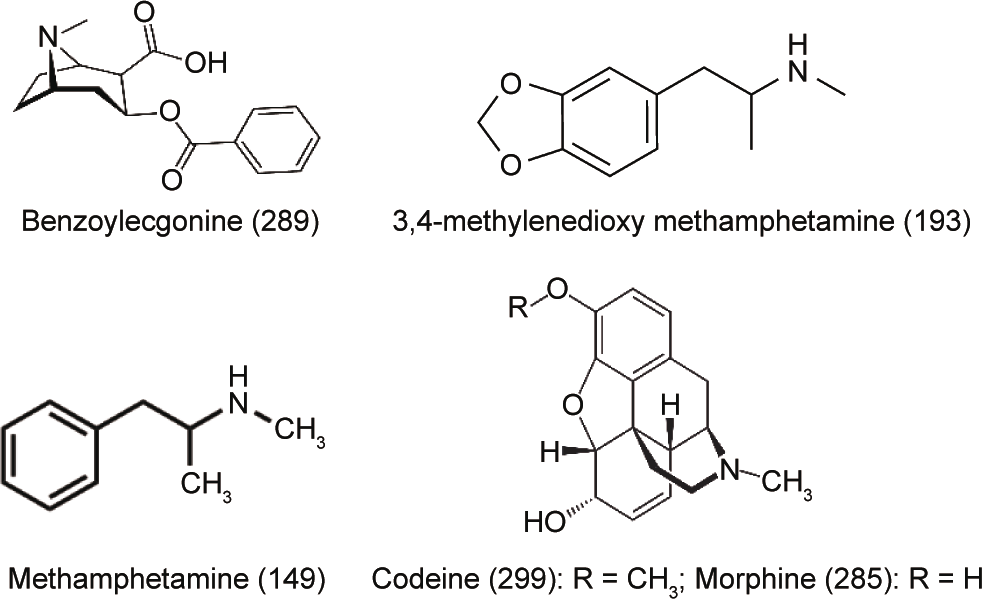
图1. 从PubChem化合物数据库获得的目标化合物的结构[包括分子质量(g·mol–1 )]。
《2. 材料和方法》
2. 材料和方法
《2.1. 化学品和试剂》
2.1. 化学品和试剂
每种药物的参考标准品和氘代内标产品均购自美国Cerilliant公司。甲醇、甲酸、二氯甲烷和异丙醇购自澳大利亚Merck公司,而乙酸购自美国Spectrum Chemical 公司,氨气购自澳大利亚Optigen Ingredients公司。超纯水是从arium ® pro VF净水装置(德国Sartorius Stedim Biotech GmbH公司)购得。固相萃取(solid-phase extraction, SPE)柱(UCTTM XRDAH;每6 mL 500 mg)购自澳大利亚PM Separations公司。
《2.2. 研究地点和样品收集》
2.2. 研究地点和样品收集
污泥样品是从澳大利亚的一家处理厂收集的(图2提供了采样位置)。该处理厂为大约7×105 人服务,平均废水流量为150 ML·d–1 。该厂采用常规的活性污泥反应器工艺运行,该工艺包括串联的厌氧、好氧和缺氧区域。初沉污泥采用重力法浓缩,而剩余活性污泥(waste-activated sludge, WAS)通过溶气气浮法浓缩,然后将合并的污泥进行中温厌氧消化,固体保留时间为18 d。消化后的部分污泥进一步通过离心机进行机械脱水,而大部分污泥则在污泥稳定塘中脱水。在1.5~3年内将填满污泥稳定塘,然后将沉淀的固体干燥并储存至少3年(即本研究中采样的储存3年的生物固体样本源于2012—2014年进入污水处理厂的废水)。然后,将A级质量的生物固体产物作为土壤补充剂广泛应用于农业。
《图2》
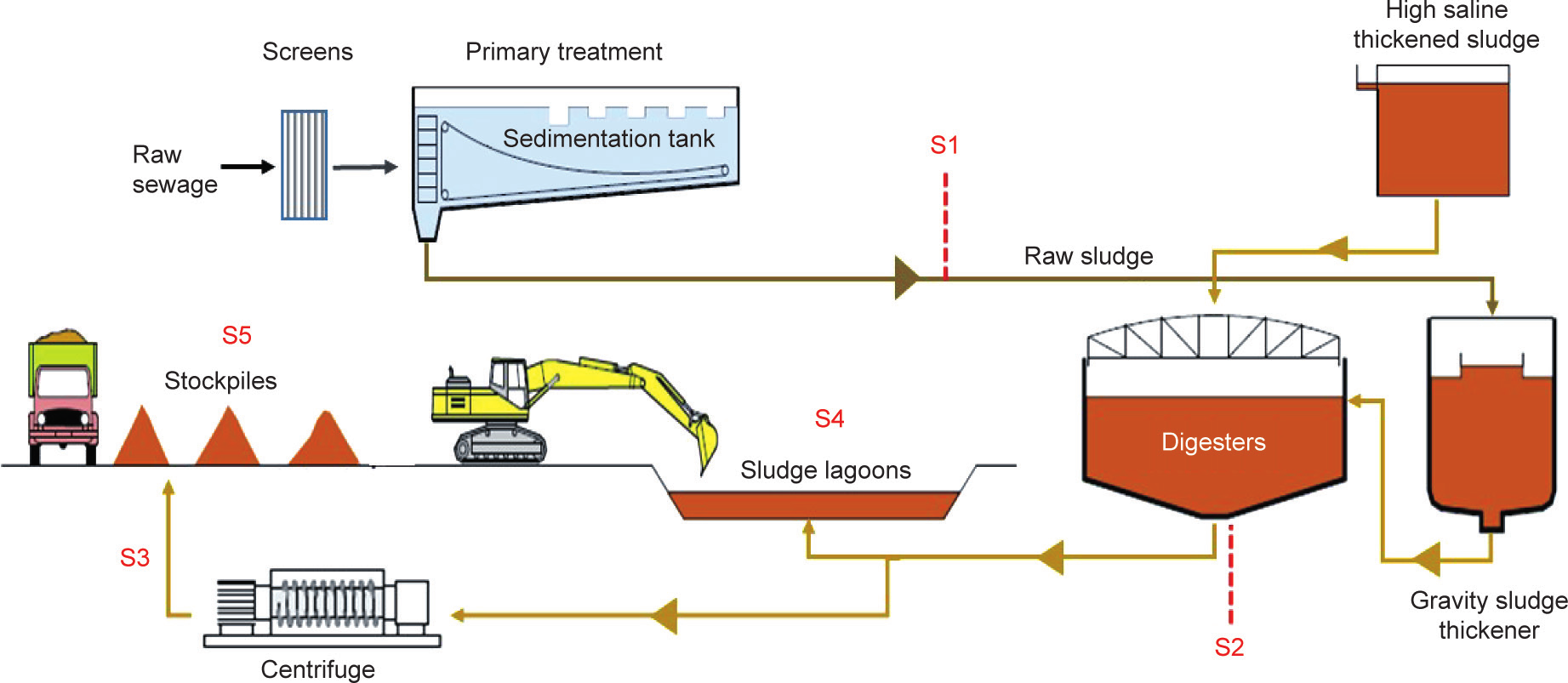
图2. 所选污水处理厂和采样点的污泥处理过程。S1:初沉污泥;S2:混合消化污泥;S3:离心脱水的生物固体;S4:污泥稳定塘;S5:储存3年的生物固体。
厌氧消化后,最初收集的样品(3个重复样本)用于开发方法(萃取和分析)。随后,在2016年12月至2017年6月之间又收集了3个样本(总共45个样本:5个处理阶段、3个时间点、3个重复样本)进行分析。这些样本是在污水处理厂不同阶段收集的,包括初沉污泥、混合消化污泥、离心脱水后的生物固体、稳定塘污泥和来自储存3年的生物固体。收集的初沉污泥为24 h复合物,其余为抓取样品。在样品制备和分析之前,所有样品均存储在–20 ℃下。
《2.3. 样品制备和提取》
2.3. 样品制备和提取
将所有样品冷冻干燥(Lyph-Lock 6,美国Labconco公司),然后均质化。首先,测试了两种溶液混合物对目标药物的萃取情况:①根据Monsalvo [50]的文章,8 mL甲醇和0.1 mol·L–1 乙酸(体积比为1∶1)溶液的混合物,以及②Kaleta等[20]的方法,20 mL的50 mmol·L–1 甲酸和甲醇(体积比为80∶20)。图3说明了详细的萃取过程。概括来讲,称量1 g冷冻干燥的样品,并加入200 μL每种药物氘代内标的混合物,将加有溶液混合物的污泥样品超声处理15 min,然后旋转混合1 h后,将样品在3500 r·min–1 (2851g)下离心10 min(澳大利亚Allegra X-12R Beckman Coulter公司)。然后将上清液收集到玻璃瓶中,重复萃取三次后合并。随后,将一个样品置于氮气中,40 ℃下直接蒸发至干,并使用先前针对废水样品发布的SPE方案萃取另一样品[51]。为此,将过滤的上清液加载到混合模式SPE柱中,该柱用甲醇(6 mL)和乙酸钠缓冲液(6 mL)预调节。用乙酸钠缓冲液(6 mL)、0.1 mol·L–1 乙酸(2 mL)和甲醇(6 mL)洗涤SPE柱。用4%氨水和96%二氯甲烷/异丙醇(80 ∶ 20)的混合物洗脱分析物,并将样品蒸发至干。两种干燥的样品(通过直接蒸发和SPE方法)都用20 μL含有0.1%甲酸的甲醇溶液和180 μL含有0.1%甲酸的Milli-Q水溶液进行重构,然后进行液相色谱串联质谱分析(liquid chromatography-tandem mass spectrometry, LC-MS/MS)。根据已知浓度药物加标的样品的准确度和回收率,选择最终的萃取溶液(表1)。
《图3》

图3. 污泥和生物固体样品的萃取方案。
《表1》
表1 用于分析目标化合物的化合物特定的质谱参数以及相应的检测限(LOD)和定量限(LOQ)
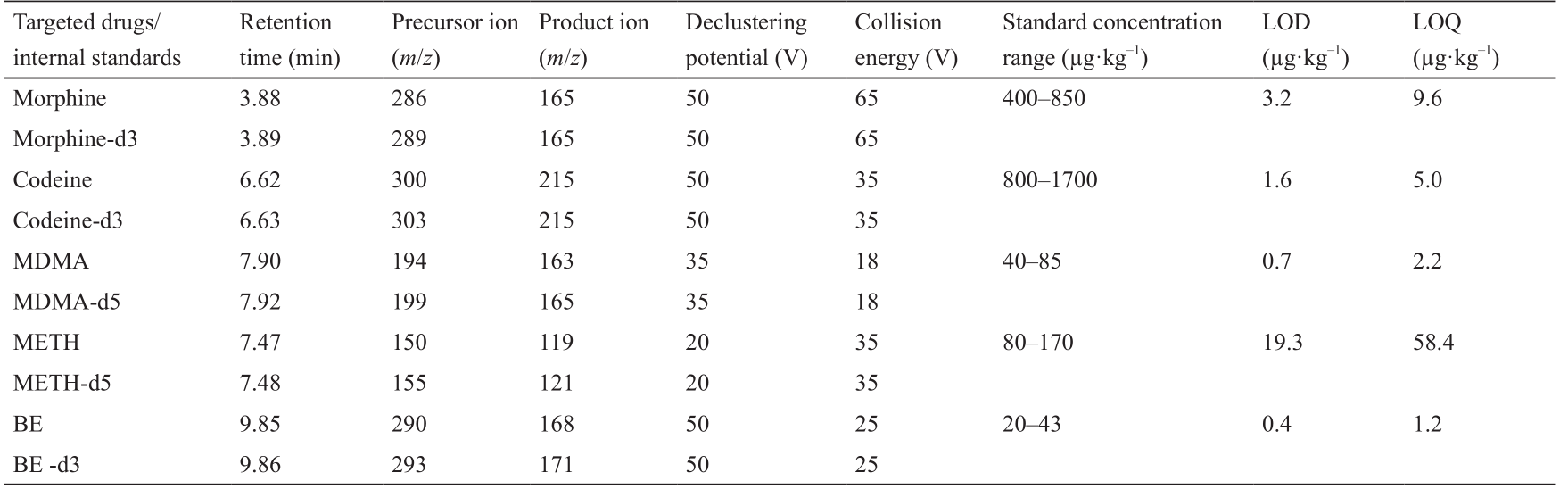
Other MS/MS parameters: Nebulizer gas: 12 pounds/square inch gauge (psig); curtain gas: 10 psig; ion spray voltage: 5000 V.
《2.4. 色谱分析》
2.4. 色谱分析
分析仪器由日本Shimadzu公司的高效液相色谱仪(high-performance liquid chromatograph, HPLC; LC-20AD)、自动进样器(SIL-20A / HT)、泵系统(LC-20AD)和脱气器(DGU-20A)组成,耦合到配备有电喷雾电离(electrospray ionization, ESI)源的API 3000三重四级杆质谱仪(加拿大Applied Biosystems公司)上。
基于先前发表的用于废水样品的方法(略有改动)[40],使用Phenomen-exTM (美国Phenomenex公司)Luna® 五氟苯基(PFP)色谱柱(100 mm×4.6 mm,3 μm) 与 五 氟 苯 基(pentafluorophenyl, PFP) 保 护柱(4 mm×2.0 mm,5 μm)进行色谱分离,总流速为0.6 mL·min–1 。由溶剂A(5%甲醇+ 0.1%甲酸)和溶剂B(95%甲醇+ 0.1%甲酸)组成流动相,样品进样量为10 μL,到4 min时,梯度从30% B开始,立即线性增加到100% B,然后是4 min等度期,然后在0.1 min内线性减少到30%。然后保持在该梯度,直到运行时间结束(10 min)。通过多重反应监测,在正电离模式下测量了质谱。具体的选定化合物的参数总结如表1所示。
《2.5. 方法验证》
2.5. 方法验证
通过加标浓度为20~1700 μg·kg–1 的样品,确定每种萃取溶液所选化合物的萃取回收率(浓度范围参见表1)。通过比较测得的浓度与加标浓度来评估回收率。药物浓度是通过同位素稀释后,分析物和内标物之比计算得出的。每种分析物的氘标记物用作内标物,以此解释萃取过程中分析物的损失情况。每种化合物的定量限(limit of quantification, LOQ)和检测限(limit of detection, LOD)分别确定为信噪比的10倍和3倍。通过分析不同浓度下的标准品建立线性关系,并选择LOQ作为最低可测量浓度,使其与标准曲线的偏差在±15%以内。
《2.6. 统计分析》
2.6. 统计分析
使用Prism 7.03(美国Graph-Pad Software公司)进行统计分析。采用Shapiro-Wilk正态性检验,然后进行双尾t 检验以比较萃取液1和2(n = 15)的回收率。同样,采用t 检验评估各种处理过程中污泥处理前后药物浓度之间的差异。
《3. 结果和讨论》
3. 结果和讨论
《3.1. 萃取回收率和数据质量保证》
3.1. 萃取回收率和数据质量保证
如表1所示,为了得到绝对回收率,通过将测得的浓度与标准浓度的样品进行比较,确定了分别采用SPE法和直接进样法测定的两种萃取液的性能。如图4所示,通过SPE法,所有用溶液1(甲醇+ 0.1 mol·L–1 乙酸)和溶液2(甲酸+甲醇)的化合物的回收率分别为93%~116%和61%~186%。回收率的变化可能与基质干扰有关,这会导致检测的抑制(可待因/吗啡)或扩增(MDMA /甲基苯丙胺)。直接进样法所得的萃取液信号响应较差,因此需要使用SPE法。但是,通过同样的SPE萃取(t28 = 2.11,p = 0.044),对比用溶液1和溶液2的所有化合物获得的回收率,两者之间存在显著差异。根据我们的研究结果,如果要萃取废水固体基质中的目标化合物,建议先进行预处理,然后进行SPE萃取。类似的,由于污泥的复杂稠度,Kaleta等[20]应用SPE萃取法分析污泥样品中的苯丙胺。因此,本研究自始至终采用溶液1与SPE萃取法结合的方法。
《图4》
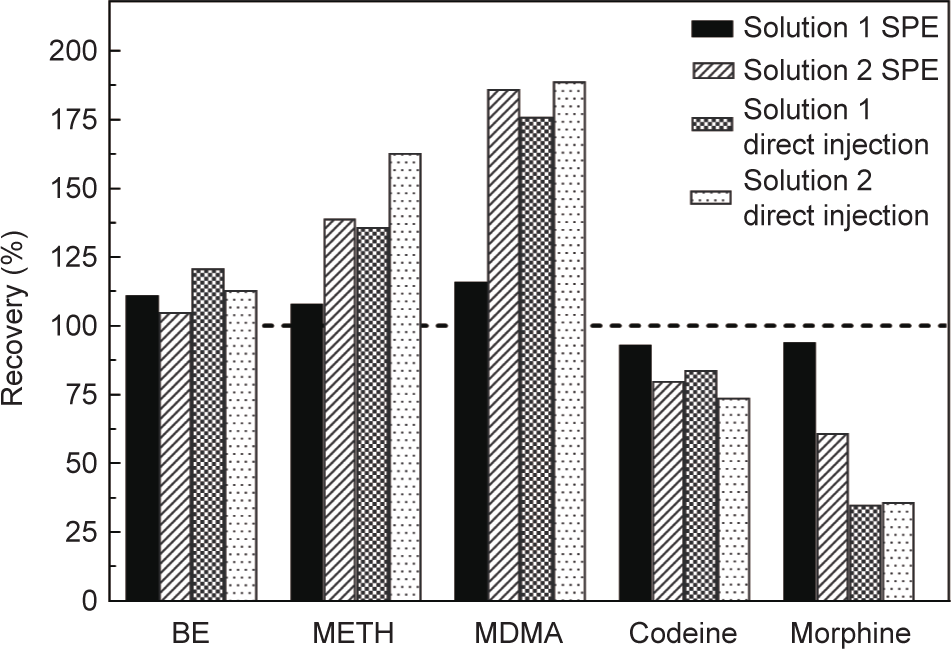
图4. 用两种溶液混合物(溶液1和溶液2),对目标药物通过SPE或直接进样进行萃取(n = 3)获得的回收率。BE:苯甲酰爱康宁;METH:甲基苯丙胺。
《3.2. 分析污泥和生物固体样品中的选定化合物》
3.2. 分析污泥和生物固体样品中的选定化合物
为了确定来自废水处理厂不同阶段的废水固体样品中药物的浓度,采用了上述萃取方法,图5总结了每个样品的结果(平均值±SEM)。最普遍存在的化合物是甲基苯丙胺、可待因和吗啡,存在于所有污泥和生物固体样品中。相比之下,苯甲酰爱康宁和MDMA存在于废水处理厂的初始阶段(初沉污泥和消化池样品),但在处理过的生物固体中并未检测到它们,从而确定在污泥处理过程已将它们完全去除或生物降解。
初沉污泥中目标化合物的浓度范围为1~78 μg·kg–1 ,其中甲基苯丙胺浓度最高(图5)。厌氧消化污泥中的吗啡浓度明显高于初沉污泥中的浓度(t6 = 2.598,p =0.0408)。这种增加(大约4倍)可能是由于在葡萄糖苷酸过程中,吗啡的主要代谢产物吗啡-6-葡萄糖苷酸转化成游离吗啡[40,52–54],或在处理过程中将可待因转化为吗啡[55]。另一种可能性是在活性污泥处理过程中吗啡被吸收和积累后,通过浓缩的WAS加入到消化池中。在该地点的前期工作表明,经过活性污泥处理后,该工厂有效地从进厂废水中去除了吗啡(原废水中的吗啡浓度约为900 μg·L–1 ,去除率>90%)[40]。假设初沉污泥与WAS之比为4∶1,在初级处理和WAS之间能够观察到吗啡水平提高了4倍。
《图5》
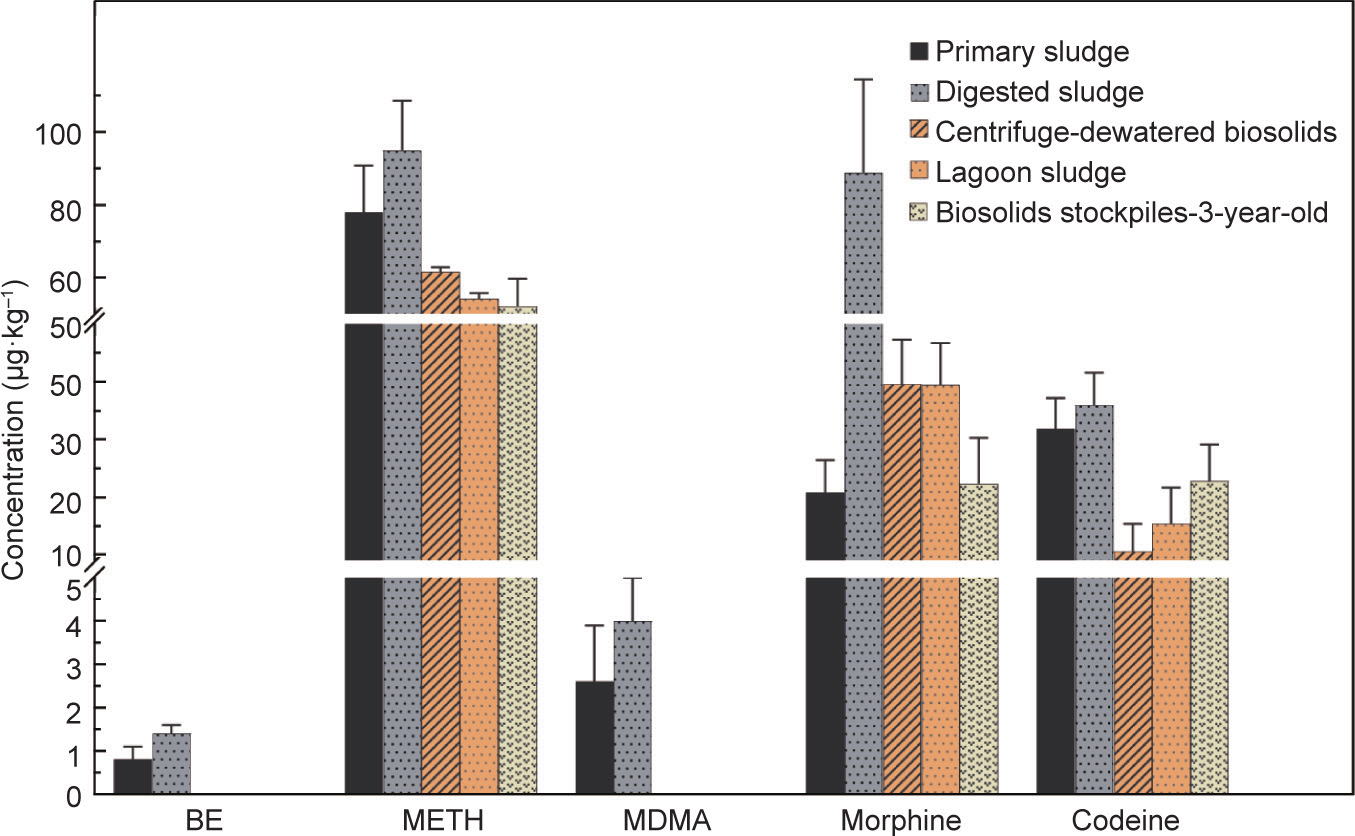
图5. 在初沉污泥、厌氧消化污泥、经离心机或稳定塘脱水处理后的污泥和储存的生物固体中发现的目标化合物(干重,μg·kg–1 )的浓度(平均值±SEM)。
在处理后的污泥(离心或稳定塘脱水)中,未检测到苯甲酰爱康宁和MDMA。由于这些化合物半衰期值较短或对固体分配的亲和力较弱,它们可能已经降解了。例如,MDMA的半衰期(15~59 d)比甲基苯丙胺(131~502 d)短很多[56,57]。Langford等[58]指出苯甲酰爱康宁为极性化合物,由于其lgΚOW 值为2.15,对固体的亲和力很弱,这会导致较大比例的苯甲酰爱康宁存在于水相中,而在固体馏分中存在的相对较少。关于未检测到MDMA的另一种可能性是MDMA代谢,这有助于MDMA降解为羟基苯丙胺。这些化合物(即羟基苯丙胺)在处理过的生物固体中可能仍具有生物活性,且毒性未知。但是,经离心分离或稳定塘脱水的污泥中的甲基苯丙胺平均浓度没有明显差异[平均值±SEM分别为(61.6±1.3)μg·kg–1 或(54.2±1.1)μg·kg–1 ]。本研究中苯甲酰爱康宁和MDMA的结果与最近的斯洛伐克的研究结果[22]相类似,在该研究中,消化污泥中苯甲酰爱康宁的平均含量低于LOQ,MDMA的平均含量非常低(<5 μg·kg–1 )。该研究中记录的甲基苯丙胺浓度相对高于之前澳大利亚污水处理厂污泥样品中报道的浓度(2 μg·kg–1 )[43],但仍在Mastroianni等[17]报道的污泥样品的范围内(6.7~111 μg·kg–1 )。应当指出的是,2013年,当Mastroianni等的研究发表时,甲基苯丙胺的使用量远低于目前使用的水平,在那时进行检测,可能导致固体中的含量也较低。例如,2011年西班牙流入废水中检测到的甲基苯丙胺浓度为50 ng·L–1 [59],而2016年在澳大利亚废水中检测到的甲基苯丙胺浓度约为3000 ng·L–1 [40]。结果表明,甲基苯丙胺是一种稳定的化合物,在中温厌氧消化条件下降解最小。
在脱水离心机或稳定塘处理过的污泥中检测到的其他两种化合物是可待因和吗啡,其平均浓度分别为10.6~15.4 μg·kg–1 和39.6~139.4 μg·kg–1 。这里的可待因平均脱水污泥值几乎是Gago-Ferrero等[60]报道的水平(6.3 μg·kg–1 )的两倍,他们的研究是从希腊的污水处理厂收集污泥,且污泥在脱水前经过好氧消化处理。然而,在本研究中发现的消化和脱水污泥中可待因浓度与Ivanová等[22]的研究结果相似,几个来自斯洛伐克污水处理厂的主要厌氧消化(有些需氧)和离心脱水的污泥中可待因的中位水平为16 μg·kg–1 。我们的数据与Gago-Ferrero等[60]的数据之间存在较大差异,而与Ivanová等[22]差异较小,可能是由于本研究采用了厌氧消化进行污泥处理,厌氧消化对可待因降解或去除的效果可能不如好氧消化。例如,有文献指出好氧消化在去除痕量有机物方面优于厌氧消化[61,62]。此外,假设数字仍在相同的数量级内(小于两倍差异),那么这些差异也可能与采样变异性、分析测量或回收率差异有关。在本研究中,两种处理过的污泥(离心或稳定塘脱水)中的吗啡平均浓度(40 μg·kg–1 )均相同,并且相对高于Mastroianni等[17]报道的来自西班牙15个污水处理厂的污泥中的范围(2.2~19.1 μg·kg–1 ),其中污泥主要为活性污泥。他们研究中的污泥处理过程与当前研究中采用的污泥处理过程相似,包括厌氧消化,然后进行离心脱水。总体而言,离心或稳定塘脱水后产生的生物固体中药物(甲基苯丙胺、可待因和吗啡)的浓度没有明显差异。
对于5个目标药物,在所有生物固体样品中均检测到了甲基苯丙胺、可待因和吗啡(图5)。通常,甲基苯丙胺浓度(52.2 μg·kg–1 )约为可待因和吗啡平均浓度(23 μg·kg–1 )的两倍。生物固体中甲基苯丙胺浓度较高的一个可能原因是其较高的进水质量负荷[40,49,63]。甲基苯丙胺在环境中相对稳定[57,64],这也可以解释它在本次检测的稳定生物固体中的普遍性和持久性。可待因含量与Langdon [65]报道的相同,但略高于Sabourin等[48]发现的加拿大生物固体中的浓度(最高为14.6 μg·kg–1 )。
据我们所知,本研究是首个提供有关澳大利亚生物固体中非法药物和医用药物存在情况的研究。为尝试了解在澳大利亚土地应用实践中,这些化合物在生物固体中相关的潜在环境风险,我们使用风险商(risk quotient, RQ)进行了危害评估。由于没有可用的预测无效应浓度(predicted no-effect concentration, PNEC)土壤值,RQ是根据我们研究的生物固体中测得的浓度与水中PNEC之比计算得出的[66,67]。根据RQ值,可以将这些化合物归类为三种:对环境有高风险(RQ≥1)、中等风险(RQ = 0.1~1)以及低风险(RQ <0.1)[68,69]。该分析得出除可待因(RQ = 0.4,中等风险)以外,所有化合物的RQ值都小于0.1 (低环境风险)。值得强调的是,由于这些RQ值是使用100%生物固体中的测量浓度计算得出的,因此该结果大大高估了澳大利亚农业生物固体再利用的风险,在这种情况下,通常以10 t·hm–2 的低剂量施用生物固体,或以干重1 kg·m–2 施用[70]。假设将生物固体埋入土壤下10 cm,则环境中与生物固体相关的化合物会进一步稀释100倍,这会使所有物质的上述RQ值降低到远低于低风险阈值。其他管辖区应根据当地情况(即生物固体药物浓度和生物固体施用量或应用)重新评估该风险,以正确评估当地环境风险。需要重申的是,用于计算RQ的PNEC值与水环境有关,因此上述RQ仅为土壤的估计值。
《4. 结语》
4. 结语
本研究调查了来自澳大利亚大型污水处理厂的污泥和生物固体,以了解在废水固体处理过程中甲基苯丙胺、MDMA、可待因、吗啡以及可卡因代谢物苯甲酰爱康宁的发生和去向。在污泥处理过程中,苯甲酰爱康宁和MDMA很容易去除,且通过长期稳定处理后未在生物固体中检测出来。在处理过的污泥(离心和稳定塘脱水)和生物固体中,甲基苯丙胺、可待因和吗啡的含量总是很低(l μg·kg–1 )。甲基苯丙胺的平均浓度高于国际上报道的水平,这可能反映了一个事实,即甲基苯丙胺是澳大利亚人选择的主要兴奋剂,从而导致废水中的含量相对较高,因此固体成分也相对较高。这项研究还发现,即使在长期(多年)暴露于固体稳定过程后,被调查的污水处理厂使用的固体处理工艺(即厌氧消化、搅拌空气干燥、稳定池和储存)也几乎不能去除甲基苯丙胺、吗啡和可待因。一个简单的环境风险评估表明,对于所有5种药物,按照标准的澳大利亚生物固体土地施用量,与生物固体土地施用相关的风险可能非常低。然而,人们对它们在环境中长期存在和积累的情况知之甚少,更多的研究可能会加快农业生物固体的使用进度,可以为这些化合物在环境中建立更好的风险预测,并评估它们进入食物链的潜力。对于此类研究,将需要进行一项长期的监测研究,其中应包括以不同的比例对生物固体改良过的土壤施用之前和之后进行取样,并监测农作物生长,以便评估植物的吸收潜力。
《Acknowledgements》
Acknowledgements
This research was supported by an Australian Government Research Training Program (RTP) Scholarship. Michael Short acknowledges the financial support of the Cooperative Research Center for Low Carbon Living Ltd. (RP2017 and RP2008) whose activities are supported by the Cooperative Research Centers program, an Australian Government initiative. The authors gratefully acknowledge the South Australian Health Network for its financial support. The authors thank staff at the Australian Water Quality Centre and the managing water authority for their assistance during the sampling.
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Meena K. Yadav, Cobus Gerber, Christopher P. Saint, Ben Vanden Akker, and Michael D. Short declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




