《1. 引言》
1. 引言
植物,尤其是农作物不断受到多种多样的病原菌攻击,造成各种病害的发生。植物病害不仅造成经济损失,影响人类健康,也可导致生物多样性破坏,致使人类生存环境恶化[1]。据估计,5种主要农作物——玉米、小麦、大米、马铃薯和木薯——由于流行性真菌病害造成的损失足以养活全世界8.5%的人口[2]。面对持续反复的植物病害,有效保护和及时控制则显得尤其重要。挖掘与病原菌生长发育和致病性相关的基因将有助于制定植物病害防控新策略[3]。
初生多肽相关复合物(NAC)是一种功能多样的蛋白质复合物,参与蛋白质的生物合成、组装和运输,对于维持蛋白质内稳态起关键作用[4]。在所有的真核生物中,NAC是由包含α-亚基和β-亚基的异源二聚体组成[5–7]。异源二聚体NAC与核糖体以1:1的比例相结合 [8],并以动态且可逆的方式与核糖体和初生多肽相互作用[9],从而实现类似分子伴侣的功能[10–12]。在酿酒酵母菌中,NAC协助新生蛋白质的折叠和成熟,防止初生多肽错误靶向内质网[13,14],进而使蛋白靶向线粒体[15],并在功能上连接其他分子伴侣网络,如Hsp70 系统[16]。在秀丽隐杆线虫中,NAC起着类似于其在酵母中的重要作用,可作为核糖体相关的分子伴侣来调节翻译和协助初生多肽的折叠;同时,它也是一种重要且有益的蛋白质内稳态传感器,不仅可以检测蛋白质毒性应激,还可以介导蛋白质毒性应激的翻译,从而为细胞提供调节反馈机制以维持蛋白质内稳态[9]。NAC的这些独特特性及其在细胞操作中的潜在作用,使它们成为从不同角度研究各种生物体的很好的对象。
在本研究中,我们鉴定了NAC在子囊真菌禾谷镰刀菌(Fusarium graminearum,有性型:Gibberella zeae)中的作用,重点挖掘了其在该菌侵染小麦过程中的作用。禾谷镰刀菌是一种极具破坏性的植物病原菌,可引起小麦和其他小粒谷物的赤霉病(FHB)[17,18]。禾谷镰刀菌的侵染不仅会直接造成田间谷物的产量损失,而且会在籽粒贮存过程中产生真菌毒素,对人体和动物健康都有直接危害;因此,该真菌给全球的粮食安全造成了严重威胁[19–22]。通过致病相关基因研究将有助于深入认识禾谷镰刀菌与寄主植物之间的相互作用机理,从而为有效控制赤霉病提供新的研究策略。本研究采用基因敲除、酵母双杂交、亚细胞定位和致病性检测相结合的方法,明确了NACα在调控小麦赤霉病菌生长发育和致病过程中所发挥的重要作用。
《2. 材料和方法》
2. 材料和方法
《2.1. 真菌菌株和培养条件》
2.1. 真菌菌株和培养条件
利用禾谷镰刀菌野生型菌株PH-1构建基因缺失突变体。野生型菌株PH-1及其突变体培养在PDA和V8琼脂培养基上。对培养于25 ℃、12 h光照/12 h黑暗交替条件下的供试菌株进行菌丝生长测定,每个菌株设置三个重复。在羧甲基纤维素(CMC)培养基中诱导分生孢子产生[23]。所有供试菌株均以分生孢子悬浮液形式保存在20%甘油中,并置于–70 ℃条件下。
《2.2. 生物信息学分析》
2.2. 生物信息学分析
禾谷镰刀菌PH-1的基因组[24]是通过裂殖酵母(Schizosaccharomyces pombe)的NACα亚基(NP_596361, EGD2)氨基酸(aa)序列[25],利用BLASTp进行搜索并下载同源序列。用PH-1的NACα 全长序列在GenBank 中搜索并下载其他物种中同源序列(Supplementary data中的Table S1)。用Clustal X 2.0对同源氨基酸序列进行比对分析[26]。用分子进化遗传学分析软件7.0版(MEGA7)构建邻接(neighbor-joining)进化树,并通过自举检验(bootstrapping,重复1000次)评估节点支持率[27]。
《2.3. 缺失突变体和回复菌株的获得》
2.3. 缺失突变体和回复菌株的获得
以禾谷镰刀菌野生型PH-1菌株基因组DNA为模板构建FgNACα 基因敲除载体[28,29]。首先,扩增FgNACα 基因上游5′端824 bp同源臂片段,定向克隆至pUC19-G418R 载体中获得pUC19-A-G418;扩增该基因下游5′端961 bp同源臂片段并定向克隆至pUC19- A-G418中,获得pUC19-A-G418-B(Supplementary data 中的Fig. S1)。然后,参照Yuan等[30]所述,采用聚乙二醇(PEG)-CaCl2法将HindIII酶切后线性化的载体转化至PH-1原生质体。采用单孢分离方法筛选获得具有 G418抗性的转化子,进一步通过测序鉴定其基因型。
回复突变株的构建,以禾谷镰刀菌野生型PH-1菌株基因组DNA为模板,扩增包含FgNACα 基因编码框[包括开放阅读框(ORF)、启动子区和终止子区]在内的片段,克隆到pMD18-T获得互补载体pMD18-FgNACα ,并进行测序鉴定。分别用EcoRI 酶切线性化回复载体 pMD18-FgNACα 和HindIII线性化的载体pUCATPH共同转化到突变菌株原生质体中获得回复菌株。筛选对 G418抗性敏感并可对潮霉素产生抗性的转化子,进一步采用ORFα-F/ORFα-R引物对就以上获得转化子的基因型进行PCR扩增鉴定(Supplementary data中的Table S2)。
《2.4. 表型分析》
2.4. 表型分析
供试菌株生长速率的测定,用打孔器在培养3 d的供试菌株菌落边缘打取5 mm菌饼接种在PDA平板上,置于25 ℃黑暗环境下培养,每天测量菌落直径,持续 4 d。将培养2 d的4个5 mm大小的菌饼接种到100 mL液体CMC培养基中,置于25 ℃下培养5 d。以5000 r·min–1 的转速离心5 min,并用无菌蒸馏水清洗2次后收集分生孢子用于产孢量的分析。参照Hou等[31]所述的方法,在显微镜下用血球计数板对分生孢子计数。在Olympus BH-2显微镜下观察和测量分生孢子的形态和大小,每个供试菌株测量100个分生孢子。宽度为中间细胞宽度,长度为从顶端细胞至足细胞之间的长度。
《2.5. 致病性测定》
2.5. 致病性测定
采用小麦品种铭贤169进行麦穗和胚芽鞘接种试验。取10 μL在CMC培养基培养了5 d的分生孢子悬浮液(4×105 conidia·mL–1 ),将其注入到生长了35~42 d的小麦花序基部的第三个完整小颖。将接种过的小麦顶端套上小塑料袋,保湿培养48 h。接种后12 d,统计每株麦穗上的发病小穗数目,并参照已报道的病情指数公式计算发病率[32]。每个试验处理接种小麦穗数为9~10株,并且所有试验至少重复4次。按照Liu等[33]报道的方法接种小麦胚芽鞘,每个供试菌株接种50个胚芽鞘,置于生长箱中室温培养。接种7 d后,测量棕色病斑的长度。
《2.6. 酵母双杂交检测和亚细胞定位》
2.6. 酵母双杂交检测和亚细胞定位
采用Matchmaker GAL4双杂交系统3(Clontech, USA)检测FgNAC的两个亚基之间的互作。将FgNACα ORF克隆到pGADT7中获得载体AD-FgNACα 。从PH-1 的cDNA中扩增出FgNACβ ORF,并将其克隆到pGBKT7载体(BD-FgNACβ)用作酵母双杂交试验的靶标。测序鉴定后,采用碱离子法酵母转化试剂盒(MP Biomedicals, USA)将诱饵和靶标载体共转化至酵母菌株AH109。在葡萄糖合成培养基(SD-Leu-Trp-His, SD– LWH)上可观察到Leu+ 和Trp+ 转化子生长,然后按照 Zhang等[34]的方法测量LacZ 报告基因的表达。
为了研究FgNACα和FgNACβ在禾谷镰刀菌中的亚细胞定位,分别扩增FgNACα 和FgNACβ 的编码区。基于pDL2载体构建包含自身启动子的FgNACα 和FgNACβ 的C端融合增强型绿色荧光蛋白(eGFP)的载体,并参照Sweigard等[35]描述的方法转化禾谷镰刀菌原生质体。在Olympus BX61荧光显微镜下观察所有供试样品。
《2.7. 统计分析》
2.7. 统计分析
使用SPSS 19软件进行统计分析,并使用单向方差分析方法(ANOVA)分析各处理之间的显著性差异。当统计学上的显著性差异p 值小于0.05时才具有统计学意义。
《3. 结果》
3. 结果
《3.1. FgNACα 和酵母 NACα同源》
3.1. FgNACα 和酵母 NACα同源
通过裂殖酵母NACα亚基基因EGD2进行BLASTp 搜索,在禾谷镰刀菌PH-1基因组中发现一个NACα亚基基因(FGRAMPH1_01G10263),将该基因命名为 FgNACα。FgNACα 由1166个核苷酸组成,ORF为627 bp,编码209个氨基酸。与EGD2类似,FgNACα分别在氨基和羧基端有一个保守的NAC结构域(57个氨基酸)和一个泛素相关(UBA)结构域(40个氨基酸)[图1(a)和(b)]。分析发现,基于NACα 序列构建的进化树与物种之间的系统发生关系完全一致[36]。FgNACα的氨基酸序列与稻瘟菌(XP_366584.1)同源序列具有70% 氨基酸相似性,并与其他两种真菌序列一起形成了一个可靠支持的亚分支(支持率79%)。所有真菌NACα序列形成一个高支持率的分支(99%)[图1(c)]。这些结果表明FgNACα 与其他真菌NACα 是直系同源基因。
《图1》

图1. FgNACα 同源基因的鉴定。(a)粟酒裂殖酵母(NP_596361, EGD2)和禾谷镰刀菌(FGSG_08560.3, FgNACα)中NACα的氨基酸序列比较;(b)粟酒裂殖酵母和禾谷镰刀菌中NACα的功能结构域;(c)基于NACα氨基酸序列构建的系统发育树。节点处数字表示自举支持率。红色标记表示禾谷镰刀菌的FgNACα。
《3.2. 禾谷镰刀菌 FgNACα 基因的敲除和回复》
3.2. 禾谷镰刀菌 FgNACα 基因的敲除和回复
以野生型PH-1作为阴性对照,通过G418抗性筛选和PCR鉴定,构建FgNACα 缺失突变体(fgnacα)。与引物对FgNACα-Ft1/Neo-F扩增的2781 bp条带相比,引物对ORFα-F/ORFα-R未检测到FgNACα 条带(755 bp) [Fig. S1(b),泳道3],说明FgNACα 已被neo 基因成功取代[Fig. S1(b),泳道1和2]。为了构建FgNACα 回复菌株fgnacα::FgNACα,克隆了包含启动子和终止子的 2993 bp的FgNACα 基因,连接至pUCATPH载体,经 HindⅢ线性化后转化缺失突变菌株fgnacα 原生质体 [Fig. S1(c)],采用潮霉素和G418共同筛选转化子并通过PCR鉴定。发现引物对ORFα-F/ORFα-R可在回复突变株中检测到FgNACα 带(755 bp)[Fig. S1(d),泳道4],但在缺失突变菌株fgnacα 中没有相关条带[图 S1(d),泳道3],表明FgNACα 基因在缺失突变菌株 fgnacα 中成功恢复。
《3.3. FgNACα 调控菌丝生长发育》
3.3. FgNACα 调控菌丝生长发育
测量PDA和V8培养基上的菌落直径发现[图2(a)],与野生型菌株PH-1相比,缺失突变菌株fgnacα 的菌丝生长显著降低。缺失突变菌株fgnacα 在培养期间生长缓慢,并且在PDA平板上接种的第3天,菌落直径仅为野生型菌株菌落直径的69% [图2(b)]。另外,缺失突变菌株fgnacα 还产生了少量含不规则菌落边缘的气生菌丝 [图2(a)]。在野生型菌株PH-1和回复菌株fgnacα::FgNACα 之间未观察到表型差异(图2)。同样,在液体 CMC培养基中,与整个培养过程中的野生型菌株和回复菌株相比,缺失突变菌株产生的菌丝体质量更小,而野生型菌株和回复菌株的菌丝体生物量基本相当[图2 (c)]。以上结果显示FgNACα 基因的缺失极大地限制了禾谷镰刀菌菌丝的营养生长。
《图2》

图2. FgNACα 基因缺失影响菌丝生长。(a)野生型菌株PH-1、缺失突变菌株fgnacα 和回复菌株fgnacα::FgNACα 的菌丝生长状态,培养条件为在 PDA和V8培养基中,在25 ℃下培养3 d;(b)在PDA培养基中,在25 ℃下培养1 d、2 d、3 d、4 d后的菌落直径;(c)在液体CMC培养基中,在 25 ℃下培养24 h、48 h和72 h的生物量。
《3.4. FgNACα 对分生孢子产量及形态的影响》
3.4. FgNACα 对分生孢子产量及形态的影响
为了研究FgNACα 基因在生殖发育中的作用,我们比较了突变菌株和野生型菌株的分生孢子产量和孢子萌发情况。发现缺失突变菌株fgnacα 与野生型菌株或回复菌株的分生孢子在形态上相比没有明显差异。而缺失突变菌株fgnacα 的产孢量显著减少(p < 0.05),仅为野生型菌株的40%左右和回复菌株的42%左右[图3(a)]。此外,缺失突变菌株fgnacα 的分生孢子萌发明显延迟,与野生型和回复菌株相比,缺失突变菌株在CMC液体培养基中培养4 h的萌发率仅为野生型菌株PH-1的32% [图3(b)]。有趣的是,随着时间的延长,缺失突变菌株的发芽率迅速上升,培养8 h时其萌发率约为野生型菌株的86%,培养12 h时其萌发率可达92%以上[图3(b)]。而回复菌株的分生孢子发育与野生型菌株相似(图4)。以上结果表明FgNACα 基因可能参与了分生孢子形成过程的早期阶段,且其功能可能受到其他基因的补偿。
《图3》

图3. 野生型菌株PH-1、缺失突变菌株fgnacα 和回复菌株fgnacα::FgNACα 在孢子数、形态和萌发率方面的差异。(a)PH-1、fgnacα 和fgnacα::FgNACα 菌株的分生孢子产量;(b)CMC液体培养基中培养4 h、8 h、12 h和24 h后的分生孢子萌发率。符号*表示差异有统计学意义(p < 0.05); NS代表无显著性差异。
《3.5. FgNACα 是禾谷镰刀菌侵染小麦的关键基因》
3.5. FgNACα 是禾谷镰刀菌侵染小麦的关键基因
采用品种小麦铭贤169进行致病性鉴定,结果如图 4所示,当小麦穗接种分生孢子12 d时,缺失突变菌株 fgnacα 的侵染率约为25%,而野生型菌株PH-1和回复菌株的侵染率超过47% [图4(b)]。缺失突变菌株fgnacα 与野生型菌株PH-1和回复菌株fgnacα::FgNACα 相比致病力减弱[图4(a)]。当接种分生孢子至胚芽鞘时,获得了相同结果[图4(c)和(d)],缺失突变菌株引起的病斑长度(约0.54 cm)明显小于野生型菌株(1.92 cm)和回复菌株(1.88 cm)。这些结果表明FgNACα调控禾谷镰刀菌对小麦的致病力。
《图4》
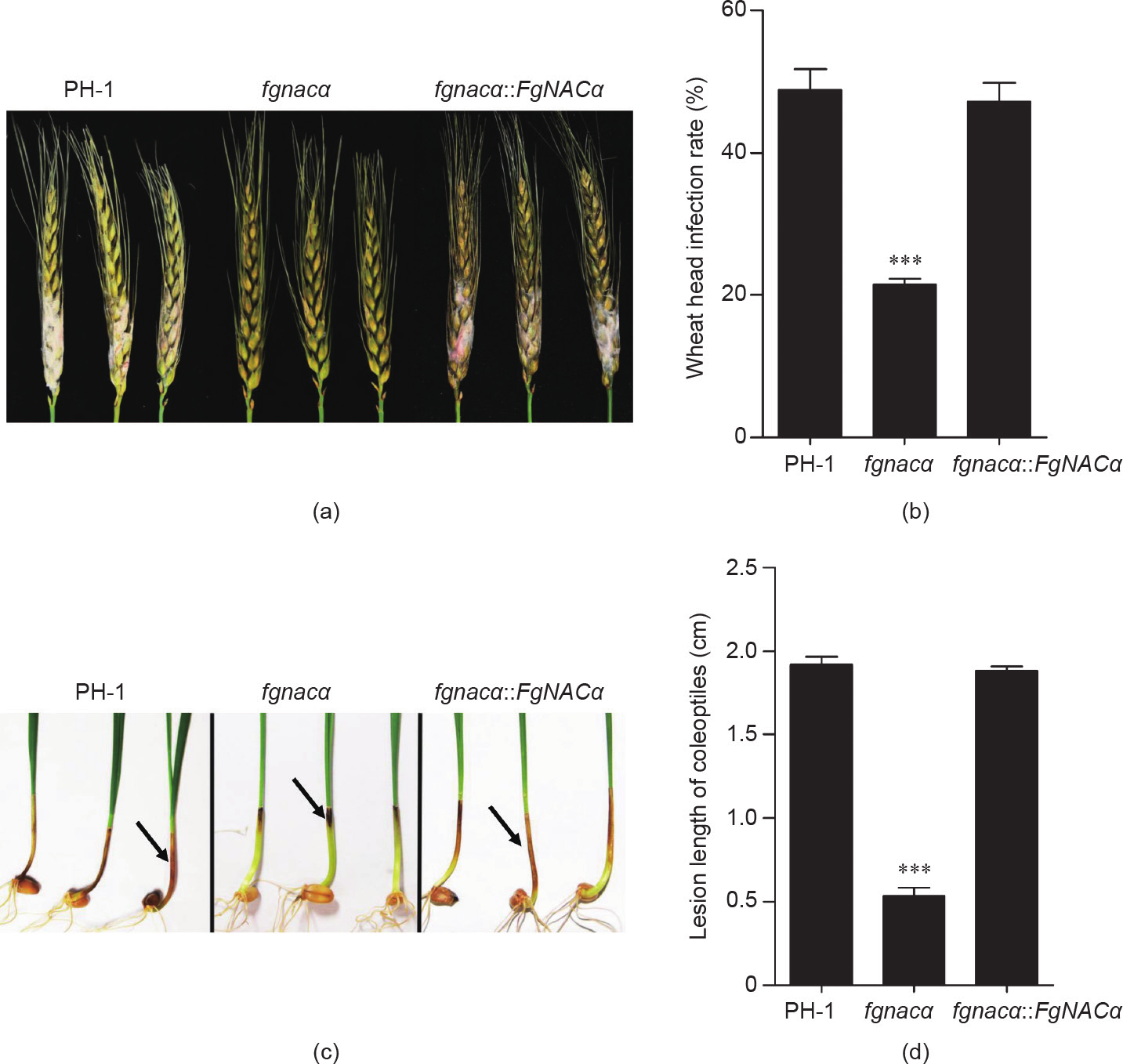
图4. FgNACα 是禾谷镰刀菌侵染小麦的关键基因。(a)、(b)麦穗接种实验,用野生型菌株PH-1、缺失突变菌株fgnacα 和回复菌株fgnacα::FgNACα 的分生孢子接种小麦穗部。照片拍摄于接种后12 d。(c)、(d)FgNACα的缺失减弱了禾谷镰刀菌对小麦胚芽鞘的致病性。箭头指向表示 PH-1、fgnacα 和fgnacα::FgNACα 侵染胚芽鞘上的棕色病变。照片拍摄于接种后7 d,符号*表示差异有统计学意义(p < 0.05)。
《3.6. FgNACα和 FgNACβ的互作及其亚细胞定位》
3.6. FgNACα和 FgNACβ的互作及其亚细胞定位
据报道,NAC的α和β亚基可以相互作用,并通过形成异源二聚体发挥作用,以促进线粒体蛋白前体在酵母胞质中的积累[37]。为了检测这两个亚基的功能是否与它们在酵母中的功能相同,我们通过酵母双杂交试验研究发现(图5),在酵母中FgNACα可以与FgNACβ相互作用[图5(a)]。这意味着FgNACα与FgNACβ相关联,并与FgNACβ在功能上相联系。它们可能通过形成异源二聚体,进而保护初生多肽不被蛋白质水解。
《图5》
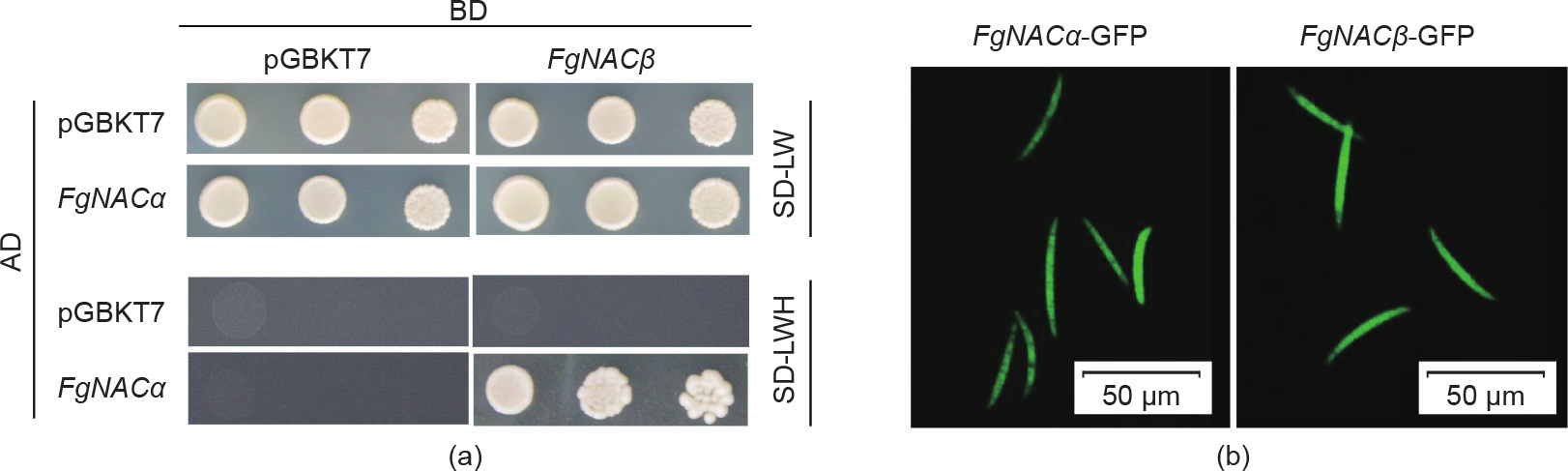
图5. FgNACα与FgNACβ相互作用。(a)酵母双杂交验证FgNACα与FgNACβ互作。FgNACβ 与GAL4 的激活域(AD)融合,FgNACβ 与GAL4 的结合域(BD)融合。AH109酵母的转化子分别被稀释10倍、100倍和1000倍,然后在不含亮氨酸和色氨酸的葡萄糖培养基(SD-LW)和SDLWH平板上生长。(b)FgNACα 和FgNACβ 在禾谷镰刀菌中的亚细胞定位。检测表达FgNACα-GFP或FgNACβ-GFP融合载体的分生孢子。在荧光显微镜下观察所有样品。
为了进一步研究FgNACα与FgNACβ的亚细胞定位,将GFP融合构建于FgNACα 与FgNACβ 编码区的羧基端,并将其转化至野生型菌株PH-1原生质体中。在荧光显微镜下,FgNACα-GFP和FgNACβ-GFP转化菌株的分生孢子胞质内均可检测到绿色信号[图5(b)]。这些结果表明FgNACα与FgNACβ在禾谷镰刀菌细胞中具有相同的定位,这可能为它们的物理相互作用提供了机会。
《4. 讨论》
4. 讨论
NAC是首个被发现的与新合成多肽有相互作用的非核糖体因子[14],其与信号识别分子一起共同促进蛋白质靶向内质网的保真性[38]。自NAC被发现20多年以来,其在酵母[15,39,40]、烟草[41]、线虫[9]等多种模式生物中的潜在作用已被证实。研究表明NAC对于维持蛋白质内稳态具有不同的作用[4,42]。在大多数情况下,这种功能的多样化常常伴随着进化的多样性。然而,我们发现NACα在一级序列结构和功能域方面的进化都是高度保守的(图1)。从动物到植物再到真菌,NACα的氨基酸序列均非常相似,都包含一个NAC结构域和一个UBA结构域[图1(a)和(b)]。在系统发育分析中,基于NACα 序列构建的进化树与物种演化关系高度一致 [图1(c)]。本研究发现NAC的α和β亚基形成异源二聚体(图5),在其他物种中也存在这种现象[5,6],因此我们猜测NACβ在进化方面也是保守的。而这种进化与功能的不一致性,可能因为NAC是蛋白质生物合成的关键因素,并且在功能上与其他代谢网络(如Hsp70系统)相连[16]。这种功能的多样性和进化的保守性,意味着本文对禾谷镰刀菌的研究结果也许可被推及至其他植物病原菌,反之亦然,因此以NAC为研究目标的病害治理方法具有跨病害的适用性。
尽管关于NACα在模式生物中的生物学功能已有广泛研究,但其在非模式生物中的作用仍鲜为人知。本研究发现,禾谷镰刀菌的NACα亚基基因不仅参与该菌的营养生长过程,而且正调控其致病性。在其他植物病原菌中,有报道称核盘菌(Sclerotinia sclerotiorum)中的NACα 对其致病性具有负调控作用[43]。NACα 对病原菌致病性的调控差异可能与这两种病原菌不同的生活方式有关。禾谷镰刀菌是半活体营养型真菌,而核盘菌是死体营养型真菌。在动物中,NACα 也参与动物对病原菌的先天免疫反应过程。当螃蟹感染鳗弧菌(Vibrio anguillarum)时,NACα 的表达量显著上调[44]。同样地,当鱼受到爱德华氏菌(Edwardsiella tarda)的攻击时, NACα 在鱼组织中的表达上调,并且NACα 的过表达增强了抗性基因的表达[45]。在植物中的研究表明,沉默本氏烟(Nicotiana benthamiana)的NACα 基因可以抑制雀麦花叶病毒在细胞间的转移[41]。此外,接种青枯菌(Ralstonia solanacearum)后,番茄抗性品种中的NACα 蛋白含量高于番茄感病品种[46]。很显然,确定NACα 在病原菌发病机制中的作用,就必须研究NACα 在小麦或寄主植物中的功能以及其在病原菌-宿主系统中的分子相互作用关系。
对真菌病原物而言,入侵植物细胞的能力是成功定植和感染植物的前提,而维持蛋白质内稳态的能力是发挥细胞功能以生存和繁衍的必要条件。而对植物病原菌中维持蛋白质内稳态的真菌调节因子的研究仍然很少。本文的研究对象是FgNACα,它是一种在进化过程中高度保守的维持蛋白质内稳态的调节因子,其参与调控真菌的生长发育和致病性。此外,我们的研究结果表明, FgNACα 的功能可能是通过与FgNACβ形成异源二聚体来实现的(图5)。然而植物的发病机制是通过病原菌与宿主之间的分子相互作用以及病原菌调节因子与宿主调节因子之间的分子相互作用来实现的。所以阐明NAC 在病原菌-宿主相互作用系统中发挥不同功能的分子机制将是非常有意义的。
《5. 结论》
5. 结论
有效的植物保护技术通常源于对病原菌的可靠了解。这些基础知识无疑将有助于人们对发病机制产生新的见解,并提出新的植物保护策略。在本研究中,我们发现植物病原真菌禾谷镰刀菌的NACα与来自酵母和其他真菌物种的同源对应物表现出高度的结构和功能相似性。缺失NACα 的禾谷镰刀菌突变体可以存活,但其在营养生长、分生孢子产生和对小麦的致病性方面均存在明显缺陷。缺失NACα 带来的功能性后果可能源于NAC 在蛋白质内稳态中的重要作用,正如在酵母和其他模型生物中所发现的那样。从植物保护的角度来看,NAC 在开发具有破坏性的植物病害FHB的创新控制方法方面的作用值得被认可。
《致谢》
致谢
这项工作得到了国家自然科学基金(31471737、 31671984、31801691)和贵州省留学归国人员高级计划([2018]02)的支持。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Xuli Wang, Xin Xie, Jin Liu, Guo-Liang Wang, and Dewen Qiu declare that they have no conflict of interest or financial conflicts to disclose.
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2019.07.025.













 京公网安备 11010502051620号
京公网安备 11010502051620号




