《1. 引言》
1. 引言
Railsback [1]在2003年发表了一篇题为《地学元素和离子周期表》的文章。与传统元素周期表仅考虑原子的周期行为不同,该周期表将离子的化学行为也纳入其中,并划入不同的群组,因而更适用于地质学研究。这一新的周期表将大量的信息以直观的方式表达出来,引起了不同学科的关注。例如,根据该周期表选取电催化剂[2]和确定溶解度[3],甚至利用该周期表进行神经学 [4]、生物学[5]、基因学[6]和酶的特性[7]的研究。然而,我们发现,该周期表与冶金学这门应用工程学科存在紧密的联系,冶金学中的许多规律,如元素的亲铜/硫性和离子配位规律等都被无意识地总结在该周期表中。地球化学和冶金学之间的相似性引起了我们的兴趣,为此本文详细地研究了该地学周期表,以期获得启发。
冶金学是一门从矿物中分离和提取金属元素的应用工程学科。虽然冶金方法种类繁多,但提取方法都受到自然环境的限制。同样,元素的地球化学行为也受到自然环境的深刻影响。因此,元素在冶金过程中的行为与其在地球化学过程中的极其相似。例如,元素在火法冶金过程中的迁移与岩浆的分馏相似、湿法冶金中的化学反应与元素在自然水体中的富集行为相当、氧化与还原反应分别对应于大气气氛和深地条件等。Railsback的新的周期表是对地球化学的一种直观表达,与常规元素周期表不同,该周期表用元素的化合态总结化学规律,与地球上大部分元素都呈化合态赋存的事实更加切合。而冶金过程中的元素也多呈化合态,因此该地学周期表对冶金过程也有一定的参考意义。
地球上常见的元素有数十种,由于价态不同而呈现上百种化合态。这些元素分布极其不均,而一系列的地球化学反应又导致了矿石种类和矿产资源的多样性。许多冶金技术曾从地球化学研究中获得启发。例如,钨(W)和钼(Mo)的元素性质相近,导致二者在冶金过程中很难被分离。Zhao等[8–10]提出了一种基于W-Mo 亲铜/硫性质差异的分离方法,而这种方法所基于的原理在钼硫化矿(MoS2)与钨氧化矿的地球化学成矿过程中早有研究。另外一个例子是氯化提金(Au)方法 [11,12],即利用Au3+与Cl−形成[AuCl4]−配合物,其与Au 的迁移和成矿机理相同[13–15]。而Au、碲(Te)、铋(Bi)、砷(As)等都是亲铜/硫元素[16],所以这些元素也往往伴随铜(Cu)元素的冶炼过程[17]。
早期,地球化学家也从冶金学中获取知识。例如, Goldschmidt [18,19]从德国Mansfeld的铜冶炼厂获取了大量数据,划分了元素的亲和性。因此,不论是地球化学给冶金学家提供了新的思路,还是冶金技术契合地球化学原理,冶金学与地球化学之间都存在着许多共性,而这些相似性在Railsback的地学周期表中都有体现。
基于以上思路,本文借助地学周期表所给出的离子性质与存在方式,以开放性的视角阐述了一种用于冶金过程的地球化学思考方式,以揭示冶金学与地球化学之间的内在联系。
《2. 地学周期表概述》
2. 地学周期表概述
Railsback在论文[1]中完整地展示了地学周期表,本文的观点主要涉及该周期表中与冶金学相关的部分原理。主表包括6个部分,即稀有气体区、硬阳离子区、过渡阳离子区、软阳离子区、天然单质元素区、阴离子区。每个部分的主要元素见表1。
《表1》
表1 地学周期表对主要元素的划分
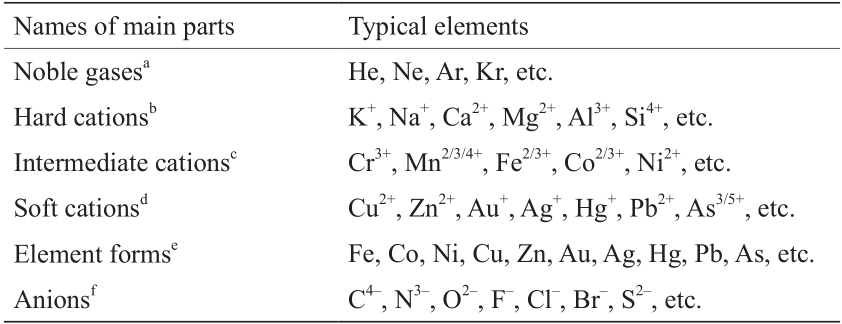
a Noble gases with no ionization.
b “Hard” or “type A” cations with all electrons removed from outer shell.
c Intermediate cations with some electrons remaining in the outer shell.
d “Soft” or “type B” cations with many electrons remaining in the outer shell.
e Elemental forms with zero valence.
f Anions that commonly coordinate with H+ .
该周期表以离子势(即离子电荷数与半径的比值, z/r)为界线被划分成几个条带。许多化学规律可以利用该周期表被准确地表达出来。例如,常见阴离子与硬阳离子的结合能力大小的顺序是F > O > N = Cl > Br > I > S,与软阳离子的结合能力大小的顺序则为I > Br > S > Cl = N > O > F,这不仅解释了硬阳离子Ca2+在自然界中不是以CaS的形式存在而是以CaO或CaSO4的形式存在,也证实了常被用作冶金渣添加剂的CaF2的化学稳定性。相比之下,软阳离子更倾向于与硫(S)结合,这也佐证了冶金领域的软阳离子矿物大部分是硫化物形式(如 CuS2、HgS、PbS等)的事实。
主表下方还有8个插图。其中,插图4是硬阳离子氧化物矿物的溶解度;插图5是典型的简单含氧酸盐矿物;插图6是过渡型阳离子和软阳离子氧化物的熔点和分解温度;插图8是硬阳离子、软阳离子的卤化物溶解性。这些插图在不同的冶金过程中都有很好的借鉴意义。例如,插图4显示,由于铍(Be)、铝(Al)、钛(Ti)、锆(Zr)等的阳离子与O2−之间具有较强的吸引力,所以其氧化物矿物铍石、刚玉、金红石、斜锆石的溶解度极低。这种离子间较强的吸引力甚至会影响冶金提取,因为在冶金过程中,为了获取Be、Al、Ti、Zr这4种金属,通常需借助卤族元素进行分离。关于硬阳离子与氧之间的结合能力的分析会在下文进行详细介绍。
《3. 离子势对地球化学和冶金学的影响》
3. 离子势对地球化学和冶金学的影响
地学周期表以离子势作为参考基线被划为多个条带,其中基线值分别为1、2、4、8、16、32。对于带正电荷的离子,比值越高,其与阴离子的结合能力就越强。因此,金属氧化物中的阳离子大致可以被划分为3大类:与氧结合较弱的低离子势组,如Na+ 、K+ 、Ca2+、Ba2+ 等;与氧结合较强的中等离子势组,如Al2O3、TiO2等;与氧结合极强的高离子势组,如Cr2O42−、WO42−等。具体分类如图1所示。离子势会影响地球化学中矿物的存在形式,在冶金学中会影响冶金工艺方法的选择。
《图1》
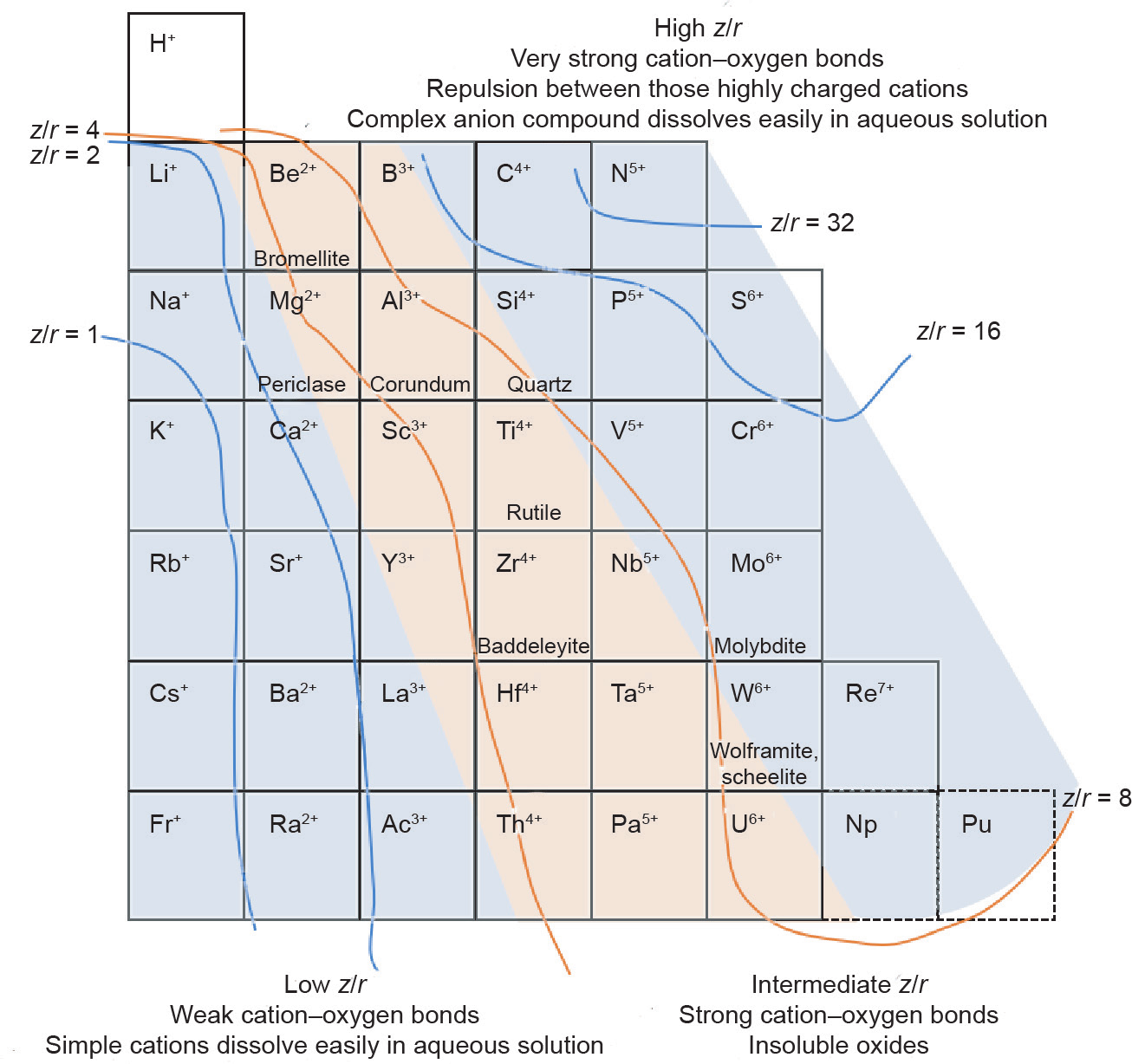
图1. 按离子势等级对硬阳离子进行梯度划分。
根据以上化学特性,地质学中只有与氧结合能力较强的中等离子势的阳离子会形成独立氧化物矿物(如红色条带中分别由Be2+、Al3+、Ti4+和Zr4+形成的铍石、刚玉、金红石和斜锆石),而低离子势的阳离子由于与氧结合能力较弱,会形成卤化物(NaCl、KCl)或者共存于其他矿物(如左侧蓝色条带中的锂云母、钾钠长石)中,与氧结合能力极强的高离子势的阳离子则会形成复杂阴离子化合物(如右侧蓝色条带中的亚铬酸盐 Cr2O42−、黑钨矿和白钨矿WO42−)。这3种分类以及对应的典型矿物见表2 [20–29]。
《表2》
表2 离子势对矿物存在形式的影响以及对应的提取方法

离子的离子势对冶金学的影响与地球化学相似。与氧结合能力较弱的阳离子通常以湿法冶金的方式进行提取,如从锂云母中提取Li+ [22]或从海绿石中提取 K+ [30]。由于中等离子势的阳离子很难与氧分离,因此,在冶金过程中,通常将其氧化物转化为卤化物再进行提取。例如,在900~1300 ℃条件下用镁(Mg)还原BeF2 [31],Al2O3溶于熔融冰晶石(Na3AlF6)后,在 950~970 ℃下采用Hall-Héroult方式进行电解[32],以及通过Hunter法[33]用钠(Na)或通过Kroll法[34]用Mg 将TiCl4还原。高离子势的阳离子通常以复杂阴离子的形式存在,如VO33−、MoO42−、WO42−等,由于其与氧极强的结合作用,使带电荷的阴离子之间产生排斥,因而又可被溶解在水溶液中进行提取。
冶金过程不只限于提取,还包括富集、纯化、精炼等。按照溶解度不同,冶金方法大致可以被分为两类,即湿法冶金和火法冶金。按离子势原则,图1对比了地球化学和冶金学在硬阳离子方面的相似性。在图2中,我们标出了更多元素的阳离子离子势,并考虑了相同元素的不同价态[35]。例如,KMnO4中的锰(Mn)的化合价是+7、离子势为8~16,而MnO中的Mn的价态是+2、离子势为2~4,因此前者是一种复杂阴离子,而后者是简单阳离子。
在图2中,虚线斜率的倒数为离子势,它可以表示离子与氧的结合能力。基于图1所示的趋势,离子势很低或很高时,离子的水溶性较高,而离子势越趋于中间,离子水溶性越差。低离子势的阳离子,与氧的结合能力较弱,在水溶液中以简单阳离子形式游离存在;高离子势的阳离子,与氧的结合能力极强,可单独束缚多个氧离子,形成复杂阴离子,也溶解在水中;而中等离子势的阳离子(离子势2~8)由于与氧的结合能力适中,所以多个离子与多个氧离子共同结合,形成难溶于水的氧化物矿物,如前面提到的铍石、刚玉、金红石、斜锆石。相应地,针对这些氧化物矿物的湿法提取方法所需要的条件往往极为苛刻。例如,拜耳法[36]就是通过极高的碱浓度和极高的温度实现铝土矿的浸出。
《图2》
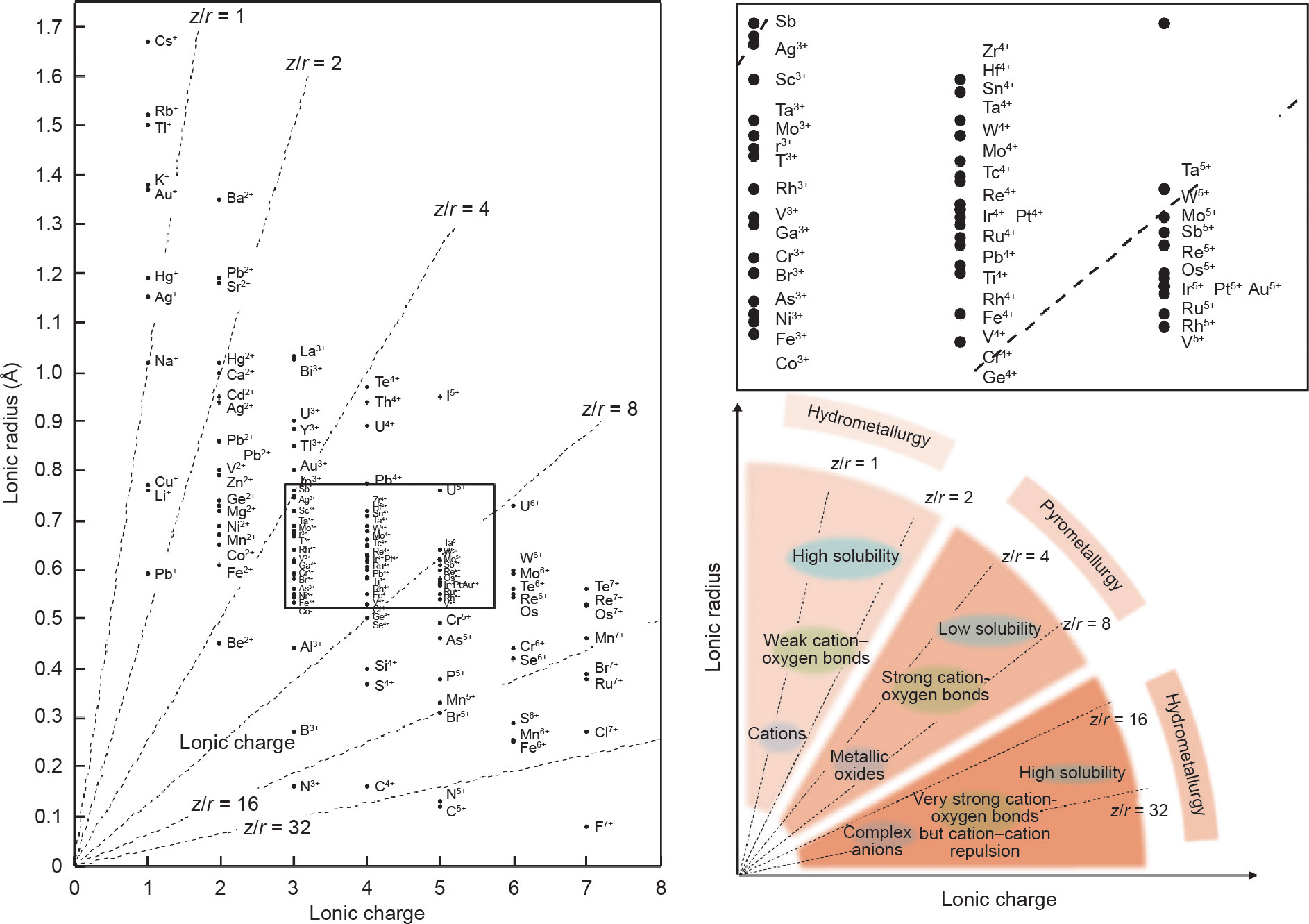
图2. 带有不同电荷的元素的离子势及其规律图。
以上规律可概括为:当离子与氧结合能力较弱时,形成的氧化物可以在水溶液中实现分离;当结合能力有所增强时,对应元素的提取则变得困难;当结合能力极强时,由复杂阴离子形成的化合物又会因阴离子的排斥作用而使溶解度增加。基于这种规律和实际案例,火法冶金法针对的对象多集中于离子势中间的位置,而湿法冶金法针对的对象则分布于低离子势和高离子势两端。
锂(Li)是21世纪的一种能源金属,目前大多数锂来自于锂云母或锂辉石[37]。事实上,Li+ 作为一种低离子势的离子,其水溶性较好。锂资源更多地分布于多个盐湖,单个盐湖中的平均锂储量为1.45 Mt,远超过单个锂矿中的平均锂储量(0.11 Mt)。盐湖中的锂资源(21.6 Mt,分布于阿根廷、玻利维亚、智利和中国)占据全球锂资源(31.1 Mt)的70%左右[38]。因此,未来锂冶金技术将从火法焙烧锂矿石[22]转向湿法提取盐湖锂[21,39,40],这也说明了元素地球化学正在影响着锂冶金技术的发展。
《4. 元素亲和性的冶金解度》
4. 元素亲和性的冶金解度
1922年,Goldschmidt通过研究陨石和冶金熔炼产物[41]后,首次提出了元素亲和性这一概念,他将元素分成了亲石元素、亲铜/硫元素、亲铁元素、亲气元素四个类别[19]。Railsback的研究(图3)[1]大体上继承了Goldschmidt这一划分。Railsback在周期表中将Cu2+/Cu+ 、Ag+ 、Hg+ /Hg2+、Tl+ 、Pb2+、Bi2+、Sb3+和As3+都用“S”进行标识,表示容易形成硫化矿物的元素。然而,巧合的是,在Goldschmidt的分类中,这些元素也都在亲铜/硫元素区域。但是,同一种元素往往存在不同价态,其亲和性也存在差异,所以Railsback以离子进行分类的周期表似乎更准确。例如,As3+非常亲铜/硫,而氧化后的As5+显示出亲石性;Mo4+以辉钼矿MoS2展示出亲铜/硫性[42],而Mo6+却以钼酸盐MoO42−的形式展现出亲石性。因此,Railsback的周期表考虑了元素的多价态,且更具有实用性。
《图3》

图3. 地学周期表中常见元素的地球化学亲和性。
氧化与还原反应是冶金过程中常用的方法。在很多情况下,元素化合价的改变往往伴随着亲和性的改变,并且元素会从一个相转移到另一个相,实现富集或提取。研究地球化学过程中元素不同价态的亲和性,有助于理解其在冶金过程中相间的转移行为。复杂多样的地球环境可提供一系列地球化学实例。因此,虽然 Goldschmidt的分类表未包含元素的离子状态,但其对元素的总结分类仍非常有意义,尤其对火法冶金。按照 4种分类具体来说(图4)[43–49]:①亲石元素对应冶金炉渣,如高炉渣、转炉渣、精炼炉渣等,这些炉渣往往包括Al2O3、SiO2、FeO、MgO、CaO中的两种以上;②亲铜/硫元素对应冶金过程中的“锍”,通常是铜锍或镍/ 钴锍(如Cu2S、Ni3S2、CoS);③亲铁元素对应亲金属或合金;④亲气元素对应冶金过程中的气相(如H、C、N、 O以及很容易以CO、CO2、H2O、SO2、N2、Ar等形式进入气相的惰性气体)。以下列举3个典型的案例。
《图4》
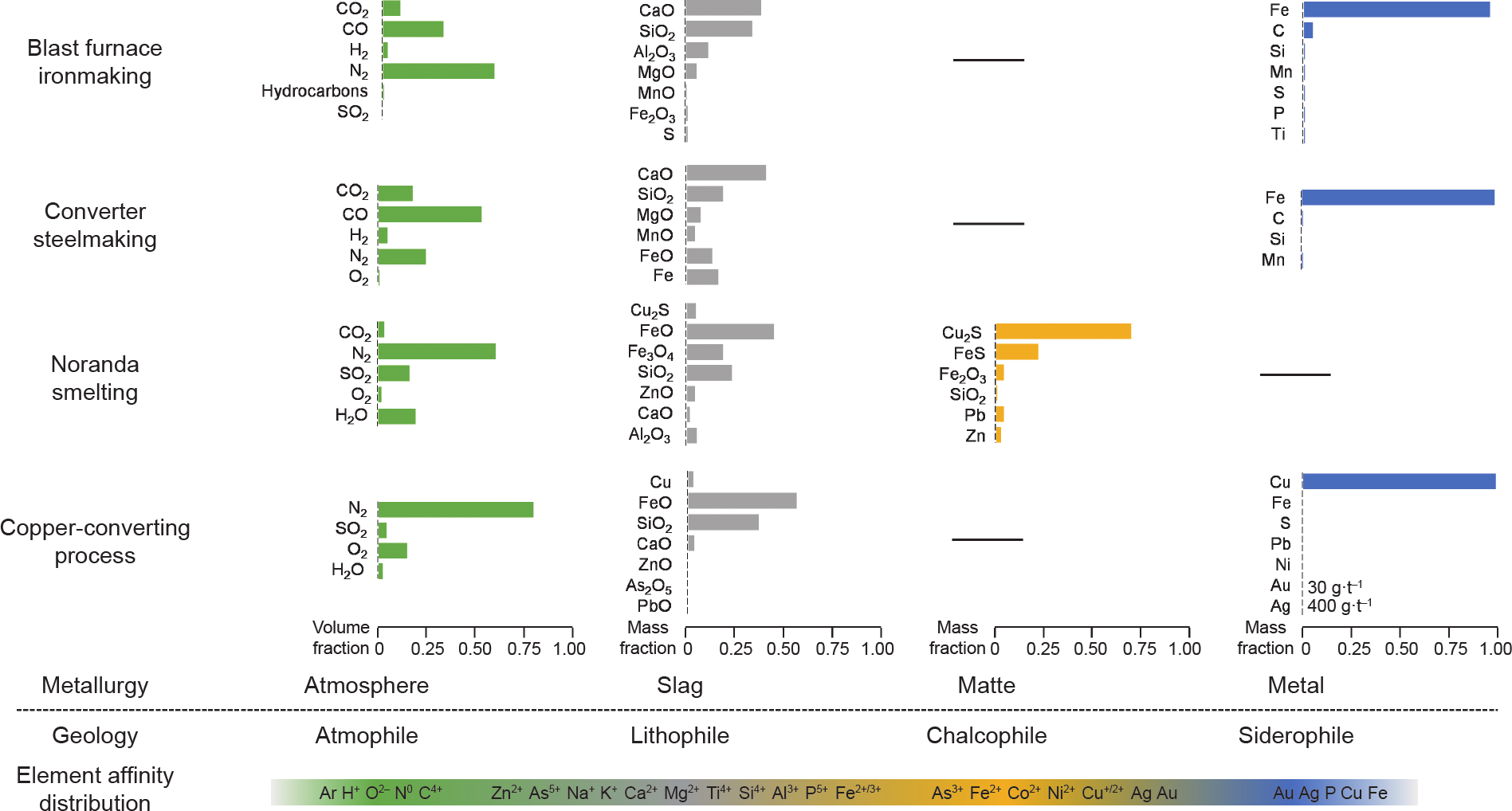
图4. 地质学和冶金学中的元素亲和性。高炉炼铁[43–45]、转炉炼钢[46–48]、诺兰达造锍[49]、转炉炼铜[49]。
如图3所示,在Goldschmidt的分类表中,磷(P)是一种亲铁元素,其依据虽然难以考究,但很可能源于冶金学的知识。因为在高温碳还原过程中,矿物中的绝大部分P会被还原并溶解到铁水中[50]。而钢中含P会产生冷脆问题,因此炼钢过程中的一个重要任务就是除P [51,52]。转炉炼钢过程主要涉及两个相,即熔渣相(Al2O3-SiO2-CaO-FeO)和金属相(Fe)。与高炉炼铁过程中P的走向不同,在转炉炼钢过程中,随着吹氧过程产生的氧化,铁(钢)水中的P会进入渣相。这个例子说明,P在高炉中是亲铁元素,而在转炉中随着氧化, P从亲铁元素P0 转化为亲石元素P5+,即P从铁水进入渣相完成了除P过程(图5)。
《图5》

图5. P在炼铁过程和炼钢过程中的转化与迁移。
与上述过程相似的是As的价态与亲铜/硫和亲石性质。在Goldschmidt的分类表中,As被归为亲铜/硫元素,但在Railsback的周期表中,只有As3+会形成硫化矿物[53],而As5+更接近亲石元素。这在铜冶金的造锍熔炼(类似于诺兰达工艺)和转炉吹炼过程中得以证实。如图6所示,造锍熔炼过程主要涉及两个相:锍相(Cu2SFeS)和炉渣相(SiO2-Al2O3-CaO-FeO)。起初,大部分 As都倾向于留在锍中[54],这说明As确实是一种亲铜/ 硫元素。然而,随着吹炼过程的进行,As被氧化为As5+ [式(1)]后从锍相迁移进入炉渣相,甚至以烟尘的形式进入炉气[55]。As的这些行为表明,As不仅是一种亲铜/硫元素,它还会随着化合价的改变转变为亲石元素。地学周期表将As按照As3+和As5+单独列出,其准确性更好。
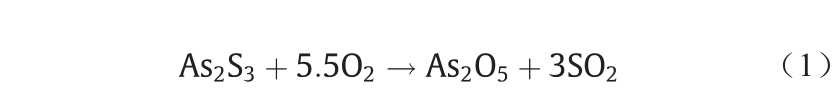
《图6》
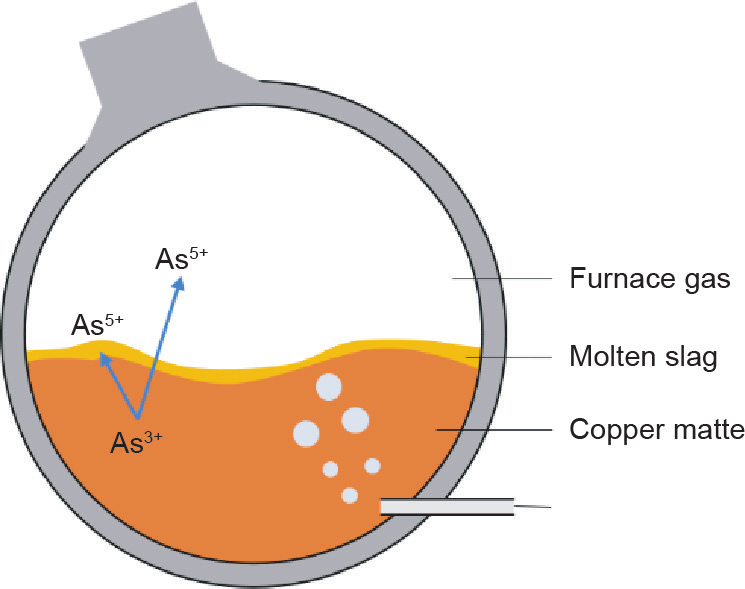
图6. As在铜锍转炉吹炼过程中的转化与迁移。
在Goldschmidt的分类表中,Mo是亲铁元素,而 W是亲石元素。与之不同的是,在Railsback的周期表中,只有Mo4+与W4+被标记为“S”,而Mo6+和W6+却没有。其中的原因可能是Mo主要以辉钼矿(MoS2)形式存在,而W主要以钨酸盐[CaWO4或(Fe,Mn)WO4]形式存在。但即使在W和Mo都是+6价的条件下,Mo也比 W更具有亲硫性。Helz等[56]和Mohajerin等[57]曾提出一种Mo的成矿过程,即在深海中(即厌氧条件下)以及H2S存在的情况下,MoO42−会在Fe2+的共同作用下形成Mo-S-Fe化合物(图7)。基于这种元素与元素间亲和性的差异,在W冶炼领域有一种从W溶液中去除Mo的方法[9],其原理如图8所示。该过程首先在W溶液中加入S2−或HS−作为硫化剂,从而将MoO42−转化为MoOxS(4−x)2− 甚至MoS42−,然后加入Fe2+、Cu2+或Co2+等与之形成共沉淀,实现Mo的去除。在该过程中,W仍然保持为WO42−被留存在溶液中。Mo在自然水体中的成矿过程以及Mo 在冶金过程中的去除都可以用公式(2)表示。
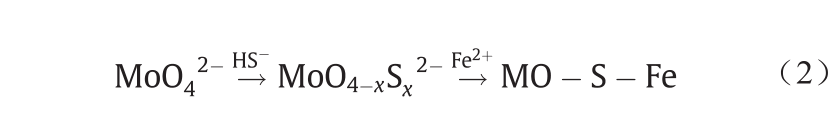
《图7》
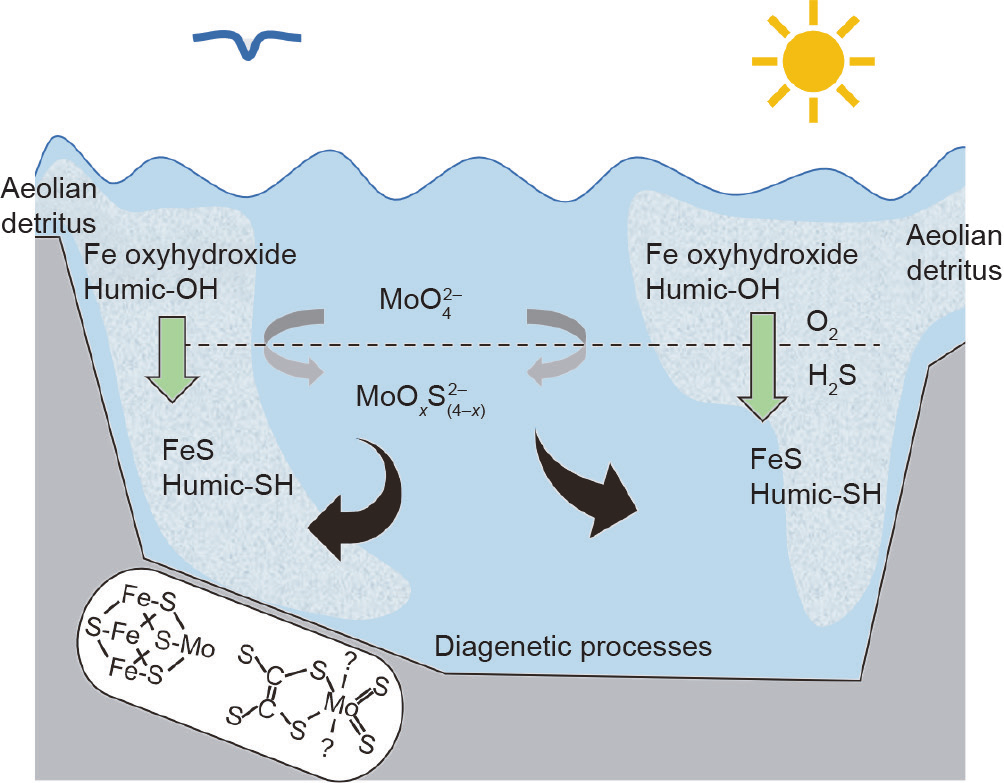
图7. 厌氧滨海盆地中Mo的自净化过程[56]。
《图8》

图8. 通过形成硫代钼酸盐从含W溶液中去除Mo。
如图4所示,除了气相外,钢铁冶金和铜冶金过程主要涉及三个熔体相,并且其元素分布与元素亲和性一致,元素的迁移即发生于两相之间。冶金过程的普遍规律如下:亲石元素容易形成氧化物渣,亲铜/硫元素容易形成锍,亲铁元素则倾向于进入金属熔体。另外,相同元素的不同价态会表现出不同的亲和性。
如图9所示,一个典型的例子是,铜镍冶炼过程中会同时涉及三个熔体相,即氧化物渣相(主要是FeOSiO2-CaO)、高镍铜锍相(NiS和Cu2S)和金属相(NiCu),而铂族金属及Au等亲铁元素很容易在金属相中富集[58]。在还未产生Ni-Cu合金之前的造锍熔炼中,Au、 Ag及铂族金属(PGE)会进入锍相。在随后的吹氧熔炼过程中,Ni-Cu合金相出现,Au、Ag及PGE又从锍相进入金属相,这使得贵金属(PGE、Au和Ag)在金属相中的富集量(551.01 g·t−1)是锍相中富集量(28.45~88.7 g·t−1) [59]的几十倍。含有贵金属的Ni-Cu合金,可以通过再次硫化,获得减量的二次合金,其中铂族金属(Pt、Pd、 Ru、Os、Ir、Rh)的浓缩可被再次提高5~8、10~15、 7~14、3~5、1~3、6~9倍[60]。这个例子很好地体现了火法冶金过程中地球化学元素的亲和性,说明Au、Ag和 PGE的亲和性顺序为亲铁性>亲铜/硫性>亲石性。
《图9》

图9. Au、Ag及PGE在Ni-Cu锍转炉吹炼过程中的富集行为。
《5. 湿法冶金中的氟和氯亲和性》
5. 湿法冶金中的氟和氯亲和性
除了O2−和S2−之外,卤族元素(F−、Cl−、Br−和 I−)也是自然界中常见的阴离子,并且F−和Cl−对元素的迁移,尤其是热液成矿[61,62]发挥着重要作用。由于F−和O2−强烈的电负性,在地学周期表中氟化物矿物大多分布在“硬阳离子”[63]区,如萤石(CaF2)、黄玉(Al2SiO4·F2)、冰晶石(Na3Al2[LiFe4]3)和氟硼钾石 [(K,Cs)BF4]。与之相对的是,“软阳离子”区的亲铜/硫元素(Cu+/2+、Ag+ 、Pb2+等)倾向于形成氯化物矿物,如斜氯铜矿[CuCl2·3Cu(OH)2]和角银矿(AgCl)。因此,硫化物和卤化物的溶解度[64]在一定程度上说明,金属阳离子与简单阴离子间的亲和性关系。如图10所示,亲氧型阳离子(Li+ 、Na+ 、K+ 和Mg2+)与F−、Cl−、Br−、I−的结合能力逐渐降低,因此其各种卤化物的溶解度不断上升,而亲硫型阳离子(Hg2+、Ag+ 、Cu+ 、Tl+ 和b2+)等卤化物的溶解度变化趋势与之相反(AgF除外)[65]。软硬酸碱(HSAB)原理[66,67]解释了很多实际的地球化学现象。例如,F−很容易与硬阳离子结合并固化在地壳中,而大部分的Cl−以及Br−和I−存在于自然水体中 [68]。再比如,亲氯或亲硫元素很容易与Cl−和S2−形成配合物(如AuCl4−、[AuS]−和[CuCl2]−),而且许多元素以此进行迁移和矿化。湿法冶金主要针对的是水溶液中的金属阳离子和简单阴离子,因此HSAB原理和氟/氯亲和性分类都非常具有实用性。以下几个例子可以用来解释这种相似性。
钽(Ta)、铌(Nb)与氧之间有中等强度的结合能,这使得由它们形成的金属氧化物(Ta2O5、Nb2O5)矿物,很难通过一般的酸浸或碱浸方式溶出。因此,通常利用HF将此类氧化物浸出,并将其转化为含氟化合物(H2TaF7、H2NbF7),这是基于亲氧型阳离子也亲氟的性质。另一个例子是,亲硫元素通常也亲氯,因此,在冶金过程中经常通过添加Cu+ 来净化电解液中的Cl− [69]。此外,亲硫元素(如Au+/3+)不仅容易与Cl−和S2−结合,也会以复杂离子Au+/3+形式溶解于多硫化物中,这说明亲硫元素容易与Cl−、S2−、NH4−、CN−形成金属配合物。
如图10所示,亲氯型金属阳离子对Br−和I−有更强的亲和性,因此,软/硬阳离子对氟和氯的亲和性可能是其对卤族元素亲和性规律的一部分。
《图10》
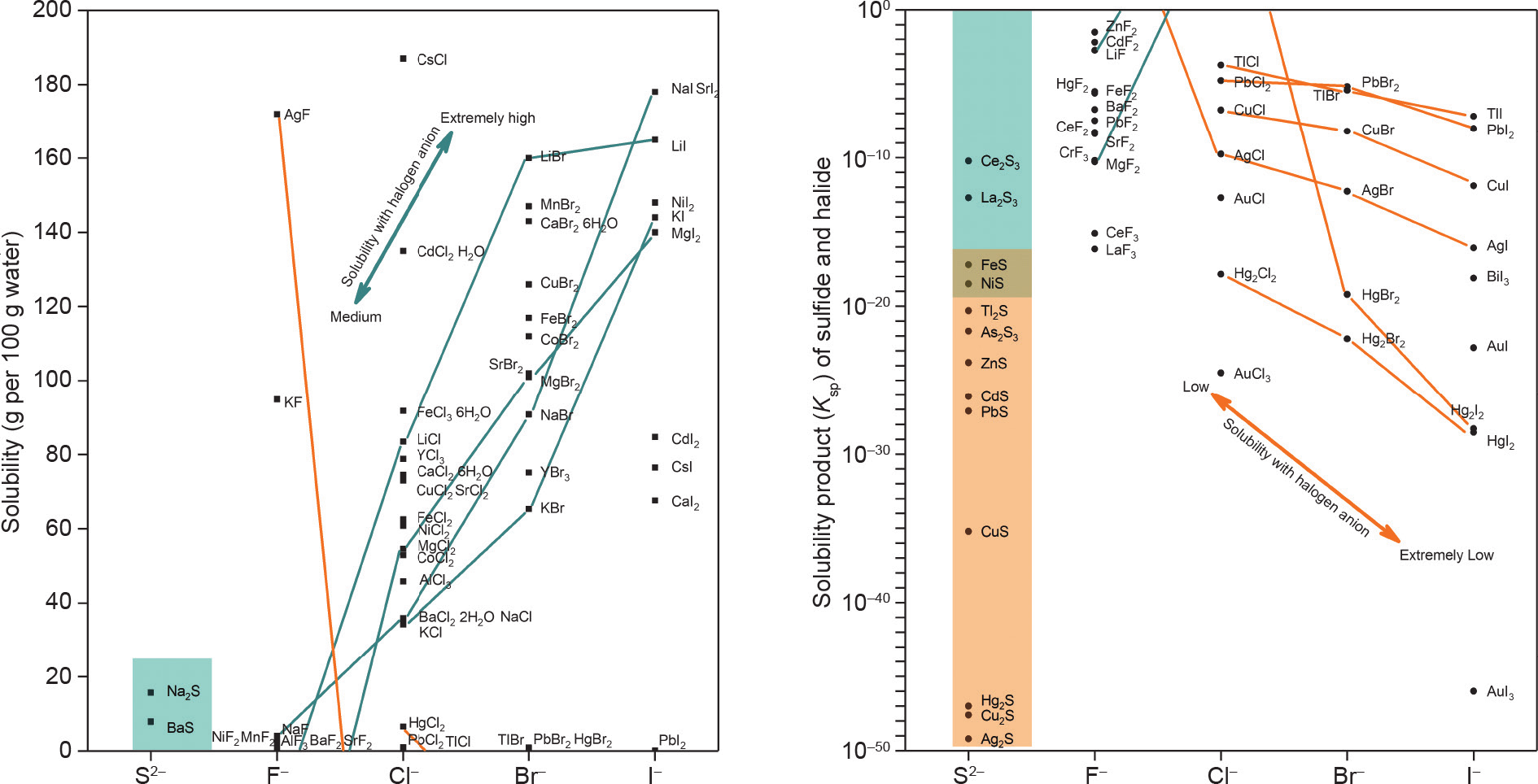
图10. 常见硫化物和卤化物的溶解度。
Au3+是一种亲氯或亲硫型阳离子,对Cl−有很强的亲合能力。如图11所示,自然界中Au在O2的氧化与Cl−的配合作用下形成AuCl4−进行迁移[式(3)]。当它遇到 Fe2+等还原剂时,Au3+被还原为Au0 并析出[式(4)]。
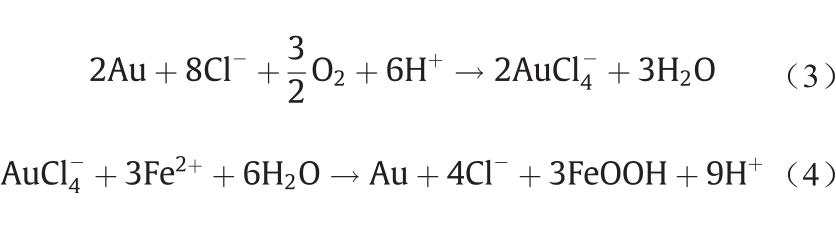
《图11》
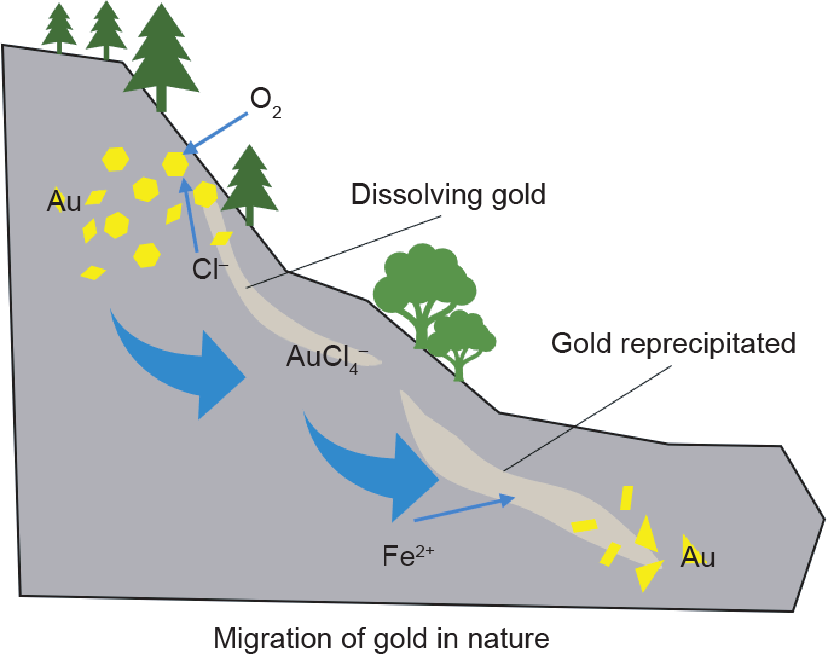
图11. Au与O2、Cl−、Fe2+的反应及溶解和析出过程。
与之类似的是,湿法冶金氯化提Au也包含这两个过程,即溶解与析出[70,71]。通过在含Cl−溶液中通入 Cl2可将载Au矿物溶出[式(5)、式(6)],然后浸出液用金属粉末进行还原,从而析出Au [式(7)、式(8)]。具体化学反应如下所示。
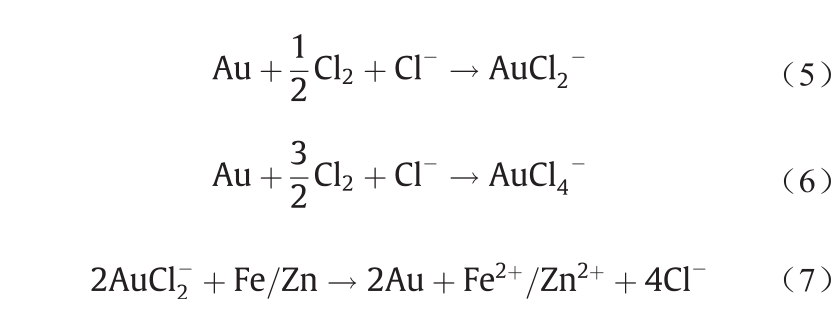
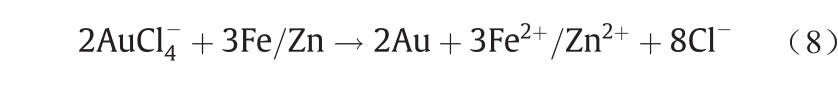
尽管地球化学的自然过程与冶金学的人工过程属于两个不同的学科,但上述Au的迁移实例的相似性证明了两者都有相同的化学机理。
《6. 总结和结论》
6. 总结和结论
地学周期表对元素周期表的重新解读与许多冶金学规律相关。新表中元素的地球化学规律与冶金方法关系紧密,即元素在自然矿物中的行为与其在冶金中的迁移和亲和性都很相似,具体可总结如下:
(1)高离子势和低离子势离子的提取通常可以采用湿法冶金的方法,而中等离子势的离子往往适合火法冶金提取;
(2)Goldschmidt的元素亲和性分类适用于冶金学中元素行为的分析,而地学周期表对同一元素的不同价态进行了更为准确的定义,而且对冶金过程中元素行为的描述更为精细;
(3)软/硬阳离子的亲氯和亲氟性的规律性特征可被用于冶金学。
总的来说,地球环境不仅产出大量的自然资源,其自然演化过程也为冶金过程提供了许多可借鉴的案例。利用地球化学规律来拓宽冶金视野是一种新的认识方法。
《致谢》
致谢
本工作得到了国家自然科学基金重点项目(51334008)的资助。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Fenglong Sun and Zhongwei Zhao declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




