《1. 引言》
1. 引言
根据病毒表面抗原的多样性,甲型流感病毒(influenza A viruse, IAV)分为多个亚型和两种主要的病理型,其中也包括了高致病性和低致病性禽流感病毒[1,2]。到目前为止,IAV中具有高致病性的禽流感病毒都属于H5/H7亚型[3]。2013年春季出现了一种新禽源流感病毒,引起人类严重致命性的呼吸系统疾病[4]。这种新型病毒与在活禽市场中禽类分离出的病毒具有相似的基因特点[4]。它是一种重组病毒,其主要衍生自IAV的H7N3、H7N9和 H9N2亚型[5−7]。尽管H7N9对禽类的致病性较低[8],但人类更易感染,尤其是在活禽市场中,与感染H7N9的禽类密切接触后[4,9],H7N9病毒能够在哺乳动物宿主之间传播而不会丧失毒力[10],在H7N9家庭聚集发病的患者[14,15]中证明存在有限的人传人的风险[11−13]。自 2013 年出现第一例H7N9病例以来,已有6次季节性流行。在2016年以后病毒显示了更强的毒力[16,17]。因此,控制H7N9引起的急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)将有助于治疗H7N9感染患者。
H7N9病毒感染在肺部表现为重症肺炎、急性呼吸窘迫综合征和呼吸衰竭等,它也可以通过细胞因子风暴引起其他肺外疾病,包括横纹肌溶解和脑病[4,18,19]。当前没有可用于预防H7N9感染的特效性疫苗,危重症H7N9 患者主要的治疗手段还包括体外膜氧合(extracorporeal membrane oxygenation, ECMO)和血液净化治疗[20−22]。而且,重症患者还需要面临病毒的耐药性,以及继发感染引起的多器官功能障碍等一系列问题,因此迫切需要探索一种有效的治疗策略来对抗H7N9感染。近期,在中国武汉暴发流行的新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)已引起全球关注[23−25],由于缺乏对该病足够的认识,近距离间相互接触,人员流动性大以及该病毒在人际的传播能力等原因,感染患者数量迅速增加[26−29]。目前,尚没有有效治愈COVID-19的方法。COVID-19和H7N9感染具有相似的呼吸系统表现(如 ARDS和呼吸衰竭)以及多器官功能障碍,并且病理表现为伴有肺炎病变和结构性损伤[24,30]。因此,针对H7N9感染所致ARDS的治疗策略的突破,将对于治疗COVID-19至关重要,尤其是对ARDS型的危重症肺炎患者。
目前已知的药物治疗不能有效控制肺损伤,因此我们利用间充质干细胞(mesenchymal stem cell, MSC)的无限自我更新和多能性的特点,将MSC疗法探索性地应用于临床。ARDS的实验治疗发现,MSC通过抑制肺泡塌陷、胶原蛋白积聚和肺组织中的细胞凋亡获得临床疗效。临床上, Wilson等[31]对9名ARDS患者使用同种异体MSC治疗,研究中未发现不良事件,包括低氧血症、心律不齐和室性心动过速等。经血来源的MSC由于其来源丰富、采集方便、增殖率高的特点,已逐渐引起了人们的广泛关注[32−34]。
本研究首次在H7N9感染的ARDS患者中临床应用经血来源的MSC,报道了在ARDS不同阶段进行MSC移植的疗效,并且评估了MSC移植后长期安全性和肺功能的改善情况。该研究揭示了MSC在H7N9感染的ARDS中的临床有效性和安全性,预示着MSC在未来救治急性危重型肺炎的临床研究中具有较广的应用前景。
《2. 材料和方法》
2. 材料和方法
《2.1. 研究对象》
2.1. 研究对象
本研究为单中心开放性临床研究,通过了浙江大学医学院附属第一医院伦理委员会的批准,将2013年3月22 日至2014年2月10日入住浙江大学医学院附属第一医院的确诊为H7N9感染所致ARDS的患者纳入研究。ARDS患者定义为PaO2:FiO2小于200 mmHg (1 mmHg = 133.3 Pa),胸片提示双肺浸润病灶,需要使用气管插管接机械通气者 [35,36]。签署知情同意书后,17名患者在常规治疗基础上选择在ARDS的急性期或晚期接受MSC移植治疗,为 MSC组;44例患者接受常规治疗,为对照组。
《2.2. 干细胞来源和制备》
2.2. 干细胞来源和制备
在签署捐献知情同意书后,从健康的女性捐献者(20~45岁)经血中分离获得了同种异体的MSC。在进一步扩大培养之前,检测并确认经血中单个核细胞的核型、细胞分化能力、细胞活力和无菌性指标。在MSC汇合率达到70%~80%时,将细胞进行传代。在临床使用之前,由干细胞临床研究中心实验室操作并将MSC重新悬浮在Plasmalyte-A中,治疗组中每位患者的MSC总容量为 100 mL。
《2.3. 实验室指标检测》
2.3. 实验室指标检测
浙江大学医学院附属第一医院医学检验科完成实验室指标检测,包括血常规、肝功能、炎症指标、肾功能和心肌酶谱等。将与H7N9诱发的ARDS患者的临床特征和治疗结果相关的因素纳入分析:①基线特征,包括年龄、基础疾病和临床症状;②实验室检查数据和影像数据;③联合基础治疗、抗病毒治疗、抗生素治疗、血管活性药物、糖皮质激素治疗、机械通气、ECMO、人工肝支持系统(artificial liver support system, ALSS)和持续肾脏替代治疗(continuous renal replacement therapy, CRRT)的综合治疗。
《2.4. 治疗方案》
2.4. 治疗方案
根据标准治疗方案,对所有患者使用抗病毒药物(奥司他韦或帕拉米韦),并根据血培养、咽拭子标本或痰培养的阳性结果给予抗生素。通过吸氧、无创通气和有创通气,以维持最低SaO2为90%。此外,当PaO2:FiO2<80时,通过股静脉和颈内静脉置管进行ECMO。血流动力学不稳定时单用或联用去甲肾上腺素、多巴胺和肾上腺素。另外,部分患者接受了糖皮质激素治疗,包括甲泼尼龙和地塞米松,以控制炎症反应。有严重的血液动力学不稳定和多器官功能障碍的患者,包括急性肾损伤、体液过多、肺水肿和严重的电解质紊乱,均予以CRRT,肝衰竭的患者接受人工肝治疗。
《2.5. 细胞移植和临床观察》
2.5. 细胞移植和临床观察
签署知情同意后,实验室制备MSC,治疗1 h前研究人员在床边持续观察患者血流动力学和呼吸参数,以确保 MSC移植前患者的状况稳定,然后使用标准血液过滤器管路套件开始输注细胞。输注期间,研究人员在床旁持续观察是否出现不良反应。3例患者在H7N9感染早期接受了3次MSC/例的输注,6例患者在H7N9感染晚期接受了 3次MSC/例的输注,8例患者在晚期接受了4次MSC/例的输注。单次输注MSC的细胞数量为每千克体重100万个。患者在输注MSC的治疗过程中,均未发生与MSC输注相关的急性毒性或严重不良事件,患者可耐受多次静脉内输注MSC治疗。
《2.6. 干细胞移植患者随访》
2.6. 干细胞移植患者随访
在MSC移植之前和之后采集血液样本分别进行实验室指标检查,包括血常规、肝功能、炎症指标、肾功能和心肌酶谱等。患者输注MSC后1周、1个月、3个月、6个月和12个月后对上述参数进行了复查。存活患者分别在短期(1~3个月)、中期(6个月)和长期(12个月)进行了胸部CT评估,在6个月和12个月评估患者的肺通气功能,并完成SF-36健康调查问卷,以评估健康相关的生活质量。如果患者无法进行面对面的采访,则致电获取生存信息。
《3. 统计学方法》
3. 统计学方法
由于我们研究的样本量很小,因此使用了单变量分析。Kolmogorov Smirnov检验计量资料的正态性分布,基线数据以平均值±标准差/中位数显示。计量资料使用t 检验或Mann-Whitney U检验分析,分类变量使用Fisher检验分析。独立样本t 检验来评估随访6个月和12个月的SF-36 评分。所有数据使用PASW Statistics软件版本22进行统计分析。P<0.05被认为具有统计学意义。
《4. 结果》
4. 结果
《4.1. 间充质干细胞和患者特点》
4.1. 间充质干细胞和患者特点
MSC的核型表现正常[37]。其生存能力维持在 90%~95%。此外,MSC的表面标记分子和三系分化潜能也已经在我们之前的研究中得到了证实[37,38]。
MSC组和对照组的所有患者均按照标准疗法接受抗病毒药物治疗。图1显示了该临床研究的流程图。如表 1 所示,参加MSC组患者有17例,对照组有44例。MSC 组和对照组患者的平均年龄分别为(62.8±14.4)岁和(61.6±11.8)岁。与对照组相比,MSC组中合并休克的患者更多(P = 0.030),表明MSC组中H7N9感染的ARDS 患者经历了更严重的循环障碍。最终,对照组中有24例患者死亡,而MSC组中有3例患者死亡。MSC组的存活率明显高于对照组(MSC组为82.4%,对照组为45.5%;P = 0.006)。
《图1》

图1. H7N9感染患者临床试验流程图。
《表1》
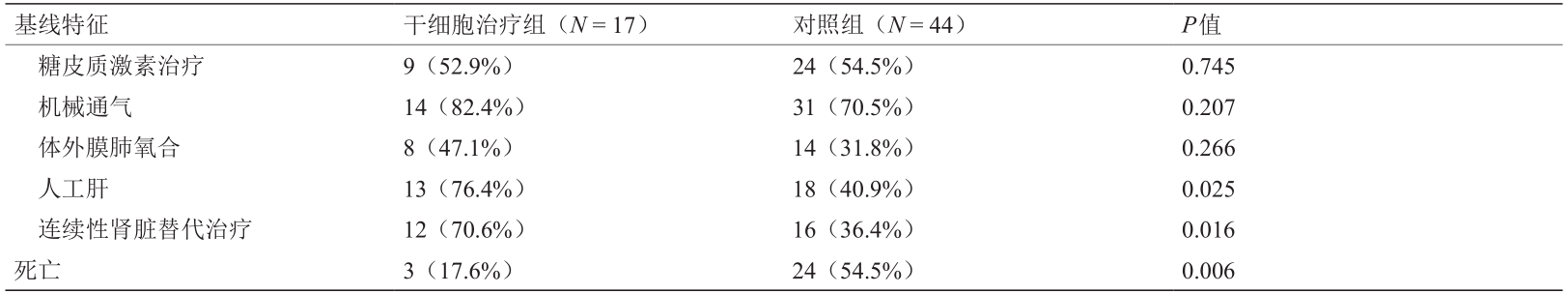
表1 61例H7N9感染的ARDS患者的基线特征

《4.2. 两组标准治疗》
4.2. 两组标准治疗
MSC组有14例接受了抗生素治疗,对照组有36例接受了抗生素治疗。由于血流动力学不稳定,12名MSC组患者和19名对照组患者接受了血管活性药物治疗。MSC 组中的9例患者和对照组中的24例患者接受了糖皮质激素治疗。MSC组中的14例患者和对照组中的31例患者接受了机械通气。MSC组的8例患者和对照组的14例患者接受了ECMO治疗。31例患者接受人工肝治疗,其中MSC 组13例、对照组18例。28例患者接受了连续肾脏替代,其中包括MSC组的12例和对照组的16例患者。除人工肝和连续肾脏替代治疗外,两组的标准策略使用频率没有差异。
《4.3. 基线临床症状和实验室特征》
4.3. 基线临床症状和实验室特征
如表2所示,入组患者中共有58人发热:MSC组17例(100%)、对照组41例(93.2%)。MSC组的大多数患者患有咳嗽(94.1%)、咳痰(76.5%)和呼吸急促(82.4%)。 MSC组肺外表现为疲劳(52.9%)、肌肉酸痛(35.3%)。对照组患者表现相似,有咳嗽(84.1%)、咳痰(54.5%),但疲劳(13.6%)和呼吸急促(31.8%)患者比例较低。
《表2》
表2 61例H7N9感染的ARDS患者的临床症状

如表3所示,两组的基线实验室指标包括血常规、肝功能、肾功能及肌酸激酶,均无统计学差异。对照组中降钙素原水平高于MSC组,而两组中C反应蛋白水平相似。这表明两组患者在我们的研究中具有可比性。但是,出院时,MSC组和对照组之间的血液指标存在显著差异,对照组的降钙素原水平明显高于MSC组(表4)。对照组的血清肌酐水平显著高于MSC组[(105.54±96.52) vs. (63.00±38.55) μmol·L−1, P = 0.019],表明对照组中合并有严重肾脏疾病的重症患者比例更高。对照组的肌酸激酶、凝血酶原时间和D-二聚体水平显著高于MSC组。由于两组的大多数实验室特征相似,因此这些显著差异可能与对照组较高的病死率相关。
《表3》
表3 61例H7N9感染的ARDS患者入院时实验室检查


《表4 》
表4 61例H7N9感染的ARDS患者出院时的实验室检查


《4.4. 4 例干细胞治疗患者 5 年随访》
4.4. 4 例干细胞治疗患者 5 年随访
如表5所示,在MSC移植后4名患者的血红蛋白水平显著上升,凝血酶原时间缩短。5年随访的实验室参数结果提示MSC移植并未对患者产生有害影响。
《表5》
表5 4名MSC治疗的ARDS患者随访5年的实验室检查

对该4例MSC移植患者同时进行了为期5年的肺功能随访(表6),在急性期肺通气和弥散功能障碍持续存在,在此后随访1年至5年期间,一秒钟用力呼气容积/用力肺活量(FEV1/ FVC)、用力呼气流量为50%肺活量时的呼气流速(forced expiratory flow at 50% of vital capacity, FEF50%)无明显变化。
《表6》
表6 4名MSC治疗的ARDS患者在随访5年内的肺功能指标

在进行MSC治疗之前,患者胸部影像学检查提示磨玻璃样病变和融合成片病灶。对4名接受MSC治疗的患者进行了5年的影像学随访期间,肺部影像表现为包括纤维条索、空气支气管征、支气管扩张、局部胸膜增厚、磨玻璃样病变和胸水。随着时间推移,这些改变逐渐消除,同时在8~12周时肺部CT观察到了肺囊性扩张和新结节(图 2、附录 A中的图S1)。MSC移植后24周和1年,4名患者的肺部CT均有改善。
《图2》

图2. MSC治疗后对4例患者进行了5年的随访,这里提供了一例患者的图像。在MSC移植之前,肺部CT表现为磨玻璃样改变、渗出实变病灶、纤维条索(a)。随访期间肺部CT表现:空气支气管征、磨玻璃样改变、支气管扩张、纤维条索、局部胸膜增厚和胸水[1周(b)、24周(c)、1年(d)和5年(e)]。随着随访时间的延长,肺部CT表现均有改善。
选择SF-36量表评估4例MSC移植患者的生活质量,随访两年后,我们发现SF-36的所有要素得分在随访期间均无显著差异。因此,这表明MSC移植未影响患者的长期生活质量。
《5. 讨论》
5. 讨论
患有H7N9感染的患者临床表现多为发热、咳嗽咳痰和呼吸急促。部分患者可迅速发展为重症肺炎、中度至重度ARDS以及脓毒症休克。Gao等[36]证明难治性低氧血症是患者死亡的主要原因之一,而全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)可能是发病机理中的主要致死因素。本研究中对照组的病死率为 54.5%,MSC组的病死率为17.6%。根据临床观察,任何患者均未发生肺栓塞病例,标准治疗和MSC移植联合治疗后1到12个月,大多数临床症状得到缓解。这些发现表明,MSC移植应用于H7N9感染的重度肺部疾病的患者是一种安全有效的疗法。同时,长期的随访中也没有发现与MSC相关的不良事件。Zheng 等[39] 对12例中度至重度ARDS患者进行干细胞治疗,未出现输注毒性或与MSC相关的严重不良事件,与我们的研究结果相似。尽管本研究中MSC的来源和剂量与Zheng等使用的不同,但我们发现在耐受性和安全性方面的一致性,其结果是令人鼓舞的。
在长期的随访中,ARDS患者的肺功能都有明显改善。与先前报道[40]一样,患者出院后1~6个月状况好转明显优于6~24个月。对ARDS幸存者的长期预后研究显示, 3个月后仍留存有轻度限制性通气功能障碍和中度CO弥散功能降低[41]。已发现感染H1N1的患者的肺功能除了弥散功能下降外,其他参数几乎是正常的[42]。在对H1N1感染相关的严重ARDS者为期1年的随访研究中发现,纤维化和肺实质病变是非常普遍的临床现象。但随着时间的推移,两者得到显著改善,尤其是在出院后的 6个月内改善明显[43]。在前 3个月期间,超过85%的患者磨玻璃表现明显改善[44]。但在 1年后,间质纤维化和磨玻璃病变改善就不明显了[42]。这些特征与本临床试验中患有H7N9感染的幸存者的特征一致。
随访过程中,我们发现患者返回家中后,不仅缺乏基本活动能力,而且由于亲戚和邻居害怕被感染,患者通常被孤立。这些幸存者的生存质量明显低于正常人群,这可能是由于社交功能和心理健康缺陷所致。此外,一项meta分析表明,ARDS 幸存者的生存质量在出院后的最初 6个月内得到显著的改善[45]。这些研究结果提示我们感染IAV 的 ARDS幸存者的生活质量比没有IAV感染史的人的生活质量差。所以,我们建议加强出院康复期间对此类患者的护理,着手启动各种社交互动,恢复生活质量。
自2019 年12月中旬以来,中国各地均报道了 COVID-19病例[46,47] ,COVID-19表现出快速的人际传播能力[48–50]。截至 2 月21日,全球已报告了 76 662例病例,其中大多数在中国,死亡人数已超过2230例。Xu等[30]根据1例COVID-19重症肺炎患者的尸检病理特征,发现有COVID-19患者死于重度ARDS 。COVID-19相关的ARDS的病理特征与 H7N9感染的ARDS异常相似。感染H7N9的患者和COVID-19的患者呼吸道临床症状相似,包括发热、咳嗽咳痰、呼吸急促和呼吸困难,并伴有ARDS或肺纤维化。因此,我们推测COVID-19相关ARDS的患者可能会受益于包括MSC治疗在内的新方法。
本研究是第一份评估H7N9感染ARDS患者MSC治疗后健康状况的前瞻性和系统性报告,同时仍存在一些局限性。首先,这项研究在单中心开展,病例数较少,在抢救性救治同时无法完美地按部就班进行。其次,我们应该指出,这不是常规的临床试验,鉴于H7N9暴发时病死率高,并且是在缺乏更好的方法时用于抢救性治疗重度ARDS患者的情况下开展的。有些患者出院后不愿意再次到医院复查,有些患者拒绝参加,有些患者没有完成随访。尽管在该临床试验中未观察到副作用,但我们仍然担心MSC治疗H7N9感染ARDS的长期安全性。另外,即使H7N9患者可能有潜在的肺部感染风险,但他们未经进一步检查就接受药物治疗,以至于MSC组与对照组之间无法理想化地比较肺功能指标。最后,由于样本量小,本研究很难获得大量的临床数据,并且在ARDS的重症患者中开展临床研究存在很大的困难。
在将MSC应用于临床之前,仍需要重视干细胞本身带来的一些问题。尽管MSC治疗显示出许多令人鼓舞的结果,但长期安全性仍具有争议,尤其是因为很难对所有患者进行长期随访,无法获得长期数据[51]。另一个问题是,MSC不仅具有抑制肿瘤免疫反应的潜力,而且还可以产生新生血管,从而促进肿瘤的生长和转移[52]。尽管MSC在治疗某些免疫性疾病尤其是在移植物抗宿主病(graft-versus-host disease, GVHD)方面显示出了广阔的前景,但来自不同供体和组织的MSC质量差异很大,并且在实验过程中治疗方案、剂量和注射方式也不一致[53],所有这些因素可能会限制MSC在临床应用中的治疗效果。为了克服这些障碍,未来需要更加仔细评估合适的细胞来源,收集更多相关的数据,对MSC免疫抑制功能进行更全面和系统的探索和研究。
《6. 结论》
6. 结论
从我们的临床结果来看,我们相信MSC具有减轻炎症反应和防御细胞因子风暴的潜在功能。尽管我们的研究团队已经报道了一些H7N9感染患者的临床特征研究[6,12,15,36],但是仍然有必要详细地了解发病的具体机制,进而阐明MSC治疗H7N9感染的ARDS的潜力。我们先前的研究工作[19,54,55]发现,在小鼠模型中,MSC能通过抗炎作用来改善急性肺损伤中的肺功能,潜在的机制可能是MSC通过减少炎症因子的分泌而达到抗炎作用。尽管MSC的临床研究仍处于起步阶段,但我们乐观地认为MSC(包括不同来源的MSC)将成为具有临床应用前景的治疗手段。
总之,MSC移植显著地降低了H7N9感染的ARDS患者的病死率,在治疗后连续5年随访期间,未发现严重的不良反应。在出院后两年,H7N9幸存者的长期肺功能障碍仍然是一个问题。我们目前开展的17例中重度ARDS患者的临床研究,旨在观察MSC治疗的长期安全性,以及这些患者长期的呼吸系统的恢复和生活质量的改善情况。
《致谢》
致谢
感谢浙江大学医学院第一附属医院郑树森教授、梁廷波教授和曹红翠教授对本研究开展给予的帮助。本研究得到了科技部重大新药研发专项(2018ZX09201002-005)和国家重点研发项目(2017YFA00105701)的基金支持。
《作者贡献》
作者贡献
李兰娟、项春生设计了本研究,陈佳佳、胡晨霞、陈利军具体实施研究的开展,收集、分析数据,并撰写全文;汤灵玲、朱一新、徐小微、陈露、高海女、鲁晓庆、俞亮、戴霞红参与收集及分析数据。所有作者都已阅读并同意最终定稿。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Jiajia Chen, Chenxia Hu, Lijun Chen, Lingling Tang, Yixin Zhu, Xiaowei Xu, Lu Chen, Hainv Gao, Xiaoqing Lu, Liang Yu, Xiahong Dai, Charlie Xiang, and Lanjuan Li declare that they have no conflict of interest or financial conflicts to disclose. This study was submitted to and approved by the Research Ethics Committee of the First Affiliated Hospital, College of Medicine, Zhejiang University. MSC transplantation in patients with H7N9 induced ARDS was conducted in a single center and open-label clinical trial (ChiCTR-OCC-15006355) and Clinical trial registration (No. NTC02095444).
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2020.02.006.














 京公网安备 11010502051620号
京公网安备 11010502051620号




