《1. 引言》
1. 引言
受蜘蛛丝和蚕丝纤维研究启发的蛋白纤维,由于非凡的力学性能和功能而受到广泛的关注[1–7]。正是基于出色的内在特征,这些纤维在生物医学、伤口愈合、传感器、药物输送和组织工程方面具有广阔的应用前景 [8–12]。因而,各种纺丝技术已被广泛用于制备蛋白纤维,包括电纺[13–15]、牵伸纺[16]、湿纺[17]、溶液吹纺[18]和干纺[19,20]。然而,这些人工纺丝与自然纺丝过程存在差异,且对所纺纤维的长度、直径和力学性能的控制较弱[21,22]。由于在纺丝过程中通常使用高浓度的蛋白溶液作为纺丝原液,因此在制备蛋白纤维的过程中必然要经过物理凝固过程[23,24]。此外,连续功能蛋白纤维的大规模生产仍然受到限制。研究发现,蜘蛛或蚕的微型纺丝管道可以被视为典型的微流控设备[25]。因此,微流控技术已被探索用于工程纺丝,并为以简易并可控的方式制造蛋白纤维提供了巨大的潜力[26,27]。
近期,微流控技术作为一种易于执行的方法,已被广泛地研究并应用于制造生物纤维(图1)[28–30]。与其他技术相比,微流控技术提供了一个简单的平台,以可控的方式模仿自然纺丝过程[31]。例如,受生物启发, Yu等[32]通过同轴毛细管微流控装置开发了具有可控构象的螺旋微纤维,展示出多功能的生物医学工程应用。此外,微流控技术的成本效益为大批量连续微纤维生产提供了简便策略[33]。在纤维纺丝中使用生物相容性溶剂,促使该技术在组织工程和药物输送研究领域得到广泛应用[34–36]。另外,通过微流控技术便于实现大规模生产具有不同形态和统一尺寸的蛋白纤维。由于通道大小和类型、流速和剪切力的精确可控性,通过设计微流控芯片便于制备具有可控形态和性质的机械强韧蛋白纤维。
《图1》

图1. 微流控技术制备蛋白纤维示意图。各种类型的蛋白可用于微流控装置纺丝制备蛋白纤维。
在此,我们对基于微流控技术的蛋白纤维制造及其力学性能的最新进展进行相关讨论。首先,对基于微流控技术开发的各种蛋白纤维,包括再生蛋白纤维、重组蛋白纤维和其他来源的蛋白纤维进行讨论;其次,对每种类型的蛋白纤维的构造过程和力学性能进行深入探讨,为具有技术应用的人造蛋白纤维的制造提供范例;最后,对用于蛋白纤维生产的微流控技术的发展进行总结与展望。
《2. 蜘蛛丝的自然纺丝过程》
2. 蜘蛛丝的自然纺丝过程
在过去的几十年里,天然蜘蛛丝的非凡力学性能激发了研究者对制造合成纤维的兴趣。天然蜘蛛丝是在生理条件(水介质、环境温度等)下由特殊的纺丝腺体生产,如大安瓿腺、小安瓿腺、鞭毛腺、梨形腺和圆柱形腺体[37]。S形的锥形管道为旋转的涂料提供了额外的剪切力,加强了蛋白分子的取向[38]。此外,由特定细胞分泌的各种离子,如H+ 和PO43−促进了脱水过程和β片状结构的形成。鉴于其化学物理条件,天然蛛丝纤维展现出超强的力学性能(杨氏模量约为15 GPa,强度约为 1.5 GPa,延展性约为40%,韧性约为200 MJ·m−3),通常是凯夫拉尔纤维的三倍,钢铁的五倍。
《3. 微流控技术的纺丝过程》
3. 微流控技术的纺丝过程
与其他纺丝技术相比,微流控技术已成为一种非常有应用前景的纤维生产方法之一[28]。如表1所示,电纺通常需要高电压和高剪切力,而熔融纺则需要高温 [40,41]。相比之下,微流控技术实施条件温和,且具有较高的可重复性和产量能力。此外,微流控技术可以在微/纳米级别精确控制纤维的形状、大小和各向异性 [42]。通常,微流控装置由一个腔室、一个储液器和通道组成。到目前为止,不同类型的通道已经被开发出来,如单通道、双通道和流聚焦结[26,27,32]。为了连续生产纤维,“芯-鞘”(core-sheath)流动曲线是必要部分,在这种情况下,纺丝溶液首先通过通道生成纤维,然后通过溶剂萃取、化学交联或光刻固化过程。纺丝后的纤维通常具有均匀的直径和光滑的表面形态,从而使得所制作的纤维表现出高力学性能。因此,这种纤维在生物医学领域有很高的潜在应用价值,如药物输送、骨组织工程和伤口封闭[9]。
《表1》
表1 不同纺丝技术的比较

《4. 基于微流控技术的再生蛋白纤维》
4. 基于微流控技术的再生蛋白纤维
尽管天然蛋白纤维表现出超强的力学特性,但它们的大规模生产仍然是一个巨大挑战。因此,再生蛋白纤维被视为可以复制天然蛋白纤维分层结构的替代品。研究者致力于开发生产具有高质量和优良力学性能的再生蛋白纤维的各种途径,如湿法纺丝和电纺。然而,所开发的方法通常存在规模有限、程序复杂和需要大量溶剂等问题。
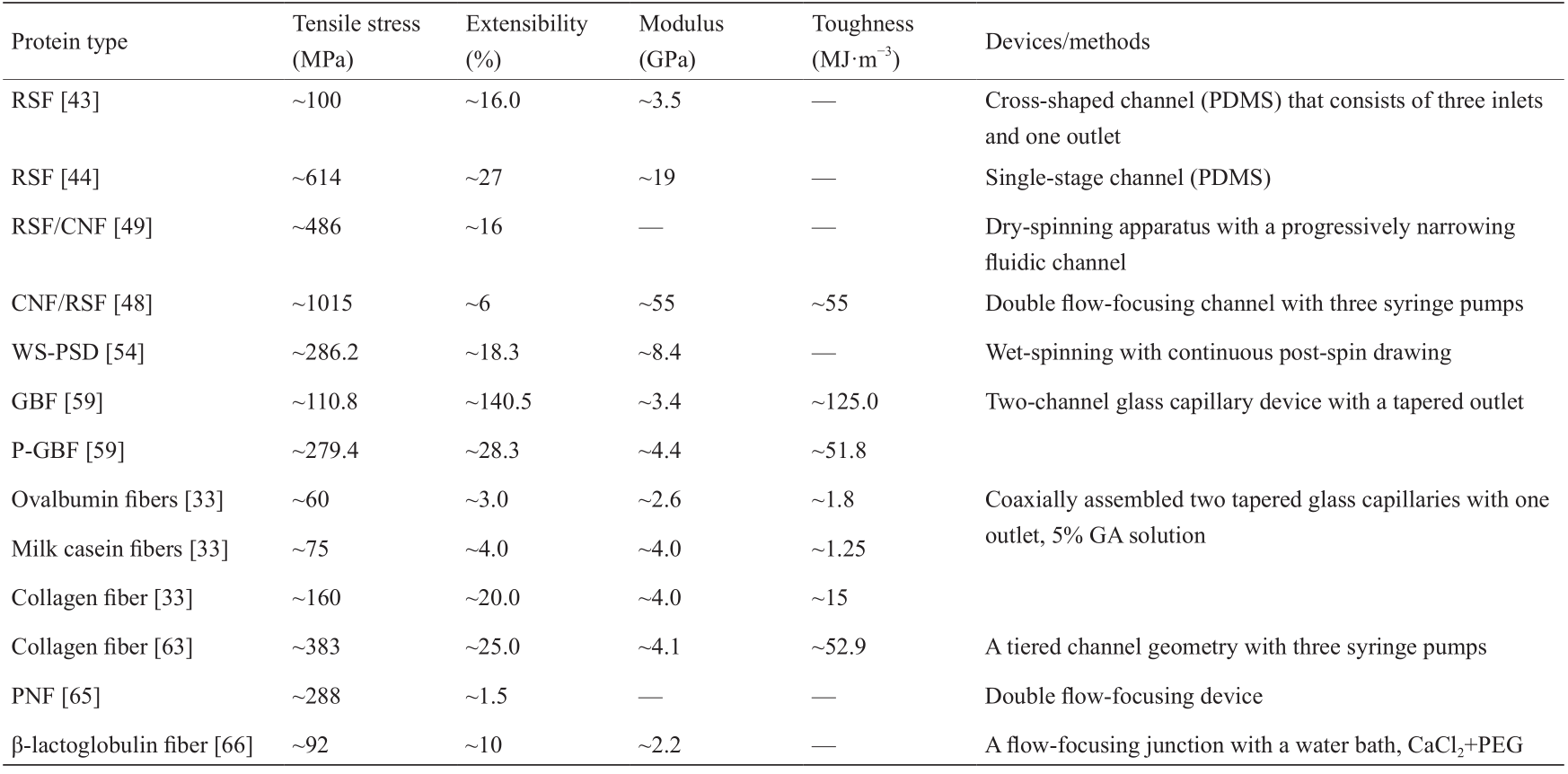
然而,微流控技术在这些方面展现出独特的性能,在制造人工蛋白纤维方面引起极大的关注。最近, Kinahan等[43]率先将微流控技术与建模相结合,通过丝蛋白的分子组装,实现了对所制作蚕丝蛋白纤维性能的预测和控制[图2(a)]。为了模仿自然界的纺丝过程,该研究设计了一个十字形通道的微流体装置,该装置具有可调控的三个入口和一个出口。在该装置中,再生丝素蛋白(RSF)水溶液(浓度为8%,pH = 6.6)流经中央入口并到达十字交叉口,然后与两股外部的聚环氧乙烷(PEG)溶液相互作用。利用一个定制的注射器泵来控制流体的流动从而调控纤维的直径。同样,后拉伸处理也可用于操纵纤维直径。研究发现,纺丝后的拉伸处理(在另一个纺丝过程后对纺丝纤维进行拉丝)增强了原纺丝纤维的力学性能,其杨氏模量约为3.5 GPa,拉伸强度约为80 MPa,断裂应变约为16%。与未拉丝的 RSF纤维(即只是纺丝的纤维)相比,纤维力学性能的提高可以归因于部分模仿天然丝力学性能的开卷区。
《图2》

图2. 微流控技术制备再生蜘蛛丝素蛋白纤维及其力学性能表征示意图。(a)左图为微流控装置,由三个入口和一个出口组成。在微流控装备交叉口处制备具有光滑表面和均匀直径的再生丝素蛋白纤维。右图为不同条件下再生丝素蛋白纤维的典型应力-应变曲线。经American Chemical Society许可,转载自参考文献[43],© 2011。(b)由单通道微流控装置纺丝而成的再生蜘蛛丝素蛋白纤维(底图)。纺丝后的再生蜘蛛丝素蛋白纤维的应力-应变曲线(顶部左上角内插图)。经Elsevier B.V. 许可,转载自参考文献[44],© 2014。
为了模仿蜘蛛丝和蚕丝的剪切和伸长条件,研究者通过单通道微流控芯片从再生的Bombyx mori 中制造了RSF纤维[图2(b)] [44,45]。在该研究中,通过以 2 μL·min−1的流速从微芯片中挤出纺丝溶液[pH值约为 4.8,50%(质量分数)的RSF溶液,0.3 mol·L−1 Ca2+]来制作纤维。与脱胶后的丝素蛋白纤维相比,未经纺丝的 RSF纤维具有相似的直径(12 μm),但力学性能较弱。与此形成鲜明对比的是,通过拉丝后处理(即在纤维纺丝后增加一个拉丝步骤),原纺丝纤维的力学性能得到显著提高,表现出优于其他RSF纤维和天然未脱胶的 Bombyx mori蚕丝的力学性能,包括杨氏模量(19 GPa)、断裂应力(614 MPa)、断裂应变(27%)和断裂能量(101 kJ·kg−1)[43,46]。
随后,研究者通过微流控技术实现了再生复合丝纤维的制造。由于优异的生物相容性和结晶区的高硬度,纤维素纳米纤维(CNF)已在作为生物相容性复合材料的增强剂方面显示出巨大潜力[47]。利用CNF的力学性能和功能,Mittal等[48]报道了一种利用流动辅助的排列和组装方法制备高度定向的复合纤维(90% 的CNF和10%的蜘蛛丝)的方法[图3(a)]。在该研究中,一个双流聚焦装置由一个复合分散体的核心流和两个周围的鞘流组成。其中一个鞘流是去离子水(pH值约为5.6),防止通道壁出现堆积,而另一个鞘流是盐酸(0.01 mol·L−1,pH值约为2),帮助CNF/丝蛋白在分散体中排列。与原始CNF纤维相比,CNF/Z-丝蛋白复合纤维的平均模量约为55 GP,韧度约为55 MJ·m−3,断裂强度约为1015 MPa,以及延伸性约为6%,均超过了典型的天然或合成纤维的力学性能[39]。此外,免疫球蛋白G(IgG)细胞结合试验表明,该复合纤维具有良好的生物相容性。以上结果表明,通过微流控技术可以实现超强复合蛋白纤维的简易、可控和工业化制备。
近期,有研究者利用微流控技术开发了一种新型的RSF/CNF杂化纤维[图3(b)] [49]。纺丝溶液以 2 μL·min−1的流速泵入微流控通道,纺丝后的纤维干燥 48 h,随后,浸泡在含有80 %(体积分数)乙醇的水溶液中。CNF的存在显著地提高了杂化纤维的力学性能。特别是,杂化纤维[含0.1%(质量分数)的CNF]的断裂强度提高到487 MPa,明显高于纯RSF的断裂强度。此外,其延伸性也延长到16%。这是由于体系中CNF的存在导致了高结晶度、高中间相含量和较小的结晶尺寸,从而提高了杂化纤维的力学性能。
《图3》
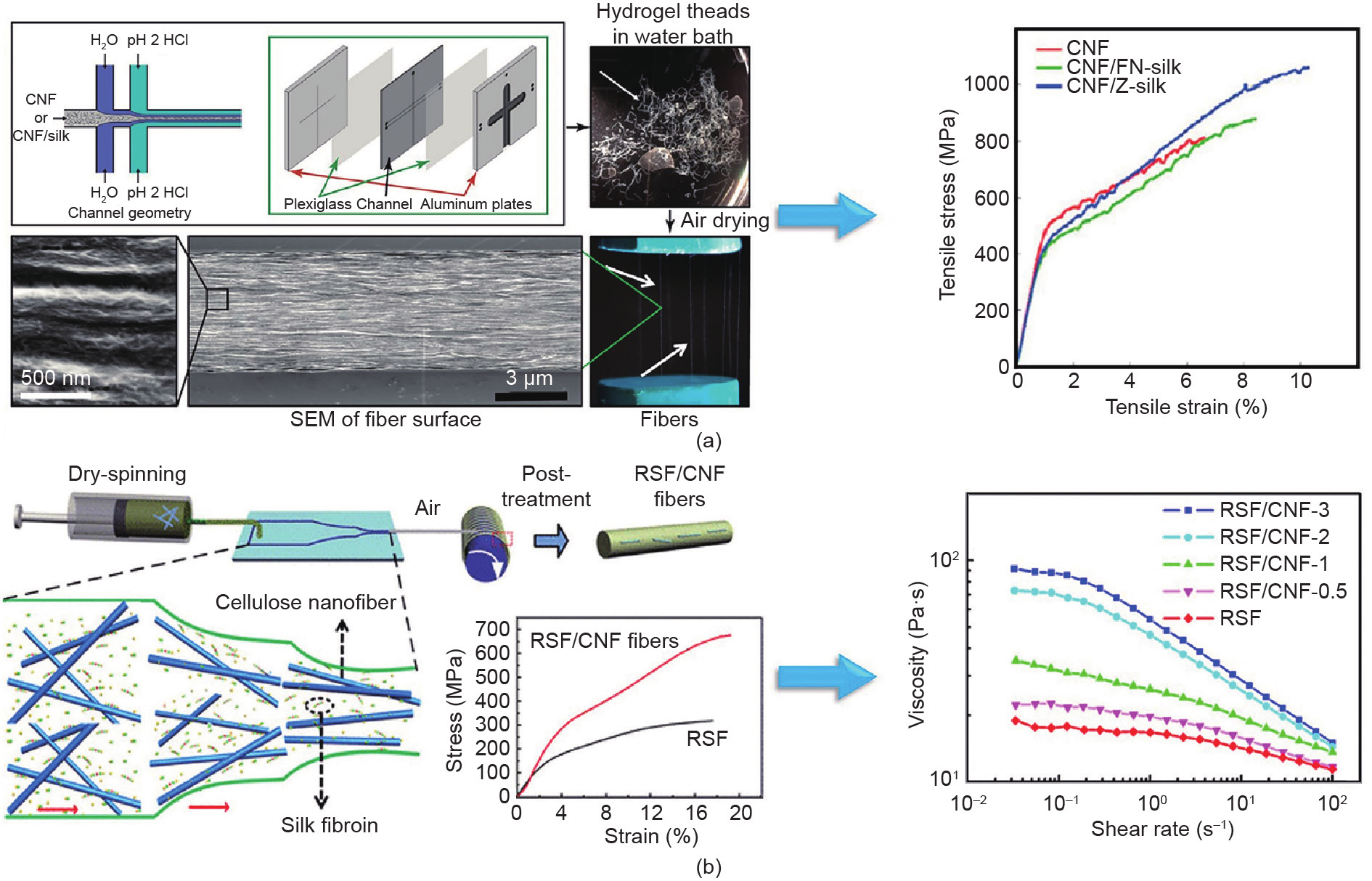
图3. 微流控技术制备再生复合蛋白纤维。(a)用于制备复合纤维的双流聚焦装置示意图。加入丝蛋白后,纤维的力学性能得到显著提升。经 American Chemical Society许可,转载自参考文献[48],© 2017。(b)使用微流控装置进行干法纺丝过程示意图。通过加入0.1%(质量分数)纤维素纳米纤维,得到的再生丝素蛋白-纤维素复合纤维的力学性能有了明显提高。经American Chemical Society许可,转载自参考文献[49],© 2019。
《5. 基于微流控技术的重组蛋白纤维》
5. 基于微流控技术的重组蛋白纤维
除了再生蛋白纤维,研究者还利用微流控技术制造并研究了重组蛋白纤维。通过基因工程手段表达的重组蛋白,可以高度模仿天然蜘蛛丝纤维素的分层结构和分子量。到目前为止,各种重组蛋白已经被用作制造人造蛋白纤维的原料[50–52]。然而,所得到的纤维力学性能和功能仍然无法与天然蜘蛛丝相媲美[53]。通过对蜘蛛和蚕丝腺体的观察,人们发现这两种天然的纺丝机制都可以被认为是复杂的微流控技术。为此,Peng等[54] 设计了一种仿生微流体通道来模仿蚕丝腺的特定几何形状[图4(a)]。该研究在大肠杆菌(Escherichia coli)中表达了Nephila clavipes(Mw = 47 kDa)的重组大壶状腺蛋白I(MaSp1),然后将其作为纺丝原液,利用仿生微流控芯片进行两种不同工艺纺丝。第一种是利用纯乙醇作为凝固浴的微流控湿纺丝(WS)工艺,第二种是利用纺丝后拉伸工艺(WS-PSD)改性湿纺丝的工艺。在纺丝后拉丝处理后,利用这种仿生策略制备的蛋白纤维具有优良的力学性能,并可与已报道的重组蜘蜘丝性能相媲美[图4(b)]。
《图4》

图4. 通过微流控技术制备重组蜘蛛丝素蛋白纤维及其力学性能的示意图。(a)模仿蚕丝腺体特定的集合构型而设计的仿生微流控装备,包括湿纺以及湿纺后拉伸。(b)重组蜘蛛丝素蛋白纤维的力学性能。典型的重组蜘蛛丝素蛋白纤维的应力-应变曲线。上图为湿纺-3x;下图为湿纺后拉伸-3x。经Springer Nature许可,转载自参考文献[54],© 2016。
《6. 基于微流控技术的其他蛋白纤维》
6. 基于微流控技术的其他蛋白纤维
尽管受到蜘蛛丝和蚕丝蛋白的启发,人们对生物纤维进行了广泛的研究,但要想在依赖低成本蛋白质和便捷纺丝技术的同时,开辟一种新的方法来制造高力学性能的生物纤维,仍然是一项挑战。虽然其他纤维蛋白,如弹性蛋白、胶原蛋白和噬菌体病毒已被探索用于纤维制造[55–58],但其力学性能仍不能令人满意。
《6.1. 球状牛血清白蛋白基纤维》
6.1. 球状牛血清白蛋白基纤维
为了克服上述局限性,我们课题组最近开发了一种有效的策略,通过微流控技术成功制造出基于球状牛血清白蛋白(BSA)的坚固蛋白纤维(图5)[59]。该微流控装置具有一个双通道的玻璃毛细管和一个单锥形出口(300 μm)。在纤维制造过程中,BSA溶液和戊二醛(GA)溶液在毛细管中汇聚,并被挤压到80%(体积分数)的甲醇/水凝固浴中,经脱水处理后成功收集BSA纤维。研究发现,与原始BSA纤维(PBF)相比,GA交联BSA纤维(GBF)的力学性能明显增强。值得注意的是,GBF的后拉伸处理(P-GBF)进一步提高了纤维的力学性能,其断裂强度(300 MPa)、杨氏模量(4.4 GPa)、韧性(50 MJ·m−3)和延伸性(30%)等,甚至比许多其他蛋白纤维更高。
《图5》

图5. 微流控技术制备血清蛋白纤维的示意图。(a)该装置由一个双通道的微流控芯片、一个凝固浴和一个旋转收集器组成。血清蛋白纤维在 80%(体积分数)的甲醇/水凝固浴中旋转,以促进戊二醛的交联和脱水过程。(b)不同条件下血清蛋白纤维的典型应变-应力曲线。经Wiley许可,转载自参考文献[59],© 2019。
《6.2. 球形和线性蛋白基纤维》
6.2. 球形和线性蛋白基纤维
同时,一系列具有球形或线性结构的蛋白,包括鸡蛋、鹅蛋、牛奶和胶原蛋白,也被应用于微流控纺丝技术并用于大量生产生物纤维[33]。研究中,微流体装置由两个锥形玻璃毛细管(同轴组装在玻璃载玻片上)组成,其特点是层间和核心层通道分别用于蛋白质溶液和 5% GA交联剂。这种技术能够制造出具有高强高韧的蛋白纤维,与许多已报道的重组蜘蛛丝或再生蚕丝纤维的性能相当,甚至比其更强[60−62]。由于其出色的力学性能和良好的生物相容性,这些蛋白纤维被成功应用于大鼠和迷你猪模型的外科缝合。
此外,为了避免添加化学交联剂,Haynl等[63]报道了一种使用微流控技术制造不含任何交联剂的单根I型胶原蛋白微纤维(图6)。他们设计出一个基于聚二甲基硅氧烷(PDMS)的微流控装置,该装置具有分层通道的几何形状,以使蛋白流周围的鞘流循环。在聚乙二醇(PEG)存在和适当的pH值条件下,微纤维在交叉点形成并被挤压到水浴中,随后使用自动线轴进行牵引。结果显示,流速对胶原蛋白纤维的力学性能有一定影响。较高的流速可以制备力学性能更强的纤维,其拉伸强度为(383 ± 85) MPa,杨氏模量为(4138 ± 512) MPa,这大大超过了用GA交联或1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)/N-羟基琥珀酰亚胺(NHS)交联生产的纤维[55,64]。此外,神经细胞NG108-15沿微纤维轴线的轴突生长揭示了这些纤维在周围神经修复中的潜在应用[42]。
《图6》

图6. 通过微流控技术制造胶原蛋白和分离乳清蛋白(WPI)纤维及其力学性能的示意图。(a)上图为一个微流控芯片与三个独立的注射泵相连,可以同时泵送pH值为3的胶原蛋白溶液(红色)和pH值为8的两个含PEG的缓冲溶液(蓝色)。微纤维被挤压到水浴中,由一个自动转轴抽出。下图为胶原蛋白纤维的典型应变-应力曲线。经American Chemical Society许可,转载自参考文献[63],© 2016。(b)上图为用于纤维组装的双流聚焦装置示意图。蛋白纳米原纤维(PNF)散体、去离子水和醋酸缓冲液(pH = 5.2)分别注入芯流、第一鞘流和第二鞘流。下图为典型的应力-应变曲线,显示出相当脆的特性,杨氏模量约为288 MPa,延伸性约为1.5%。经National Academy of Sciences许可,转载自参考文献[65],© 2017。
《6.3. 以乳清蛋白分离物为基础的纤维》
6.3. 以乳清蛋白分离物为基础的纤维
最近,乳清蛋白分离物(WPI)被开发为构建蛋白纤维的替代平台。Kamada等[65]报道了一种自下而上的组装策略,通过微流控技术制造微纤维[图6(b)]。他们使用双流聚焦微流控装置,在浓度为0.45%~1.8%、 pH值为5.2的条件下生产淀粉样蛋白纳米原纤维(PNF)。结果显示,纤维排列程度较低的弯曲PNF产生了机械强度高的微纤维,其杨氏模量约为288 MPa,延伸性约为1.5%。Kamada等[66]设计出一种流动聚焦的微流控装置,用于从β-乳球蛋白中制造分级的蛋白质宏观纤维,这种纤维可以自组装成纳米纤维。利用β-乳球蛋白制备纺丝涂料溶液,与CaCl2交联剂溶液在连接处共流。将PEG加入鞘流来制造本体纤维,然后从通道出口立即收集,制成宏观纤维。通过控制鞘层流速,可以精确地控制纤维的直径和力学性能。特别是,通过添加预制的纳米纤维和它们的排列,所纺纤维的杨氏模量和拉伸强度分别被进一步提高到(2.21 ± 0.4) GPa和(92.0 ± 28.0) MPa。
表2总结并比较了通过微流控技术开发的不同类型的蛋白纤维的力学性能。对比可知,微流控技术可以为制造高强高韧蛋白纤维提供一个强大的平台。这样的通用策略不仅适用于再生丝蛋白和重组蛋白,而且也适用于其他常用蛋白。特别是自然界中广泛存在的蛋白,如鸡蛋卵白蛋白和牛奶酪蛋白,都可以通过微流控技术来制造坚固的蛋白纤维。此外,与使用细胞毒性交联剂制造的蛋白纤维相比,通过微流控技术制造的蛋白纤维表现出良好的生物相容性。微流控装置为制造低浓度蛋白纤维提供了很好的潜力,从而产生了具有更明显排列的无纺纤维。然而,用微流控技术生产的蛋白纤维的力学性能仍然不如天然蜘蛛丝纤维。因此,需要更进一步研究纤维力学、通道大小和类型、流速、剪切力和分层蛋白质结构之间的关系。
《表2》
表2 微流控技术制备蛋白纤维的比较
《7. 结论和展望》
7. 结论和展望
作为迅速崛起的材料之一,生态友好和坚固的蛋白纤维除了一些高科技应用外,还被广泛用于组织工程领域。最近,通过微流控技术制造蛋白纤维取得了重大进展。与其他纺丝技术相比,微流控技术在微尺度方面提供了方便和可控的操作,以生产连续的蛋白纤维。同时,该方法具有特殊的优势,包括成本低,易于制造设计良好的结构,以及简单的后期处理。此外,在使用微流控技术生产的纤维中灵活地加入各种功能材料,为提高原纺纤维的力学性能提供了更多机会。鉴于该技术的显著优势,微流控技术可以实现大规模制造具有多种功能的高机械强度的纤维材料。
尽管通过精确控制通道的大小和类型、流速和剪切力,可以在设计良好的微流控装置中产生机械强度高的蛋白纤维,但在纤维加工过程中仍存在一些不足。众所周知,蛋白结构在决定蛋白纤维的机械行为方面起着举足轻重的作用。然而,到目前为止,微流控芯片还不足以在纳米尺度上有效控制蛋白结构。这种方法也缺乏有效的策略来构建具有分层结构的蛋白质纤维,如芯壳型、多股型、螺旋型或詹纳斯型结构。此外,在单个微流控芯片中整合单丝和扭转纺丝技术仍然是个问题。当然,设计多个通道以生成复杂的蛋白纤维仍然具有挑战性。
设计一类不牺牲蛋白结构和取向的新型微流控技术,对于改善蛋白纤维的机械行为和功能是非常可取的。为了进一步促进微流控技术在蛋白纤维制造中的应用,新的制造技术,如三维或四维印刷可以被整合到微流控芯片的设计中。设计具有独特的刺激反应特征的微流控芯片同样也可以促进对所纺蛋白纤维力学特性的控制。因而,在制造具有各种定制特性、成分、结构和按需功能的蛋白纤维方面,先进的微流控技术的发展将为生物纤维的实际应用铺平道路。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Jing Sun, Jingsi Chen, Kai Liu, and Hongbo Zeng declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




