《1. 引言》
1. 引言
疫苗临床试验通过三个不同的阶段,从安全性、免疫原性和临床效力方面研究疫苗对人类志愿者的影响[1]。通常,1期研究集中在安全性和反应原性上,而 2期研究则试图建立剂量范围、剂次和免疫程序(有时甚至是效力数据)选择的免疫原性证据。大型3期研究旨在评估剂量和剂次、免疫程序是否提供了理想的保护效力并具有可接受的安全性[2]。3期疫苗临床试验提供了必不可少的效力数据,以支持已获得许可的疫苗。
迄今为止,截至2021年4月30日,共有27款新冠病毒疫苗处于3期临床试验,所有3期临床试验均被设计为随机、安慰剂对照研究,每项试验有3万~4万名受试者。最近宣布了10种第一代新冠病毒疫苗的3期试验的初步功效(表1):两种mRNA疫苗[BioNTech / Pfizer研发的BNT162b2,疫苗功效(VE)为95.0%;由Moderna 研发的mRNA-1273,VE为94.1% ];四种非复制型病毒载体疫苗(牛津大学/阿斯利康大学研发的AZD1222, VE为70%;Gamaleya研发的Sputnik V,VE为91.4%; Janssen研发的Ad26.COV2.S,VE为66%;CanSino Biologics和军事科学院研发的Ad5-nCoV,VE为68.8%);蛋白亚单位疫苗(Novavax研发的NVX-CoV237,VE为 89.3%);三种灭活疫苗(北京生物制品研究所开发的 BBIBP-CorV,VE为78.1%;武汉生物制品研究所开发的灭活全病毒nCov-19疫苗,VE为72.8%;以及由Sinovac开发的CoronaVac,在土耳其的VE为91.3%,在巴西的VE为50.4%)[3–8]。根据这些结果,在某些地区或国家/地区已批准了10种新冠病毒疫苗中的9种获得紧急使用授权或有条件许可。另一种蛋白亚基疫苗(ZF2001)也已获得紧急使用许可。
《表1》
表1 新冠病毒候选疫苗已公开的效力
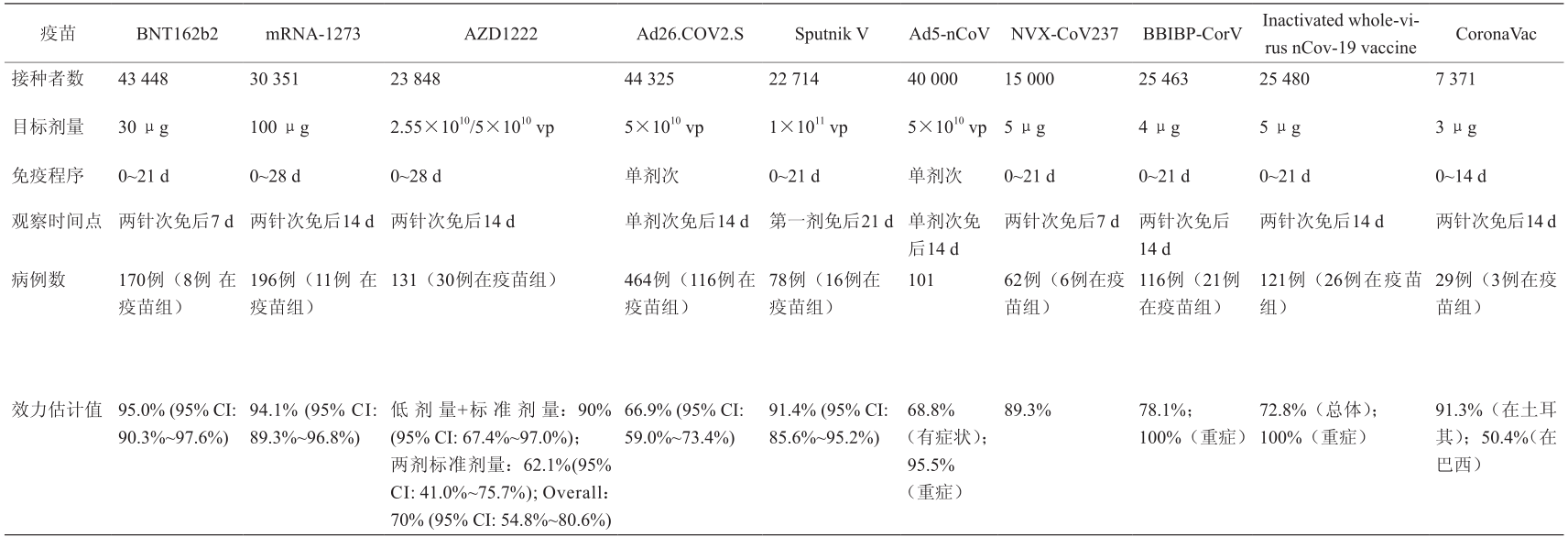
随着新冠病毒肺炎大流行继续在世界范围内蔓延,对有效疫苗的需求空前巨大。显然这10种初代疫苗的产量不太可能满足世界需求。因此,仍需要对其他新冠病毒候选疫苗进行研究,并有望在3期临床试验中确定更有效的疫苗来对抗新冠病毒肺炎。然而,在疾病负担如此重的新冠病毒肺炎大流行期间进行个体、随机、安慰剂对照的临床试验,并在已获得新冠病毒疫苗批准使用的情况下开展免疫接种,这是以前从未出现过的。第一波新冠病毒疫苗的批准使用引发了人们对正在进行的和未来的其他新冠病毒候选疫苗3期试验期间使用安慰剂的担忧。
在这里,我们同时从伦理问题、疾病流行情况和统计学角度进行考虑,讨论了可能影响新冠病毒疫苗临床试验的问题,旨在不久的将来评估疫苗效力并探索替代试验设计的可能性。
《2. 未来新冠病毒疫苗临床研究的挑战》
2. 未来新冠病毒疫苗临床研究的挑战
《2.1. 数百种正在评价的新冠病毒疫苗》
2.1. 数百种正在评价的新冠病毒疫苗
根据世界卫生组织(WHO)的调查,截至2021年4月30日,全球正在开发277种针对严重急性呼吸系统综合征冠状病毒 2型(SARS-CoV-2)的候选疫苗[9]。其中,至少有93种疫苗已获批进行临床试验。这些获批疫苗主要包括亚单位蛋白疫苗( n = 29,占93种获批疫苗的31%)、病毒载体类疫苗( n = 18, 占19%)、灭活疫苗( n = 13, 占14%)、DNA 或RNA疫苗( n = 23, 占25%)和病毒颗粒疫苗( n = 5, 占5%)。
除了第一波新冠病毒疫苗外,许多正在开发的候选疫苗的效力尚未确定;对于基于亚单位蛋白技术平台的疫苗尤其如此,其占总数的三分之一以上。这种基于重组亚单位蛋白的疫苗通常可以安全地用于更广泛的人群,包括儿童、老年人和免疫功能低下的个体;它们在存储和物流方面也很容易处理。如果所有这些候选疫苗同时进入临床试验,可能没有足够的资源来完成有效的临床试验,就像中国大陆疫情期间、全球大流行初期的情况一样,缺乏获得研发新冠病毒肺炎治疗药物确凿证据的能力。
效力试验通常应在疾病流行地区,在那些当时无法获得有效获批疫苗的具有暴露风险的人群中进行。然而,在紧急情况下进行临床试验会带来巨大挑战[10] ,特别是如果已经实施了紧急使用的疫苗接种运动,这将减少合格的后续新冠病毒疫苗试验的研究人群。因此,未来新冠病毒疫苗 3期效力试验的实施可能会集中在医疗资源不足的发展中国家或地区,这可能会给当地医疗系统带来进一步的负担,并加剧有效疫苗可及性的不平衡。
《2.2. 正在进行的新冠病毒疫苗临床研究的局限性》
2.2. 正在进行的新冠病毒疫苗临床研究的局限性
第一波新冠病毒疫苗 3期临床试验的疗效数据的中期分析结果证明了它们的安全性和对新冠病毒肺炎的有效性,但均是在相当短时间内的结果。BNT162b2 、 mRNA-1273 和AZD1222试验中新冠病毒肺炎病例监测的平均观察期为2~3个月[3–5],因此这些疫苗的保护持久性和长期安全性仍有待确定。由于观察期有限,试验期间仅捕获了少数或几个严重的新冠病毒肺炎病例,导致缺乏这些疫苗针对严重病例的可靠效力数据。此外,尽管在BNT162b2 、mRNA-1273 、Sputnik V 和Ad26. COV2.S [3,4,8,11] 的 3期效力试验的公开结果中,在按年龄定义的亚组中观察到了类似的VE,但这一数据并不可靠,因为参与试验的老年人数量很少,而其他候选疫苗对老年人的保护效力也没有被评估。因此,关于这些疫苗对老年人保护作用的证据仍然不足。但是,由于表1 候选疫苗对老年人具有良好的免疫原性,并且老年人感染SARS-CoV-2的风险较高,因此中国60岁及以上的人群也有资格接种疫苗。
由于所有这些知识差距,科学家呼吁继续使用安慰剂进行临床试验,以避免在受试者不属于确定的优先接种群体的情况下,丢失有价值的研究数据及降低健康公平性[12]。
《3. 评价疫苗效力的研究设计》
3. 评价疫苗效力的研究设计
《3.1. 当安慰剂的使用是可以接受的》
3.1. 当安慰剂的使用是可以接受的
根据 WHO 专家小组的建议,当不存在有效和安全的疫苗,并且该候选疫苗旨在使评价疫苗的人群受益时,在疫苗试验中使用安慰剂显然是可以接受的[13]。尽管某些新冠病毒疫苗已被批准用于紧急使用或附条件上市,但它们不被认为具有与针对其他疾病的已知的非紧急使用疫苗相同的保护效力和安全性水平,因为它们的批准仅基于短期效力和安全数据。因此,它们的紧急使用批准不是上市许可,许多专家仍然主张在疫苗试验中使用安慰剂对照(表2)。
《表2》
表2 建议的研究设计的要素

3.1.1. 交叉设计
在传统的(2×2)交叉设计中,每个受试者接受两种不同的治疗,标记为A和B。一半的参与者先接受A,然后,选择一段合适的时间后,再接受B。剩下的受试者先接受B,然后再交叉接受A。这项研究的目的是比较A和B的效果[14,15]。这种交叉设计可能是在3期试验中评价新冠病毒疫苗效力的替代方法,而不是安慰剂对照随机试验(图1)。在第一阶段,参与者将被单独随机分配到研究的疫苗组或安慰剂组中;他们将分别接受疫苗或安慰剂注射,然后进行随访以监测新冠病毒肺炎病例。之后,疫苗组的受试者将交叉接受安慰剂,而安慰剂组的受试者将接受疫苗。研究者和受试者都不知道分配情况。这种设计可以保持安慰剂对照和随机化的好处,而不需要受试者表现出特殊程度的利他主义;通过这种方式,它可以帮助保持公众的信任,即科学家和监管机构正在优先考虑科学性和受试者[16]。然而,与安慰剂相比,这种设计不能用于评估疫苗的长期安全性和效力。另一个问题是,向安慰剂组的受试者提供疫苗会降低健康公平性,因为在疫苗稀缺的情况下,安慰剂组的受试者可能不会在试验之外优先接种疫苗。
《图1》
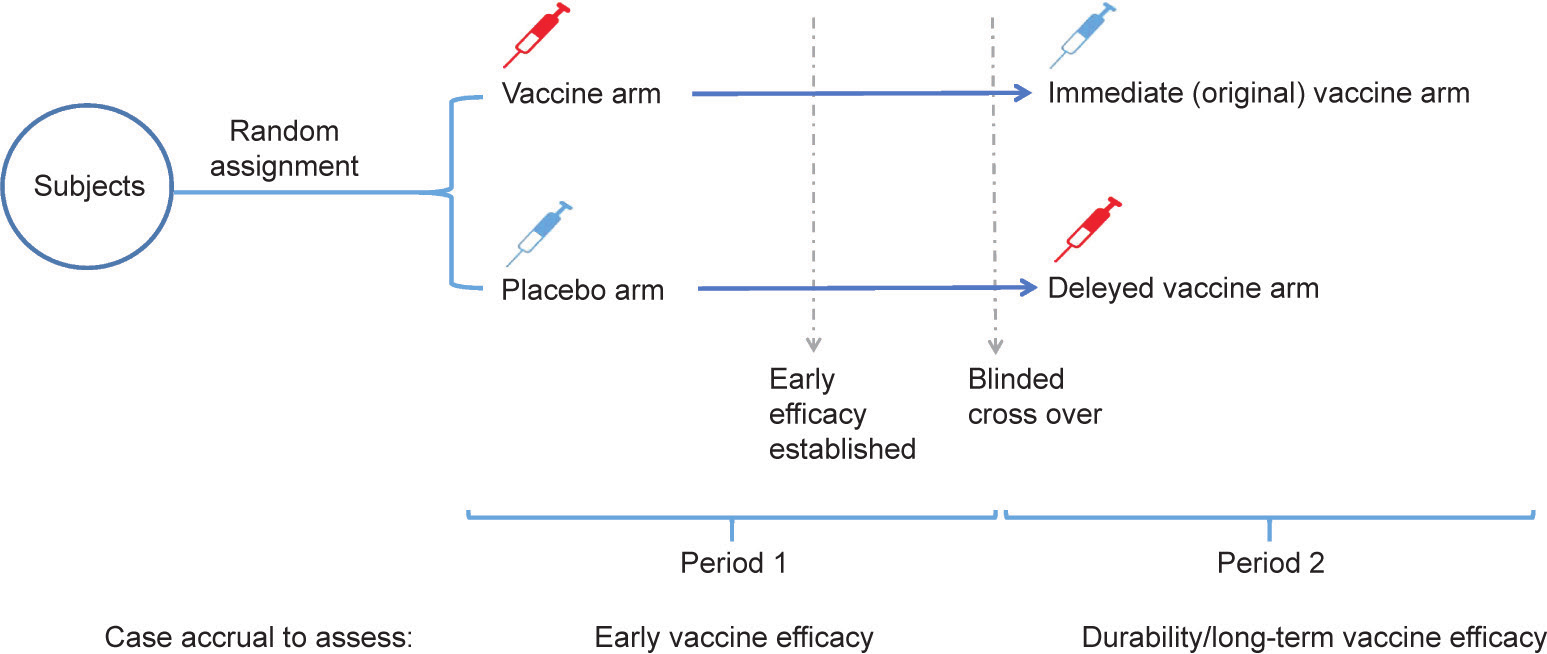
图1. 新冠病毒疫苗效力评价的个体随机、双盲、交叉设计。
3.1.2. 人体挑战试验
人体挑战试验是指用传染源(如病毒、寄生虫、细菌或真菌)有意感染健康、成年、有意向的志愿者。受试者被随机分配到研究的疫苗组或安慰剂组。接受干预后,受试者在可控的具有充分医疗保障的环境中暴露于传染性病原体。攻毒毒株应该被很好地表征,经常减毒,并在当前的良好生产规范(cGMP)或类似GMP的条件下生产[17,18]。人体挑战试验比传统人体试验进展更快,可以快速获得疫苗效力数据;此外,与传统的随机对照试验相比,它们需要的样本量要小得多。然而,这种设计无法评估疫苗效力对严重疾病和死亡的影响,因为病毒的攻击剂量是精心设计的,并且在志愿者生病的早期,他们就会得到相应的治疗。然而,在一项针对新冠病毒疫苗的人体挑战试验中,安慰剂组的志愿者可能仍面临风险,因为对于重症COVID-19没有可靠的治疗方法[19]。此外,从年轻志愿者那里获得的结果可能无法合理地外推到老年人身上。用于攻击志愿者的传染性病原体在剂量或基因方面可能与天然病原体不同[19]。
《3.2. 当安慰剂的使用是不可接受的》
3.2. 当安慰剂的使用是不可接受的
如果①存在高效和安全的疫苗且目前其在有试验计划的国家的公共卫生系统中可以获得,并且②无法充分降低或减轻受试者延迟或放弃可用疫苗的风险(例如,通过提供关于行为疾病预防策略的咨询和教育,或通过确保对所研究的疾病进行充分治疗以防止严重伤害),那么在疫苗试验中不能使用安慰剂[13]。随着时间的推移,积累的数据将支持已经被批准用于紧急使用并已被证明是安全有效的疫苗。因此,一旦获得足够数量的授权疫苗并开始对更广泛的群体进行免疫,将个体纳入安慰剂对照试验可能不再可行或不合乎道德[12]。因此,有必要讨论没有安慰剂组的替代研究设计。
3.2.1. 头对头非劣效性试验
一项头对头的非劣效性随机对照试验旨在证明,一种新疫苗并不比一种阳性对照物差,这种阳性对照物已经在一个预先确定的界限内显示出了比安慰剂更有效的效果,而当安慰剂的使用不可接受时,这种研究设计可能会被采用[20]。非劣效性设计在新疫苗的效力被认为与阳性对照物相同的情况下是有用的,但新疫苗具有额外的好处,如较少的不良事件或降低的成本。如果阳性对照物与新疫苗之间的差异大于预定义的界值(即置信区间的边界超过界值[20,21]),则新疫苗被称为不劣于对照物。如果非劣效性假设得到充分确立,就可以与阳性对照物进行进一步的优效性测试,尤其是对于临床终点只有中等效力的阳性疫苗。然而,与安慰剂对照试验相比,非劣效性试验需要更大的样本量和更长的时间才能获得临床终点,因为研究的两个组都接种了疫苗,疾病发生率将显著降低。根据阳性对照物的不同效力和界值,非劣效性试验的计算样本量可能在每年20 000~50 000人之间变化,但它仍然是可行的。此外,非劣效性试验还可以促进新疫苗与其既定对照物之间的直接安全性比较。
3.2.2. 检测阴性设计
检测阴性设计是一项改良的病例对照研究,被用来评价疫苗有效性,尤其是针对流感疫苗的有效性[23]。在疫苗有效性的检测阴性设计下,研究对象是所有因疑似症状而寻求医疗护理的人。为了评价新冠病毒疫苗,所有受试者将首先使用高度特异性的检测方法[如聚合酶链反应(PCR)]检测新冠病毒肺炎病例;然后根据他们的测试结果将其分组为病例组(测试为阳性的那些)或对照组(测试为阴性的那些)。疫苗有效性将根据病例中接种疫苗的比例与对照组中接种疫苗的比例之比来估计[24]。从实用的角度来看,检测阴性设计比其他研究设计更容易进行,并且可以最大限度地减少因寻求医疗保健行为而造成的混杂[25]。然而,检测阴性设计是一项观察性研究,因此其有效性取决于对潜在偏倚的仔细评价并对其进行调整,特别是在病例与非病例之间疾病严重程度的差异方面。
3.2.3. 阶梯设计
阶梯整群随机对照试验通常用于评估在集群级别提供的服务或政策干预。集群的例子可能包括学校、社区、工厂或家庭,还有许多其他可能的选择。为了获得干预措施在人群水平的影响,例如,旨在减少传染性病原体传播的疫苗,可以采用整群随机设计[26]。该设计包括一个初始阶段,在该阶段中没有集群暴露于候选疫苗。随后,以固定间隔,将一个群(或一组群)随机接受从对照物交叉到正在评价的疫苗。这个过程一直持续到所有群都暴露于疫苗接种。数据收集在整个研究过程中持续进行,因此每个组群都会提供接种前和接种后的观察结果[27]。通过比较阶梯接种后部分的数据点与对照部分的数据点来确定干预效果。与传统的平行设计相比,只要事先相信疫苗接种利大于弊,并且当疫苗接种由于后勤、实用和财务限制而只能分阶段实施时,阶梯设计就被认为是有优势的[28]。使用阶梯设计评估新冠病毒疫苗效力的最大潜在问题是新冠病毒肺炎发病率随时间和空间而变化。此外,设计的样本量可能比个体随机试验的样本量大100倍。因此,阶梯设计通常用于在获得疫苗上市许可后估计疫苗的有效性。
《4. 展望》
4. 展望
传统的大规模个体随机、安慰剂对照试验是现代临床决策的基础,并且仍然是获得新型疫苗可靠结果的最有效方式[29],前提是试验的风险收益情况可以接受 [30]。由于紧急使用许可和附条件许可不是完全许可,因此WHO建议在现有研究中继续对安慰剂接受者进行盲法随访并继续进行安慰剂对照试验,以为下一代候选疫苗提供公正的证据,这在伦理上是可以接受的[29]。然而,随着越来越多的关于新冠病毒疫苗安全性和有效性的证据积累以及随着授权疫苗的广泛使用,正常安慰剂对照试验的风险收益状况将变得不可接受,并且试验可能会受到退出或“沾染”的影响。因此,需要研究方法替代策略来评价这些疫苗。
安慰剂对照的交叉设计可以作为常规的安慰剂对照试验的替代方案,减少接受安慰剂的受试者关于长期风险的伦理方面的担忧;然而,与安慰剂相比,该疫苗的长期效力是无法获得的。当不再推荐在大量人群中使用安慰剂时,人体挑战试验也可用于加速疫苗的安慰剂对照效力评估。然而,人类攻毒模型只能在少数参与者中进行,这可能不足以获得疫苗使用授权,因此需要扩展的安全队列和扩展的头对头免疫原性队列,以确保疫苗的安全性、免疫原性和持久性。
头对头非劣效性随机对照试验是评价新型候选新冠病毒疫苗的另一种设计。针对效力的头对头比较设计需要相对较大的样本量和更长的新冠病毒肺炎病例监测期,以确保可以获得疫苗相关效力的足够证据,以便疫苗获得批准[31]。一般而言,基于临床终点的疫苗效力评价成本高且耗时久,尤其是对于使用阳性疫苗作为对照时。
相比之下,基于免疫学相关性保护的疫苗效力评估更容易操作;它还通过估计产生特定免疫反应的疫苗接种者的比例来节省时间,而无需捕获临床事件[32]。使用免疫相关性结合扩展安全队列的血清学研究策略已成功应用于评估其他疫苗,如流感疫苗。然而,由于尚未建立标准的血清免疫学测试,因此可能无法在短时间内获得新冠病毒的免疫相关性保护指标[33]。
为了评估真实世界中的疫苗有效性,建议进行非随机观察性研究,如检测阴性设计。然而,观察性研究可能会产生关于安全性和有效性的误导性答案,这主要是由于疾病流行期间接种疫苗的人与未接种疫苗的人之间的暴露风险不同[34,35]。评价针对新冠病毒肺炎的人群水平疫苗效果的潜在策略是设计可以揭示间接有效性的整群随机试验[36];例如,已推荐使用阶梯设计来评价疫情暴发环境中的疫苗[37]。
尽管如此,在大量人群中对疫苗有效性和安全性的上市后研究非常重要,特别是为了筛查所有罕见的严重不良反应。在3期研究中报道了一些不良事件,如急性过敏反应、贝尔面瘫、横贯性脊髓炎和异常血糖,但尚未证实其与新冠病毒疫苗的相关性,对这些不良事件将继续在上市后进行监测和评估[38]。
总之,仍需要进一步评估首次批准使用的新冠病毒疫苗,以填补知识空白,并研发可能出于安全性、有效性、亚组优势等原因更可取的其他疫苗。安慰剂对照试验对于效力和安全性评价至关重要,因此不应立即取消。然而,当使用安慰剂在伦理上不可接受且难以实施时,也必须考虑替代试验设计。随着大规模疫苗接种,新冠病毒疫苗上市后数据的研究结果可以指导监管决策和公共卫生实践,以保持积极的利益-风险平衡。














 京公网安备 11010502051620号
京公网安备 11010502051620号




