《1、 引言》
1、 引言
由多重耐药(MDR)的革兰氏阴性菌(GNB)导致的严重临床感染已对全球公共卫生健康构成严重威胁[1]。目前对由产β-内酰胺酶的革兰氏阴性菌,特别是碳青霉烯耐药细菌引起的感染的治疗策略有限。“最后一线”(last-line)药物(如多黏菌素、替加环素)的治疗效果可能会受到耐药性、次优药代动力学和(或)菌株高毒性的影响[2‒4]。2015年2月,美国食品药品监督管理局(FDA)批准了一种新型头孢菌素/β-内酰胺酶抑制复合物——头孢他啶-阿维巴坦(CAZ-AVI),这在很大程度上缓解了MDR GNB治疗手段匮乏的现状[5‒7]。
阿维巴坦(原名AVE1330A或NXL104)是一类二氮杂双环辛烷(DBO)β-内酰胺酶抑制剂[8]。该抑制剂可以快速酰化各种β-内酰胺酶,同时降低β-内酰胺酶的水解能力。因此,CAZ-AVI对产Ambler A类[超广谱β-内酰胺酶(ESBL)和肺炎克雷伯菌耐碳青霉烯酶(KPC)]、C类(AmpC β-内酰胺酶)及某些类D类[苯唑西林酶(OXA-48)] β-内酰胺酶的菌株具有抑制能力,但是对产B类金属内酰胺酶(MBL)[新德里金属β-内酰胺酶(NDM)、维罗纳整合子编码的金属β-内酰胺酶(VIM)、亚胺培南细菌金属β-内酰胺酶(IMP)]的菌株无效[9]。
然而,使用抗菌药物的一个潜在危险是细菌的耐药性。自CAZ-AVI开始应用于临床,全球范围内已陆续有与耐药菌株产生相关的报道[10‒14]。因此,迫切需要了解短时间内菌株产生CAZ-AVI耐药性的遗传机制。本文系统回顾了CAZ-AVI的流行病学、耐药机制及其临床应用,并讨论了应对CAZ-AVI耐药GNB感染的治疗方法,以便研究新策略、应对新问题。
《2、 已批准用于临床的阿维巴坦及其他β-内酰胺酶抑制剂的特性》
2、 已批准用于临床的阿维巴坦及其他β-内酰胺酶抑制剂的特性
迄今共有6种β-内酰胺酶抑制剂已被批准用于临床。舒巴坦和他唑巴坦属于青霉烷砜类,克拉维酸是氧氮双环庚酮。这三种抑制剂具有“自杀”(suicide)失活的作用,利用保守的活性残基与其靶位相互作用,导致靶向β-内酰胺酶的不可逆失活。这些抑制剂的使用范围在很大程度上仅限于一些A类丝氨酸β-内酰胺酶,如TEM-1 [15]。最近被批准的其他三种抑制剂是DBO(阿维巴坦和瑞来巴坦)[16‒17]和硼酸(法硼巴坦)[18]。与“自杀”失活的作用机理不同,后三种抑制剂作为竞争性抑制剂,以缓慢可逆的共价结合方式与目标β-内酰胺酶结合,因此可以重新生成有活性的β-内酰胺酶以及部分抑制剂[16,19]。虽然法硼巴坦最初被用于抑制KPC,但它也可对其他A类、C类β-内酰胺酶的活性起到抑制作用[19]。不过,美罗培南-法硼巴坦对缺乏孔蛋白或过表达药物外排泵的菌株的抑制能力比较低[18]。FDA在2019年批准瑞来巴坦与亚胺培南、西司他丁可联合使用。亚胺培南-瑞来巴坦对产KPC和C类β-内酰胺酶的碳青霉烯耐药肠杆菌科细菌(CRE)和铜绿假单胞菌(CRPA)起作用。亚胺培南-瑞来巴坦对缺乏孔蛋白的碳青霉烯耐药菌,如OprD失活的铜绿假单胞菌和外膜蛋白OmpF/OmpK35失活的CRE具有良好的抑制能力[17,20]。法硼巴坦和瑞来巴坦都不能抑制B类、D类β-内酰胺酶。
在头孢他啶中加入阿维巴坦可以恢复其抑制产多种A类和C类β-内酰胺酶的肠杆菌科和铜绿假单胞菌的活性[8,21]。值得一提的是,在已批准使用的抑制剂中,阿维巴坦是唯一一个可以帮助头孢他啶抑制D类β-内酰胺酶(如OXA-48)的药物。体外研究表明,阿维巴坦对β-内酰胺酶有较高的抑制作用,一般1~5个阿维巴坦分子足以抑制一个β-内酰胺酶分子的活性,而他唑巴坦分子和克拉维酸分子则需要达到55~214个[8]。此外,KPC-2与阿维巴坦的反应是不可逆的,它们的结合会形成β-内酰胺/β-内酰胺酶抑制剂复合物,从而导致阿维巴坦的水解和游离KPC-2的再生[22]。与其他已批准的抑制剂相比,阿维巴坦具有高效抑制β-内酰胺酶特别是OXA-48型碳青霉烯酶的优点。
《3、 头孢他啶-阿维巴坦的临床应用》
3、 头孢他啶-阿维巴坦的临床应用
CAZ-AVI在美国和欧洲被批准用于治疗包括肾盂肾炎在内的复杂的尿路感染(cUTI)、复杂腹腔内感染(cIAI),以及包括呼吸机相关肺炎(VAP)在内的医院获得性肺炎(HAP)[23‒24]。该复合物在欧洲也被用于治疗由治疗方案有限的需氧型GNB引起的成年患者感染[24]。到目前为止,该药物已获得全球40多个国家和地区的批准,中国于2019年5月批准使用该药物。CAZ-AVI对健康人群和医院患者(儿童和成人)的耐受性良好,大部分副作用的强度为轻微或者中度[25‒26]。据报道,在由对碳青霉烯产生耐药性的肺炎克雷伯菌(CRKP)引起的感染中,与其他药物相比,使用CAZ-AVI临床治疗的成功率和存活率均有显著提高[5]。研究表明,使用CAZ-AVI或多黏菌素治疗CRE感染的患者,30天死亡率分别为9%和32% [6],说明CAZ-AVI比多黏菌素更具优势[5]。此外,接受CAZ-AVI治疗的患者比接受氨基糖苷类联合用药或多黏菌素联合用药的其他患者发生急性肾衰竭的概率更低。这些临床研究结果说明,在由碳青霉烯耐药菌引起的感染中,CAZ-AVI可以作为“最后一线”药物的一些潜在替代品。截止到2020年4月,共开展21项临床研究以评估CAZ-AVI的药效,其中包括一项IV期、6项III期、5项II期和9项I期的研究(见附录A中的表S1)。
《4、 头孢他啶-阿维巴坦的耐药性机制》
4、 头孢他啶-阿维巴坦的耐药性机制
《4.1 头孢他啶-阿维巴坦暴露诱导的耐药性》
4.1 头孢他啶-阿维巴坦暴露诱导的耐药性
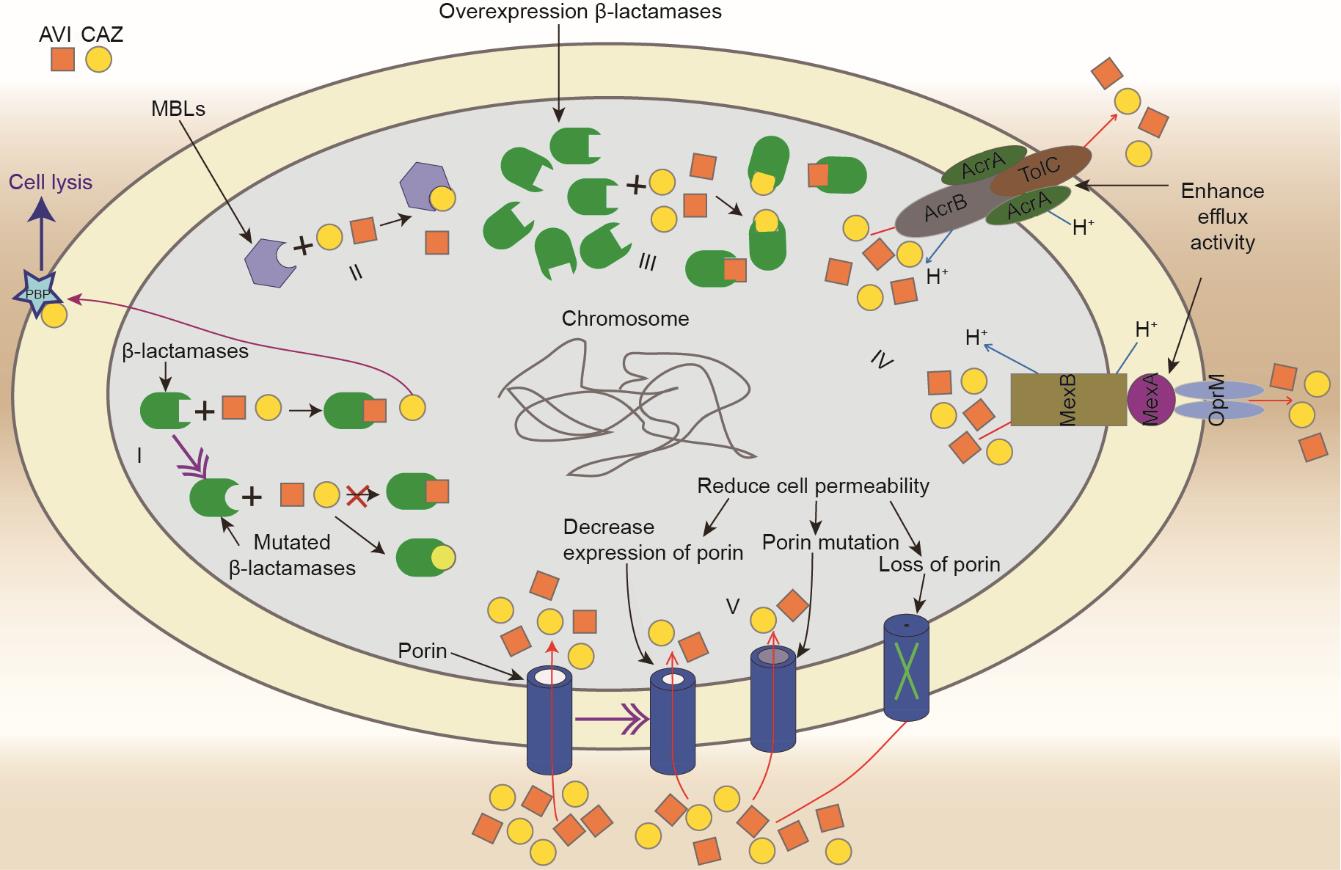
体外和临床研究均报道了菌株对CAZ-AVI的耐药性。等进行了一项体外研究,预测对CAZ-AVI敏感的产KPC-3的阴沟肠杆菌和肺炎克雷伯菌临床菌株的耐药性相关突变。他们发现在高达16倍最小抑菌浓度(MIC)下,CAZ-AVI耐药菌的产生频率约为1 × 10-9。首例对CAZ-AVI产生耐药性的菌种是一株产KPC的肺炎克雷伯菌(KPC-Kp),携带这株菌种的患者在用CAZ-AVI治疗之前没有该药物的暴露史[10]。随后,全球多地出现了有关CAZ-AVI耐药的报道[11‒14]。CAZ-AVI的耐药机制见表1 [11‒13,28‒44]和附录A中的表S2。CAZ-AVI耐药机制复杂,可能在单个细菌中同时由多种机制介导(图1)。下面将对这些机制进行详细介绍。
《表1》
表1 人体内的CAZ-AVI耐药机制
| Protein name | Resistance mechanism | Year | Location | Country | Species | Reference |
|---|---|---|---|---|---|---|
| KPC-8 | V240G substitution of KPC-3 | 2017, 2020 | Plasmid | USA, Argentina | [ | |
| KPC-28 | A two-amino-acid (G‒T) deletion at positions 242 and 243 of KPC-3 | 2019 | NA | France | [ | |
| KPC-31 | D179Y substitution of KPC-3 | 2017, 2018, 2019 | Plasmid or NA | USA, Italy, Germany | [ | |
| KPC-41 | Insertion of P‒N‒K between positions 269 and 270 of KPC-3 | 2019 | Plasmid | Switzerland | [ | |
| KPC-50 | Insertion of E‒A‒V between positions 276 and 277 of KPC-3 | 2020 | Plasmid | Switzerland | [ | |
| — | T243M substitution of KPC-3 | 2017 | NA | USA | [ | |
| — | Insertion of E‒L between positions 165 and 166 of KPC-3 | 2017 | NA | USA | [ | |
| KPC-14 | A two-amino-acid (G‒T) deletion at positions 242 and 243 of KPC-2 | 2020 | Plasmid or NA | USA, Italy | [ | |
| KPC-33 | D179Y substitution of KPC-2 | 2018, 2020 | Plasmid or NA | USA, Greece, Italy | [ | |
| KPC-35 | L169P substitution of KPC-2 | 2019 | Plasmid | USA | [ | |
| KPC-44 | 15 amino acid insertion after position 269 of KPC-2 | 2020 | Plasmid | Greece | [ | |
| KPC-57 | D179V substitution of KPC-2 | 2020 | Plasmid | Greece | [ | |
| — | P170S substitution of cefotaximase CTX-M-14 | 2017 | Plasmid | Germany | [ | |
| OXA-539 | D149 duplication of OXA-2 | 2017 | Chromosome | Spain | [ | |
| Vietnamese extended-spectrum β-lactamase (VEB)-14 | T216del of VEB-1 | 2020 | Plasmid | Greece | [ | |
| VEB-25 | K234R substitution of VEB-1 | 2020 | Plasmid | Greece | [ | |
| KPC-3 | Increased expression | 2017 | Plasmid | USA | [ | |
| RamR | An 8 bp insertion in | 2017 | Chromosome | USA | [ | |
| OmpK35 | Disruptions (frameshifts or > 2 amino acid insertions/deletions) | 2019 | NA | USA | [ | |
| — | T333N substitution of OmpK36 | 2017 | NA | USA | [ | |
| OmpK36 | Disruptions (frameshifts or > 2 amino acid insertions/deletions) | 2019 | NA | USA | [ | |
| OmpK37 | Disruptions (frameshifts or > 2 amino acid insertions/deletions) | 2019 | NA | USA | [ |
《图1》
图1 细菌对CAZ-AVI的耐药机制示意图。(I)β-内酰胺酶突变,包括KPC、AmpC、CTX-M,以及OXA-48;(II)产生不受阿维巴坦作用的金属β-内酰胺酶;(III)过表达水解酶;(IV)提高外排泵活性,包括AcrA/B‒TolC和MexA/B‒OprM;(V)降低细胞通透性。AVI:阿维巴坦;CAZ:头孢他啶;MBL:金属β-内酰胺酶;PBP:盘尼西林结合蛋白。
《4.1.1. 基因突变》
4.1.1. 基因突变
到目前为止,报道的对CAZ-AVI产生耐药性的菌种多数来自含有突变的blaKPC-2和blaKPC-3基因的肺炎克雷伯菌(见附录A中的图S1)。结果表明,这些突变经常发生在A类β-内酰胺酶的Ω环中,这段保守序列包含KPC从Arg164到Asp179的氨基酸残基[45]。值得注意的是,替换Ω环中某个氨基酸,特别是164号、167号、169号、179号氨基酸,可以显著降低菌株对CAZ-AVI的敏感性[12,27,37,46]。Gaibani等[31]通过对一位接受CAZ-AVI治疗的KPC-Kp血流感染患者的临床分离菌株进行测序,描述了该菌株对CAZ-AVI耐药性的发展进程。通过全基因组测序,他们发现CAZ-AVI耐药菌的KPC-3相比敏感菌在179号位点出现了氨基酸替换(D179Y)。通过该替换形成一个更深的口袋状结构,将头孢他啶分子的固定时间拉长,避免头孢他啶分子与阿维巴坦结合,从而增强了对头孢他啶的水解[47]。D179Y突变的双重作用在很大程度上提高了菌株对CAZ-AVI的耐药性。另一项研究表明,肺炎克雷伯菌的CAZ-AVI耐药性是由KPC-2的L169P氨基酸替换导致的。这个菌株分离自一位接受CAZ-AVI联合庆大霉素治疗的VAP患者。与野生型KPC-2相比,该突变蛋白使大肠杆菌DH5α对CAZ-AVI的MIC值提高了8倍[12]。值得注意的是,由Ω环氨基酸替代引起的CAZ-AVI耐药性可以通过增强头孢他啶的反应动力学,防止其与阿维巴坦结合来实现。这种机制已经在体外[27,30,46]和体内[12]研究中得到证实。
在Ω环中也存在其他导致CAZ-AVI耐药性变化的替代和缺失,如V20G、T243M。自CAZ-AVI被批准临床使用以来,Shields等[48]首次报道了在CRE感染的治疗过程中出现CAZ-AVI耐药性。在使用CAZ-AVI治疗时,37位患者中有三位患者对CAZ-AVI产生耐药性,导致最终治疗失败。对CAZ-AVI敏感菌株和耐药菌株进行对比分析,结果表明,细菌的耐药性是由KPC-3的氨基酸替换(D179Y & T243M、D179Y、V240G)引起的。与野生型相比,三种KPC-3突变体在经过大肠杆菌DH5α表达后,对CAZ-AVI的MIC值均有所提高。结果表明,blaKPC-3突变体对CAZ-AVI的抵抗能力的大小依次为D179Y & T243M > D179Y > V240G [11]。然而,Ω环中氨基酸替换的潜在机制仍然不清楚。
除了替换之外,氨基酸的插入和缺失也可以导致对CAZ-AVI产生耐药性。据报道,在KPC-2和(或)KPC-3中插入1~15个氨基酸会引起细菌对CAZ-AVI产生耐药性(见表1和附录A中的表S2)。例如,对于三个不同的KPC-2突变体(分别分离自三位患者的CAZ-AVI耐药肺炎克雷伯菌),其中两个突变体的Ω环中分别存在D179Y和D179V替换。在第三株菌种的KPC-2的259位氨基酸之后插入15个氨基酸,这个突变体被命名为KPC-44 [38]。KPC-41突变体是指在KPC-3的269位和270位氨基酸之间插入三个氨基酸[脯氨酸-天冬酰胺-赖氨酸(P-N-K)],表达KPC-41的肺炎克雷伯菌可对CAZ-AVI产生耐药性[33]。此外,KPC-3中缺失两个氨基酸(Δ242-G-T-243),形成新的突变体KPC-28,也可引起肺炎克雷伯菌对CAZ-AVI产生耐药性[29]。在KPC-2的突变体KPC-14中也发现了同样的氨基酸缺失,导致肺炎克雷伯菌对CAZ-AVI耐药性的改变[36]。
值得注意的是,blaKPC基因突变可引起CAZ-AVI耐药性改变,进而导致菌株原本的碳青霉烯酶活性降低或消失[11‒13,29‒30,37,49],从而展现出类似ESBL的功能[30]。例如,KPC-2在D179Y替换后,阿维巴坦对其催化性能的抑制作用减弱,对头孢他啶水解能力增强[46]。然而,这种突变体失去了原有的对氨曲南和亚胺培南的水解能力。
《4.1.2. 基因突变》
4.1.2. 基因突变
CTX-M型酶是一种全球广泛传播的A类ESBL,可被阿维巴坦抑制[50]。有报道显示,肺炎克雷伯菌临床分离株由于blaCTX-M-14基因突变而获得CAZ-AVI耐药性。在blaCTX-M-14基因中发现了两个非同义的单核苷酸序列多态性,导致两个氨基酸出现变化(P170S和T264I),其中一个(P170S)位于Ω环上。与blaCTX-M-14野生型相比,这些突变体在大肠杆菌TOP10菌种中表达后,可导致菌株对头孢他啶的MIC值增加(超过64倍;从等于4 mg·L-1到大于256 mg·L-1)以及对CAZ-AVI的MIC值增加(16倍;0.5~8 mg·L-1)[39]。另一项研究报道,CTX-M-15中同时发生的两个氨基酸替换(L169Q和S130G)可导致体外CAZ-AVI耐药性的产生[51]。阿维巴坦在高达50 000 μmoL·L-1的浓度下,才可以抑制部分双突变菌株,且这两个位点的氨基酸替换都不能单独发挥作用[51]。Livermore等[52]发现,CTX-M-15的一个氨基酸位点替换,即D182Y可以使CAZ-AVI的MIC值从0.25 mg·L-1提高到2 mg·L-1,但对其他头孢菌素的耐药能力降低了。由于CTX-M是最流行的EBSL之一,CTX-M突变介导的CAZ-AVI耐药性在未来可能具有流行病学意义。
《4.1.3. 基因突变》
4.1.3. 基因突变
VEB类β-内酰胺酶是一类非线性、非含巯基变体(SHV)的A类ESBL。在不同的VEB中,包含阿维巴坦结合口袋的残基要么相同,要么在功能上保守,所以阿维巴坦可以对它们产生抑制作用[53]。最近发现,VEB-1突变可以引起菌株产生CAZ-AVI耐药性[53]。研究人员在两株对CAZ-AVI有耐药性的KPC-Kp分离株中检测到VEB-1的一个新型突变体VEB-25。这些分离株来源于2019年希腊两位没有接受过该药物治疗的住院患者。由于发生了K234R氨基酸替换,阿维巴坦对突变的VEB-1酶没有抑制作用[42]。之后,另一个研究小组报道,在希腊雅典的一家医院出现了同时产KPC-2和VEB-25的对CAZ-AVI具有耐药性的肺炎克雷伯菌株。共有7位患者被对CAZ-AVI产生耐药性的肺炎克雷伯菌株定植,其中有三人被感染。用CAZ-AVI + 美罗培南 + 磷霉素或CAZ-AVI + 氨曲南 + 磷霉素三联治疗14 d后,有两位患者治疗成功,而CAZ-AVI +美罗培南的联合治疗均失败;不幸的是,所有感染的患者在第28天后都没有生存下来。这个研究小组还报告了一个案例,即在疫情暴发前一年,接受CAZ-AVI治疗的住院患者被对CAZ-AVI有耐药性的KPC-Kp菌种定植。该菌株可产生另一个VEB-1突变体——VEB-14 (T216缺失),该突变体降低了被阿维巴坦失活的能力[41]。VEB-1突变体的出现警示我们要对新型耐药机制的发生保持高度的警惕。
《4.1.4. 基因的过表达与突变》
4.1.4. 基因的过表达与突变
C类β-内酰胺酶的改变也可导致CAZ-AVI耐药性的发生。为了了解CAZ-AVI和头孢洛芬/他唑巴坦的耐药机制,Zamudio等[14]分析了来源于囊性纤维化(CF)患者的24株铜绿假单胞菌。他们发现菌株对头孢洛芬/他唑巴坦和CAZ-AVI的耐药性是由AmpD突变引起AmpC过表达造成的。同样,从CF的成年患者体内分离出9株CAZ-AVI耐药铜绿假单胞菌,其中有6株ampC基因表达升高[54]。AmpC的Ω环改变也可以产生CAZ-AVI耐药性。例如,三株头孢他啶耐药的铜绿假单胞菌分离株经体外诱导变为CAZ-AVI耐药,这些菌株AmpC的Ω环有数量不同的氨基酸缺失(分别包括5个、7个、19个氨基酸残基),这些突变体和CAZ-AVI耐药相关[55]。Livermore等[52]发现,在AmpC解抑制的肠杆菌科细菌中,AmpC的R168P/H、G176R/D、N366Y氨基酸替换,以及309~314位氨基酸的缺失,都可以导致细菌对CAZ-AVI的MIC值的提高。在另一项研究中,Compain等[56]克隆了分别由染色体和质粒携带的三个AmpC的N346Y突变体,构建重组质粒并导入大肠杆菌TOP10后,发现突变体对CAZ-AVI的MIC值增加,推测N346Y替换可能是AmpC获得CAZ-AVI耐药性的途径。鉴于一些临床上重要的肠杆菌科细菌如肺炎克雷伯杆菌和阴沟肠杆菌本身就携带ampC基因,因此将来确定这些菌种是否因为AmpC的改变而产生CAZ-AV耐药性将具有重要意义。
《4.1.5. 基因突变》
4.1.5. 基因突变
目前,CAZ-AVI是被批准使用的内酰胺酶抑制剂中唯一一种对OXA-48有效的药物。因此,CAZ-AVI可用于治疗由产OXA-48的肠杆菌科细菌引起的感染[57]。然而,由OXA-48突变引起的CAZ-AVI耐药已经在体外得到证实。OXA-48双氨基酸替换(P68A和Y211S)导致阿维巴坦的抑制能力降低为原来的1/5 [58]。P68A替换增加了底物结合位点的灵活性和可塑性,使可水解药物的体积增加。Y211S的突变则影响了酶的稳定性,并通过改变氢键而提高对头孢他啶的耐药性。因此,双氨基酸替换降低了阿维巴坦对OXA-48的抑制活性,并使碳青霉烯酶特异性水解头孢他啶[58]。值得庆幸的是,迄今为止还没有临床分离出具有CAZ-AVI耐药性并且产生OXA-48的菌株,这可能是由于OXA-48突变介导的耐药对细菌来说需要付出更多代价。
值得注意的是,窄谱OXA β-内酰胺酶的突变也可能导致细菌对CAZ-AVI产生耐药性。一项临床研究从术中感染的患者身上分离出一株对CAZ-AVI产生耐药性的铜绿假单胞菌,这株菌株的blaOXA-2基因发生了三个碱基的插入,导致一个关键残基 D149的重复。这可能是造成细菌对CAZ-AVI产生耐药性的决定因素[40];但是其中的耐药机制还不清楚。
《4.1.6. 降低通透性及过表达外排泵》
4.1.6. 降低通透性及过表达外排泵
作为常见的耐药性因素,孔蛋白和外排泵也参与了细菌对CAZ-AVI耐药性的产生[44,54,59‒60]。在CAZ-AVI耐药细菌中经常出现孔蛋白缺失、突变和表达下降,并与其他机制如头孢他啶水解活性提高[61]和KPC突变[49]协同作用。相比碳青霉烯类抗生素,虽然头孢他啶进入周质空间对主要孔蛋白(如OmpK35和OmpK36)的依赖程度更小[9],但一些临床研究发现,主要孔蛋白也在细菌对CAZ-AVI耐药性方面发挥作用。有研究连续两天从一位患者身上分离得到两株肺炎克雷伯菌,其中一株对CAZ-AVI敏感,而另一株对CAZ-AVI有耐药性。两株菌种均编码了无功能的OmpK35,耐药株的OmpK36中含有T333N氨基酸位点替换,并且blaKPC-3基因的表达量比敏感株更高[43]。该研究表明,OmpK36的T333N替换降低了菌株对CAZ-AVI的敏感性。此外,当耐药株的OmpK36突变体被野生型取代时,CAZ-AVI的MIC值下降为原来的1/2。同样,OmpK35失活在细菌对CAZ-AVI产生耐药性中的作用也被证实。一项研究表明,在CAZ-AVI的MIC ≥ 1 mg·L-1的产KPC-2肺炎克雷伯分离株中,ompK35的表达量降低了,是MIC ≤ 0.5 mg·L-1的菌株表达量的1/28.5。ompK35的表达下调是由调控因子的移码突变或者过表达引起的,可以通过表达有功能的OmpK35来恢复菌株的敏感性,从而使CAZ-AVI的MIC值降低为原来的1/4~1/2 [61]。类似的结论也在其他研究中得到证实[54,59]。
外排泵不是细菌抵抗CAZ-AVI的主要途径,但在耐药菌中可发现外排泵活性增强与其他耐药表型结合的耐药机制[44,60]。Nelson等[44]的研究表明,acrAB外排泵的调节因子ramR突变可导致肺炎克雷伯菌AcrAB-TolC外排系统的过表达,并与孔蛋白的改变共同促成了对CAZ-AVI的耐药性。此外,外排泵MexAB-OprM的活性增加和ampC的高表达共同促进了从CF患者分离的铜绿假单胞菌对CAZ-AVI的耐药性[62]。外排泵在细菌对CAZ-AVI产生耐药性过程中的作用已被进一步证实,有研究发现在对CAZ-AVI产生耐药性的10株临床铜绿假单胞菌中,OprD存在多种不同的氨基酸替换;使用外排泵抑制剂后,CAZ-AVI的MIC值显著降低。因此,该研究表明,CAZ-AVI的主要屏障是膜通透性和药物外排[60]。在第4.1.4节描述的9株CAZ-AVI耐药铜绿假单胞菌分离株中,有7株检测到OprD缺失,表明孔蛋白和AmpC共同参与了细菌对CAZ-AVI耐药性的改变[54]。因此,铜绿假单胞菌对CAZ-AVI的耐药机制是多因素的,可能因样本来源的不同而有所不同。了解细菌对CAZ-AVI的耐药性涉及细菌适应性代价和流行情况,可能有助于在临床经验性治疗过程中对CAZ-AVI的合理使用。
《4.2 β-内酰胺酶的产生不受阿维巴坦抑制》
4.2 β-内酰胺酶的产生不受阿维巴坦抑制
表达不受阿维巴坦抑制的β-内酰胺酶(如MBL和大多数D类酶)是产生CAZ-AVI耐药性的常见机制[63‒64]。MBL可以水解大多数临床上使用的β-内酰胺,包括碳青霉烯,并且到目前为止,MBL还不能被任何商业化的β-内酰胺酶抑制剂所抑制。根据锌离子的依赖性和序列相似性,可将MBL分为三个亚类(B1、B2和B3)。B1亚类(如NDM、IMP、VIM)由质粒编码,是目前临床上最重要的一类[65],已经在肠杆菌科细菌如肺炎克雷伯菌和大肠杆菌的临床菌株中发生转移[66],说明MBL的广泛传播对CAZ-AVI的临床应用具有很大的挑战。值得注意的是,与上述耐药性的出现相反,产生不受阿维巴坦抑制的β-酰胺酶可以说是产生CAZ-AVI耐药性的基线。
《5、 头孢他啶-阿维巴坦耐药菌株的全球流行病学特征》
5、 头孢他啶-阿维巴坦耐药菌株的全球流行病学特征
最近引入的CAZ-AVI提高了治疗由MDR GNB引起的感染的能力,特别是由CRE引起的感染的能力。然而,随着CAZ-AVI在临床治疗中的应用越来越多,细菌耐药率可能也将不断提高。如上文所述,对CAZ-AVI产生耐药性的原因主要是自主转移质粒携带的耐药基因发生了突变,这将极大地增加对CAZ-AVI耐药性传播的风险。
根据现有资料显示,对CAZ-AVI产生耐药性的GNB主要属于肠杆菌科和铜绿假单胞菌。在一项全球性的监测研究中,对879例来自医院相关性肺炎患者的呼吸道和血液标本的分离株的CAZ-AVI耐药率进行了评估。其中肠杆菌科(n = 370)的耐药率为1.4%,铜绿假单胞菌(n = 129)的耐药率为11.6% [67]。在另一项全球(不包括北美地区)监测研究中,发现肠杆菌科(n = 59 828)的耐药率小于1.6% [68]。CAZ-AVI的耐药率可能与地理位置有关。拉丁美洲的数据表明,肠杆菌科(n = 7665)对CAZ-AVI高度敏感,耐药率为0.3%,而铜绿假单胞菌(n = 1794)的耐药率更高,达到12.6% [69]。中国微生物监测网2017年的数据表明,肠杆菌科(n = 1774)和铜绿假单胞菌(n = 524)的耐药率分别为5.4%和13.5% [70]。上述研究数据共同说明肠杆菌科的CAZ-AVI耐药率远低于铜绿假单胞菌。从CF患者中分离的铜绿假单胞菌对CAZ-AVI具有更高的耐药性,耐药率为24%~57% [54,71‒72]。铜绿假单胞菌对CAZ-AVI的耐药率高于肠杆菌,原因可能是两者采用的碳青霉烯耐药机制不同。
最近一项流行病学研究对中国在将CAZ-AVI投入临床使用之前收集的872株CRKP的耐药情况进行了检测,结果表明CAZ-AVI的耐药率为3.7% [73]。超过一半(53.1%)的耐药株产生了MBL,40.6%为KPC-KP,其他(6.3%)同时产MBL和KPC。另一份来自中国一家大学附属医院的232株CRKP分离株的报告显示,菌株对CAZ-AVI的耐药率为8.2%。值得注意的是,根据大蜡螟感染模型和小鼠致死测定的结果,其中有9例是对CAZ-AVI有耐药性的高毒CRKP(hvCRKP)[74]。这些数据表明,在临床使用CAZ-AVI之前,CRKP对CAZ-AVI的耐药性已经出现,并且新出现的对CAZ-AVI有耐药性的hvCRKP菌株可能成为公共卫生网络的另一个严重威胁。
《6、 临床应用前景》
6、 临床应用前景
目前,KPC和OXA是在临床中发现的主要碳青霉烯酶,也是CAZ-AVI的作用靶点。这种新药物的使用可能会改变碳青霉烯酶的流行病学趋势,如碳青霉烯酶从KPC到MBL的转变[75]。此外,由于复杂耐药机制以及自主转移质粒的水平传递(如KPC经常携带质粒)引起的耐药性提高,将改变临床环境中的耐药细菌种类[76],因此,非常有必要对CAZ-AVI耐药性的出现进行积极监测。即使患者没有药物暴露史,也建议医院对从临床样本中分离的肠杆菌科细菌进行常规CAZ-AVI敏感性检测。
了解当地的流行病学模式对于指导CAZ-AVI的合理使用、防止CAZ-AVI耐药性的广泛传播非常重要。医疗卫生人员也有责任分享他们关于使用CAZ-AVI和其他新型β-内酰胺酶抑制剂的临床经验。
blaKPC突变引起菌株对碳青霉烯敏感,意味着碳青霉烯有潜力被用于治疗对CAZ-AVI产生耐药性的GNB感染[12]。有研究人员建议使用碳青霉烯联合CAZ-AVI治疗CRE感染,理论上可以同时治疗由产野生型和突变型KPC菌株引起的感染[12]。阿维巴坦也许可以保护碳青霉烯不被碳青霉烯酶水解,碳青霉烯可以治疗对CAZ-AVI产生耐药性的blaKPC突变菌。然而,这种联合用药在临床中的安全性和有效性仍有待探索,而且菌株对碳青霉烯的敏感性得到恢复后,这种敏感性维持时间往往较短。此外,目前尚不清楚在这种情况下是否会产生其他耐药机制,因此可能导致治疗失败。需要注意的是,一旦在治疗过程中出现了对CAZ-AVI产生耐药性的情况,其他药物也可用于挽救性治疗。例如,Athans等[37]报道了一则将美罗培南-法硼巴坦用作CAZ-AVI耐药肺炎克雷伯菌感染的挽救性治疗的临床案例。在经美罗培南加多黏菌素治疗14 d后,成功地治疗了由对CAZ-AVI产生耐药性的肺炎克雷伯菌引起的复发性肺炎[11]。总的来说,了解CAZ-AVI的耐药机制对于制定合适的治疗策略用于有效治疗CAZ-AVI耐药细菌感染至关重要。
虽然阿维巴坦的加入大大提高了头孢他啶对大多数肠杆菌科细菌的活性,但阿维巴坦并不能提高头孢他啶对不动杆菌或大多数厌氧菌(普氏菌属和卟啉单胞菌属除外)的活性[77‒78]。目前治疗CRE的最大挑战之一是开发用于MBL的抑制剂。单环类药物氨曲南有望成为MBL的抑制剂,它对MBL具有活性,但是对ESBL、KPC、AmpC这类β-内酰胺酶没有活性[79]。因此,将阿维巴坦和氨曲南联合,有望用于治疗既编码丝氨酸β-内酰胺酶又产MBL的菌株。有部分研究已经证实了这种联合用药可以治疗产MBL和A类或C类β-内酰胺酶的肠杆菌科细菌[21,80]。例如,一项研究评估了阿维巴坦与头孢他啶、头孢洛林或氨曲南对57株GNB的活性,发现产VIM-1‒TEM-1的阴沟肠杆菌仅对氨曲南-阿维巴坦敏感(MIC, 0.12 mg·L-1)[80]。然而,当KPC经氨曲南-阿维巴坦治疗诱导突变后,携带MBL和KPC突变体的菌株将不能被氨曲南-阿维巴坦抑制。氨曲南-阿维巴坦正处于III期临床试验阶段(https://clinicaltrials.gov/ct2/show/record/NCT03329092)。目前正在试验中的其他碳青霉烯酶抑制剂是否也同样容易受到耐药性的快速进化的影响,以及需要特别强调哪些遗传因素,这些仍有待进一步确定。
《7、 结论》
7、 结论
虽然当前新型碳青霉烯酶抑制剂可以满足抑制CRE的需求,但由于不断出现复杂的耐药机制,因此这些药物不太可能结束CRE的流行。多黏菌素和碳青霉烯的暴露可能会进一步加剧这种状况。本文强调,一方面要在临床中合理使用CAZ-AVI以尽量减少细菌耐药性的出现;另一方面则需要持续跟踪细菌耐药性的发展以指导开发新的治疗方法。在未来有很多问题需要解决:① CAZ-AVI的临床使用是否会改变CRE的流行病学趋势或碳青霉烯酶的流行基因型?②对CAZ-AVI治疗失败的有效挽救策略是什么?③如何开发临床安全有效的抑制剂来抑制MBL(如NDM和IMP)和其他具有临床意义的D类碳青霉烯酶(如OXA-23)?④如何获得其他的流行病学数据,以了解CAZ-AVI在临床环境中流行的耐药机制?













 京公网安备 11010502051620号
京公网安备 11010502051620号




