《1. 引言》
1. 引言
在整个美洲,需要进行害虫治理以尽量减少寄生在水果上的按实蝇(Anastrepha sp.;双翅目:实蝇科)的数量。仅在美国,宿主水果每年的价值就超过70亿美元[1‒2]。使用诱捕网络对商业生产区的按实蝇种群进行监测,最终指导各种控制工作:综合害虫治理(IPM)策略、杀虫喷雾技术、检疫管理和昆虫不育技术(SIT)。在佛罗里达和大安的列斯群岛,加勒比按实蝇,即Anastrepha suspensa(A. suspensa)引起了人们的关注,其雄性信息素(在自然聚集策略中具有重要作用)是IPM策略关注的重点[3‒5]。
雄性加勒比按实蝇产生挥发性信息素(R,S,S)-(–)-anastrephin和(S,R,R)-(+)-anastrephin,以及(S,S,S)-(–)-epianastrephin和(R,R,R)-(+)-epianastrephin,这些信息素在短期生物测定中对雄性和雌性按实蝇均有吸引力[5‒14]。然而,在某种程度上因为缺乏可用的测试材料,利用这些信息素引诱加勒比按实蝇的方法仍然难以掌握。虽然已经报道了一些精细的合成物[4,15‒25],但大多数都不能满足配方研究的质量要求,更不用说重复的现场试验了[26]。最近的一项合成技术提供了相对方便的用于获得克量级(±)-anastrephin(1)和(±)-epianastrephin(2)的方法[27]。为了设计一种利用这些信息素的诱捕系统,人们开始尝试制备一种传统的聚氯乙烯(PVC)聚合物基引诱剂[28‒30]。本研究报道了与PVC基质释放1和2相关的动力学,作为温度和绝对湿度的函数——这是进行田野调查和捕获效率研究的关键第一步。
《2. 方法和材料》
2. 方法和材料
《2.1. 化学试剂》
2.1. 化学试剂
PVC(低分子量,524 980)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二辛酯(DOP)、无水四氢呋喃(THF;无抑制剂)和10%的碳(C)载钯(Pd)购自Aldrich化学有限公司(美国)。分析级甲基叔丁基醚(MTBE)购自Fisher Scientific公司(美国)。在瓷孔(Coors™多孔板;Sigma-Aldrich,美国)中成形聚合物圆盘。合成物1和合成物2是由美国农业部(USDA)制备的,纯度大于99%,并经气相色谱(GC)和电子冲击质谱(GC-EIMS)验证。用10% Pd/C在乙酸乙酯中催化加氢(101 kPa)得到合成物3,作为定量分析的内标(IS)(图1)[3,27]。
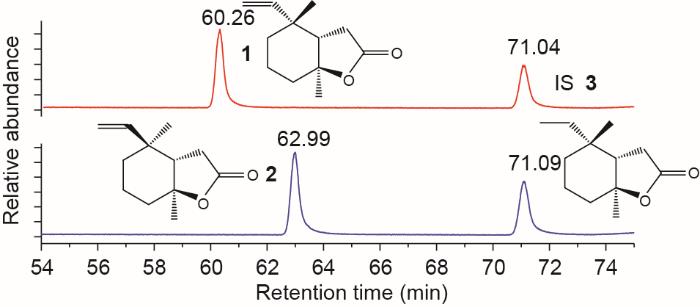
《图1》
图1 信息素结构和GC-EIMS总离子色谱图,显示
《2.2. 制备》
2.2. 制备
PVC-信息素圆盘的质量占信息素2和1(比例7:3)总质量的10%。在锥形瓶中,将PVC(251.5 mg)、DBP(125.6 mg)、DOP(127.5 mg)、信息素2(38.5 mg)和信息素1(16.5 mg)溶解在THF(1.665 g)中。利用抹刀将混合物混合,然后盖住锥形瓶并在40 ℃下加热。20 min后,将混合物再次按上所述方法混合,然后将约400 mg的溶液移至各自的瓷孔中。将瓷板在40 ℃下加热15 min,使THF蒸发,然后将其在室温下放置过夜,得到三个质量为(110.4 ± 0.8) mg(平均值±标准偏差,
《2.3. 挥发性信息素的收集》
2.3. 挥发性信息素的收集
对Walse等[5]报道的挥发性收集系统进行修改;除非另有说明,否则所有管道均使用直径为1/4 in(1 in= 25.4 mm)的Teflon管,所有连接均使用标准Swagelok接头。压缩机将空气(413 kPa)压缩并送入15.2 m3的可编程温度环境室,并通过活性炭过滤器(Westates Vocarb 48C;西门子工业有限公司,USA)串联连接到计量阀。然后将气流导入226.2 L的腔室,加压至约14 kPa,该腔室装有可调节的玻璃容器加湿器(Zoo Med®,美国),使在所有温度下(见下文)离开腔室的空气的绝对湿度(
在本研究中的温度[与加勒比按实蝇所在地区(大安的列斯群岛和佛罗里达州)相关的温度:(33.2 ± 0.1) ℃、(26.7 ± 0.3) ℃、(20.7 ± 0.3) ℃和(15.1 ± 0.4) ℃ ] 下,使用GC-EIMS在时间间隔内量化PVC圆盘释放的信息素。为了制备用于GC-EIMS分析的样品,取下VCT(并在必要时更换),用MTBE(8 mL)冲洗,并将其置于含有1 mL IS 3的MTBE溶液(16.1 ng⋅μL-1)的10 mL容量玻璃瓶(慢吹Kuderna-Danish)中。在通风橱中通过被动浓缩将洗脱液减至1 mL,并用移液管转移至2 mL玻璃GC样品瓶中。用直径为9 mm的Teflon内衬瓶盖密封样品瓶,为GC-EIMS分析做准备。正如Walse等[5]的报道,在5000~0.5 ng范围内,1和2的收集效率大于98%。一般先对释放出的信息素浓度进行初始量化,即[1和(或)2]=0或[1和(或)2]0,此后几乎每天进行一次量化,即[1和(或)2](其中t是时间,t = 1 d、 2 d、 3 d等)。
《2.4. 气相色谱-电子冲击质谱法》
2.4. 气相色谱-电子冲击质谱法
一般来说,1、2和IS 3是根据色谱、光谱分析结果与已发表文献的研究结果的一致性来确定的。使用GC保留时间(tR)和(或)质谱法进行化学验证,使用IS 3峰面积归一化法(参考相对检测器响应的六点线性最小二乘法校准相关方法)来确定挥发性收集研究中的浓度。对于已知体积的MTBE(即校准标准)中1的连续稀释的校准研究,每天测定检测器响应和保留指数。
使用7890A气相色谱仪和5973N四极杆质谱仪(Agilent Technologies,美国)进行电子冲击电离(70 eV)操作。在143 ℃下用氦气(He)载气(1.0 mL⋅min-1)进行冷柱上进样(1 μL)。烘箱程序为:在140 ℃下恒温1 min;以4 ℃⋅min-1加热至150 ℃,恒温70 min;以30 ℃⋅min-1加热至230 ℃,恒温2 min。GlasSeal连接器(Supelco®,美国)用于融合4个串联的色谱柱:一个失活柱[长(L)为8 cm,id = 0.53 mm;Agilent Technologies,美国],注入物沉积在该色谱柱上;一个失活保留间隙色谱柱(L = 2 m,id = 0.2~5 mm;Agilent Technologies,美国);一个DB-1701分析柱[L = 60 m,id = 0.25 mm,膜厚(df)= 0.25 μm;J & W Santa Clara,美国];一个失活柱(L = 1.5 m,id = 0.25 mm;Agilent Technologies,美国)直接导入检测器。传输线、离子源和四极杆温度分别为280 ℃、230 ℃和150 ℃。分析物tR (n = 10)如下所示。1:(60.26 ± 0.02) min;2:(62.98 ± 0.01) min;IS 3:(71.06 ± 0.03) min(图1)。
在每次扫描0.34 s时获得从50到600质荷比(m/z)的全扫描光谱,分辨率为± 0.3 m/z,用于定性验证。m/z (相对强度,%)如下所示。1:94 (3)、179 (33)、151 (14)、135 (33)、108 (61)、81 (100);2:194 (2)、179 (23)、151 (11)、135 (24)、108 (54)、81 (100) ;3:196 (0.8)、181 (72)、153 (71)、137 (12)、110 (61)、83 (100)。从总离子色谱图(TIC)中提取的用斜体字标注的离子用于定量分析。
《3. 结果》
3. 结果
《3.1. 信息素释放速率》
3.1. 信息素释放速率
在每个时间间隔(t),使用GC-EIMS对固体(s)圆盘上的气态(g)信息素损失进行量化。实验时间过程中的信息素损失由微分速率方程表示:
(1)
式中,kv (d-1)是与一级反应速率定律积分相关的可观测挥发速率常数:
(2)
实验数据支持动力学模型,即与信息素损失的一级动力学近似;对三次重复试验的ln([1 and/or 2]/[1 and/or 2]0) 进行最小二乘分析,绘制与时间的关系,得出斜率为-kv的复合线性回归。在(33.2 ± 0.1) ℃、(26.7 ± 0.3) ℃、(20.7 ± 0.3) ℃和(15.1 ± 0.4) ℃下,kv分别为9.51 × 10-3 d-1、4.14 × 10-3 d-1、1.57 × 10-3 d-1和1.34 × 10-3 d-1(图2)。由ln(2)/kv计算的半衰期(t1/2)分别约为73 d、167 d、352 d和519 d。
《图2》
图2 结果支持PVC信息素圆盘的一级损失为
释放速率随温度(T)增加而增加,经验上近似为阿伦尼乌斯方程:
(3)
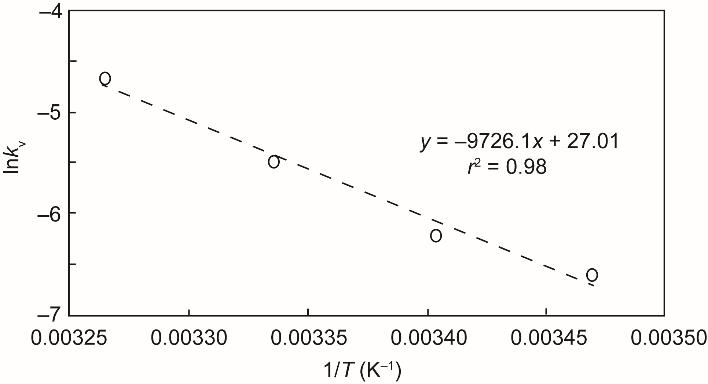
式中,Ea是活化能;R是气体常数(8.314 J⋅mol-1⋅K-1);T的单位为K;A是指前因子。对每个温度的lnkv进行最小二乘分析,绘制与1/T的关系,得到斜率为Ea/(-R) 、相关系数为r = 0.98的线性回归(图3)。求解方程(3)得到A的值为5.36 × 1011 d-1。
《图3》
图3 经验估计可观测挥发速率常数、-kv和温度之间的关系。
遵循Fickian扩散原理,化学物质通过薄膜传输到理想槽的过程可以用Higuchi方程[31‒32]来描述:
(4)
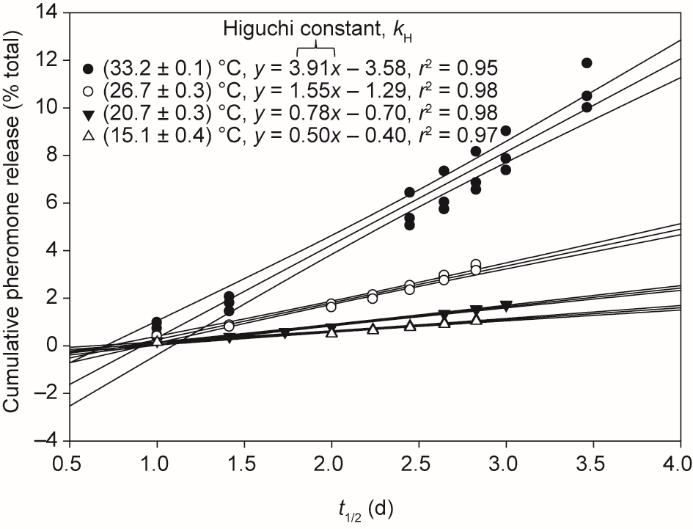
式中,Q是t(d)时刻化学物质的累积损失[占总损失的百分数];kH是Higuchi常数(d-1)。为进一步提供证据来支持PVC信息素圆盘释放的扩散控制机制,对三次重复试验累积损失1和(或)2进行最小二乘分析,得出斜率为kH、相关系数r≥ 0.95的复合线性回归;在 (33.2 ± 0.1) ℃、(26.7 ± 0.3) ℃、(20.7 ± 0.3) ℃和(15.1 ± 0.4) ℃下,相关系数r2分别为0.95、0.98、0.98和0.97(图4)。据我们所知,这是首次将Higuchi模型应用于“薄膜”聚合物基质中信息素的释放。
《图4》
图4 显示不同温度下最小二乘分析线性关系(显示95% CI)的Higuchi图[正如相关系数(所有r2≥0.95)所证明],进一步支持PVC信息素圆盘挥发性释放的Fickian扩散控制机制。
需要注意的是,在所有温度下,PVC圆盘的2和1相对损失比率保持恒定,大约为2.3∶1,这是自然发生的非对映体比例(图5)。单因素方差分析(ANOVA)不显著(F3,76 = 0.72,P = 0.74),表明2和1的总体均值的比率为2.39 ± 0.18,可以用来描述在95%置信区间(CI)下针对各个温度所观察到的比率[33]。这一发现为支持上述动力学和力学模型提供了额外的证据。
《图5》
图5 箱形图显示了PVC信息素圆盘中2相对于1的释放中值(---)作为温度的函数,涉及第1到第3个四分位数(灰色矩形)、异常值(•)、配方比例[约为2.3∶1(-)],这与天然存在的挥发性信息素的非对映体比例相匹配[
《4. 讨论》
4. 讨论
目前,针对包括加勒比按实蝇在内的按实蝇属主要害虫的诱捕系统依赖于食物引诱剂,这些食物引诱剂的选择性较差,而且从操作角度来看成本很高[1‒2,34]。为了设计一种利用已知加勒比按实蝇挥发性信息素的诱捕系统,将基于PVC聚合物的引诱剂配制在含有10%(质量分数)的1和2、非对映体比例为3∶7的圆盘中。信息素的释放速率随温度升高而增加,1和2的配比没有变化。结果表明,在几周的温度范围内,每个圆盘每小时释放的1和2小于10 ng——这一发现与“召唤”雄性加勒比按实蝇的1和2的释放速率一致[5‒6]。
分子扩散系数、黏度(μ)和温度(T)之间的关系可以推广为Stokes-Einstein方程:
(5)
式中,DES/AS是1和2的平移扩散系数(cm2⋅s-1);kB是玻尔兹曼常量(1.38 × 10-23 kg⋅m2⋅s-2⋅K-1);r是“球形”1和2的流体动力学半径(约0.45 nm)[35]。初步研究表明,相对湿度的变化不会改变聚合物圆盘的质量,进而不会改变μ。这一发现与使用基于保湿剂的基质以与湿度水平成正比的速率发射1和2的研究结果形成对比[5]。因此,当考虑聚合物基质,或者至少是本研究中使用的PVC时,扩散控制释放量将直接随温度而变化。几何形状对扩散速率的影响已经得到充分证实[36],因此上面用来描述聚合物圆盘的动力学模型可以扩展到其他几何形状,如在捕获系统中使用历史更长的圆柱形“塞子”和球体。
未来的研究将报道将PVC信息素圆盘[和(或)塞子]集成到潜在的按实蝇捕获系统中以进行现场部署,以及与此类工作相关的捕获效率研究。从更广泛的角度来看,这项工作提供了一个动力学框架,用于预测聚合物基质中昆虫引诱剂的Fickian扩散释放机制,并将其作为环境条件,特别是温度的函数,使其能够在化学理解和(或)对引诱剂寿命的预期下启动田野生物调查。
Chemical Characterization
1: IR (neat) 2942, 2871, 1780, 1016 cm-1; 1H NMR (300 MHz, Chloroform-d) δ: 5.68 (dd, J = 17.6, 10.6 Hz, 1H), 5.00 (d, J = 1.5 Hz, 1H), 4.95 (dd, J = 4.7, 0.8 Hz, 1H), 2.38 (dd, J = 16.4, 14.8 Hz, 1H), 2.24 (dd, J = 16.4, 6.4 Hz, 1H), 2.10 (dd, J = 14.8, 6.4 Hz, 1H), 2.01 (dd, J = 7.9, 3.0 Hz, 1H), 1.84 (ddd, J = 8.2, 6.2, 3.9 Hz, 1H), 1.73‒1.59 (m, 2H), 1.59‒1.43 (m, 2H), 1.38 (s, 3H), and 1.06 (s, 3H). 13C NMR (75 MHz, CDCl3) δ: 176.12, 147.76, 111.59, 86.03, 53.43, 38.46, 37.90, 37.02, 29.46, 20.90, 20.43, and 16.37.
2: IR (neat) 2942, 2868, 1770, 1029 cm-1; 1H NMR (300 MHz, CDCl3) δ: 5.89 (ddd, J = 17.4, 11.2, 0.9 Hz, 1H), 5.19‒5.03 (m, 2H), 2.65‒2.30 (m, 3H), 2.16‒1.94 (m, 3H), 1.31 (dd, J = 13.1, 5.3, 1H), 1.26 (s, 3H), and 1.04 (s, 3H). 13C NMR (75 MHz, CDCl3) δ: 176.14, 139.98, 112.94, 86.34, 55.51, 38.62, 37.19, 36.07, 30.35, 29.01, 20.38, and 20.21.
3: 1H NMR (300 MHz, CDCl3) δ: 2.49 (dd, J = 16.3, 14.9 Hz, 1H), 2.31 (dd, J = 16.3, 6.5 Hz, 1H), 2.15‒1.90 (m, 2H), 1.85‒1.69 (m, 2H), 1.68‒1.40 (m, 3H), 1.36 (s, 3H), 1.33‒1.24 (m, 1H), 1.19‒0.97 (m, 1H), 0.91 (s, 3H), and 0.85 (t, J = 7.5 Hz, 3H). 13C NMR (75 MHz, CDCl3) δ: 176.62, 86.57, 56.81, 37.68, 36.36, 35.68, 29.40, 27.64, 24.44, 21.08, 20.53, and 9.05.















 京公网安备 11010502051620号
京公网安备 11010502051620号




