《1. 引言》
1. 引言
含铬矿石及其化合物广泛应用于冶金、电镀、制革等工业制造[1‒3]。然而,铬是一种毒性较大的无机污染物,在生产过程中极易进入水体和土壤[4‒6]。Cr(VI)和Cr(III)是自然环境中观察到的主要价态,Cr(VI)的毒性比Cr(III)高100多倍[7]。因此,将Cr(VI)还原成Cr(III)一直是含铬废水净化的研究热点。还原方法主要有化学还原法[8‒10]、光催化还原法[11‒13]和生物修复法[14‒16]。目前,化学还原法由于操作简单和使用的化学试剂廉价,已成为一种普遍的商业化方法[17‒18]。但是,在化学还原过程中会产生大量的毒性污泥,这些污泥属于危险废物[19]。生产这些污泥的企业必须向处理污泥的专业机构支付高昂的费用,而这些污泥处理机构通常采用填埋或固化处理,从而造成污泥中的大量有价金属流失和产生二次污染的风险。因此,亟需探索一种既能净化含铬废水又能回收废水中有价金属的替代技术[20]。
铁氧体法能够合成结构稳定、磁性好的尖晶石矿物,在含铬废水处理中受到广泛关注[21‒24]。废水中的铬不仅可以被去除,而且可以转化为稳定的铬铁矿资源[式(1)至式(4)] [25‒26],从而避免了铬在环境中的二次污染,得到的铬铁矿得到了充分的利用。Erdem和Tumen [21]证实,在50 ℃条件下,采用铁氧体法可完全去除水溶液中的Cr(III),合成产物为稳定的铬铁矿。Pei等[22]研究了初始铬浓度为1539 mg·L-1的含铬废水,采用75 ℃的铁氧体法处理,铬的去除率达到99.97%。此外,铁氧体法对含铬多金属废水也有较好的净化效果。Song等[23]报道了在70 ℃下采用铁氧体法处理含铬、镍离子废水。结果表明,铬、镍离子的去除率可达98%左右,合成的Ni-Cr铁氧体具有良好的化学稳定性。Tu等[24]采用高于70 ℃多级铁氧体法处理含Cr、Cd、Cu、Pb的混合废水。结果表明,获得的上清液中重金属浓度达到排放标准,形成的污泥具有稳定的化学性质。
(1)
(2)
(3)
(4)
前人研究表明,铬的去除率可达90%以上。经铁氧体法处理后,出水水质和合成产物稳定性均达到标准。然而,通常需要将反应温度保持在70 ℃以上,以促进合成产物的晶体生长[24,27]。由于高温成本高、操作困难,限制了铁氧体法的进一步工业化应用。反应温度高,需要消耗大量的煤炭提供热能。此外,含铬废水中存在的许多有机污染物容易蒸发到空气中,从而造成严重的空气污染。为解决这些问题,在较低的温度甚至常温条件下合成铬铁矿显得尤为重要。
本研究考查了在含铬废水中常温合成铬铁矿的可行性,并通过优化反应参数提高了合成产物的结晶度和稳定性。通过原子吸收分光光度法(AAS)、X射线衍射(XRD)和毒性浸出试验,研究了温度、初始pH值、硫酸亚铁用量、充气速率、搅拌速率和反应时间对合成铬铁矿的结晶行为和稳定性的影响。利用扫描电子显微镜和能谱仪(SEM-EDS)分别对合成铬铁矿的表面形貌和成分进行了分析。该研究可为常温下铁氧体法处理含铬废水的工业化应用提供理论参考。
《2. 材料和方法》
2. 材料和方法
《2.1. 材料》
2.1. 材料
电镀废水中铬的主要价态为Cr(VI)。首先用还原剂将其还原成Cr(III),然后加入亚铁离子合成铬铁矿。因此,采用硫酸铬[Cr2(SO4)3·6H2O]为研究对象。本研究中使用的硫酸铬、硫酸亚铁等化学试剂均为AR分析纯。为制备100 mg·L-1 Cr(III)水溶液,将0.144 g硫酸铬加入装有300 mL去离子水的500 mL烧杯中。在试验中,氧气浓度为21%的压缩空气作为氧化剂。
《2.2. 试验方法》
2.2. 试验方法
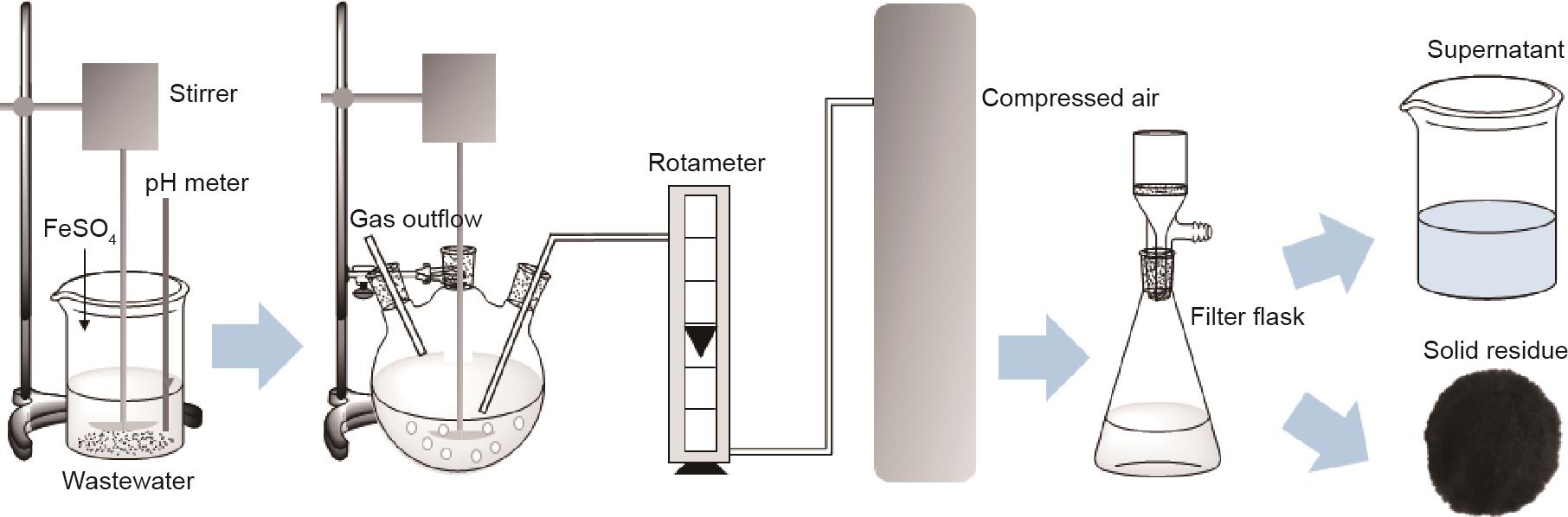
图1为试验装置示意图。硫酸亚铁与含100 mg·L-1 Cr(III)的溶液均匀混合。然后用硫酸或氢氧化钠快速调节混合溶液的pH值至所需值。之后,将溶液放入500 mL的三口烧瓶中。以一定的流量引入压缩空气,同时对溶液进行机械搅拌。当反应时间达到需要时,在过滤瓶中进行固液分离,得到固体残渣和上清液。用XRD、SEM-EDS和毒性浸出试验对固体产物进行分析。用原子吸收分光光度法测定上清液中铬和铁离子的浓度。
《图1》
图1 试验装置示意图。
《2.3. 分析技术》
2.3. 分析技术
合成产物的矿物组成用X射线衍射仪(日本Rigaku D/Max 2200)检测。用扫描电子显微镜(荷兰 FEI Quanta 600)和能量色散光谱(美国EDAX ApolloX)对合成产物的表面形貌和组成进行研究。用振动样品磁强计(中国Zetian BKT-4500)测试合成产物的磁学性能。用原子吸收分光光度法(中国Rayleigh WFX-320)分析上清液中剩余的铬和铁离子浓度。用电位-pH计(中国雷磁PHS-3C)监测氧化还原电位(ORP)和pH值。在MedeA 3.1软件中绘制推测的微观反应的路径图。
采用我国固体废弃物毒性浸出试验方法进行毒性浸出试验研究[28‒30]。硫酸和硝酸以2:1的摩尔比混合。将混合物加入蒸馏水中调节pH值至3.2,所得溶液作为浸出剂。然后将合成产物(kg·L-1)按1:10的比例放到浸出试剂中,水平振动(110 r·min-1)。反应8 h后,溶液静置16 h。最后,将溶液放入过滤瓶中过滤,用原子吸收光谱法分析上清液中铬离子的浓度。
《3. 结果与讨论》
3. 结果与讨论
《3.1. 温度的影响》
3.1. 温度的影响
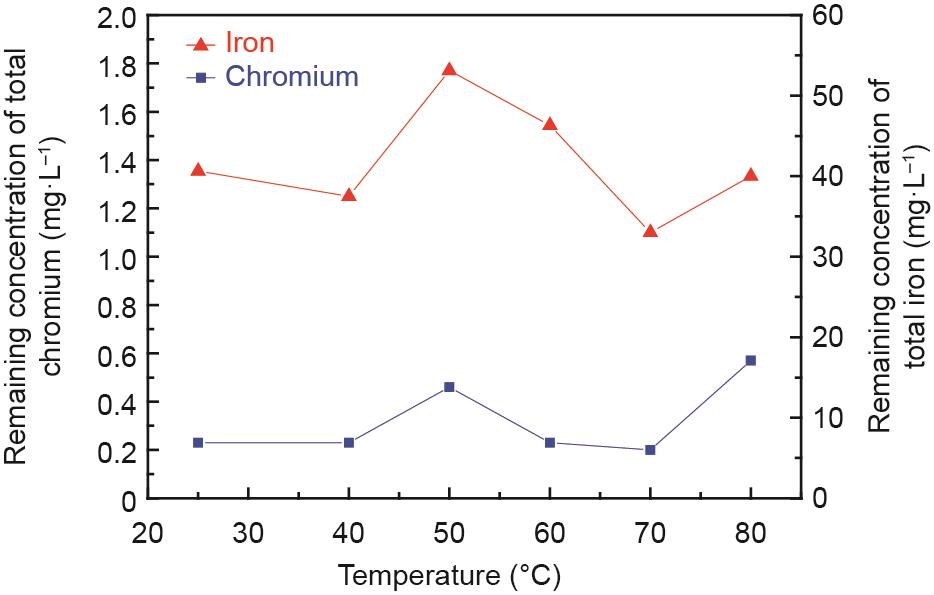
通常反应温度对铁氧体的合成起着至关重要的作用[31‒33]。为了研究温度对含铬废水中铬和铁离子去除率的影响,进行了试验研究,结果如图2所示。在给定的温度范围内,铬和铁离子去除率略有波动,说明温度对其去除率的影响不显著。反应后溶液中铬的残留浓度在0.60 mg·L-1以下,即铬离子去除率高于99.0%。根据中国污水排放标准[34],溶液中总铬离子浓度低于1.50 mg·L-1。因此,处理后的溶液中铬离子的残留浓度达到标准。此外,处理后溶液中铁离子剩余浓度小于55.0 mg·L-1,即铁离子去除率高于98.5%。
《图2》
图2 反应温度对反应后上清液中铬离子和铁离子浓度的影响。C0:100 mg·L-1,Fe(II)和Cr(III)的摩尔比:8:1,初始pH值:9.5,搅拌速率:300 r·min-1,充气速率:200 mL·min-1,反应时间:60 min。
图3为不同温度下合成产物的X射线衍射(XRD)图谱。由图可知,随着反应温度的升高,合成产物的特征峰强度增强,说明较高的温度有利于产物的结晶。反应温度的升高加速了铁氧体前驱体的水解和脱水反应[35]。然而,当反应温度为常温时,合成产物弱的特征峰也出现。考虑到实际操作和成本较低,初步选择常温进行后续的试验研究。
《图3》
图3 不同温度下合成产物的XRD图谱。
为考查不同温度下获得的合成产物的稳定性,进行了毒性浸出试验,结果如图4所示。不同温度下浸出液中铬的浓度均低于5.0 mg·L-1,达到美国环境保护署(USEPA)规定的毒性浸出限值[21]。结果表明,常温下合成的铬铁矿具有良好的稳定性。因此,在25 ℃条件下合成铬铁矿是可行的。
《图4》
图4 不同温度下合成产物的浸出毒性结果。
《3.2. 初始pH值的影响》
3.2. 初始pH值的影响
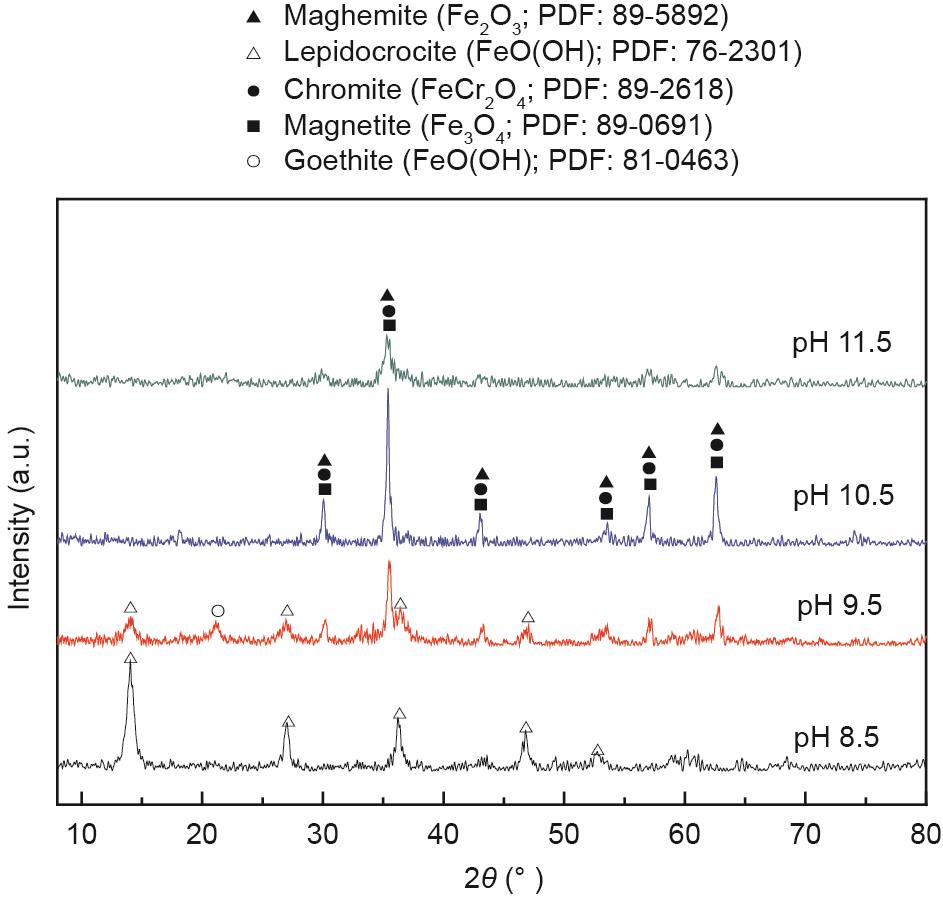
根据前人研究,废水中铬铁矿的形成最初需要Cr(III)、Fe(II)和Fe(III)共沉淀[式(1)至式(4)]。然而,过量的OH-会导致Cr(OH)3、Fe(OH)2和Fe(OH)3再次溶解[36‒38]。因此,该研究选择水溶液的初始pH值在8.5~11.5之间。图5和图6分别为初始pH值对出水水质和合成产物结晶行为的影响。从图5可以看出,在给定的pH值范围内,合成铬铁矿后的上清液中铬的浓度下降至0.25 mg·L-1以下,铬的去除率高于99.5%。结果表明该技术对铬离子有较好的去除效果。
《图5》
图5 初始pH值对反应后上清液中铬离子和铁离子剩余浓度的影响。C0:100 mg·L-1,Fe(II)和Cr(III)的摩尔比:8:1,充气速率:200 mL·min-1,搅拌速率:300 r·min-1,常温,反应时间:60 min。
《图6》
图6 不同初始pH值下合成产物XRD图谱。
此外,随着初始pH值从8.5增加到10.5,上清液中总铁的剩余浓度迅速从68.6 mg·L-1降低至4.7 mg·L-1。铁离子去除率相应地提高至98%以上。随着初始pH值的进一步增加,总铁的剩余浓度略有下降。这些结果表明,提高初始pH值有利于废水中铁离子的去除。
从图6中可以看出,当溶液初始pH值为8.5时,纤铁矿是仅存的合成产物,说明较低的pH值不利于铬铁矿的合成。当溶液初始pH值增加至9.5时,纤铁矿的特征峰强度降低,铬铁矿的特征峰开始出现[22,39]。然而,峰值信号似乎也有可能代表磁铁矿或磁赤铁矿,因为它们与铬铁矿的峰位极其相似。当溶液初始pH值增加到10.5时,只有铬铁矿的特征峰。当溶液初始pH值进一步提高至11.5时,铬铁矿的峰强度明显降低,说明较高的pH值不利于铬铁矿的结晶。这一结果似乎与图5的结论相矛盾,图5说明在该初始pH值下铬和铁离子的去除效果都较好。这可能是由于所生成的多羟基离子,如
为了深入研究铬铁矿的合成历程,测定了反应过程中溶液的氧化还原电位(ORP)和pH值,并绘制了常温下Cr-Fe-H2O体系下E-pH图,结果如图7所示。从图7(a)可以看出,随着反应时间的增加,溶液的pH值逐渐从9.5下降至4.96。然而,随着反应时间的延长,氧化还原电位逐渐从-0.278 V增加到0.315 V。结合E-pH图[图7(b)]可知,pH值在4.96 ~ 9.5范围内,电位在-0.278 ~ 0.315 V范围内,以铬铁矿为主。因此,通过对其他参数进行优化,可在常温下高效合成铬铁矿。
《图7》
图7 初始pH值为9.5时试验中pH值和ORP的变化(a)及常温下Cr-Fe-H2O的E-pH图(b)。
《3.3. 硫酸亚铁剂量的影响》
3.3. 硫酸亚铁剂量的影响
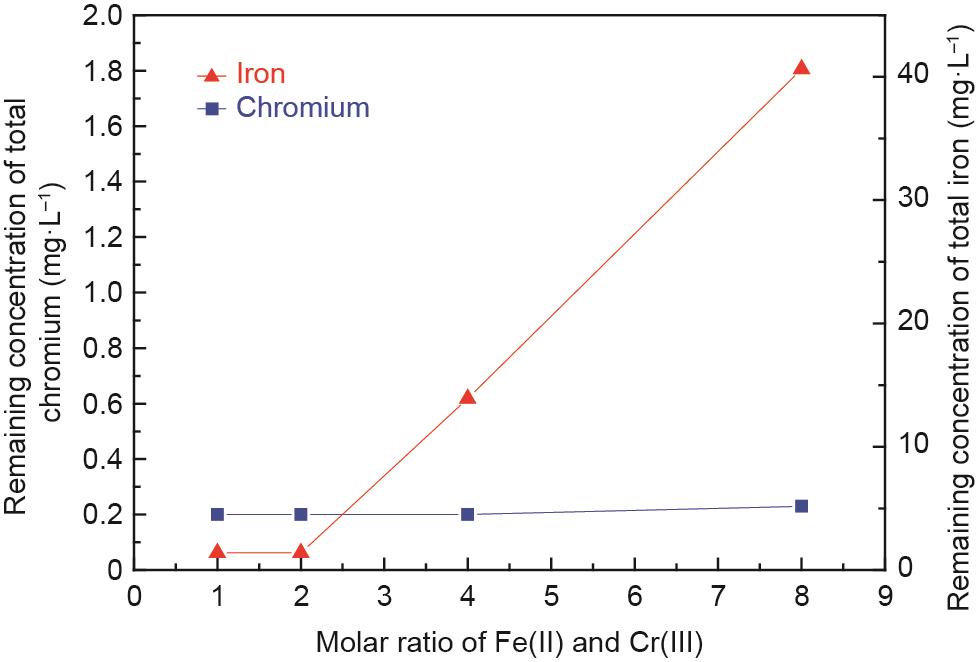
研究了硫酸亚铁用量对出水水质的影响,结果如图8所示。在一定的Fe(II)/Cr(III)摩尔比范围内,合成后的上清液中总铬剩余浓度低于0.23 mg·L-1,达到我国污水排放标准[34]。相应的铬的去除率达到99.0%以上,表明铬离子进入氢氧化物或氧化物沉淀。此外,当Fe(II)/Cr(III)摩尔比从2.0增加到8.0时,上清液中总铁的剩余浓度从1.40 mg·L-1增加到40.61 mg·L-1,这与过多的硫酸亚铁加入有关。铁离子去除率也达到99.0%以上。
《图8》
图8 Fe(II)和Cr(III)摩尔比对反应后上清液中剩余铁、铬离子浓度的影响。C0:100 mg·L-1,初始pH值:9.5,充气速率:200 mL·min-1,搅拌速率:300 r·min-1,常温,反应时间:60 min。
图9为不同Fe(II)/Cr(III)摩尔比下合成产物的XRD图谱。初始Fe(II)/Cr(III)摩尔比为1:1时无任何衍射峰,说明没有产物合成或合成产物为无定形的化合物。可能为Fe(OH)2、Fe(OH)3和Cr(OH)3的生成[式(1)至式(3)] [25‒26]。当Fe(II)/Cr(III)摩尔比增加到4:1时,铬铁矿的特征峰开始出现。随着初始Fe(II)/Cr(III)摩尔比进一步增加到8:1,铬铁矿的特征峰强度明显增强,表明铬铁矿形成了良好的结晶。
《图9》
图9 不同Fe(II)和Cr(III)摩尔比下合成产物的XRD图谱。
《3.4. 充气速率的影响》
3.4. 充气速率的影响
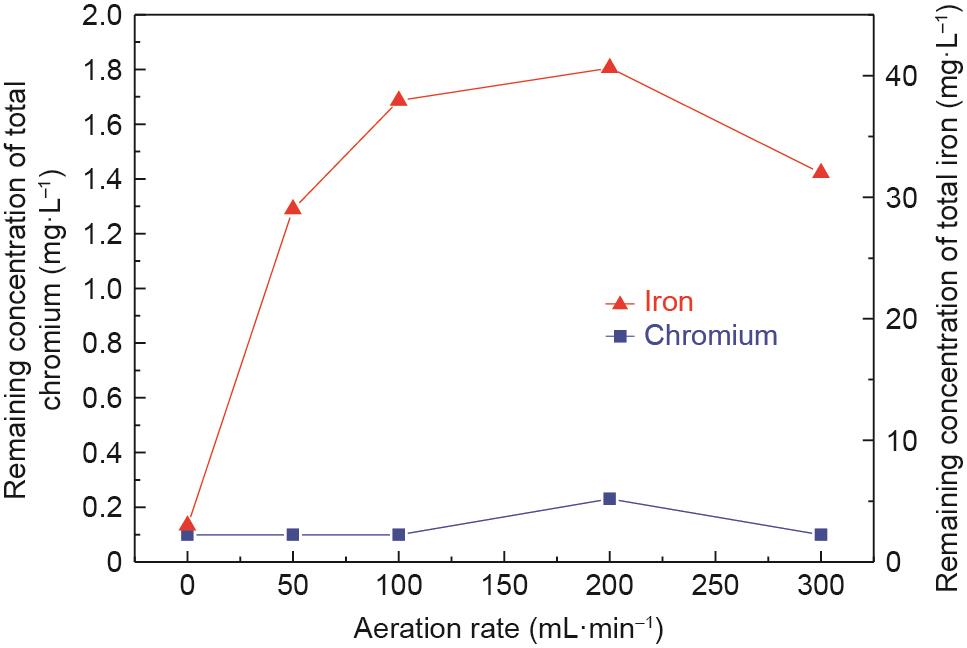
为了研究充气速率对出水水质的影响,进行了批量试验研究,结果如图10所示。溶液中铬和铁离子浓度分别低于0.23 mg·L-1和40.0 mg·L-1。铬和铁离子去除率均在99.0%以上,达到了排放标准。
《图10》
图10 充气速率对反应后上清液中铬和铁离子剩余浓度的影响。C0:100 mg·L-1,Fe(II)和Cr(III)的摩尔比:8:1,初始pH值:9.5,搅拌速率:300 r·min-1,常温,反应时间:60 min。
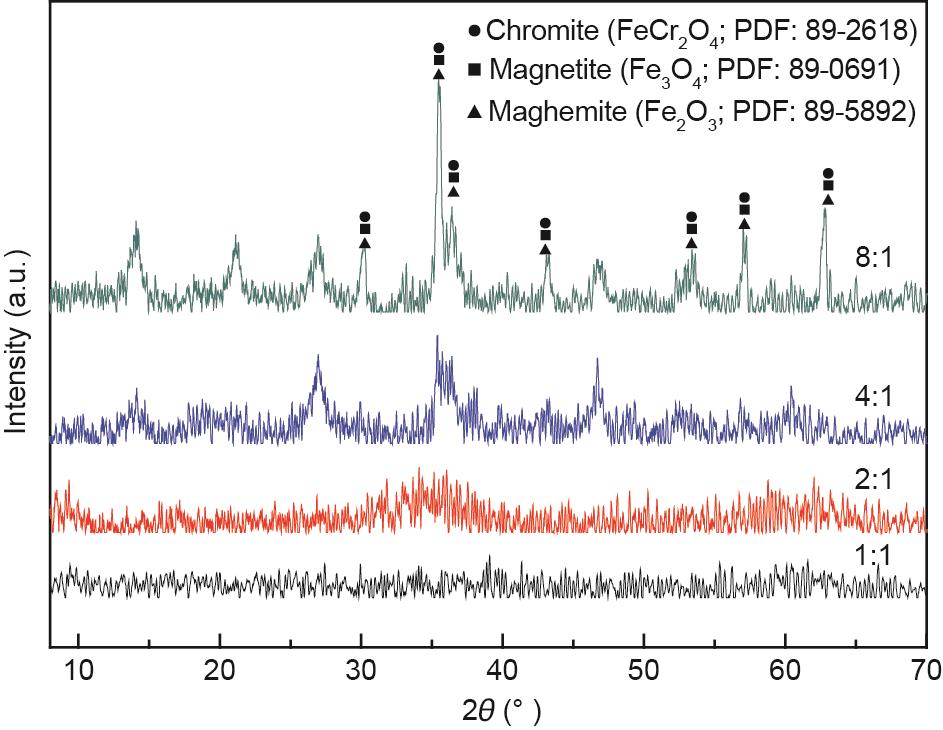
为了确定充气速率对合成产物结晶行为和稳定性的影响,进行了XRD和毒性浸出试验研究,结果如图11和图12所示。从图11可以看出,当充气速率从50 mL·min-1增加到100 mL·min-1时,铬铁矿的衍射峰强度增强。当充气速率增加到200 mL·min-1甚至300 mL·min-1时,铬铁矿的衍射峰强度不断下降。这可解释为充气速率的增加加速了铬铁矿核的形成,而抑制了晶核的生长。此外,随着充气速率的增加,合成产物的衍射峰向高衍射角区域移动,表明合成了含铬量较高的铬铁矿。这是因为在尖晶石结构中,半径为0.63 Å的Cr(III)逐渐取代半径为0.67 Å的Fe(III),从而导致晶胞收缩[41]。
《图11》
图11 不同充气速率下合成产物的XRD图谱。
《图12》
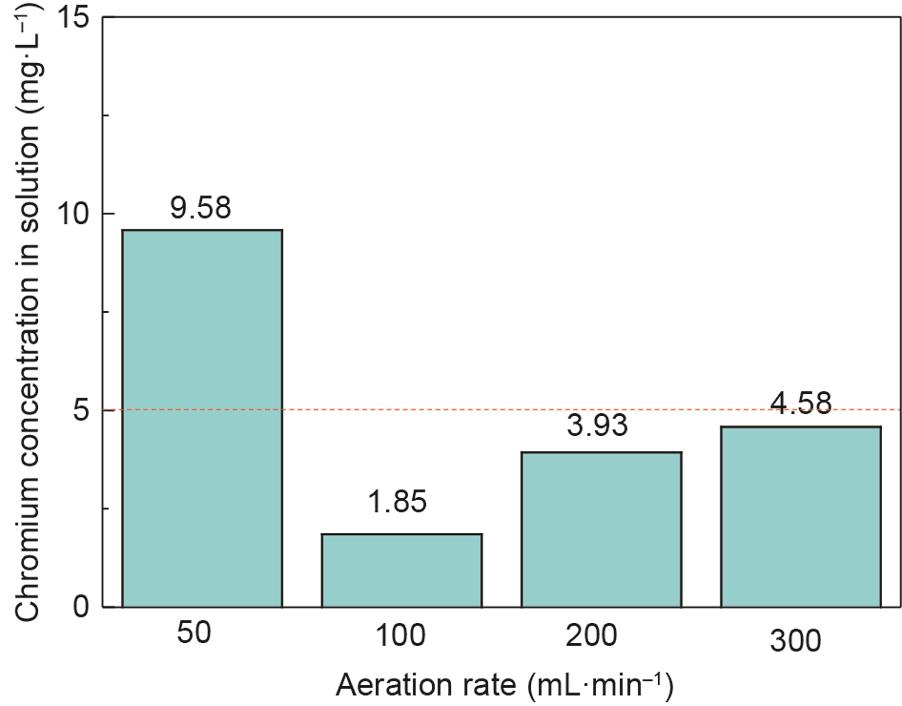
图12 不同充气速率下合成产物的毒性浸出结果。
从图12可以看出,当充气速率是50 mL·min-1时,浸出液中铬的浓度为9.58 mg·L-1,高于USEPA规定的5 mg·L-1标准[21]。当充气速率增加到100 mL·min-1时,浸出液中铬的浓度降低到1.85 mg·L-1。随着充气速率的进一步增加,浸出液中铬的浓度逐渐增加,但铬的浓度低于标准。过低和过高充气速率均不利于废水中合成稳定的铬铁矿。这可能是由于过少或过多的亚铁离子转化为三价铁离子,导致亚铁离子与铁离子不平衡而难以形成尖晶石结构[35]。
《3.5. 搅拌速率的影响》
3.5. 搅拌速率的影响
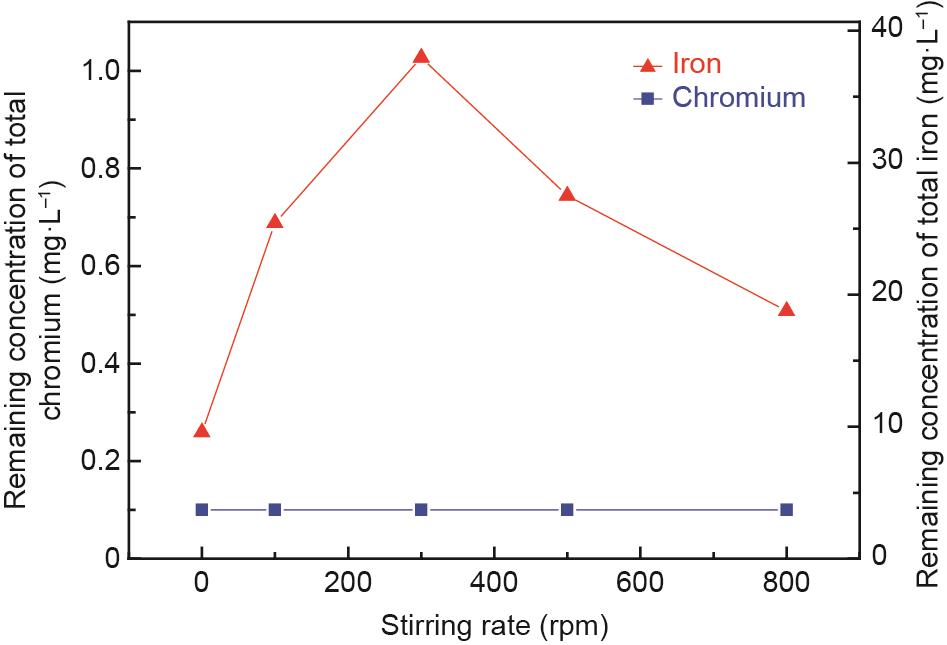
为了研究搅拌速率对出水水质的影响,进行了大量试验研究,结果如图13所示。溶液中铬和铁离子的剩余浓度分别为0.1 mg·L-1和低于38 mg·L-1,铬和铁离子的去除率均在99.0%以上,达到排放标准。
《图13》
图13 搅拌速率对反应后上清液中铬离子和铁离子剩余浓度的影响。C0:100 mg·L-1,Fe(II)和Cr(III)的摩尔比:8:1,初始pH值:9.5,充气速率:100 mL·min-1,常温,反应时间:60 min。
考查了搅拌速率对合成产物结晶行为和稳定性的影响。XRD和毒性浸出试验结果分别见图14和图15。从图14可以看出,搅拌速率在0 ~ 500 r·min-1范围内,铬铁矿的衍射峰比较明显。当搅拌速率增加到800 r·min-1时,峰值信号几乎消失。此外,当搅拌速率从300 r·min-1增加到500 r·min-1时,合成产物的衍射峰向高衍射角区域移动,这是因为尖晶石结构中更多半径为0.63 Å的Cr(III)取代了半径为0.67 Å的Fe(III),导致了晶胞的不断收缩[41]。因此,合成了含铬量较高的铬铁矿。从图15可以看出,当搅拌速率从0 ~ 300 r·min-1时,浸出液中铬的浓度从46.60 mg·L-1下降到1.85 mg·L-1。结合XRD结果,在较低的搅拌速率(0~100 r·min-1)下,可生成铬铁矿,但Cr(III)似乎没有完全进入稳定的尖晶石结构,可能是由于溶液中Cr(III)的传质速率较低所致。
《图14》
图14 不同搅拌速率下合成产物的XRD图谱。
《图15》
图15 不同搅拌速率下合成产物的毒性浸出结果。
《3.6. 反应时间的影响》
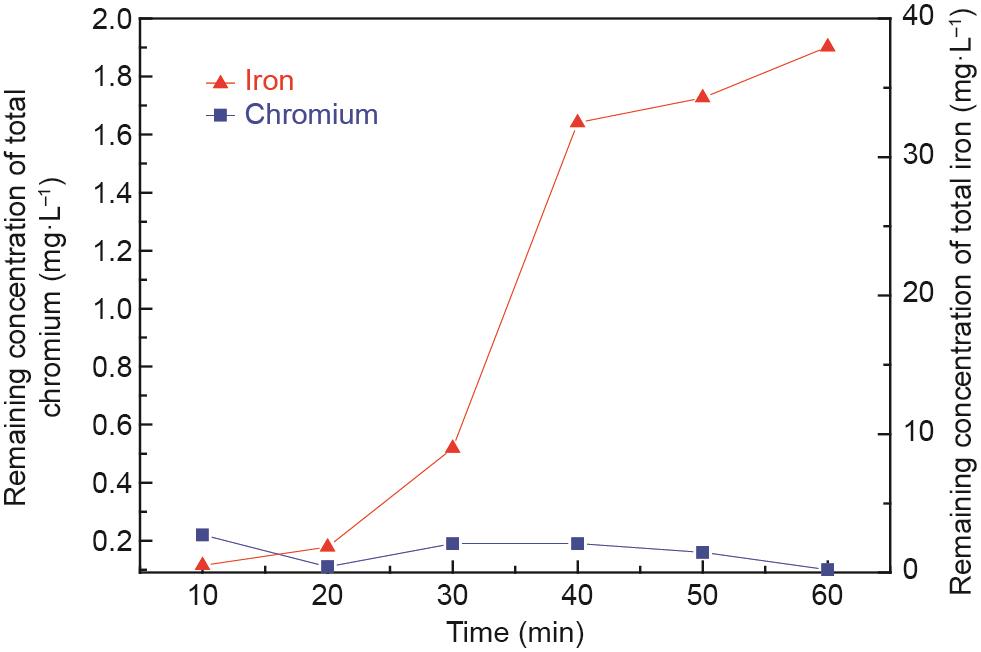
3.6. 反应时间的影响
为了考查反应时间对出水水质的影响,进行了大量试验研究,结果如图16所示。溶液中铬和铁离子的剩余浓度分别低于0.22 mg·L-1和37.95 mg·L-1,表明铬和铁离子的去除率均在99.0%以上。
《图16》
图16 反应时间对反应后上清液中铬和铁离子剩余浓度的影响。C0:100 mg·L-1,Fe(II)和Cr(III)的摩尔比:8:1,初始pH值:9.5,搅拌速率:300 r·min-1,充气速率:100 mL·min-1,常温。
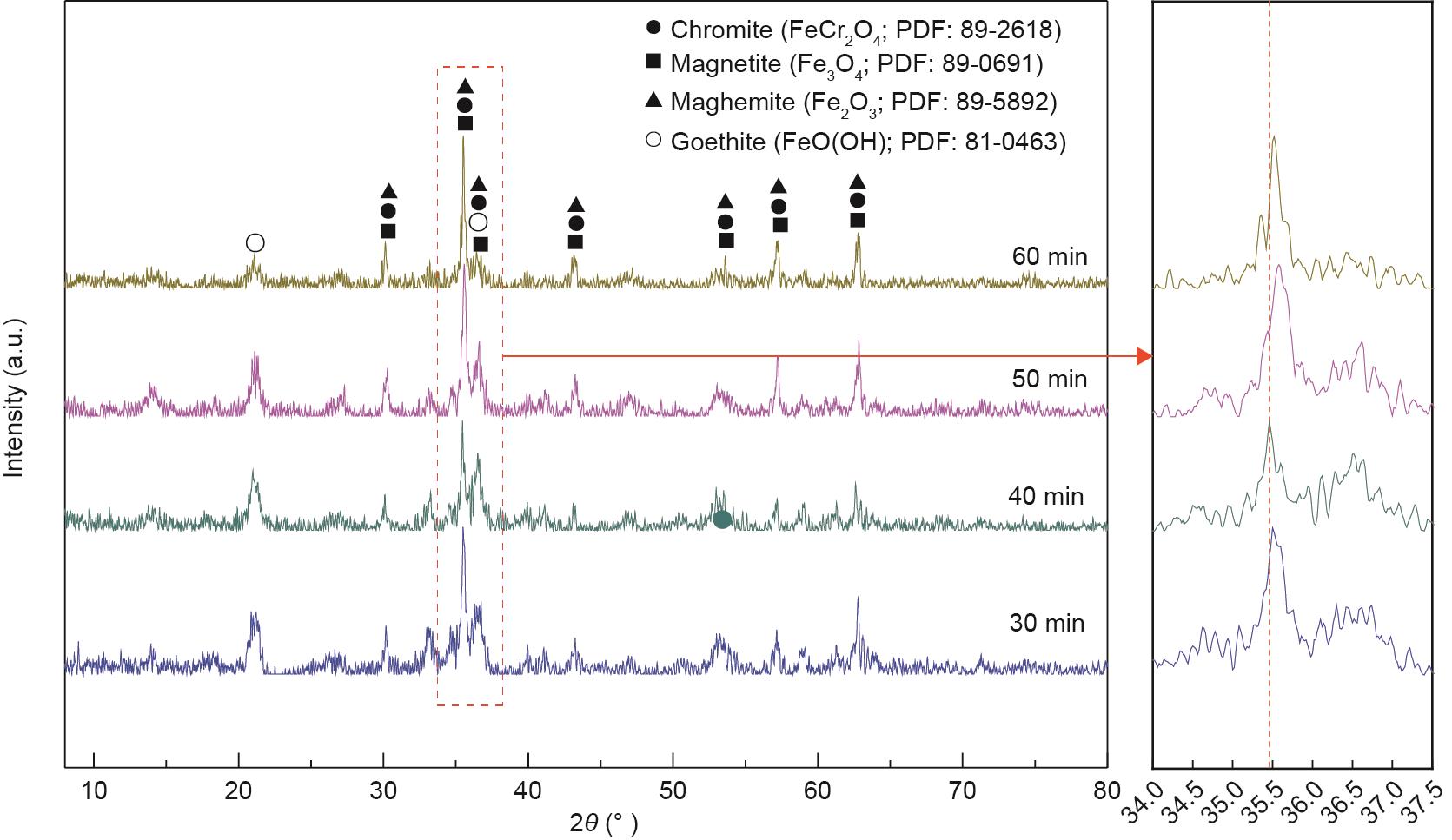
考查了反应时间对合成产物结晶行为和稳定性的影响。XRD和毒性浸出试验结果分别如图17和图18所示。从图17可以看出,当反应时间为30 min和40 min时,铬铁矿的特征峰明显,随着反应时间进一步增加,铬铁矿的特征峰强度增强。此外,合成产物的特征峰向高衍射角区域移动,表明合成出了高铬含量的铬铁矿。从图18可以看出,随着反应时间的延长,浸出液中铬的浓度不断降低。当反应时间达到60 min时,浸出液中铬的浓度降至1.85 mg·L-1,低于标准。这些结果进一步证实了铬铁矿由低铬演化为高铬。
《图17》
图17 不同反应时间下合成产物的XRD图谱。
《图18》
图18 不同反应时间下合成产物毒性浸出结果。
《3.7. 合成产物的形貌和磁学性能》
3.7. 合成产物的形貌和磁学性能
为了进一步阐明合成产物的形貌和磁学性能,进行了形貌和磁滞回线分析,结果如图19所示。从图19(a)可以看出,合成的粗糙表面颗粒结构紧凑。此外,颗粒表现出不规则的六面体特征。所得颗粒的最大粒径达到52 μm。合成产物的磁滞回线如图19(b)所示,可以看出合成产物的剩磁和矫顽力都很小。也就是说,磁滞回线较窄,说明合成的产物是软磁材料。合成产物的饱和磁化强度达到1.6 emu·g-1 (1 emu·g-1 = 1 A·m2·kg-1)。这些结果表明,合成产物可在后续分离中回收。
《图19》
图19 合成产物的形貌(a)和磁滞回线(b)。
《3.8. 微观反应路径》
3.8. 微观反应路径
为了揭示在铬铁矿常温合成过程中废水中铬离子的迁移规律,采用扫描电子显微镜-能谱分析(SEM-EDS)对合成矿物进行进一步分析,结果如图20所示。图20(a)显示合成矿物的中心和边缘之间的颜色不同。结合EDS结果[图20(b)、(c)],证实合成产物中心的铬含量高于边缘铬的含量。这一结果表明,随着反应的进行,铬逐渐进入铬铁矿的结构中,这与第3.6节中得出的结论一致。从图20(d)~(f)中观察到合成产物中Fe、Cr和O的分布重叠,这表明合成的矿物可能是单一的铬铁矿。结合EDS结果[图20(b)、(c)],进一步计算出合成铬铁矿的分子式可能是Fe3-CrO4,其中,x约为0.30。
《图20》
图20 合成产物SEM- EDS结果。(a)SEM图像;(b)、(c)特定位置的EDS;(d)~(f)Fe、Cr、O元素分布图。
根据上述结果,提出了微观反应路径,结果如图21所示。从图可以看出,在合成反应开始时,少量的铬离子优先进入尖晶石结构,形成了稳定的铬含量较低的铬铁矿。此外,剩余的铬离子形成氢氧化铬或不稳定的铬铁矿。随着反应的进行,更多的铬离子进入铬铁矿的晶胞,形成稳定的高铬铬铁矿。也就是说,在铬铁矿的合成过程中,晶胞内的铬离子浓度逐渐升高。最后,几乎所有的铬离子进入铬铁矿中,形成产物的化学式为Fe3-CrO4,x值远低于FeCr2O4的理论值,这可以解释为在合成初期铬离子浓度远低于铁离子浓度。
《图21》
图21 常温下废水中铬铁矿合成的微观反应路径图。
《4. 结论》
4. 结论
本研究证实了常温下采用铁氧体法从含铬废水中合成铬铁矿的可行性,主要结论如下:
(1)采用铁氧体法常温处理含铬废水后,上清液中铬的去除率达99.0%以上,铬浓度达到污水排放标准。最佳工艺参数:初始pH值为9.5~10.5,初始Fe(II)/Cr(III)摩尔比为8:1,充气速率为100 mL·min-1,搅拌速率为300 r·min-1,反应时间为60 min。在此条件下,合成产物毒性浸出后,浸出液中铬的浓度为1.85 mg·L-1。
(2)温度、pH值、硫酸亚铁用量、充气速率、搅拌速率和反应时间等参数对铬铁矿的合成有明显影响。提高这些参数有利于铬铁矿的结晶和稳定性,但较高的pH值、充气和搅拌速率不利于铬铁矿的结晶生长。
(3)在常温条件下,合成的颗粒表面粗糙、结构紧凑,具有不规则的六面体特征。所得颗粒的最大粒径达到52 μm。合成产物的分子式可能为Fe3-CrO4,其中,x约为0.30。最后,提出了常温下采用铁氧体法在含铬废水中合成铬铁矿的微观反应路径。
























 京公网安备 11010502051620号
京公网安备 11010502051620号




