《1、 引言》
1、 引言
在世界上,特别是发展中国家的偏远地区,安全而充足的饮用水供应越来越缺乏[1]。距离远、社区分散和交通基础设施落后,使得人们难以提供和保证足够的安全供水。在这些偏远地区,包括河流和湖泊在内的地表水受到的污染较轻,因此,可以通过较简单的方法将其处理后作为饮用水的水源。膜过滤技术,特别是超滤膜过滤技术[2],是一种成熟的、通用的水质净化和饮用水生产方法[3]。由于超滤膜的孔径(大约100 kDa)小于悬浮的固体、胶体和细菌,因此其可通过尺寸排阻效应将它们截留[4]。此外,水可以在较低的跨膜压力下通过超滤膜,这可以通过重力驱动装置实现[5‒6]。
重力驱动膜滤技术因具有低能耗、无需反洗和通量稳定等优点,已被广泛地应用于处理灰水[7‒8]、废水[9]、雨水[10]和海水预处理[11]等过程中。累积的生物膜在重力驱动膜滤系统的调控中起着重要的作用。首先,可渗透的生物污染层可以作为二级膜[6],保持稳定的通量[5]。其次,它可以降解有机物[8,12]。为揭示生物膜的特性并有效控制其累积,人们探究了其相关的影响因素,如给水[5]、曝气剪切应力[13]、生物控制[14]和营养盐限制[15]等,并解析了生物膜形态与过滤性能之间的关系[2]。在进水的影响中,溶解性有机物浓度起着重要的作用,而且其与膜滤系统的渗透通量呈负相关[5]。然而,该方面仍需进一步的探究。
微生物产物和缓慢生物降解产物[13,15‒16]是生物膜基质的主要成分[17]。微生物在生物污染中起着关键性的作用,因此,通过控制微生物的生长可能会减缓生物污染。氯在世界范围内被广泛应用于饮用水和废水的处理,以灭活病原体和预防水媒疾病[18‒21]。然而,对于氯是否能够显著缓解膜污染尚不清楚。由于存在的微生物较少,猜测会引起较轻的膜污染。但是,有些微生物是耐氯的,关于这部分细菌对膜污染的贡献尚不清楚。此外,膜的亲、疏水性是关系到膜的应用和性能的关键参数[22],它会影响到膜滤过程中有机物的分离性能和选择渗透性[23]。由于截留有机物的亲、疏水性差异,不同的细菌群落会存活下来并形成不同的生物膜,从而影响过滤性能。然而,尽管其很重要,但相关的研究却很缺乏。
此外,据Flemming和Wingender [24]报道,生物膜是微生物的聚集体。细胞通常被埋入在其自产的胞外聚合物基质中,这表明探究细菌是识别和调控生物污染的必要条件。即使在同一反渗透膜水质净化装置中,各反应池的微生物群落和膜污染情况也是不同的[25]。Wu等[26]研究发现,当给水相同时,不同的过滤装置也会形成不同的微生物群落。以上研究表明,生物膜中的细菌群落是动态的、复杂的,需要在生物污染的研究中予以重视。
在本研究中,我们从实际出发,选择了自来水[典型的氯化水;低溶解性有机物浓度为(2.920 ± 0.011) mg·L-1]和湖水[未经预处理的常见地表水;高溶解性有机物浓度为(6.440 ± 0.039) mg·L-1]作为进水。对于生活在城市的人们来讲,自来水是饮用水;对于生活在偏远地区的人们来讲,地表水,如湖水,是可利用的水源。本研究还对比了两种超滤膜,即聚偏氟乙烯膜和聚醚砜膜,探究膜的亲、疏水性是否会影响所形成生物膜的性能。为揭示过滤系统中生物膜的生物污染特性,我们深入探究了生物膜的性质,包括形态、官能团和基质成分等。同时,特别关注了生物膜中的细菌群落结构和多样性,以及它们的生物污染机制。
《2、 材料与方法》
2、 材料与方法
《2.1 反应器的构建与运行》
2.1 反应器的构建与运行
本研究分析了两种类型的水体(已去除余氯的自来水和湖水),其中,自来水取自自来水水龙头,湖水取自北京奥林匹克公园。自来水的源头是北京市第九自来水厂,在排出之前,使用浓度为1.2~1.8 mg·L-1的液氯消毒5 h,使得水龙头水中的余氯浓度为0.07~0.08 mg·L-1。将自来水静置24 h(以便去除余氯),再进行实验。每隔一天取一次水样,储存在2 L的容器中。关于该两种水体的水质参数可见于附录A中的表S1,其中,自来水的有机物浓度较低,而湖水的有机物浓度较高。此外,本实验采用了两种超滤膜(北京赛普瑞特设备有限公司),分别为聚偏氟乙烯膜和聚醚砜膜,其过滤面积为25 cm2,切割分子量为100 kDa,相当于7~8 nm。三个重力流驱动膜滤系统同时以死端过滤的方式运行32天,过滤压力为40 mbar水压(1 bar = 105 Pa;见附录A中的图S1)。将以上系统命名为tap water-PVDF、lake water-PVDF和lake water-PES。在过滤过程中,每天记录渗透通量,并按照附录A中的方法进行计算。运行结束后,取出三个平行过滤系统中的生物膜,并按照如下步骤进行分析。
《2.2 进、出水及生物膜中有机物分子量的测定》
2.2 进、出水及生物膜中有机物分子量的测定
应用高效尺寸排阻色谱技术确定有机物的分子量分布。高效尺寸排阻色谱技术采用高效液相色谱泵(Waters 1525,美国)进行,包括BioSep-SEC-S3000柱(7.8 mm × 300 mm;Phenomenex,美国)、固定于内径为4 mm的圆盘(GFC-3000)的保护柱、200泵、在254 nm波长下工作的光电二极管阵列检测器(Waters 2998,美国)以及自动进样器(Waters 2707,美国)。以10 mmol·L-1的乙酸钠溶液(Sigma-Aldrich,美国)为流动相,设置流速为1 mL·min-1,注射体积为100 µL。在上样之前,设置流速为2 mL·min-1,净化色谱柱。待基线稳定后,对样品进行测定,并根据标准溶液获得的谱图进行校准。所有的样品均经过0.22 μm的滤头过滤。
为测定生物膜中的有机物,将生物膜切割为0.25 cm2,并用2 mL 1%的磷酸盐缓冲液溶解在5 mL的离心管中。涡旋混合2 h后,置于80 ℃的水浴锅中加热20 min。之后,将1.5 mL混合液转移至新的2 mL无菌离心管中,并于10 000 r·min-1的转速下离心2 min。将上清液进行收集,用于下一步的测定。每个生物膜均选取面积相同的三个样本进行测定。
《2.3 进、出水及生物膜中有机物的荧光特征解析》
2.3 进、出水及生物膜中有机物的荧光特征解析
应用荧光光谱仪(F-4600, Hitachi,日本)分析进、出水及生物膜中的类蛋白或类腐殖酸类物质。设置激发波长的范围为200~450 nm,发射波长的范围为250~550 nm,带通均为5 nm。为降低离子的干扰,所有水样均经过0.45 μm的针头过滤器过滤。此外,利用MATLAB软件进行平行因子分析。
《2.4 滤液中亲、疏水性有机物特征解析》
2.4 滤液中亲、疏水性有机物特征解析
利用Superlite DAX-8(Supelco,美国)和Amberlite XAD-4(Rohm and Hass,美国)树脂,将滤液中的亲、疏水性有机物分为三类:强疏水性物质(被DAX-8树脂吸附)、弱疏水性(或反亲水性)物质(被XAD-4树脂吸附)和亲水性物质(通过DAX-8和XAD-4树脂)。分析之前,将树脂用甲醇和去离子水洗涤几次,以确保其不含有机物,并用溶解性有机物浓度进行表征。将水样的pH调整为2.0,设置通过DAX-8树脂的流速为5 mL·min-1,通过XAD-4树脂的流速为15 mL·min-1。根据通过DAX-8和XAD-4树脂前后测定的溶解性有机物浓度,确定三类有机物的浓度。溶解性有机物的浓度应用总有机碳分析仪(TOC-V, Shimadzu,日本)测定。
《2.5 生物膜电位和接触角的测定》
2.5 生物膜电位和接触角的测定
应用电固体表面分析仪(SurPASS 3, Anton Paar,奥地利)测定生物膜的ζ电位,利用接触角仪(Dataphysics,德国)测量生物膜的接触角。对于接触角,随机选取5个位置进行测定,并连续200 s记录数值。
《2.6 生物膜的扫描电子显微镜和原子力显微镜图像》
2.6 生物膜的扫描电子显微镜和原子力显微镜图像
通过冷冻干燥和表面喷金制备生物膜和膜样品,进行扫描电镜(S-4800, Hitachi,日本)的拍摄。为呈现生物膜的三维结构,分别从表面和横截面拍摄图像。
为探究生物膜的粗糙度及成分的分布,应用原子力显微镜进行分析。具体来说,应用Bruker Dimension Icon ScanAsyst在PeakForce Tapping的模式下使用ScanAsyst Air tip(FASTSCANBIO, Bruker,德国)拍摄三个生物膜的原子力显微图像。图像(10 μm × 10 μm)的扫描速率为0.1~0.3 Hz,峰值力设定的范围为8~15 nN。在数据不确定的情况下,对图像进行来回扫描。使用NanoScope Analysis 1.8软件对图像进行平滑,以去除扫描缺陷。同时,应用该软件进行颗粒分析,并使用Origin 2018软件(Electronic Arts Inc.,美国)绘制拟合曲线。
《2.7 生物膜的傅里叶变换红外光谱测定》
2.7 生物膜的傅里叶变换红外光谱测定
为识别生物膜中的特定官能团,对生物膜进行傅里叶变换红外光谱(Spectrum Two, PerkinElmer,美国)分析。同时,为直观显示生物膜中物质的分布,进行傅里叶变换红外显微成像(Spotlight 400, PerkinElmer,美国)分析。生物膜样品的扫描长度和宽度均为500 μm,空间分辨率为6.25 μm × 6.25 μm。为更全面地反映生物膜中物质的分布,每个生物膜至少捕获三张图像。
《2.8 生物膜的激光共聚焦显微图像测定》
2.8 生物膜的激光共聚焦显微图像测定
将带有膜的生物膜样品从过滤系统中取出,立即用2.5%的甲醛固定,并用双面胶粘在载玻片上。在黑暗的环境下,用10 μg·mL-1的FITC(Sigma-Aldrich,美国)染蛋白[27‒28],10 μg·mL-1的ConA(Sigma-Aldrich,美国)结合α-甘露吡喃糖基和α-吡喃糖基糖残基[29]以及10 μg·mL-1的DAPI(Sigma-Aldrich,美国)染生物膜上的eDNA [30]。对每个生物膜进行间歇染色和冲洗,每个步骤间隔30 min,再用磷酸盐缓冲液冲洗,如此重复几次。通过激光共聚焦显微镜观察载玻片上的蛋白质、多糖以及eDNA [31‒34],采用的通道对应的激发波长和发射波长分别为FITC (488 nm/520 nm)、ConA (543 nm/560 nm)和DAPI (371 nm/397 nm)。应用Image J软件对激光共聚焦显微镜获得的z轴的图像进行处理。
《2.9 分子实验和生物信息学分析》
2.9 分子实验和生物信息学分析
通过高通量测序技术解析生物膜中的细菌群落,由于16S rRNA V4区在结构域和门水平上具有最大的生物多样性[35],故选取该区域为扩增片段。应用蛋白酶K和十二烷基硫酸钠裂解液[36]从面积约为6.25 cm2的生物膜中提取DNA,并依据制造商的方法使用DNA Clean and Concentrator-25试剂盒(Zymo Research,美国)进行纯化。应用NanoDrop-1000分光光度计(NanoDrop Technologies,美国)检测DNA在波长为230 nm、260 nm和280 nm处的吸光度(吸光度比值:260 nm/280 nm,约1.8;260 nm/230 nm,大于1.8),并通过0.8%的琼脂糖凝胶电泳检测其完整性。最后,将DNA保存于-20 ℃的环境中,直到进行聚合酶链反应。
采用通用引物扩增16S rRNA V4区,分别为正向引物515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和反向引物806R (5′-GGACTACHVGGGTWTCTAAT-3′) [35]。为区分不同的样品,对每个样品添加条形码,并应用Phusion® High-Fidelity PCR Master Mix with GC Buffer(New England Biolabs,美国)进行扩增。通过一系列反应[37]获得扩增产物后,将三个PCR产物合并在一起,并用1%的琼脂糖凝胶电泳检测。同时,应用GeneJET PCR Purification Kit(Thermo Scientific,美国)纯化及Qubit dsDNA HS Assay Kit(Invitrogen,美国)定量,并等摩尔浓度混合。采用Ion Plus Fragment Library Kit 48 rxns(Ion Torrent,美国)制备样品库,并委托北京诺禾致源科技股份有限公司采用Ion S5TM XL测序仪(Thermo Scientific,美国)进行单端测序。基于条形码,将正向和反向的reads结合并分配到不同的样本中,并将位于每条read末端的引物序列和条形码删除。删除碱基不明确、长度小于100 bp或平均质量得分小于20的序列。通过与参考数据集(Greengenes database †)[38]进行比对,删除干净序列中的嵌合体序列,只保留有效序列进行下一步的分析。应用UPARSE pipeline [39]在97%的相似度下,将序列聚类为可操作分类单元(OTU),并使用Ribosomal Database Project classifier [40]在0.8的置信阈值下对每个OTU的代表性序列进行分类,其中代表性序列指的是出现频率最高的序列。由于Greengenes database可将物种分类到种水平,因此采用其进行分类。将每个样本的序列数归一化到同一深度(每个样本70 301条序列),以便进行后续分析。原始序列已提交至National Center of Biotechnology Information的Sequence Read Archive数据库,序列号为PRJNA692793。
应用MEGA 6.0 [41]软件,采用邻接法基于每个OTU的代表性序列构建系统发育树,其中采用Kimura two-parameter距离模型测量OTU间遗传差异,并进行数千次的bootstrap试验。更多的信息,比如OTU的数量、每个OTU的reads数、每个分类单元的分布以及每个分类单元中OTU的比例等,均使用interactive tree of life online tool [42]进行了补充(附录A)。应用R v3.5.2绘制反映物种丰富度和丰度的韦恩图和圆形图,应用Origin 2018绘制反映门水平的细菌相对丰度和生物多样性指数(如Shannon指数、Chao1指数和ACE指数)的条形图。
《3、 结果》
3、 结果
《3.1 重力驱动膜滤系统中生物膜的理化性质》
3.1 重力驱动膜滤系统中生物膜的理化性质
tap water-PVDF系统的初始渗透通量高于其他两个系统[图1(a)]。对于湖水过滤系统来讲,两个系统的初始通量非常接近,其中,lake water-PES系统略高。对于所有系统来讲,通量均随时间呈现出下降的趋势,并在第20天达到接近稳定的状态,这与其他在恒压下进行的实验结果一致[5,11]。在稳定条件下,lake water-PVDF (1.23 L·m-2·h-1)和lake water-PES (1.24 L·m-2·h-1)系统的通量略高于tap water-PVDF (1.10 L·m-2·h-1),与运行初期的变化趋势相反。由此看来,膜的通量与膜的亲、疏水性关系不大,可能受到原水的影响,并且氯化水的通量低于地表水。
《图1》
图1 系统过滤性能及生物膜的物理化学性质。(a)运行期间(32天)渗透通量的变化;(b)接触角在180 s内的变化;(c)氢氧化钠处理后各生物膜中有机物的分子量分布;(d)生物膜的表面ζ电位;(e)总有机碳表示的滤液中有机物的亲、疏水组分。(b)~(e)中显示的结果是基于实验结束时的样品。a.u.:任意单位。
然而,从接触角的结果[图1(b)]可以看出,累积的生物膜均是强疏水性的,与水处理的过程无关,这说明了生物膜的通性。同时,可以发现所有生物膜中有机物的分子量范围为1~100 kDa [图1(c)],氯化水所形成生物膜(tap water-PVDF)的有机物浓度高于湖水所形成的生物膜(lake water-PVDF和lake water-PES),也就是说,氯化水形成的生物膜中含有更多的有机物。从膜孔一样但是自来水中有机物的含量低可以看出,微生物所具有的很强的胞外聚合物分泌能力是导致氯化水形成的生物膜中有机物浓度高的原因。
此外,自来水所形成的生物膜的ζ电位[(-24.50 ± 2.89) mV]较湖水所形成的生物膜[(-29.83 ± 2.78) mV和(-29.27 ± 2.44) mV]更负,说明自来水所形成的生物膜上的物质更易接触(静电斥力更低),这可能是自来水形成的生物膜有机物浓度高的原因。对于在不同膜上所形成的湖水生物膜来讲,其ζ电位非常接近。膜后的滤液中有超过50%的有机物是强疏水性的[图1(e)],但是对于长期运行的系统来讲,两个湖水系统并没有在亲、疏水有机物方面呈现出明显的差异,这也正说明了膜的亲、疏水性影响的有限性。
《3.2 生物污染层的形态结构》
3.2 生物污染层的形态结构
tap water-PVDF过滤系统所形成的生物膜结构致密,物质聚集在一起,空隙较小[图2(a)]。相比之下,如图2(b)、(c)所示,湖水所形成的生物膜结构与自来水明显不同,其呈现出多孔的“蜘蛛网”结构。tap water-PVDF过滤系统所形成的生物膜(12.8 μm)比其他两种生物膜厚[5.8 μm,lake water-PVDF系统;8.8 μm,lake water-PES系统;图2(d)~(f)]。这为氯化水影响膜污染提供了直接有力的证据,即过滤自来水导致了更严重的膜污染,说明原水中的有机物可能不是影响膜污染的关键因素(自来水的有机物浓度低而湖水的有机物浓度高),而被膜截留的细菌起着重要的作用,特别是那些未被氯去除的耐氯菌。此外,从自来水和湖水所形成生物膜的结构差异可知,被膜截留的细菌会影响其形成的生物膜结构。
《图2》
图2 不同重力驱动过滤系统中生物膜的扫描电镜图像。(a)~(c)为生物膜(tap water-PVDF、lake water-PVDF和lake water-PES)的表面显微图像。插图为每个生物膜的初始图片,比例尺为500 μm;外部为红色方框的放大图像,比例尺从(a)到(c)分别为1 μm、100 μm和100 μm。(d)~(f)为生物膜(tap water-PVDF、lake water-PVDF和lake water-PES)的横断面显微图像,比例尺为10 μm。
《3.3 生物膜的颗粒及官能团分析》
3.3 生物膜的颗粒及官能团分析
过滤自来水所形成的生物膜,其颗粒较钝,而过滤湖水所形成的生物膜中颗粒较尖锐(图3)。自来水所形成的生物膜的颗粒分布范围较广,为140~350 nm(频率大于0.2)(附录A中的图S2),而lake water-PVDF和lake water-PES系统对应的范围分别为85~210 nm和80~160 nm。tap water-PVDF生物膜的粗糙度为(71.7 ± 1.3) nm,而lake water-PVDF和lake water-PES生物膜的粗糙度为(54.2 ± 1.2) nm和(32.2 ± 0.9) nm(附录A中的表S2)。这些结果进一步揭示了生物膜中物质的尺寸和形态,说明预氯化会对膜污染产生不利的影响,这是因为自来水所形成的生物膜中的物质颗粒更大更钝,更容易导致严重的生物污染。
《图3》
图3 过滤自来水和湖水形成的生物膜的原子力显微图像和红外光谱图。(a)、(e)和(i)为各生物膜的原子力显微图像的三维结构;(b)、(f)和(j)为生物膜的表面形态,比例尺为1 μm;(c)、(g)和(k)为生物膜的原位显微图像,比例尺为100 μm;(d)、(h)和(l)为(c)、(g)和(k)中十字标记对应的红外光谱。上、中和下层分别对应tap water-PVDF、lake water-PVDF和lake water-PES样品。
根据傅里叶变换红外光谱显微图像[图3(c)、(g)和(k)]和对应的谱图[图3(d)、(h)、(l)]可知,每个生物膜均存在三种主要成分,并以不同的颜色显示。据不同颜色的出现频率可知,物质1是主要成分,其次是物质2和物质3。物质1在lake water-PVDF和lake water-PES生物膜上的谱图较为相似,说明类似的物质被保留或被微生物分泌。在所有的生物膜中均可以观察到酰胺I(1640 cm-1)、酰胺II(1528 cm-1)和酰胺III(1392 cm-1)[43‒47]的吸收带,这表明蛋白质分布广泛。因为这些谱带是蛋白质的特征峰,而且是形成蛋白质的重要成分[46]。此外,位于1052 cm-1的C—O峰表明生物膜中存在多糖[43]。
当对比聚偏氟乙烯膜和聚醚砜膜在污染前后的谱图(附录A中的图S3)时,发现有几条吸收带存在显著的变化。由于酰胺I的伸缩振动,污染后的聚偏氟乙烯膜均在1651 cm-1处出现吸收峰,说明膜中存在蛋白质。对于聚醚砜膜,未经污染的膜在O—H(伸缩振动)和‒CH2‒的吸收明显强于污染后的膜,说明附着在膜上的物质覆盖了膜的吸收峰,而被截留或分泌的物质决定了官能团的类型。
《3.4 生物膜基质组分的分布形态》
3.4 生物膜基质组分的分布形态
根据每种颜色的荧光强度可知,在三个生物膜中,多糖(红色)比蛋白质(绿色)和eDNA(蓝色)更丰富[图4(a)~(c);附录A中的动画S1~S3]。与其他两个生物膜相比,tap water-PVDF生物膜中存在大量的多糖和eDNA,而且它们的分布范围较广。但是,蛋白质较少,这可能与细菌的种类有关(分泌的蛋白质较少)。如前所述,湖水系统所形成的生物膜结构疏松。结合扫描电子显微图像的结果可知,自来水所形成的生物膜较厚的主要原因是其多糖含量较高,这是影响膜滤性能的重要因素。此外,我们发现蛋白质主要位于生物膜的下部,而多糖和eDNA主要位于生物膜的上部[图4(d)~(f)]。这些组分的空间分布结果表明,蛋白质直接与膜表层联系,这与膜的傅里叶变换红外光谱的结果一致。
《图4》
图4 生物膜的激光共聚焦显微图像[FITC染色蛋白(绿色)、ConA染色多糖(红色)、DAPI染色eDNA(蓝色)]。(a)~(c)为生物膜tap water-PVDF、lake water-PVDF和lake water-PES的俯视图;(d)~(f)为生物膜tap water-PVDF、lake water-PVDF和lake water-PES的正视图。每张图都是在z轴上扫描生物膜获得的一系列显微照片的堆叠。代表10个记录位置。比例尺为50 μm。
《3.5 解析生物膜中细菌群落》
3.5 解析生物膜中细菌群落
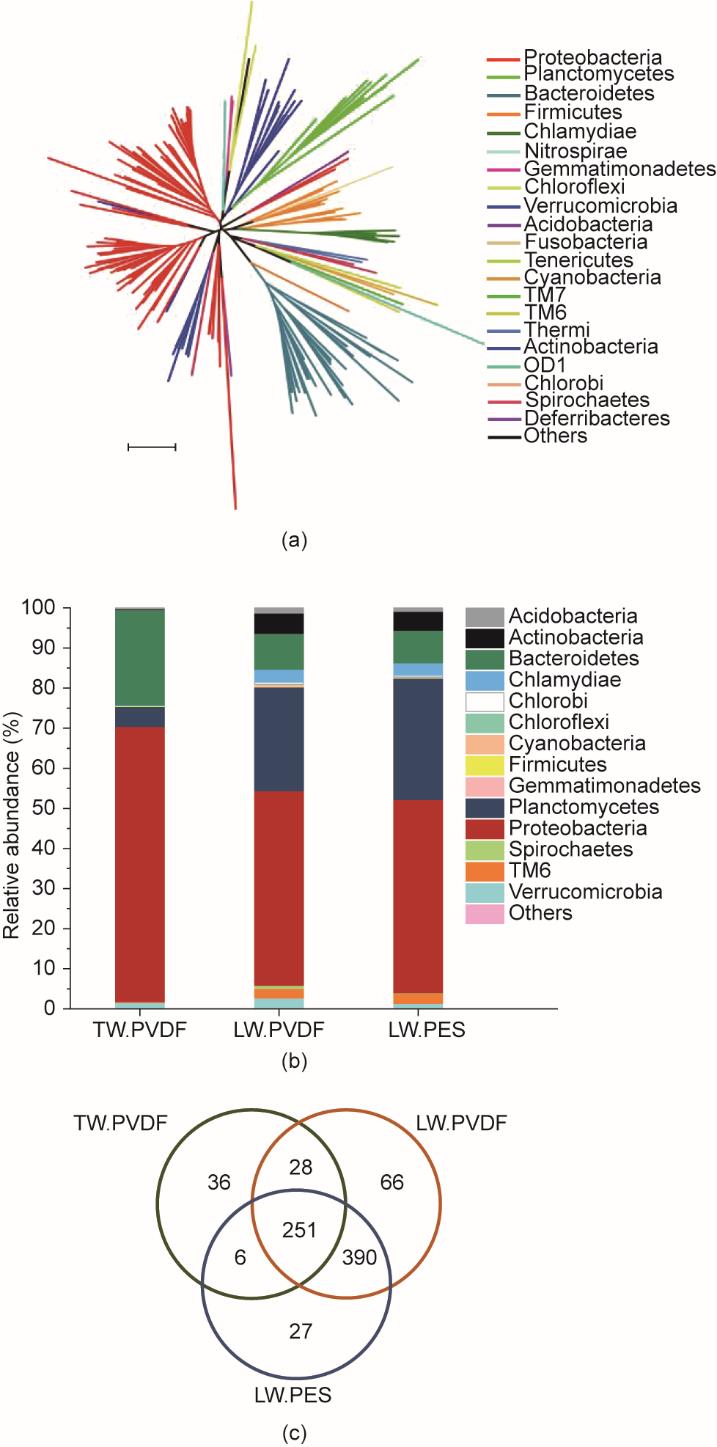
根据基于OTU代表性序列构建的系统发育树[图5(a)]可知,三个生物膜在门水平上共获得20个类群。OTU数量最多的是Proteobacteria(红色分支),其次是Bacteroidetes(青色分支)和Planctomycetes (蓝色分支)。在相对丰度方面[图5(b)],条形图显示Proteobacteria、Bacteroidetes和Planctomycetes在三个生物膜中均是主要成分。Proteobacteria的占比超过50%,说明其在生物膜中是非常重要的。Proteobacteria和Bacteroidetes在自来水所形成的生物膜中的比例显著高于湖水所形成的生物膜。而对于两个湖水所形成的生物膜来讲,由Proteobacteria (48.54%, lake water-PVDF; 48.19%, lake water-PES)、Bacteroidetes (8.90%, 8.06%)、Planctomycetes (25.87%, 30.26%)、Actinobacteria (5.15%, 4.76%)和Chlamydiae (3.18%, 3.12%)相似的相对丰度可见,其细菌群落在门水平上较为相似。此外,根据韦恩图[图5(c)]可知,在三个生物膜中共有251个OTU,其中在两个湖水生物膜中共存的OTU达到641个,这也证实了膜的亲、疏水性对细菌群落的影响是有限的。更详细的有关Proteobacteria、Bacteroidetes和Planctomycetes的信息,见附录A中的图S4、图S5及补充材料和方法。
《图5》
图5 基于测序数据构建的进化树和不同生物膜中微生物的相对丰度。(a)以所有分类中的代表性序列构建的进化树。距离为依据K2P方法测量的碱基替换数。比例尺表示0.1。(b)在门水平上不同生物膜的细菌相对丰度。(c)三种生物膜共有的OTU韦恩图。TW.PVDF表示tap water-PVDF,LW.PVDF表示lake water-PVDF,LW.PES表示lake water-PES。
基于以上分析,对20个丰度最高的属在OTU和reads水平上进行了更小分类单元(属)的分析。在OTU水平上[图6(a)],Gemmata、Planctomyces和Prosthecobacter的丰富度最高,而Rhodoplanes、Rhodobacter和Pseudomonas的丰富度最低。对于同一属,在不同的生物膜中,其丰富度也存在差异。比如,Aquicella在湖水所形成的生物膜中OTU数目最高,而在自来水所形成的生物膜中数目较少。
《图6》
图6 生物膜中微生物前20属的丰富度(a)和丰度(b)。圆圈的大小表示各参数的数值,不同的颜色表示不同的生物膜。TW.PVDF表示tap water-PVDF,LW.PVDF表示lake water-PVDF,LW.PES表示lake water-PES。
如图6(b)所示,物种的丰度从1 [如Kaistia和Polynucleobacter (tap water-PVDF)]变化到20 133 [如Xanthobacter (tap water-PVDF)]。Xanthobacter能产生大量的黏液[48],也被称为胞外聚合物。因此,在自来水过滤系统中形成较厚的生物污染层的原因也就清晰了。Xanthobacter可以利用卤代烷烃作为其唯一的碳源,对氯代脂肪族和氯代芳香族化合物进行脱卤[48]。由此,Xanthobacter在细菌群落中占主导地位的原因也就明晰了。对于湖水所形成的生物膜,在上述属中可以发现一致的变化。这可能是由于生物膜随着时间不断累积,而对膜的选择性产生了不利的影响。此外,Shannon指数[49]、Chao1指数[50]和ACE指数[51](附录A中的图S6)均表明,自来水所形成生物膜的细菌群落的多样性低于湖水所形成的生物膜。
《3.6 过滤系统中有机物的去除效果》
3.6 过滤系统中有机物的去除效果
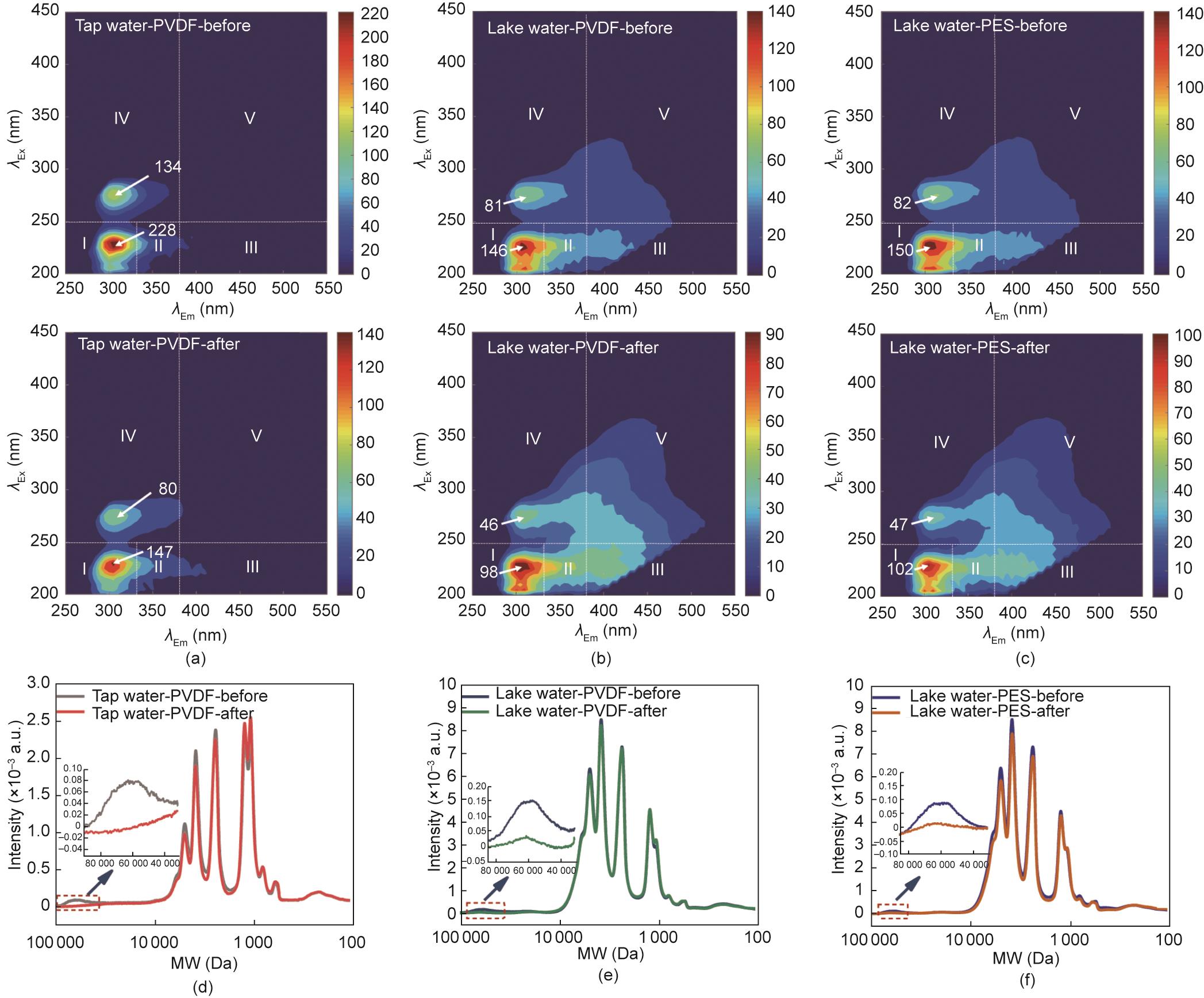
为进一步探究生物膜的差异及其在过滤系统中的作用,对有机物的去除效果进行了研究。三维荧光光谱显示,在原水及出水中主要存在两个峰,分别位于λEx/Em = 220~250 nm/280~330 nm和λEx/Em = 250~290 nm/280~330 nm [图7(a)~(c)]。依据传统的“峰匹配”技术[52]可知,该峰是类酪氨酸类物质。将同一过滤系统的荧光光谱图进行比较时,可以清楚地发现,膜及附着的生物膜显著降低了类酪氨酸类物质的强度,与进水和所用的膜无关。
《图7》
图7 不同过滤系统中(tap water-PVDF、lake water-PVDF和lake water-PES)进、出水的有机物特征。(a)~(c)为三维荧光光谱图,(d)~(f)为分子量分布图。I~V区分别表示类酪氨酸、类色氨酸、类富里酸、类可溶性微生物副产物和类腐殖酸物质。所有的分析都是在实验结束时进行的。“-before”和“-after”后缀分别表示进水和出水。
此外,利用平行因子分析法,将有机物的荧光信号分解为潜在的单个荧光图谱[53‒54],以量化和追踪那些在化学上独立但是光谱重叠的有机成分的变化[55]。结果表明,tap water-PVDF系统中原水和出水的荧光物质均不能进一步分解,说明类酪氨酸类物质是独立的,不受其他组分的光谱影响。但是,对于湖水系统的有机物来讲,其均被分解为类酪氨酸、类富里酸和类腐殖酸类物质(附录A中的图S7和图S8)。这些物质是通过检索包含大量已发表的平行因子分析结果的数据库(即OpenFluor database †)确定的。虽然荧光强度发生了改变,但是过滤系统并没有改变水体中荧光物质的种类。与进水相比,出水中的类酪氨酸类物质明显减少,而其他两种组分几乎没变,说明被去除的荧光物质是类酪氨酸类物质。同时,根据高效尺寸排阻色谱的谱图[图7(d)~(f)]可知,所有过滤系统去除的有机物的分子量范围为20~100 kDa,与“生物聚合物”的出现区域非常吻合[56‒58],验证了细菌在形成这些有机物中发挥了关键的作用。
《4、 讨论》
4、 讨论
在本研究中,探讨了常见水体(氯化水和湖水)对膜污染的影响,膜的亲、疏水性在生物污染形成中的作用以及相关的关键微生物,主要包括应用重力驱动膜滤技术进行小型试验,分析生物膜的形态、理化性质、基质(胞外聚合物)及细菌群落。研究发现,自来水和湖水所形成的生物膜迥异。自来水过滤系统形成了更严重的膜污染,这表现为渗透通量较低,生物膜较厚。在以往的研究中发现[5],溶解性有机物浓度对渗透通量稳定水平有重要的影响,表现为溶解性有机物浓度越高,渗透通量越低。然而,在本研究中,我们发现了相反的结果,这就意味着除了溶解性有机物浓度之外,其他重要因素(如细菌)可能参与其中。
自来水所形成的生物膜结构密实,这与添加叠氮化钠抑制生物活性的研究结果一致[5],表明虽然大部分细菌已被杀死,但残余的细菌可能会分泌更多的胞外聚合物,从而形成更密实的结构和更严重的膜污染。然而,湖水所形成的生物膜是多孔的,类似蜘蛛网。这种迥异的结果可以解释为以下两点:首先,每种微生物分泌的胞外聚合物不同,产生的膜污染不同。不同的微生物群落可能会形成不同结构的生物膜。Akhondi等[11]研究表明,不同的微生物会显著影响生物污染层的形态。Bae等[59]也强调了细菌在生物膜形成中的重要作用。其次,胞外聚合物的分布模式会改变生物膜的结构。尽管从傅里叶变换红外光谱上可以看出,蛋白质、多糖和eDNA是主要的成分,但是其不同的分布模式可能会导致不同的生物膜形态。从激光共聚焦显微图像上可以看出,自来水和湖水所形成的生物膜中主要组分的形状和尺寸均存在显著差异,从而形成不同的生物污染层。Desmond等[15]也提出胞外聚合物的组成与生物膜的结构有关,表现为低浓度的多糖和eDNAs所形成的生物膜结构异质性更大,本研究中扫描电镜的结果也证实了这一点。
激光共聚焦显微图像显示,多糖和eDNAs主要位于生物膜的上部,而蛋白质主要位于底部,这与进水的类型及所用的膜无关。本研究首次提出了三种主要的胞外分泌物的空间分布信息,这将有助于了解它们在生物膜中所发挥的作用。多糖和eDNAs可以保护细菌免受外界不利因素的干扰。而蛋白质由于具有丰富的官能团,可以与膜的活性层紧密结合,从而促进细菌在膜表面的生长,形成生物膜。
当分析生物膜菌落时,研究发现自来水所形成生物膜的优势类群为Xanthobacter,其可以分泌大量的黏液(胞外聚合物)[48]。据报道,Xanthobacter以卤代烷烃和卤代羧酸为食[60‒61],可以产生卤代烷烃脱卤酶,并从卤代物质中释放氯[61]。因此,Xanthobacter在自来水所形成的生物膜中丰度极高也就不难理解。此外,这些未被氯去除的细菌在生物污染的形成中作用巨大,需要重视。然而,由于自来水的水源不同(地表水或地下水)、测序技术不同(Illumina [62]或454焦磷酸测序技术[63])以及最小分类单元不同(门[63]、科[64]或属[65]),因此有关自来水中Xanthobacter的信息比较缺乏。此外,由于本研究中测序样本数量有限,未分组进行统计学分析。但是,根据细菌组成分析的结果可以看出,本研究已揭示了不同生物膜中的关键类群。
根据扫描电子显微图像、ζ电位、官能团及激光共聚焦显微图像的结果可以看出,膜的亲、疏水性对生物污染层性能的影响较小。这是因为累积的生物膜覆盖在膜的活性层上,从而降低了它的重要性。随着生物膜的成熟,其性质逐渐由进水决定。
综上所述,本研究揭示了氯化水对膜污染的影响以及所导致的生物污染层的性质,并提出了细菌驱动的生物膜累积机制;深化了耐氯菌在生物污染形成中的认识,必将有助于更好地控制膜污染。
《5、 结论》
5、 结论
在本研究中,我们发现氯化水(自来水)在过滤过程中比未经处理的地表水(湖水)产生了更严重的膜污染,这表现为更低的渗透通量和更厚的生物膜。对于自来水形成的生物膜来讲,其呈现出密实的形态,而湖水所形成的生物膜是多孔的,类似于蜘蛛网;这与微生物的群落结构密切相关。16S rRNA测序结果表明,Xanthobacter是自来水所形成生物膜的优势类群。自来水所形成的生物膜中多糖和eDNA的含量高于湖水所形成的生物膜,这表明多糖和eDNA在膜污染中起着关键性的作用。同时,我们发现膜的亲、疏水性对膜污染特性和微生物群落的影响很小。此外,本研究首次揭示了基质的主要成分在垂直方向上的分布规律,蛋白质主要位于生物膜的下部,多糖和eDNA位于生物膜的上部,这对于探究它们在生物膜中所发挥的作用具有重要的意义。


















 京公网安备 11010502051620号
京公网安备 11010502051620号




