《1、 引言》
1、 引言
脑电活动,即神经元的兴奋,是大脑功能的重要体现[1‒7]。持续观察大脑的电生理信号对于了解神经系统的功能和信息处理机制具有重要意义[8‒20]。有关大脑对刺激的电反应已经在皮层的孤立区域或少数神经元中得到了很好的研究[例如,可以用多个电极矩阵记录诱发皮层电位(ECP)];然而,关于大脑对周围神经刺激反应的确切时间-空间演变却了解的较少。这是一个重要的知识盲区,因为大脑的功能是由许多神经元协调完成的。这种复杂的过程无法用由传统方法获得的神经系统的碎片信息来很好地理解。然而,考虑到基于单电极或多电极矩阵的传统ECP记录方法的缺点,尽可能完整地确定大脑的功能参数极具挑战性[21‒23]。首先,记录的信号只反映了电极周围少数皮层神经元的动作电位[24‒25],因此,很难获得靶区全细胞群的电生理特征,并分析复杂的脑功能。其次,电极位置的微小变化会导致信号出现较大的波动和个体出现较大的变化,进而容易遗漏共同的规律。再次,传统的开颅手术和将电极置于大脑皮层表面或者植入脑皮层会对大脑造成严重的创伤和产生广泛的干扰。此外,传统方法难以实现长期、连续的检测和观察。因此,研究周围神经刺激下大脑的时间-空间动态变化,对于更深入地理解大脑的工作模式具有重要意义。
本研究通过采用正交导联系统和微创的方法研究了一种新的电生理记录方式,并研究了大鼠经外周刺激后对应的不同脑功能区域的整体兴奋过程;还研究了不同周围神经及其分支的完整的典型ECP图谱,使其能够可视化大脑和周围神经重建的时空特性和相互作用。
《2、 方法》
2、 方法
《2.1 实验动物及伦理》
2.1 实验动物及伦理
成年雄性Sprague-Dawley(SD)大鼠,体重200~250 g,获取自北京大学人民医院实验动物中心[PKUPH;无特定病原体动物(SPF)级,批准号:SYXK(京)2011-0010]。实验动物饲养于自然光照(12∶12小时/昼∶夜)环境并能够自由获取水及食物。本研究中使用的麻醉、手术和术后护理方案符合美国国立卫生研究院关于动物实验的指导方针,并经PKUPH研究伦理委员会批准,尽一切努力减少动物的痛苦,减少使用的动物数量。
《2.2 手术流程及电极植入》
2.2 手术流程及电极植入
对大鼠进行随机分组,分别检测正中神经、尺神经、桡神经及分支的ECP。用18只动物获取前臂三根主神经干的电信号(6只动物对应一根神经)。对于三根神经干分支,采用另外18只动物进行数据采集,避免因操作平面不同、操作时间长大鼠产生不必要的反应错误。
采用戊巴比妥钠30 mg·kg-1腹腔注射麻醉大鼠,必要时给予15 mg·kg-1戊巴比妥钠维持麻醉深度。麻醉完成后对大鼠头颅顶部及右侧上肢内侧区剃毛,碘伏消毒皮肤。将正中神经、尺神经、桡神经的主干及分支从周围组织暴露出来,用生理盐水浸润过的湿纱布覆盖神经加以保护。实验时室温保持在20~25 ℃,使用恒温毯系统将大鼠直肠温度维持在37~37.5 ℃,防止低温影响大脑生理活动。
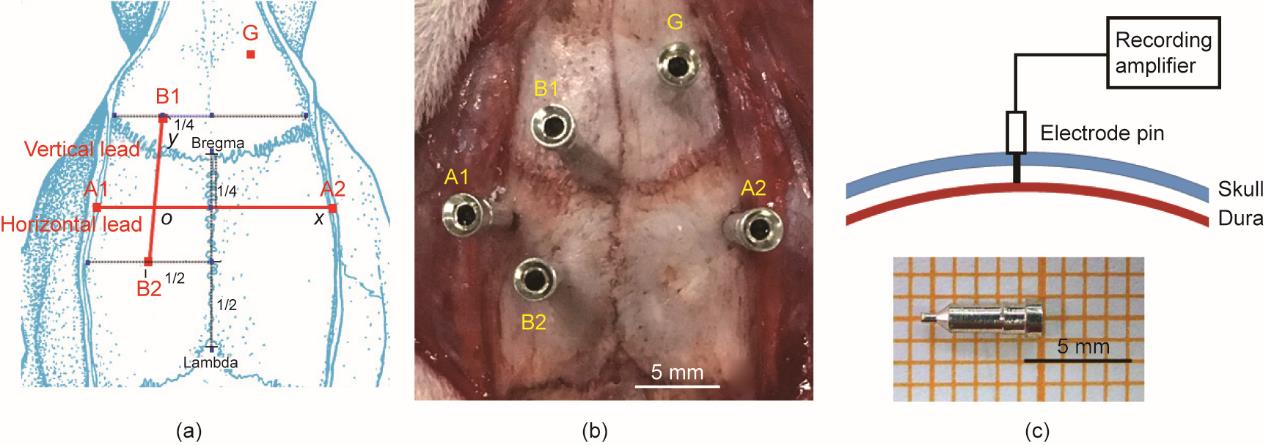
将大鼠的头部固定于脑立体定位仪上。颅骨固定良好后沿大鼠颅骨矢状缝作3 cm长的正中切口,充分显露前囟(Bregma)和后囟(Lambda),用3%双氧水擦洗颅骨表面。根据Khazipov等[26]和Paxinos等[27]的报道,确定A1、A2、B1和B2的电极位置[图1(a)、(b)]。将材质为Ag/AgCl的记录电极(pin;头端为中空状,长8 mm,管壁厚0.2 mm,内径0.5 mm;尾端为实心,长2 mm,直径0.5 mm)插入颅骨表面标记点(直径0.5 mm,深度1 mm)[图1(b)、(c)]。该方法巧妙地避开了血窦的位置,减少了意外损伤血窦导致颅内血肿的可能性。
《图1》
图1 (a)使用bregma和lambda 点作为参考来确定A1、A2、B1和B2的电极位置。水平连线是连接A1和A2的线;垂直连线是连接B1和B2的线。(b)大鼠的正交导联系统。(c)采用引脚作为记录电极。电极仅仅突破大鼠颅骨板障,接触到硬脑膜,大脑皮层仍保持完整。G是地线。
《2.3 记录皮层诱发电位》
2.3 记录皮层诱发电位
仔细显露目标神经及其分支。将记录电极和参照电极的两端分别与MedlecSynergy电生理仪和pin相连,刺激电极的信号端与电生理仪相连。利用球形Ag/AgCl电极采集皮层信号。以A1到A2的连线作为正交导联的水平导联(H导联),B1到B2的连线作为正交垂直导联(V导联)。对目标神经进行单向连续方波电刺激(3 Hz,100 μs脉宽),刺激强度为0.09 mA,刺激持续时间为0.2 ms,刺激重复率为5 pps(pulse per second,每秒脉冲);平均叠加300次取一个ECP。为了说明ECP的波形,将负波标记为N,正波标记为P。当振幅大于10 μV时,波形被标记为N或P,反之被标记为n或p。分别刺激正中神经、尺神经和桡神经及其分支并记录ECP。
《2.4 正交导联系统时间-空间参数的转换》
2.4 正交导联系统时间-空间参数的转换
在直角坐标系中,水平ECP矢量x的正方向从A1指向A2,而垂直ECP矢量y的正方向从B2指向B1。合成的ECP矢量ρ是由水平分量和垂直分量合成的。为了更好地理解ECP的时空特征,将直角坐标系转换为极坐标系统,其中点o是矢量x和矢量y的交点,ρ =
《2.5 正中神经离断损伤模型》
2.5 正中神经离断损伤模型
利用戊巴比妥钠30 mg·kg-1腹腔注射麻醉6只实验大鼠。对术区剃毛并消毒,显露正中神经后,于肘窝上方3 mm处离断正中神经。正中神经近端残端用5-0尼龙线结扎,反方向缝合至邻近肌肉,防止神经生长。用大量生理盐水冲洗伤口,然后用5-0尼龙缝线缝合。将实验大鼠放回笼中继续饲养。术后4个月行电生理检查,评估ECP的变化。
《2.6 数据分析》
2.6 数据分析
本研究的数据以均数±标准差(SD)表示。采用SPSS 20.0软件(SPSS Inc., USA)进行分析和统计。
《3、 结果》
3、 结果
《3.1 电极与大鼠皮层功能区的位置关系》
3.1 电极与大鼠皮层功能区的位置关系
本实验中,正交导联位于左侧大脑躯体运动区和躯体感觉区的上方。图2中的绿色区域和红色区域分别代表体躯体运动区和体感区;H导联和V导联正交穿过相应的皮层功能区。
《图2》
图2 正交导联系统与大脑皮层对应功能区的示意图。大鼠皮层功能区域示意图。绿色和红色区域分别代表躯体运动区和躯体感觉区。S1FL:第一躯体感觉皮层前肢区域,即前肢区;S1HL:第一躯体感觉皮层后肢区域,即后肢区;M1:第一运动皮质;M2:第二运动皮质。
《3.2 正中神经及其分支诱发的ECP的时空特征》
3.2 正中神经及其分支诱发的ECP的时空特征
通过刺激正中神经干,H导联和V导联均可获得稳定的ECP。H导联和V导联ECP的潜伏期分别为(1.21 ± 0.04) ms和(1.25 ± 0.06) ms,这与神经脉冲从刺激部位向皮层扩散所需的时间一致(图3和表1)。
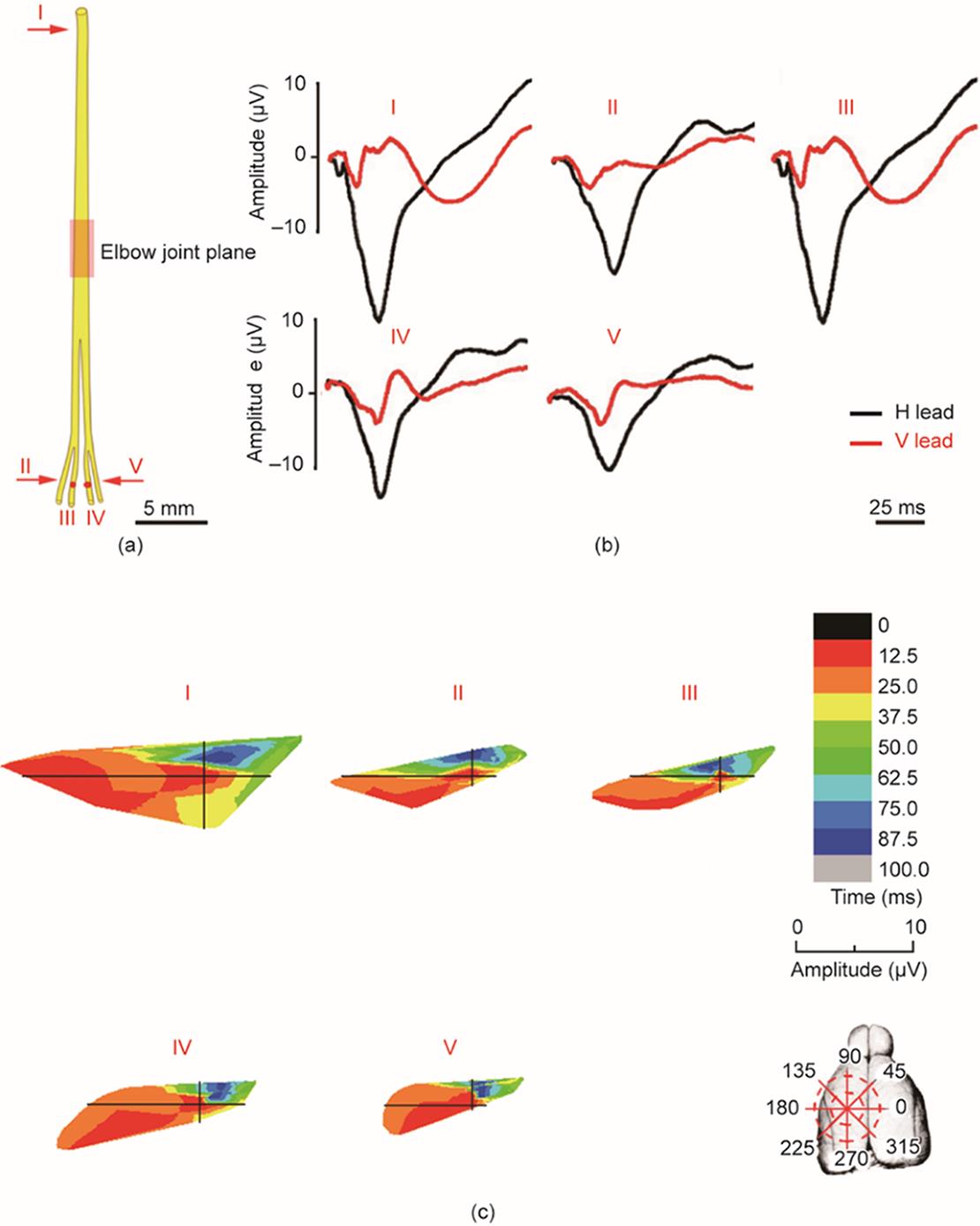
《图3》
图3 正中神经及其分支的ECP。(a)正中神经示意图,箭头处为刺激点。(b)正中神经及其分支的ECP波形。(c)正中神经及其分支诱发ECP的时空特征。I为正中神经;II为正中神经肌支;III为骨间前神经;IV、V、VI为掌指总神经(分别为桡侧、正中侧、尺侧)。
《表1》
表1 正中神经及其分支诱导的ECP参数(平均值±标准差, = 6)
| Parameter | Median nerve | Muscular branch | Anterior interosseous nerve | Common palmar digital nerve (radial) | Common palmar digital nerve (median) | Common palmar digital nerve (ulnar) |
|---|---|---|---|---|---|---|
| Waveform | ||||||
| H lead | n1N2N3 | p1N1 | p1N1N2 | N | n1N2 | N1N2 |
| V lead | N1N2n3 | N1N2 | N1n2 | N | N | N1N2 |
| Latency | ||||||
| H lead (ms) | 1.21 ± 0.04 | 1.29 ± 0.04 | 1.30 ± 0.07 | 1.40 ± 0.05 | 1.45 ± 0.04 | 1.45 ± 0.06 |
| V lead (ms) | 1.25 ± 0.06 | 1.30 ± 0.04 | 1.29 ± 0.09 | 1.45 ± 0.10 | 1.50 ± 0.10 | 1.50 ± 0.03 |
H导联正中神经干ECP主波由n1N2N3N4 4个连续负波组成。V导联的ECP主波显示N1N2n3型波形(图3和表2)。
《表2》
表2 正中神经主干H导联、V导联主要ECP波形及参数(平均值±标准差, = 6)
| Parameter | H lead | V lead | |||||
|---|---|---|---|---|---|---|---|
| n1 | N2 | N3 | N4 | N1 | N2 | n3 | |
| Amplitude (μV) | 1.80 ± 1.20 | 8.37 ± 5.01 | 14.51 ± 9.43 | 8.12 ± 5.35 | 12.68 ± 10.70 | 24.96 ± 19.38 | 6.31 ± 4.96 |
| Peak time (ms) | 3.11 ± 0.44 | 8.38 ± 1.15 | 12.64 ± 2.35 | 30.46 ± 6.82 | 7.22 ± 2.74 | 10.67 ± 1.94 | 23.79 ± 1.77 |
正中神经分支(即肌支、骨间前神经、桡侧指掌总神经、正中侧指掌总神经、尺侧指掌总神经)诱导的ECP各有特点,可通过特定的波形识别[图3(a)、(b)及表1]。
在极坐标系下,获得不同神经分支刺激对应的大脑皮层兴奋时空序列。对于正中神经干,刺激投射区在前12.5 ms(从225°移动到240°)从第二象限开始,相当于初级运动皮层(M1)边缘。在接下来的12.5 ms中,激活区域从大约210°移动到225°。最后,顺时针传导后,投影区域结束于第一象限(87.5~100 ms从45°移动到60°),对应于第二运动皮层(M2)边缘[图3(c)]。不同正中神经分支诱导的皮层兴奋过程表现出特定的时空特征[图3(b)、(c)]。
《3.3 尺神经及其分支诱发的ECP的时空特征》
3.3 尺神经及其分支诱发的ECP的时空特征
尺神经干的H导联、V导联潜伏期分别为(1.30 ± 0.06) ms、(1.25 ± 0.04) ms(图4、表3)。与正中神经不同,尺神经干在H导联的ECP主波表现为n1N2型,在两个连续的负波(n1和N2)之间存在一个平台期。V导联的ECP主波为n1p1N2型(图4和表4)。
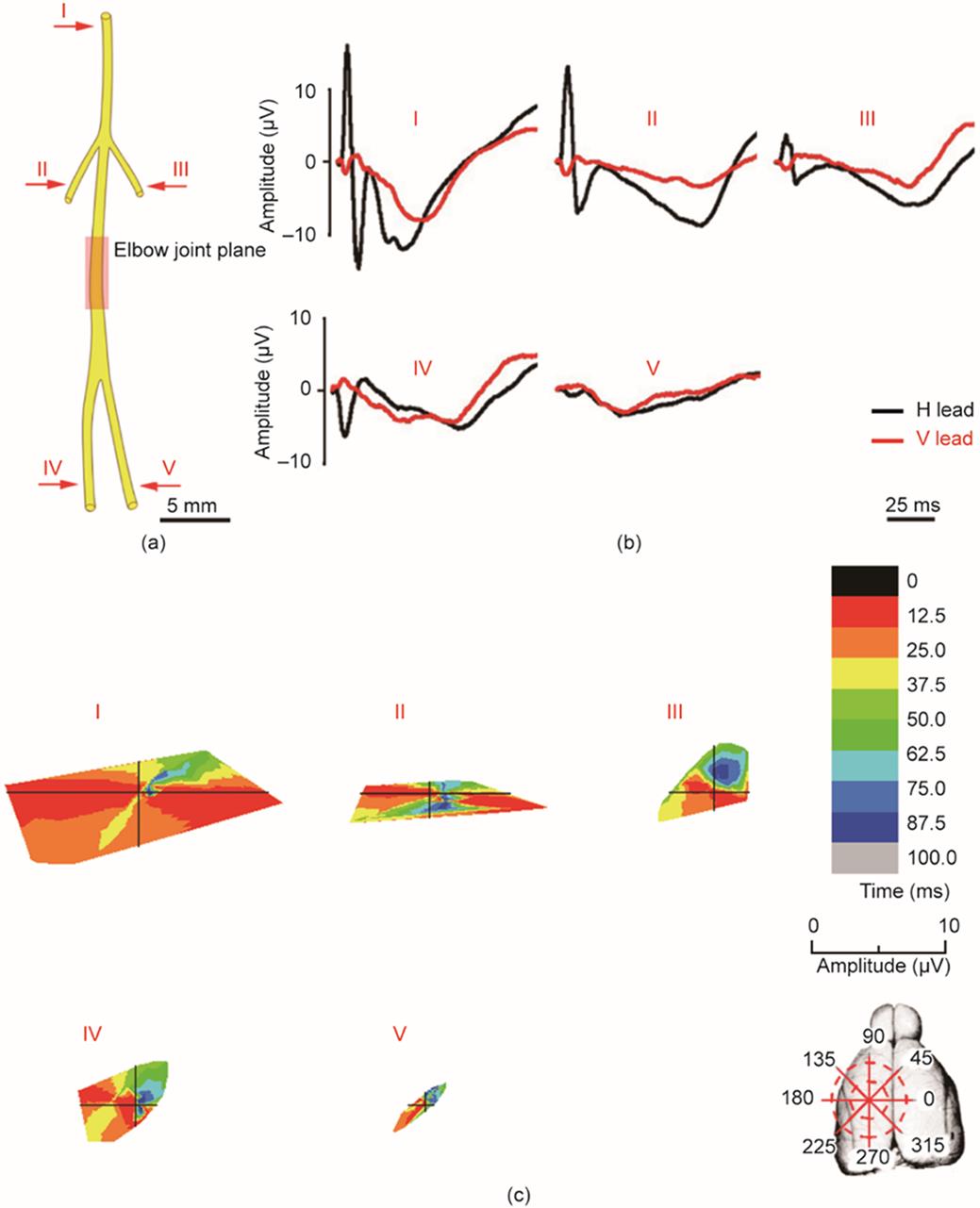
《图4》
图4 尺神经及其分支的ECP。(a)尺神经示意图,箭头处为刺激点。(b)尺神经及其分支的ECP波形。(c)尺神经及其分支诱发ECP的时空特征。I为尺神经;II和III为指背神经(分别为桡侧和尺侧);IV和V为皮支(分别为桡侧和尺侧)。
《表3》
表3 尺神经及其分支诱导的ECP参数(平均值±标准差, = 6)
| Parameter | Ulnar nerve | Dorsal digital nerve (radial) | Dorsal digital nerve (ulnar) | Cutaneous branch (radial) | Cutaneous branch (ulnar) |
|---|---|---|---|---|---|
| Waveform | |||||
| H lead | n1N2 | N | N | N | N |
| V lead | n1p1N2 | n1n2 | n1n2 | N1p1n2 | n |
| Latency | |||||
| H lead (ms) | 1.30 ± 0.06 | 1.35 ± 0.07 | 1.55 ± 0.06 | 1.51 ± 0.06 | 1.53 ± 0.08 |
| V lead (ms) | 1.25 ± 0.04 | 1.36 ± 0.06 | 1.50 ± 0.12 | 1.55 ± 0.07 | 1.52 ± 0.03 |
《表4》
表4 尺神经主干H导联、V导联主要ECP波形及参数(平均值±标准差, = 6)
| Parameter | H lead | V lead | |||
|---|---|---|---|---|---|
| n1 | N2 | n1 | p1 | N2 | |
| Amplitude (μV) | 3.23 ± 0.79 | 27.47 ± 12.51 | 11.55 ± 11.54 | ‒9.94 ± 8.37 | 8.47 ± 8.96 |
| Peak time (ms) | 2.86 ± 0.39 | 12.76 ± 1.89 | 7.94 ± 2.77 | 13.53 ± 4.57 | 30.87 ± 4.78 |
当刺激尺神经分支(即两根指背神经和两根皮神经)时,H导联的ECP波形均表现为N型,V导联的ECP波形表现为复杂型(图4和表3)。
尺神经的ECP矢量在前12.5 ms从第二象限与第一象限之间的区域(170° ~ 210°),即M1的边缘开始。在接下来的12.5 ms中,激活区从大约225°移动到250°,从150°移动到170°。最后,经过双向扩散,激活区结束在第一象限(30° ~ 65°),该区域与M2边缘相对应[图4(c)]。每个尺神经分支对应的皮层区域的兴奋过程表现出不同的时空特征[图4(c)]。
《3.4 桡神经及其分支诱发的ECP的时空特征》
3.4 桡神经及其分支诱发的ECP的时空特征
桡神经干H导联和V导联的潜伏期分别为(1.28 ± 0.05) ms和(1.30 ± 0.06) ms(表5)。桡神经干在H导联的ECP主波以一个显著的正波(P1)开始,接着是三个连续的负波(P1N1N2N3)。V导联的ECP主波为n1p1N2型(图5和表6)。桡神经分支(即肱三头长头肌支、肱三头外侧肌支、桡深肌支和桡浅肌支)H导联诱导的ECP大多有明显的初始正向波(表5)。
《表5》
表5 桡神经及其细分分支诱导的ECP波形及参数(平均值±标准差, = 6)
| Patameter | Radial nerve | Triceps long head muscle branch | Triceps lateral head muscle branch | Radialis profundus | Radialis superficialis |
|---|---|---|---|---|---|
| Waveform | |||||
| H lead | P1N1N2N3 | P1N1N2 | p1n1N2 | N1p1N2 | n1n2 |
| V lead | n1p1N2 | n1p1n2n3 | n1p1n2 | p1n1n2 | n |
| Latency | |||||
| H lead (ms) | 1.28 ± 0.05 | 1.29 ± 0.06 | 1.30 ± 0.06 | 1.49 ± 0.07 | 1.46 ± 0.06 |
| V lead (ms) | 1.30 ± 0.06 | 1.31 ± 0.03 | 1.29 ± 0.07 | 1.47 ± 0.04 | 1.50 ± 0.08 |
《图5》
图5 桡神经及其分支的ECP。(a)桡神经示意图,箭头处为刺激点。(b)桡神经及其分支的ECP波形。(c)正交导联系统中桡神经及其细分分支的时空序列分析。I为桡神经;II为桡神经三头肌长头分支;III为桡神经三头肌外侧头分支;IV为深桡肌;V为桡浅肌。
《表6》
表6 桡神经主干H导联、V导联的主要ECP波形及参数(平均值±标准差, = 6)
| Parameter | H lead | V lead | ||||||
|---|---|---|---|---|---|---|---|---|
| P1 | N1 | N2 | N3 | n1 | p1 | N2 | ||
| Amplitude (μV) | ‒16.32 ± 9.32 | 18.60 ± 10.06 | 10.18 ± 10.65 | 11.60 ± 14.92 | 1.90 ± 1.93 | ‒2.38 ± 0.99 | 10.40 ± 6.98 | |
| Peak time (ms) | 2.59 ± 0.39 | 5.16 ± 0.80 | 13.07 ± 0.91 | 22.28 ± 3.01 | 2.59 ± 0.42 | 4.69 ± 0.84 | 22.06 ± 3.00 | |
桡神经干诱导的大脑皮质兴奋性空间分布呈矩形。在最初的12.5 ms,ECP信号同时起源于原点的顶部和底部(范围为170°~ 210°和310°~ 360°),靠近M1的边缘。在接下来的12.5 ms内,ECP信号传播到初始兴奋区域的两侧(210°~300°,以及160°和10°附近的小区域)。最终,经过双向扩散,兴奋信号在第一象限(M2处,近30°~60°)结束[图5(c)]。每个桡神经分支对应的皮层区域的兴奋过程表现出特定的时间-空间特征[图5(c)]。
《3.5 正中神经损伤后ECP的时空变化》
3.5 正中神经损伤后ECP的时空变化
正中神经离断后4个月进行再次检查,采用相同方法刺激尺神经和桡神经干时,ECP的时空特征及波形均有明显变化。与正常大鼠的n1N2型相比,尺神经干H导联的ECP主波波形变为n1N2N3型。在V导联中,由初始的n1p1N2型变为N1N2型(表7)。桡神经干的H导联和V导联的ECP波形分别为P1N1N2、n1p1n2,术前分别为P1N1N2N3、n1p1N2(表8)。
《表7》
表7 正中神经离断后尺神经干的波形及潜伏期(平均值±标准差,= 6)
| Parameter | H lead | V lead | |||
|---|---|---|---|---|---|
| n1 | N2 | N3 | N1 | N2 | |
| Amplitude (μV) | 6.47 ± 5.06 | 30.24 ± 18.65 | 52.34 ± 43.06 | 12.21 ± 6.91 | 14.83 ± 10.55 |
| Peak time (ms) | 2.92 ± 0.35 | 8.34 ± 0.94 | 12.40 ± 1.69 | 8.16 ± 0.88 | 14.16 ± 2.17 |
《表8》
表8 正中神经离断后桡神经干的波形及潜伏期(平均值±标准差, = 6)
| Parameter | H lead | V lead | ||||
|---|---|---|---|---|---|---|
| P1 | N1 | N2 | n1 | p1 | n2 | |
| Amplitude (μV) | ‒21.56 ± 14.43 | 31.03 ± 19.48 | 60.60 ± 53.51 | 9.32 ± 6.29 | ‒5.40 ± 6.06 | 7.29 ± 4.46 |
| Peak time (ms) | 2.76 ± 1.11 | 6.64 ± 2.85 | 13.14 ± 1.68 | 3.36 ± 0.54 | 4.78 ± 0.39 | 13.91 ± 3.18 |
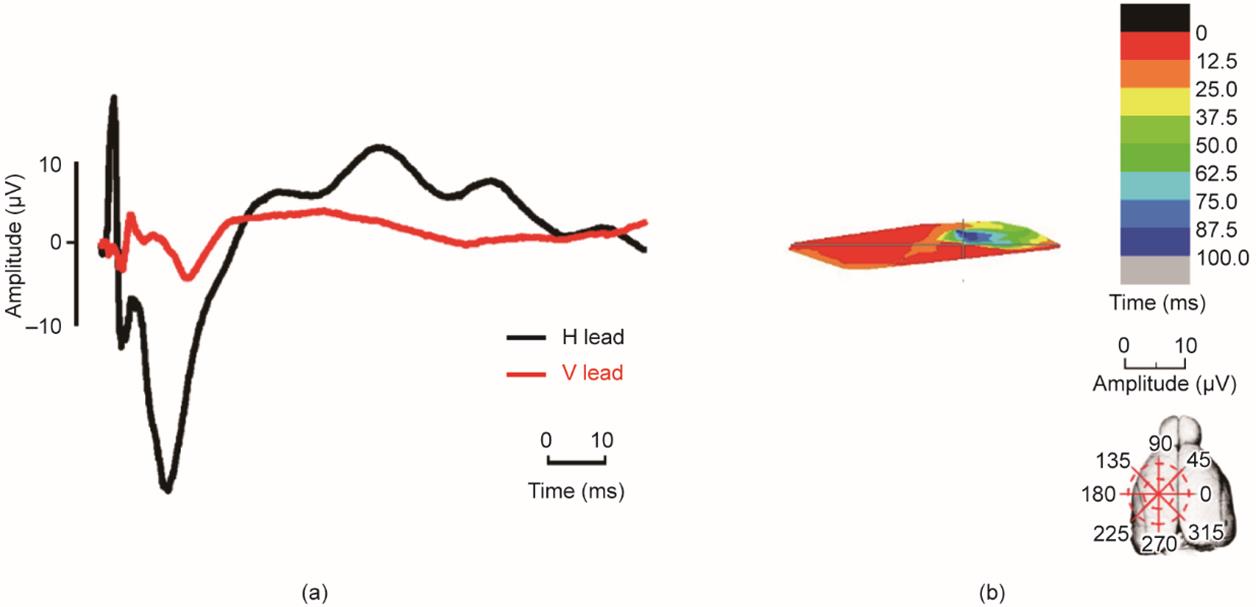
虽然术后4个月尺神经诱发的兴奋投射区形状仍为三角形,但分布区域有向正中神经诱发区延伸的趋势。分布区域在前12.5 ms从第三象限(235° ~ 250°,M1处)开始。在接下来的12.5 ms中,兴奋区向逆时针方向(约225° ~ 230°)移动。最后,在顺时针传导后,兴奋区在第一象限和第二象限(330° ~ 360°和0° ~ 30°)的较小区域结束,该区域与M2相对应(图6)。对于桡神经,其兴奋进程仍保持原来的模式,然而,正中神经损伤后ECP矢量的振幅明显增加(图7)。
《图6》
图6 正中神经离断4个月后尺神经诱发ECP的时空变化。(a)尺神经ECP波形;(b)尺神经时空序列。
《图7》
图7 正中神经离断4个月后桡神经诱发ECP的时空变化。(a)桡神经ECP波形;(b)桡神经的时空序列。
《4、 讨论》
4、 讨论
本研究创建了一种新的电生理方法,该方法采用正交导联系统和经颅骨微创植入电极,可以获得刺激周围神经后产生的脑皮层诱发电位和时间-空间特征。美国最近提出的脑10年计划(ten-year brain research plan),其中重要的一个方向就是解决既往对高级神经功能理解的碎片化问题[28‒31]。在该计划中,一个重要的研究领域是开发新技术,以尽可能完整地理解复杂的大脑功能[30,32‒33]。传统的电生理方法只能通过测量神经传导速度和诱发电位来确定周围神经与大脑的连续性[34]。一直以来对周围神经系统与中枢神经系统之间复杂的功能关系都很难进行监测和分析。本研究提供了一种周围神经连续电刺激后诱发脑皮层复合动作电位的电生理检测方法。然后,这些复杂的信号被分解到多个正交空间,从而产生的脑电信号可以被广泛地解析为时间和空间分量。通过这种方式,研究人员可以观察到大脑多个皮层区域在不同阶段的功能状态。本研究显著地克服了传统方法不可避免的缺陷,如稳定性和可重复性差、个体变异严重、代表性有限;因此,本研究在反映大脑的整体功能过程和特征方面迈出了一大步。
本研究首次获得了不同周围神经及其分支对应的典型的ECP图谱。根据ECP图谱的结果,可以很容易地通过典型的波形来区分周围神经或分支。如研究结果所述,刺激桡神经后在H导联的前相正波之后诱发了三个连续的负波(P1N1N2N3),而尺神经的ECP在H导联中在小的负波后出现一个大的负向波(n1N2)。在其他小的神经分支中也观察到了类似的结果(图8)。此外,ECP的参数,如潜伏期、振幅和波的组成与神经传导速度、兴奋程度和激活细胞群分布等神经功能状态高度相关(图8)。因此,可以分析波形的特征,进而确定周围神经与大脑皮层之间的状态和相互作用。这种方法类似于利用心电图来解释心脏的工作状态。因此,识别度高的ECP图谱可以用于分析高级脑功能。
《图8》
图8 桡神经刺激诱发ECP的理论模型图。特定的神经刺激诱发的ECP表现出显著的、可重复的参数特征,包括潜伏期、振幅和波的组成。
利用上述方法可以在特定的周围神经刺激和重建的反应中观察大脑的时空特性和精确的过程。根据研究结果,正中神经的ECP矢量主要位于M1和M2外侧。此外,可以逐步捕捉并观察ECP矢量从M1侧沿顺时针方向扩展到M1/M2边界的详细时空过程。桡神经和尺神经及其分支在皮层的兴奋过程也得到了体现。当大脑执行一个动作时,不同的神经元会去极化、复极化,或者以一种协调的方式改变膜电位。正交导联平面投射ECP矢量的位置和时间相位,反映了大脑皮层中不同功能细胞群的空间分布和参与反应的相关神经元群的时间序列。因此,这种方法可以让研究人员精确地观察和分析大脑中神经激动的时空序列细节。
本研究中主要的科学发现,如ECP图谱和本文报道的对周围刺激诱发的皮层兴奋序列的可视化,有助于理解大脑的工作方式和反应模式,并产生新的假设。本研究所获得的结果为今后的研究提供了许多线索。研究观察到的不同神经投射皮层区域的兴奋顺序表明了大脑中复杂的神经信号传递过程和反应机制。本文所描述的数据为后续研究提供了基础,所提供的ECP图谱可作为其他研究的基线参考。ECP波形和时间-空间序列的不同变化提示神经功能改变和脑重构的典型病理及生理过程。如图6、图7所示,正中神经离断后,大脑皮质的ECP有向正中神经投射区延伸的趋势。
综上所述,本研究为探索周围神经系统与中枢神经系统之间的整体功能联系和重塑机制提供了一种新的方法。本研究首次获得了大脑对外周刺激的精确且可重复的时空反应。该方法简单、稳定、重复性好、个体变异小。该方法提供了丰富的信息并为系统分析外周和中枢神经系统之间的功能联系提供了基础。本研究可以作为一个实验平台,用于研究大脑和周围神经重建随着时间推移的动态交互情况。但是,本研究目前还缺乏对每个波分量的生理意义的准确分析。本研究获得的参数均为麻醉下获得的;虽然每条外周神经的刺激呈现出独特的重复脑反馈波形,但这些波形应与正常生理状态下的不同。未来的研究将更详细地解决这些问题。


















 京公网安备 11010502051620号
京公网安备 11010502051620号




