《1. 引言》
1. 引言
苯酚是一种用途广泛的重要工业化合物。因此,苯酚也是树脂生产、煤炭气化、炼油、采矿等行业产生的废水中常见的污染物[1]。苯酚在水中的高溶解度增加了其流动性,并对环境造成了大范围的污染。因此人们已经开发、试验和实施了几种技术来降解和去除各类废水中的苯酚[1‒3]。苯酚的厌氧生物降解是一种有效的处理技术,该技术能够完全降解苯酚,能耗低,且具有产生生物能源(即甲烷气体)的潜力。利用厌氧微生物菌群降解苯酚已经被广泛研究[2,4‒9],然而,对于参与苯酚降解的微生物及其在分解中的作用缺乏系统研究。
有文献报道,参与苯酚降解的微生物主要类群有互营杆菌(Syntrophorhabdaceae)、暗色厌氧肠状菌(Pelotomaculum)、脱硫肠状菌(Desulfotomaculum)、互养菌(Syntrophus)、梭菌(Clostridium)[2,7,9‒10]等。关于其他微生物在苯酚生物降解中的作用也有不同的说法。食芳香族物互养棍状菌(S. aromaticivorans)[11]和酚隐厌氧菌(C. phenolicus)[12]是两个已知的能利用苯酚在产甲烷环境中生长的物种。许多研究将苯酚降解途径描述为:苯酚在与氢营养型产甲烷菌的互饲作用下被互养棍状菌(Syntrophorhabdus)降解为乙酸盐。这些研究也表明,苯酚首先被互养棍状菌或暗色厌氧肠状菌转化为苯甲酸盐,然后被暗色厌氧肠状菌、脱硫肠状菌或互养菌[4‒5,8,13‒15]转化为乙酸盐。然而,在已发表的研究中,没有明确的证据表明任何单纯培养的暗色厌氧肠状菌都能降解苯酚。因此,暗色厌氧肠状菌不太可能将苯酚转化为苯甲酸盐。同时,互养棍状菌也不太可能为其他苯甲酸盐清除者生产苯甲酸盐,因为食芳香族物互养棍状菌将苯酚转化为苯甲酰辅酶A(CoA)是一个消耗三磷酸腺苷(ATP)的过程。食芳香族物互养棍状菌需要进一步降解苯甲酰辅酶A以获得能量[16]。这一推理提出了两个关键问题:①如果互养棍状菌能够产生苯甲酸盐作为中间产物,然后苯甲酸盐被其他微生物消耗,那么在热力学上互养棍状菌如何从这个过程中受益? ②如果互养微生物,如互养菌和暗色厌氧肠状菌不以互养棍状菌产生的中间产物为食,那么在苯酚降解菌群中,让它们保持丰度的主要底物是什么?
为了回答这些问题,本文研究了从处理苯酚的升流式厌氧污泥床(UASB)反应器中取样的颗粒污泥中的微生物群落结构。通过16S核糖体RNA(rRNA)的基因序列构建克隆文库,分析微生物群落结构。然后应用新设计的探针进行荧光原位杂交(FISH),揭示了参与苯酚降解的微生物的空间分布。研究颗粒污泥的优势在于,在颗粒的深度上存在明显的苯酚浓度梯度[17],因此,存在于颗粒不同深度的微生物暴露在不同的苯酚浓度中。也就是说,微生物在颗粒中的分布和生长是由苯酚及其副产物在颗粒深度上的浓度梯度决定的。此外,通过对特定微生物群的原位染色,可以观察到其交互共生关系。本研究首次对从苯酚厌氧降解颗粒群中发现的微生物的作用及其相互作用进行了解释。
《2. 材料和方法》
2. 材料和方法
《2.1. 反应器的操作方法和颗粒污泥的取样技术》
2.1. 反应器的操作方法和颗粒污泥的取样技术
实验室规模的UASB反应器(容量为11 L)以苯酚为唯一碳源,并额外添加营养物质(见附录A中的表S1),在中温(35 ℃)条件下运行1000 d以上。UASB反应器的水力停留时间(HRT)设定为9.2 h。UASB反应器开始以630 mg·L-1的浓度[相当于以重铬酸钾为氧化剂测定的每升化学需氧量(COD),为1500 mg(COD·L-1)]投放苯酚。苯酚浓度逐渐升高至1260 mg·L-1(3000 mg COD·L-1),对应化学需氧量负荷为7.8 kg COD·(m3·d)-1。反应器的COD去除率为60%~80%。
本研究中的颗粒污泥取样自UASB反应器的底部。用于提取DNA的样品用磷酸盐缓冲液(PBS)洗涤两次。用于荧光原位杂交分析的样品用磷酸盐缓冲液洗涤两次,在4 ℃的条件下,在3%多聚甲醛溶液中固定15 h,然后再次用磷酸盐缓冲液洗涤两次,在-20 ℃的条件下在乙醇或磷酸盐缓冲液中保存。
《2.2. DNA的提取、克隆、进化分析、探针设计和验证》
2.2. DNA的提取、克隆、进化分析、探针设计和验证
采用ISOIL Beads Beating试剂盒(日本NIPPON GENE公司)进行DNA提取。分别用引物对Eub8F-Univ1500R [18]和Arc109F-Univ1500R [19]对细菌和古菌的16S rRNA基因进行扩增。经MinElute PCR纯化试剂盒(德国Qiagen公司)处理后,按照厂家说明书,用TOPO TA克隆试剂盒(美国Invitrogen公司)克隆聚合酶链反应(PCR)的产物。随机挑取117个细菌和38个古菌进行克隆。对大概600个碱基进行测序,其中包括16S rRNA基因的V3~V4区。所获得的序列,利用mothur算法将一致性在97%以上的序列聚类为操作分类单元(OTU)[20]。为了选择重要的OTU,对基因的全长都进行了测序。所得序列保存于日本DNA数据库(DDBJ;编号见附录A中的表S2)。利用SILVA Release 138数据库[21]和ARB软件进行进化分析和探针设计。设计的探针用math荧光原位杂交[22]进行评估。在预计亲和性较低的情况下,引入了锁核酸(LNA)[23]。如文献[24]所述,探针验证采用克隆荧光原位杂交。
《2.3. 原位杂交和激光扫描共聚焦显微镜》
2.3. 原位杂交和激光扫描共聚焦显微镜
本研究使用的寡核苷酸探针见表1 [25‒27]。用等量的Eub338 Ⅰ&Ⅳ和Eub338 Ⅱ&Ⅲ探针的混合物来检测细菌。杂交缓冲液[0.9 mol·L-1 NaCl, 20 mmol·L-1 Tris-HCl(pH值为7.5),0.01%十二烷基硫酸钠]中每种探针含量为0.5 µmol·L-1,在46 ℃的条件下杂交3~6 h。通过在杂交缓冲液中加入甲酰胺来调节杂交的紧密度(表1)。将载玻片浸入含甲酰胺的杂交缓冲液中,在48 ℃的条件下浸泡15 min,以去除过量的探针。为了增强某些探针的信号强度,在3´和5´端用荧光染料进行标记[28]。干燥后用ProLong Gold(美国Invitrogen公司)覆盖样品,并使用荧光显微镜(BX50,日本Olympus公司)或共聚焦激光扫描显微镜(LSM710,日本Carl Zeiss显微镜公司)进行评估。用被4´,6-二酰胺-2-苯基吲哚(DAPI)染色的细胞数除以荧光原位杂交阳性的细胞数来计算细胞丰度(用百分率表示)。
《表1》
表1 本研究中所使用的探针
| Name | Sequence (5′–3′) | Targets | Formamide (%) | References |
|---|---|---|---|---|
| Eub338 I&IV | GCW GCC TCC CGT AGG AGT | Bacteria | 20 | [ |
| Eub338 II&III | GCW GCC ACC CGT AGG TGT | Bacteria | 20 | [ |
| Arc915 | GTG CTC CCC CGC CAA TTC CT | Archaea | 20 | [ |
| Syha828 | ATT ACA CCT CCC ACA CC | Syntrophorhabdaceae | 10 | This study |
| Syphu459L | GTA CALa AGG CTR TTLa ACC TC a | 10 | This study | |
| Cph1269 | CCG GCT TTT WTC GGA TTT GCT CCA CC | 10 | This study | |
| cCph1269 | CCG GCT TTT WTC GGA TTT GCT CCG CC | Competitor probe for Cph1269 | 10 | This study |
《3. 结果和讨论》
3. 结果和讨论
《3.1. 微生物的群落组成》
3.1. 微生物的群落组成
分别对克隆的117个细菌和38个古菌进行测序,以构建细菌库和古菌库。从所有克隆菌中,获得了30个细菌和5个古菌的OTU。细菌的群落组成见附录A中的表S2。其中3个OTU与已知的苯酚降解菌,即食芳香族物互养棍状菌(OTU B1和B15)和酚隐厌氧菌(OTU B4)接近。食芳香族物互养棍状菌能够在厌氧环境中与产甲烷菌发生互养结合,将苯酚降解为乙酸[11]。同样地,已知酚隐厌氧菌可以将苯酚转化为苯甲酸盐[12]。
OTU B4对酚隐厌氧菌的赋值并不明显。虽然利用基本局部比对搜索工具(BLAST),在美国国家生物技术信息中心(NCBI)的数据库中进行搜索的结果显示,OTU B4与三邻苯二甲酸暗色厌氧肠状菌(P. terephthalicicum, 96%)的序列同源性比与酚隐厌氧菌(95%)的高;但直接序列匹配结果显示,OTU B4与酚隐厌氧菌(1499个碱基中有1431个符合)的序列同源性比与三邻苯二甲酸暗色厌氧肠状菌(1488个碱基中有1422个符合,见附录A中的表S2)更接近。为了进一步明确OTU B4的进化位置,构建了进化树,清晰地表明OTU B4与隐杆厌氧菌成员的亲缘关系比与暗色厌氧肠状菌的亲缘关系更近[图1(a)]。这种分类学分配数据分析方法的异常,可以解释为什么许多研究提到苯酚降解菌群中存在暗色厌氧肠状菌而非隐杆厌氧菌[2,15]。下一代测序技术能提供更多的序列读数,尽管长度较短,可能不足以区分隐杆厌氧菌和暗色厌氧肠状菌。即使获得了近全长的16S rRNA基因序列,其结果仍可能偏向于暗色厌氧肠状菌,特别是在连进化分析都没有的情况下。Ju等[5]利用16S rRNA基因全长或近全长的序列进行进化分析,发现中温和高温环境中的厌氧苯酚降解菌群中隐杆厌氧菌丰度相对较高,暗色厌氧肠状菌相对较少。这些结果表明,为了更准确地划分属于隐杆厌氧菌的序列,有必要对近全长的16S rRNA基因序列进行进化分析。
《图1》
图1 OTU的进化位置与隐杆厌氧菌(a)及互营杆菌和互养菌(b)有关。获得的克隆菌数量列于括号中。用颜色表示所设计的探针的覆盖物:Cph1269为蓝色、Syha828为粉色、Syphu459L为绿色。采用ARB程序中的邻接法构建了16S rRNA基因树。比例尺表示每个序列位置核苷酸的变化数量。
第二个高丰度的OTU(OTU B2,相对丰度为17%)与巴斯韦尔氏互养菌(Syntrophus buswellii)关系密切,且已知巴斯韦尔氏互养菌能将苯甲酸盐转化为乙酸盐[29]。第三个高丰度的OTU(OTU B3,相对丰度为10%)属于FCPU426门。利用从解冻冻土中获得的样本[30]构建基因组,这些基因组共同组成了该门的宏基因组,但关于其代谢功能尚未有详细报道。此外,脱硫弧菌(Desulfovibrio)的OTU也是高丰度的:B6(4个克隆菌)、B9(3个克隆菌)和B13(2个克隆菌)。另外一些研究也提到了在苯酚降解菌中存在脱硫弧菌。Chen等[9]在中温苯酚降解富集培养基中观察到脱硫弧菌的存在,但没有讨论其在降解苯酚中的作用。脱硫弧菌可能参与以硫酸盐为底物的氢气消耗(见附录A中的表S1)。其对氢气的消耗可能导致较难提取出与氢营养型产甲烷菌相关的古菌克隆菌(见附录A中的表S2)。
在古菌库中(见附录A中的表S2),由于在苯酚厌氧降解过程中乙酸盐相比氢气是主要子产物,所以属于甲烷丝状菌(Methanosaeta,一种乙酸发酵型产甲烷菌)的OTU占主导地位;也获得了相对丰度较低的OTU,其与氢营养型产甲烷菌,即甲烷绳菌(Methanolinea)和甲烷杆菌(Methanobacterium)有关。
《3.2. 探针设计与有效性》
3.2. 探针设计与有效性
由与互营杆菌、隐杆厌氧菌和互养菌相似的OTU构建的进化树如图1所示。设计了三种寡核苷酸探针,即Cph1269、Syha828和Syphu459L,分别检测隐杆厌氧菌、互营杆菌和互养菌(表1)。设计的探针的进化范围如图1所示。利用克隆荧光原位杂交方法(见附录A中的图S1)对设计的探针进行进一步的验证和优化。在三个探针中,即使在5´和3´端都进行了荧光标记,以互养菌为靶点的Syphu459与DNA探针仍表现出较低的信号强度[28]。因此,引入LNA以增强杂交效率[23]。替换两个腺嘌呤碱基(Syphu459L)后,得到更亮的信号。对于隐杆厌氧菌的检测,初步设计探针Cph1271(见附录A中的图S1)。本探针在3´端与Pelotomaculum propionicum(P. propionicum)只有一个碱基不匹配。因此,结合Cph1271来设计和应用竞争探针cCph1271(见附录A中的图S1)。即使有cCPh1271,也不能消除其与P. propionicum的非特异性杂交。然后通过在3´端添加两个胞嘧啶碱基(命名为Cph1269)将探针拉长,并与竞争探针cCph1269一起应用。这种结合能够明显区分隐杆厌氧菌与P. propionicum。
《3.3. UASB颗粒污泥中苯酚降解微生物的原位定位》
3.3. UASB颗粒污泥中苯酚降解微生物的原位定位
将所设计的探针应用在经超声均匀化后的颗粒样品中,研究人员成功地检测到了三种微生物类群,即互营杆菌、隐杆厌氧菌和互养菌(图2)。每个探针检测到的细胞丰度如下:互营杆菌为22% ± 0.6%、隐杆厌氧菌为3.5% ± 1.5%、互养菌为14.4% ± 0.6%。这一结果与在克隆文库中发现的它们的相关种群非常吻合。
《图2》
图2 与Syha828探针(互营杆菌)(a)、Cph1269探针(隐杆厌氧菌)(b)、Syphu459L探针(互养菌)(c)原位杂交后的苯酚处理颗粒污泥样品的显微照片。每组图片中的左侧图片用于描绘DAPI,右侧图片显示探针染色。比例尺为10 µm。
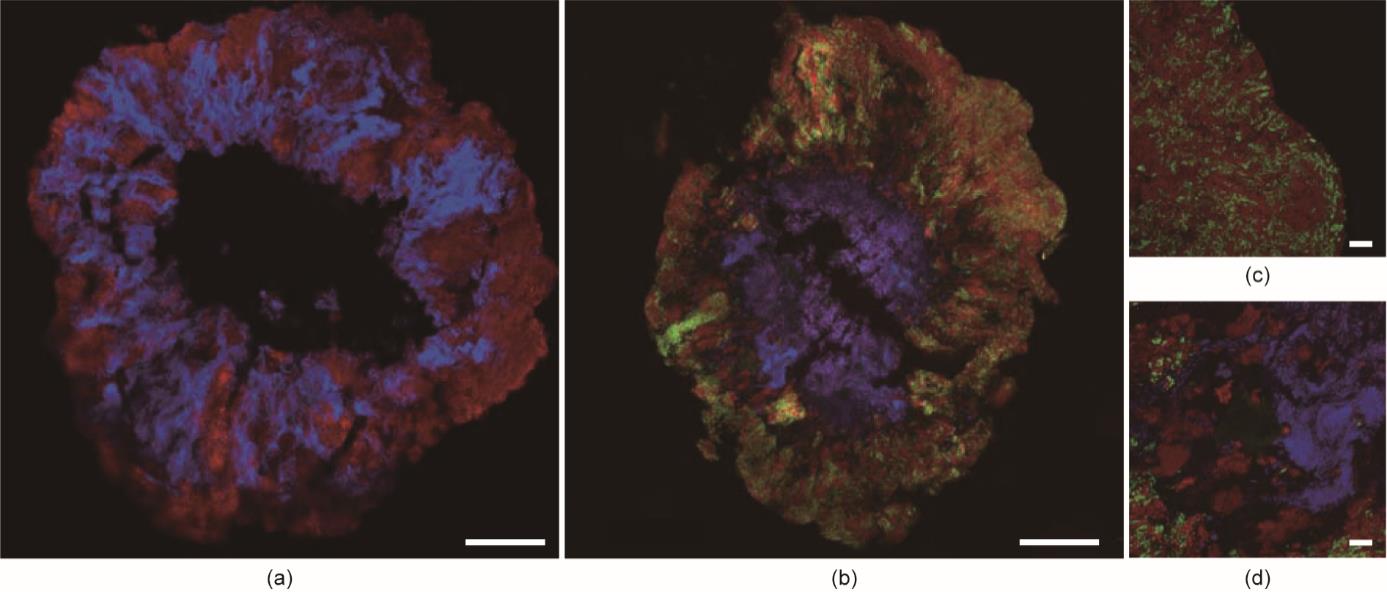
接下来制备颗粒样品薄片,以揭示苯酚降解菌群沿颗粒深度的分布。首先使用的是针对细菌和古菌的探针。结果表明,细菌和古菌在整个颗粒中均有分布。在颗粒中心,有一个非活性区或类似矿物的物质发出荧光(图3)。然后,将所设计的三种探针同时应用于互营杆菌、隐杆厌氧菌和互养菌。研究发现,隐杆厌氧菌和互养菌在空间上关系密切,都位于颗粒的外部,而互营杆菌则存在于颗粒的较深部位(即位于隐杆厌氧菌和互养菌与中心不活跃区之间;图3)。
《图3》
图3 经苯酚处理的原位杂交颗粒切片。切片同时与细菌Eub338混合液(红色)和古菌Arc915混合液(蓝色)(a)杂交,或与以隐杆厌氧菌为靶向的Cph1269探针(绿色)、以互养菌为靶向的Syphu459L探针(红色)、以互营杆菌为靶向的Syha828探针(蓝色)(b)杂交。(c)、(d)为与三个探针(Cph1269、Syphu459L和Syha828)同时杂交的截面外部的放大图和更深部位的放大图。(a)、(b)比例尺代表200 µm;(c)、(d)比例尺代表20 µm。
《3.4. 苯酚厌氧降解群落的生态学视角》
3.4. 苯酚厌氧降解群落的生态学视角
本研究成功地展示了用于处理含酚废水的颗粒污泥中苯酚降解微生物的原位分布。此前已有报告观察到细菌和古菌在苯酚降解颗粒和生物膜中呈随机分布[7,9‒10,14],本文的研究结果与这些观察结果一致。有趣的是,在本研究中利用荧光原位杂交技术分析出,在颗粒污泥中不同的细菌种类在分布上存在明显差异。微生物在颗粒中的特殊分布可能是由苯酚降解率、代谢关联性、对抵御苯酚毒性的能力以及隐杆厌氧菌和互营杆菌生长速率的差异等因素造成的。隐杆厌氧菌可能比互营杆菌的生长速率更快,这有助于前者通过更快利用苯酚而获得颗粒外部的生态位。根据克隆文库获得的信息(见附录A中的表S2)可知,互营杆菌和互养菌可以利用由隐杆厌氧菌产生的苯甲酸盐。荧光原位杂交的结果显示,互养菌的丰度在空间上与隐杆厌氧菌接近,这表明互养菌比互营杆菌更适合利用苯甲酸盐。此前已有研究报道,相比互营杆菌,互养菌在利用苯甲酸盐时更具优势[9];在同样的研究工作中,当底物由苯酚转变为苯甲酸盐时,研究人员观察到菌群从互营杆菌向互养菌转移。这些观察结果表明,苯酚降解是通过颗粒外部的隐杆厌氧菌与互养菌之间的互养结合发生的。
虽然互营杆菌的种群生长速度较慢,但与隐杆厌氧菌相比,它们可能对苯酚有更高的亲和力,其生态位位于颗粒的更深处。本研究中的反应器所采用的苯酚浓度较高(1260 mg·L-1),但由于微生物降解苯酚,所以沿着颗粒深度可能会形成陡峭的苯酚浓度梯度[17]。因此,颗粒内较深部位的苯酚浓度明显较低,可促进颗粒内较深部位中互营杆菌的生存、生长和蔓延。Chen等[14]报道了用浓度较低的苯酚(25~30 mg·L-1)在全厌氧流化床反应器中进行富集培养,在碳活化颗粒的生物膜表面上存在互营杆菌。此外,在低浓度苯酚的富集培养中,发现互营杆菌在微生物中占主导地位[31],但在苯酚浓度较高时,发现暗色厌氧肠状菌和互养杆菌在微生物中占优势[2,7,10]。虽然目前的研究还没有将关注点放在这些微生物对苯酚的亲和力上,但本研究中的微生物分布情况和颗粒中可能存在的苯酚浓度梯度都表明:与隐杆厌氧菌相比,互营杆菌对苯酚的亲和力更高。
本研究显示的生态位分化也显示了厌氧生物在苯酚降解中起着不同的作用。有研究称,互营杆菌很可能是苯酚降解为苯甲酸盐过程中的关键微生物,其后由互养菌和暗色厌氧肠状菌[4,14]进行苯甲酸盐的降解。但是,由于这样做对互营杆菌几乎没有益处,因此它不太可能总是生产苯甲酸盐作为中间产物来喂养其他微生物[16]。荧光原位杂交的结果显示,互营杆菌本身存在于颗粒的较深部位,而不是与互养菌共存。这一发现表明,互营杆菌与颗粒中的互养菌不存在互养关系。另一方面,有报告表示低浓度苯酚的生物膜表面附近,互营杆菌和互养菌呈随机分布[14],表明不同的微生物之间的相互作用(与本文的研究结果相比)。微生物之间的相互作用可能受到几种不同环境因素的影响,如苯酚浓度、有机负荷、生物膜厚度等。
本研究证明了将近全长的16S rRNA基因序列进行进化分析,对于正确鉴定隐杆厌氧菌的重要性,以便将其与暗色厌氧肠状菌进行区分。以前的一些研究可能将隐杆厌氧菌误认为是苯酚降解菌群中的暗色厌氧肠状菌。本研究辨别了负责降解苯酚的微生物,并指出了它们在厌氧颗粒生物膜环境中的作用。最后,本研究能够回答两个关键问题:①互营杆菌通过将苯酚降解为乙酸盐而获得能量,不向邻近微生物提供苯甲酸盐;②互养菌从隐杆厌氧菌中获得苯甲酸盐作为主要底物。
















 京公网安备 11010502051620号
京公网安备 11010502051620号




