《1、 引言》
1、 引言
等温核酸扩增技术,如核酸序列扩增、链置换扩增、解旋酶依赖性扩增、滚环扩增和环介导等温扩增(LAMP)等,是很有前途的现场病原体鉴定方法;因为它们可以有效地扩增靶标,而不需要基于聚合酶链反应(PCR)的方法所需的热循环设备[1‒2]。LAMP是一项特别有趣的技术,因为该技术使用一种酶,可以在一小时内扩增多达109个拷贝,使用不到10个拷贝的输入模板[3]。尽管有这些优势,但传统的LAMP检测偶尔会遇到挑战,如非特异性扩增、引物-二聚体形成或污染,最终导致假阳性结果,原因是高浓度的引物和Mg2+ [4‒5]。常用的LAMP扩增子可视化技术,如浊度测量[6]、琼脂糖凝胶电泳[7]、荧光插层染料染色[8‒9]、金属离子指示剂[10]和pH敏感染料[11],无法区分非特异性副产物。虽然已经通过各种方法解决了这一问题,包括尿嘧啶DNA-糖基化酶(UDG)补充LAMP,其中在第一轮扩增时将脱氧尿嘧啶三磷酸(dUTP)纳入扩增子中,然后在下一轮扩增之前被UDG消化以消除携带[12];以及荧光共振能量转移探针[13]、分子信标[14],猝灭未纳入的信号扩增探针[15],通过释放猝灭来检测扩增[16‒17],但这些方法需要相对昂贵的试剂和设备,并且在即时诊断中存在问题。相比之下,侧流免疫检测试纸条(LFIAS)更快、更简单;据报道,该测试条有望增强LAMP扩增产物的可视化和分析[18‒21]。不幸的是,LAMP-LFIAS也可能检测到扩增副产物,导致虚假的结果。Phillips等[22]最近通过将链置换(SD)探针集成到LAMP分析中,成功地防止了商业AuNP-LFIAS上的副产物捕获。SD探针是通过将带有羧基荧光素(FAM)标记的环状引物退火到带有淬灭剂标记的较短互补链来制备的。然而,使用荧光团标记的环状引物限制了对不同靶标的适应,因为环状引物设计通常在这方面不太令人满意,而且大多数胶体金试纸条只能进行定性或半定量检测。
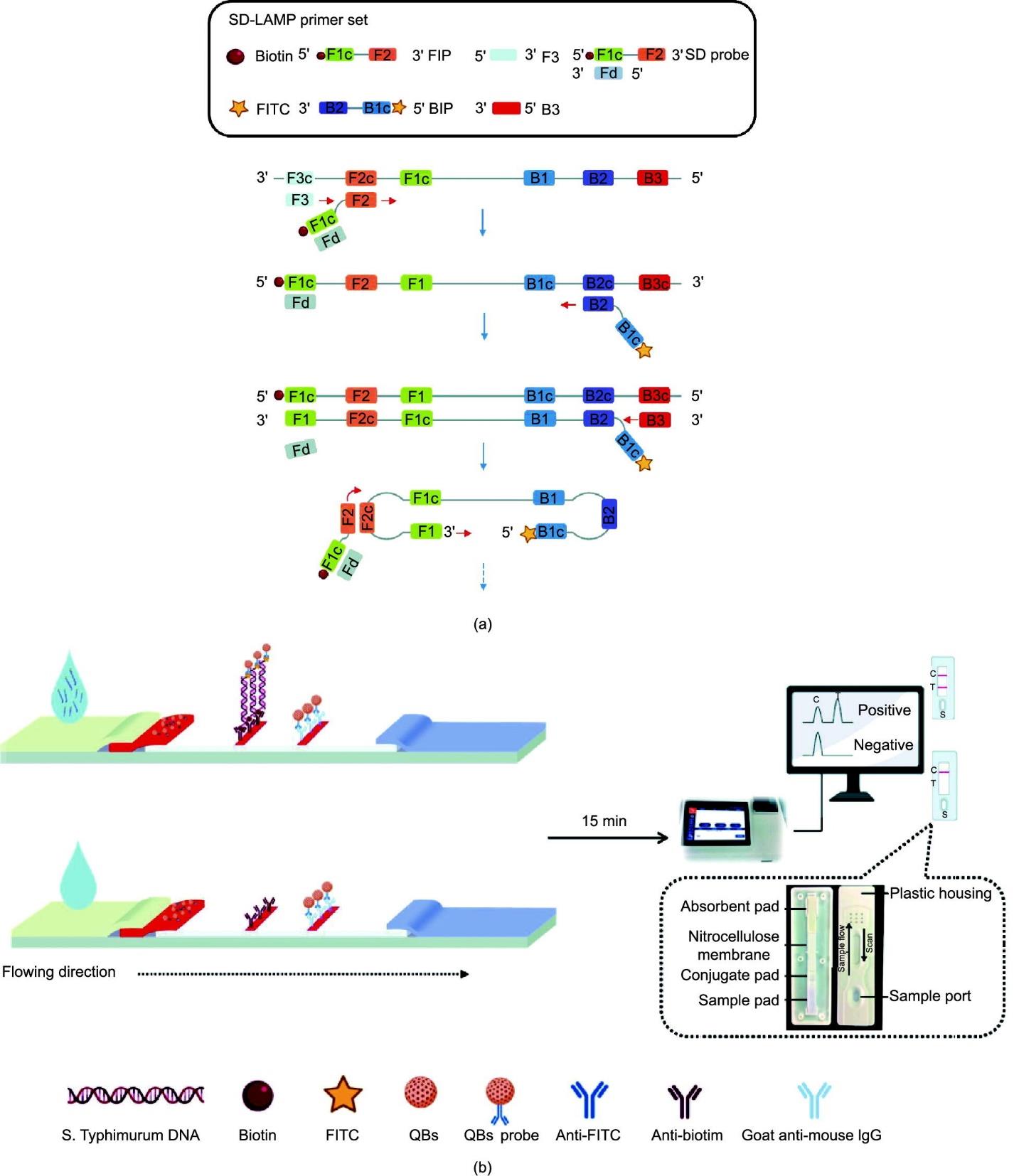
为了解决这些问题,需要确保SD-LAMP检测的特异性和可靠性,即SD-LAMP只有在靶标DNA存在的情况下才会给出真正的阳性反应[23]。使用标记的内引物[正向内引物(FIP)或后向内引物(BIP)]取代SD探针中的标记环引物[环正向(LF)或环后向(LB)];由于后者在LAMP反应中的使用浓度是前者的两倍,因此在扩增过程中被更大程度地结合到扩增产物中。为了更简单和更灵敏地直接读出LAMP扩增,进一步将SD-LAMP与量子点纳米珠(QB)标记的LFIAS结合用于细菌检测。QB是一种新型的荧光纳米材料,由掺杂了大量量子点的聚合物纳米棒组成,具有优异的亮度和很强的抗光漂白稳定性[24]。与使用胶体金纳米颗粒或荧光染料的LFIAS相比,QB标记的LFIAS表现出更高的灵敏度和准确性,以及更低的背景干扰[25]。这种新建立的检测方法的工作原理如图1所示。简单地说,在一个典型的程序中,使用生物素标记的内引物和异硫氰酸荧光素(FITC)标记的SD探针进行核酸扩增,以标记靶标DNA [图1(a)]。然后,将得到的具有双标记(FITC和生物素)的杂交产物沉积到QB标记的LFIAS上,根据形成的三明治结构来指示靶标的存在或不存在[图1(b)]。研究推测,SD-LAMP与QB标记的LFIAS方法相结合,可以以特定的方式成功地检测目标病原体。鼠伤寒沙门氏菌(ST)是一种通常会导致人和动物严重疾病的病原菌,该病原菌被用于检查拟议平台的性能。该方法具有较高的特异性和灵敏度,检测时间短,操作方便,可作为实验室细菌检测和现场检测的有用工具。
《图1》
图1 (a)SD-LAMP反应的原理;(b)用于检测扩增产物的QB标记的LFIAS的示意图。FITC:异硫氰酸荧光素。FIP:正向内引物。BIP:后向内引物。SD:链置换。IgG:免疫球蛋白G。
《2、 材料和方法》
2、 材料和方法
《2.1 材料和试剂》
2.1 材料和试剂
将10个ST菌株和20个非ST菌株保存在25%的甘油中,温度为-80 ℃。所有菌株在37 ℃的Luria-Bertani(LB)肉汤中复苏两次,持续24 h,使用HiPure Bacterial DNA Kit(广州美基生物科技有限公司)提取基因组DNA。在SD-LAMP反应中使用了从美国New England Biolabs公司获得的Bst 2.0 WarmStart DNA聚合酶(M0538L)。所有引物和探针都是从北京擎科生物科技股份有限公司订购的。
本文研究团队在实验室合成了涂有羧基的亲水CdSe/ZnS QB耦合试剂,1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)和牛血清白蛋白(BSA)购自Sigma-Aldrich公司(美国)。Tween-20、聚乙二醇(PEG)、果糖、蔗糖和其他分析级试剂购自Aladdin公司(中国)。抗FITC单克隆抗体(mAb1)、抗生物素单克隆抗体(mAb2)和山羊抗小鼠IgG均来自Abcam公司(英国)。所有的LFIAS材料、样品垫(Ahlstrom 8951)、共轭垫(Ahlstrom 8964)、硝酸纤维素(NC)膜(Sartorius CN 140)、吸收垫(H5072)和PVC板(DB-6)均购自上海杰一生物技术有限公司。
《2.2 SD探针设计和SD-LAMP反应》
2.2 SD探针设计和SD-LAMP反应
SD探针基本上是由杂交的寡核苷酸组成的半双链DNA,其中内部引物(FIP或BIP)在其5ʹ或3ʹ端含有一个荧光团和一个较短的互补支架(称为Fd)。一般来说,设计荧光团标记的引物的目的是避免形成稳定的发夹;SD探针的熔解温度应明显低于65 ℃(至少低5 ℃),以确保启动趾状物介导的链置换反应。SD-LAMP引物是用PrimerExplorer V5在线软件(Eiken Chemical Co. Ltd.,日本)为ST设计的。本研究通过将10 μmol·L-1的5ʹ-FITC标记的BIP与50 μmol·L-1的Fd在95 ℃下退火5 min,然后以0.1 ℃·s-1的速度缓慢冷却到4 ℃以制备SD探针的储备溶液。SD-LAMP反应与标准LAMP反应的进行方式几乎相同,只是加入了SD探针。反应混合物含有1 μL DNA模板、6 mmol·L-1 MgSO4、1.4 mmol·L-1 dNTP、0.32 U·μL-1 Bst 2.0 WarmStart DNA聚合酶、0.2 μmol·L-1 F3和B3引物、1.6 μmol·L-1 FIP引物、0.8 μmol·L-1 BIP引物和0.8 μmol·L-1 SD探针,总体积为25 μL的1×等温缓冲液,在Biometra TOne 96G(Jena Analytik,德国)中进行,65 ℃孵育1 h,然后加热到80 ℃持续10 min,使聚合酶变性,然后保持在4 ℃直到用于分析。标准LAMP和SD-LAMP产品采用2%聚丙烯酰胺凝胶电泳,溴化乙锭染色,并使用Tanon-2500紫外线(UV)透射器(Tanon,中国)进行可视化分析。此外,本研究使用LightCycler® 96实时荧光检测(Roche,瑞士)进一步确认了SD-LAMP的有效性。
《2.3 QB-mAb共轭物的制备和表征》
2.3 QB-mAb共轭物的制备和表征
利用QB表面的羧基与抗体的胺基发生EDC共轭反应,制备了QB-mAb1共轭物。具体来说,5 μL的QB(10 mg·mL-1)在500 μL磷酸盐缓冲液(PB)(0.01 mol·L-1, pH = 6.0)中用新制备的5 μL EDC(2 mg·mL-1)预活化。将混合溶液置于25 ℃的旋转器中30 min,然后加入5 μg mAb1并搅拌2 h。为了阻断剩余的活性偶联部位,加入含10%牛血清白蛋白的50 μL的PB(0.01 mol·L-1, pH = 6.0),孵育1 h;对QB-mAb1 10 000 g离心20 min,用纯水洗涤至少两次。最后,将纯化的共轭物悬浮在1 mL PB(0.01 mol·L-1, pH = 7.4)中。PB含2%(浓度)果糖、5%(浓度)蔗糖、1%(浓度)牛血清白蛋白、1%(浓度)PEG 20 000和0.4%(体积分数)Tween-20,并在4 ℃保存以备后用。QB与mAb1的最佳配比为20~300 μg mAb1与1 mg QB共轭。用紫外-可见(vis)吸收光谱(Lambda 45分光光度计,PerkinElmer,美国)和荧光发射光谱(LS 45光谱荧光仪,PerkinElmer,美国)对QB-mAb1共轭物进行表征。用Zetasizer Nano ZS 90(Malvern Instruments,英国)测量了纳米颗粒的流体力学直径。用H-7650透射电子显微镜(Hitachi,日本)拍摄QB的形态图像。
《2.4 QB标记的等温核酸扩增技术的制作和优化》
2.4 QB标记的等温核酸扩增技术的制作和优化
QB标记的LFIAS由样品垫、共轭垫、NC膜和吸收垫组成。由玻璃纤维制成的样品垫被浸泡在含有2%(浓度)PEG 8000和1.5%(体积分数)Tween-20的盐酸三羟甲基氨基甲烷(Tris-HCl)(0.05 mol·L-1, pH = 8.0)中,达到完全饱和,并在50 ℃下干燥24 h。共轭垫的制备方式与样品垫相似,不同的是处理液为硼酸盐缓冲液(BB)(0.002 mol·L-1, pH = 8.5),含有5%(浓度)海藻糖、0.5%(浓度)酪蛋白钠盐,0.1%(浓度)PEG 20 000和0.5%(体积分数)Tween-20,在浸泡之后,用一定体积的QB-mAb1喷洒共轭垫,在37 ℃下干燥12 h。然后,用XYZ3060分配器(BioDot,美国)将一定浓度的mAb2和1 mg·mL-1的山羊抗鼠IgG分别加入NC膜,形成测试(T)线和对照(C)线。点胶速度为1 μL·cm-1,T线和C线之间的距离约为4 mm。然后将NC膜在真空条件下于37 ℃培养12 h。根据相应的阳性样品的T线和C线的信号强度来确定T线上的最佳抗体浓度。吸收垫未经处理就被使用。所有部分被依次粘贴在聚氯乙烯(PVC)板上,重叠2 mm,以确保液体能顺利通过整个测试条。最后,用条形切割器(HGS201,杭州峰航科技有限公司)将组装的测试条切割成4 mm大小,并储存在干燥器中,用于后续的检测。
《2.5 QB标记的LFIAS进行程序检测》
2.5 QB标记的LFIAS进行程序检测
整个过程包括SD-LAMP反应和QB标记的LFIAS检测步骤。将10 μL SD-LAMP产物与90 μL磷酸盐缓冲液(PBS)(0.01 mol·L-1, pH = 7.4)混合,并用吸管将液体输送到样品垫上,使液体在毛细管力的作用下被吸收并向吸收垫迁移。一旦靶标DNA被包含在样品中,FITC和生物素标记的扩增物就可以通过抗原-抗体相互作用与QB-mAb1结合物结合,然后被T线上的mAb2包被捕获,形成夹心复合体。多余的QB-mAb1进一步迁移并与山羊抗鼠抗体在C线上发生反应。相反,如果样品中不存在靶标DNA,它将在没有相互作用的情况下流经T线,这导致在T线处没有荧光信号,但在C线处保留正信号。如果不存在C线,则认为该测试无效。15 min后,将试纸插入FIC-S1荧光条阅读机,记录T线和C线的荧光强度(FI)以定量分析物。为了消除批次变化和样本矩阵的干扰,使用HMReader 8.3软件计算FIT/FIC比。以无靶标DNA的SD-LAMP反应为对照。在相同的条件下,每个样品的测试进行三次。
《2.6 性能分析》
2.6 性能分析
利用细菌DNA模板对SD-LAMP QB标记的LFIAS的性能进行评估。共有10株ST和20株非ST(包括10种不同血清型的沙门氏菌和10种非沙门氏菌)具有相同浓度[107个菌落形成单位(CFU)·mL-1],用于评价LFIAS的特异性。使用从10倍系列稀释的ST ATCC 14028培养基中提取的DNA进行灵敏度测试,范围从107 CFU·mL-1到100 CFU·mL-1。通过绘制FIT/FIC与样品中ST的浓度的关系,制作校准曲线。检出限(LOD)由方程LOD = 3σ/S定义,其中σ是空白测量的标准偏差,S是校准曲线的斜率。作为对照,分别用新设计的正向引物5′-CGTGCTTGAATACCGCCTGT和反向引物5′-AGATCGTGTCCGCTATAGGT-3′与所有DNA模板同时进行扩增。
《2.7 在食物样品中的应用》
2.7 在食物样品中的应用
本实验使用不同类型的食物,如饮用水、橙汁、生菜和鸡肉,与ST混合得到加标样品,测试了SD-LAMP QB标记的LFIAS的适用性。简而言之,本研究使用PB(0.01 mol·L-1, pH = 7.4)对液体样品(包括饮用水和橙汁)进行100倍稀释,以便进一步使用。至于固体样品(生菜和鸡肉),本研究使用90 mL PB(0.01 mol·L-1, pH = 7.4)将10 g样品均质到无菌袋中,然后孵化30 min。将所有的食物样本离心以去除食物残渣,使用ST ATCC 14028人工感染上清液,以获得107~100 CFU·mL-1的最终浓度。对照组样品没有加注ST ATCC 14028。最后,使用SD-LAMP QB标记的LFIAS方法对加标样品进行单独分析。食物样品购自广州当地的一家超市,并通过标准的培养方法确认不含ST。
《3、 结果和讨论》
3、 结果和讨论
《3.1 SD-LAMP的可行性》
3.1 SD-LAMP的可行性
4条引物(F3、B3、FIP和BIP)和SD探针被用来扩增和检测ST特异性DAN序列(见表1和附录A中的图S1)。如附录A中的图S2所示,本研究在阳性反应中观察到梯状条带和白色沉淀物,但在阴性和空白对照中未观察到,表明该SD-LAMP扩增体系是可行的。相反,标准LAMP产生了虚假的扩增子(如附录A中图S3的阴性对照)。实时SD-LAMP还揭示了靶标与SD探针的结合引发了链置换反应,该反应将导致FD从SD探针上移位,从而激活FD上的荧光团(见附录A中的图S4)。因此,SD探针在LAMP中的应用并不影响扩增反应,并且可以区分假阳性扩增产物和在没有特定靶标DNA的情况下产生的引物扩增伪迹。
《表1》
表1 本研究中使用的引物的序列
| Primer type | Sequence (5′ to 3′) | Length base pair (bp) |
|---|---|---|
| SD-LAMP a | ||
| F3 | AGCCGCATTAGCGAAGAG | 18 |
| B3 | GCGGTCAAATAACCCACGT | 19 |
| FIP | Biotin-ACCTGCAGCTCATTCTGAGCAGGGCTCCGGTAATGAGATTGG | 42 |
| BIP | FITC-GAAAAGGACCACAAGTTCGCGCTCAGTGAGCATGTCGACGAT | 42 |
| Fd | CTGCTCAGAATGAGCTGCAGGT | 22 |
| Real-time SD-LAMP | ||
| F3 | AGCCGCATTAGCGAAGAG | 18 |
| B3 | GCGGTCAAATAACCCACGT | 19 |
| FIP | BHQ1-ACCTGCAGCTCATTCTGAGCAGGGCTCCGGTAATGAGATTGG | 42 |
| BIP | GAAAAGGACCACAAGTTCGCGCTCAGTGAGCATGTCGACGAT | 42 |
| Fd | CTGCTCAGAATGAGCTGCAGGT-FAM | 22 |
《3.2 QB-mAb1的表征》
3.2 QB-mAb1的表征
本研究基于耦合方法,将QB与抗FITC单克隆抗体耦合,制备QB-mAb1共轭物。如图2(a)所示,随着大量CdSe/ZnS QD嵌入聚合物基质中,QB呈准球形;QB具有良好的均匀性和分散性。为了确认共轭过程,本研究使用紫外-可见吸收光谱和荧光光谱图像对自由和生物共轭的QB进行了研究。图2(b)显示了紫外-可见吸收光谱。从图中可见,QB-mAb1的紫外-可见吸收峰在278 nm附近有一个特征性的抗体峰,而QB没有,表明该抗体已与QB结合。这在图2(c)中也可以观察到,因为发射带的位置在与mAb1结合时没有明显移动,但FI下降。这些现象被认为是由围绕着mAb1的QB有机层造成的。此外,由于QB-mAb1共轭物比同批次的QB大,在琼脂糖凝胶电泳过程中,QB在凝胶中的迁移速度比QB-mAb1快(见附录A中的图S5),而且平均流体动力学颗粒尺寸增大(见附录A中的图S6)。这些结果表明,QB-mAb1共轭物制备成功,可用于SD-LAMP产品的LFIAS检测。
《图2》
图2 QB和QB-mAb1共轭物的特征。(a)合成的QB的TEM图像;(b)自由QB(黑线)和QB-mAb1共轭物(红线)的紫外-可见吸收光谱;(c)荧光发射光谱。关于本图例中对颜色的解释,请参考本文的网络版。a.u.:任意单位。
《3.3 实验条件的优化》
3.3 实验条件的优化
为了使SD-LAMP QB标记的LFIAS达到最佳的分析性能,本研究对三个关键因素进行了优化,即QB-mAb1的性质、标记溶液在共轭垫上的加入量,以及T线上抗体的浓度。首先,与QB结合的mAb1的量对QB-mAb1的结合能力有很大影响。如果mAb1的量太少,灵敏度就会降低。但是,如果用量过高,QB-mAb1的化学稳定性和胶体稳定性会降低,导致粒子聚集。设定QB浓度为1 mg,分别测试mAb1浓度为20 μg、50 μg、100 μg、150 μg、200 μg、250 μg和300 μg时,mAb1与QB的比例的影响。如附录A中图S7(a)所示,在较低的浓度下,共轭溶液的FI随着mAb1浓度的增加而急剧增加,在250 μg·mg-1时达到最大值,随后又下降。因此,选择250∶1(μg∶mg)作为制备QB-mAb1的最佳共轭比。接下来,本研究调查了标记量对LFIAS的影响。本研究将不同体积(2 μL、4 μL、6 μL、8 μL、10 μL和12 μL)的QB-mAb1加入每个共轭垫的1 cm处,并记录T线和C线的FI。附录A中图S7(b)显示了FIT/FIC比率与不同标记量之间的关系。在1 cm的共轭垫上加入8 μL QB-mAb1,可提供令人满意的反应,此时FIT/FIC比值最高。此外,为了进一步改善QB标记的LFIAS的荧光反应,本研究对涂在T线上的mAb2的浓度进行了优化。本研究在1~4 mg·mL-1的范围内评估了不同浓度的mAb2。如附录A中图S7(c)所示,随着mAb2浓度的增加,T线的FI增加到3 mg·mL-1,达到一个平稳状态。同时,C线的FI相对较高。基于这一分析,本研究选择了2 mg·mL-1的mAb2作为T线的最佳浓度。
《3.4 检测的特异性》
3.4 检测的特异性
特异性结果如图3所示。正如预期的那样,只有ST菌株在T线和C线上显示出高QB荧光信号,而非ST菌株和空白对照在T线上没有观察到荧光信号。此外,LFIAS的结果与聚合酶链反应和SD-LAMP的琼脂糖凝胶结果一致,表明ST检测是准确的。因此,本研究的方法表现出非常高的特异性,这可能要归功于SD探针的应用和LFIAS的捕获能力。
《图3》
图3 QB标记的LFIAS检测ST的特异性。评估是基于PCR(i)和SD-LAMP(ii)产物的电泳分析以及通过QB标记的LFIAS(iii)的检测。(a)来自靶标沙门氏菌的DNA模板[泳道1~10:ATCC 14028、FSCC(I) 215588、FSCC(I) 215635、FSCC(I) 215655、FSCC(I) 215189、FSCC(I) 215125、FSCC(I) 215141、FSCC(I) 215031、FSCC(I) 215036的ST ]。(b)来自非靶标沙门氏菌血清的DNA模板(泳道1~11:ST, S. Enteritidis, S. Derby, S. Indiana, S. Stanley, S. Agona, S. Infantis, S. Rissen, S. Albany, S. London, S. Meleagridis)。(c)来自非沙门氏菌菌株的DNA模板(泳道1~11:ST、大肠杆菌、阪崎弯曲菌、副溶血性弧菌、金黄色葡萄球菌、铜绿假单胞菌、蜡样芽孢杆菌、单核细胞增多性李斯特菌、空肠弯曲菌、小肠结肠炎耶尔森菌和奇迹变形杆菌);泳道C:空白对照;泳道M:DL2000 DNA标志物。
《3.5 检测灵敏度》
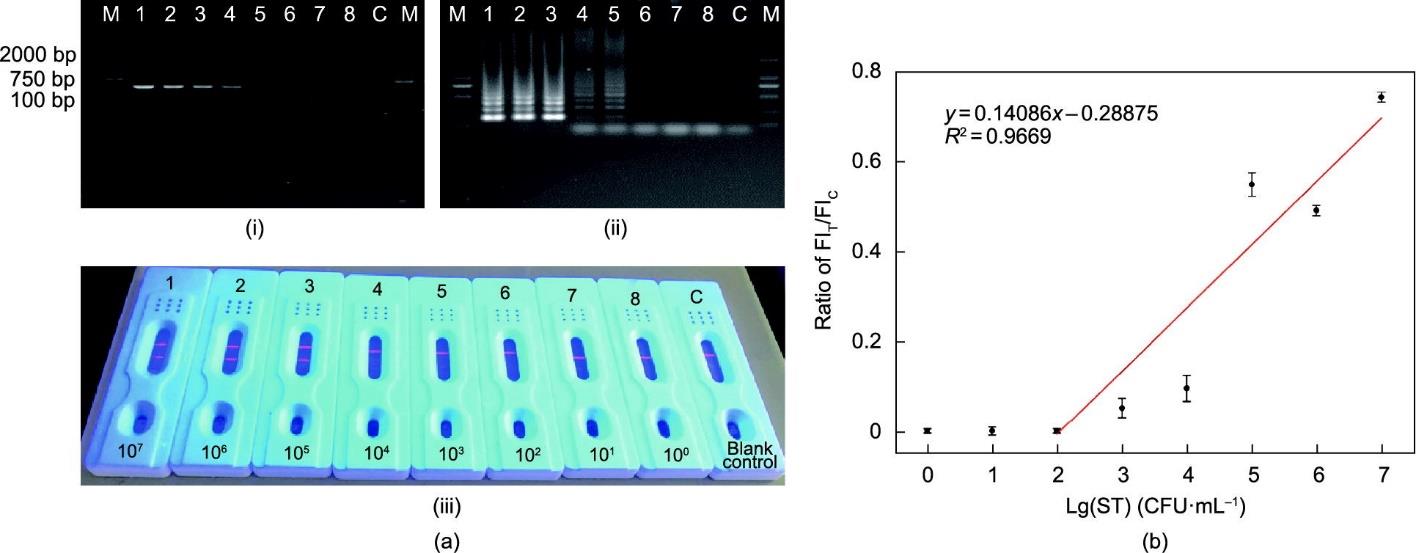
3.5 检测灵敏度
如图4(a)所示,试条的荧光照片清晰,T线的亮度随着细菌浓度的增加而增加。LFIAS的视觉LOD为103 CFU·mL-1,定义为在紫外线下可以看到的最低细菌浓度。通过分析T线和C线的FI,确定细菌标准溶液相对于其浓度的FIT/FIC值,获得了校准曲线[图4(b)]。在102~107 CFU·mL-1范围内有良好的线性关系,相关系数(R2)为0.9669,计算的LOD值为10-1 CFU·mL-1。此外,利用相同的扩增产物,比较了QB标记的LFIAS和传统的AuNP标记的LFIAS的灵敏度。根据附录A 中图S8所示的结果可知,AuNP标记的LFIAS的视觉LOD为104 CFU·mL-1,其灵敏度是QB标记的LFIAS的1/10。基于QB的荧光方法可以在相对较低的LOD下提供比其他分析方法,如流式细胞术(104 CFU·mL-1) [26]和表面等离子体共振(105 CFU·mL-1)[27]更好的灵敏度。在其他研究中,应用LAMP和LAMP-LFISA检测不同靶标物种已显示出与当前研究大致相当的灵敏度。例如,Wachiralurpan等[28]报道了LAMP法检测纯培养物中单核细胞增多性李斯特菌的灵敏度为2.82 × 103 CFU·mL-1。已有研究表明,LAMP-LFISA的LOD低于本研究中的LOD,报道的LOD分别为20 CFU·mL-1 [29]和6.7 CFU·mL-1 [30]。本研究认为,这些差异可能反映了不同的成分,包括优化的系统和浓度的变化,如DNA模板的加入量。一些研究规定LAMP [31]使用1.5 μL的DNA模板,而其他方法需要5 μL的DNA模板[32‒33]。此外,与普通LAMP-LFISA相比,本文中方法的另一个优势是在LAMP系统中添加了SD探针,缓解了LFISA中的虚假放大和非特异性检测问题,提高了LAMP在实验室外的利用率。
《图4》
图4 QB标记的LFIAS对基因组DNA的灵敏度。(a)通过PCR(i)、SD-LAMP(ii)和QB(iii)标记的LFIAS进行灵敏度测试的结果,使用来自ST ATCC 14028的纯化靶标DNA的10倍连续稀释液。1~8泳道:107~100 CFU·mL-1模板DNA;C泳道:空白对照;M泳道:DL2000 DNA标志物。(b)使用QB标记的LFIAS进行ST检测的校准曲线。误差条代表三次重复实验的标准偏差。
《3.6 食物样品中的检测》
3.6 食物样品中的检测
为了进一步证明本研究的方法对食物样品分析的适用性,使用饮用水、橙汁、生菜和鸡肉。测试条的图像如图5所示。T线的FI随着添加浓度的降低而逐渐褪色,这与上述的标准细菌溶液的结果一致。ST在饮用水、橙汁、生菜和鸡肉中的视觉LOD分别为103 CFU·mL-1、104 CFU·mL-1、104 CFU·mL-1和105 CFU·mL-1。与纯细菌溶液中的LOD相比,灵敏度的降低是由于SD-LAMP反应效率的降低或共轭垫上更多的残留QB-mAb1,表明该方法对食物样品中的ST检测有效,或者对结果几乎没有基质影响。此后,本研究进一步分析了观察数据与实际数据的相关性(在被测样品中加入低、中、高水平的标准分析物溶液),表2中显示的结果表明,加标ST的平均回收率在85%~110%之间,相对标准偏差(RSD)值均低于7.8%。
《图5》
图5 QB标记的LFIAS对食物样品中ST的检测结果,红色矩形框代表最低视觉LOD。(a)饮用水;(b)橙汁;(c)生菜;(d)鸡肉。
《表2》
表2 本文所提方法对食品样品中加标ST的回收效率
| Sample | Spiked (CFU·mL-1) | Recovery (%) | RSD (%, |
|---|---|---|---|
| Potable water | 1.41 × 107 | 90.78 | 2.3 |
| 1.41 × 105 | 94.33 | 3.2 | |
| 1.41 × 103 | 92.07 | 4.2 | |
| Orange juice | 5.60 × 107 | 94.29 | 4.7 |
| 5.60 × 105 | 89.21 | 7.8 | |
| 5.60 × 103 | 88.98 | 6.6 | |
| Lettuce | 2.40 × 107 | 93.38 | 3.8 |
| 2.40 × 105 | 105.11 | 5.3 | |
| 2.40 × 103 | 85.25 | 4.8 | |
| Chicken | 1.35 × 107 | 110.21 | 5.3 |
| 1.35 × 105 | 90.63 | 4.7 | |
| 1.35 × 103 | 85.00 | 6.5 |
总的来说,本研究新开发的方法可以在适当稀释后用于对食物样品中的细菌进行分析,具有较高的准确性和灵敏度。一些样品预处理步骤,如选择性富集培养[34]和免疫磁性分离技术[35]在基质应用前使用时可以增加相关分析物。这种方法的局限性在于无法区分存活的细胞和死亡的细胞,因为检测靶标是自由DNA。然而,对于DNA结合染料,如一氮化乙锭(EMA)和一氮化丙锭(PMA)[36],如果在提取基因组DNA进行SD-LAMP反应之前将这些染料加入样品中,就可以克服这个局限。
《4、 结论》
4、 结论
综上所述,本研究构建了QB标记的LFIAS与SD-LAMP相结合的快速检测ST的方法。本研究所提出的方法采用QB标记的LFIAS作为信号输出平台,而SD-LAMP反应则是为了进一步提高特异性。研究结果显示,LOD达到10-1 CFU·mL-1,线性范围为102~107 CFU·mL-1。本研究将该方法应用于食物样品中ST的检测,并获得了令人满意的结果。与现有方法相比,本研究开发的方法有以下优点:将SD探针应用于LAMP,减少了假阳性结果的发生;②在LFIAS中采用QB而不是AuNP作为探针,提高了灵敏度。总的来说,目前的方法不仅简单方便,省去了对复杂设备的要求,而且可以进行快速、灵敏的分析,得到定性和定量的结果。通过改变靶标LAMP引物,可以扩展这种方法,将该方法用于检测其他类型的病原体。在未来的研究中,将增加快速的样品预处理步骤,以提高系统的灵敏度,并探索SD探针与其他等温核酸扩增技术的组合,实现无设备检测。凭借其出色的性能,相信这种方法可以被很容易地应用于更多领域的基因检测。

















 京公网安备 11010502051620号
京公网安备 11010502051620号




