《1. 引言》
1. 引言
以细胞生物学、生物化学、分子生物学和组织学为基础,通过各种研究方法显著提高了对于肝脏等实体器官的复杂生物学的理解。传统方法(如通过组织学和免疫组织化学法评估组织结构形态)不仅提供了宝贵的知识,还揭示了治疗各类肝病的改进方案。此外,最新的技术进步或许有助于深化对生理和病理组织结构以及体内动态过程的认识。这类新方法包括单细胞靶向转录组分析、基于质谱的代谢物和蛋白质表达研究,以及二维(2D)和三维(3D)成像方面取得的重大进展。本文将简要回顾基于成像的肝脏研究领域取得的最新进展,同时强调在2D和3D领域应用高维多参数成像,并实现体外和体内动态延时成像的可能性(图1)。此外,还将重点介绍上述技术在有关肝脏生物学和肝病的具体研究课题中的一些潜在应用。
《图1》
图1 肝脏研究中最先进的表型和功能器官成像方法。以外植/活检组织和常规切片技术为基础,可通过多重组织技术(包括成像质谱流式和多重荧光术)在2D空间分辨率下生成供组织细胞术参考的高维表型数据。使用化学物质实现组织透明化后,可通过细胞断层扫描以3D形式展示器官和发育中的生物体内复杂的微组织结构。组织的透明化通过匹配折射率并去除光衍射结构和光吸收生色团实现。活体显微镜检术适用于以高时空分辨率观察数小时内的动态生物过程,如细胞浸润、细胞活化和细胞间相互作用。本图由BioRender.com创建。
《2. 多种研究方法——成像流式》
2. 多种研究方法——成像流式
过去数十年来,人们始终从传统的组织学角度描述组织的病理性变化,如临床和肝脏实验样本中的免疫细胞浸润。常规的整体染色、免疫组织化学法或免疫荧光成像曾经是用于组织学描述的重要方法,但这类方法只能同时处理极少量标志物。随着单细胞分析时代的到来以及对不同细胞亚群的深入理解,传统方法已无法充分解读未知的复杂生物学。因此,需要一种涉及多参数、可视化的方法来描述细胞类型、效应分子和潜在的原位遗传途径之间的复杂关系。现有的某些方法允许通过基于荧光的高复合物组织学分析福尔马林固定石蜡包埋(FFPE)组织或冻存组织。这些方法各有利弊,必须综合考虑。
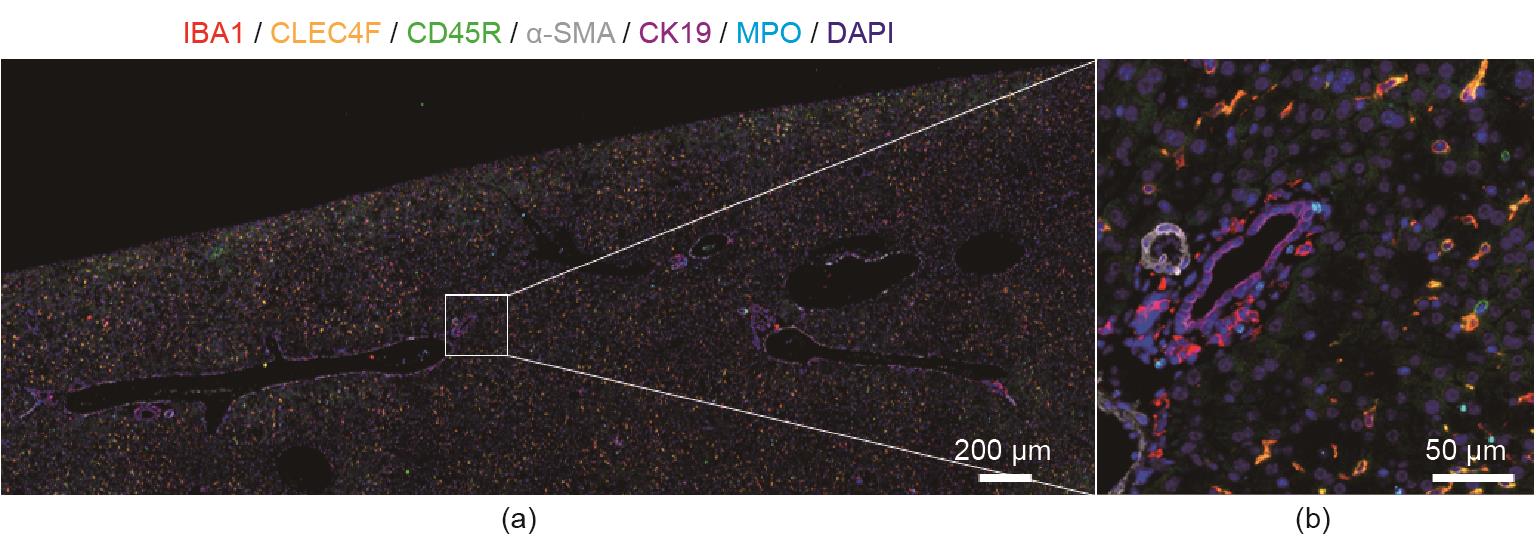
酪酰胺信号放大技术是一项重大进展,用于扩展多重免疫染色应用范围(通常多达8种抗体)[1]。如使用多重免疫荧光法,可在循环免疫染色并连续去除信号后对齐数字图像,从而克服该方法的局限性(如有限的抗体数量以及研究过程中失去抗体组设计的灵活性)[2‒3]。对检测抗体进行化学漂白、光化学漂白或化学剥离可去除荧光信号。但此类方法需对样本进行额外处理,可能会改变组织完整性或靶点抗原性;此外,这类方法涉及多步过程,易因各循环信号未完全去除以及抗原丢失或受到干扰而产生误差。尽管如此,仍可通过优化方案解决上述问题。我们描述了一种通常能从小鼠或人类肝脏的单个存档石蜡包埋切片中获得12~16个参数的多重染色方案(图2)[2]。光学分辨率主要受限于数据采集成像系统。因为大部分方法依靠传统的宽场显微镜实现,所以分辨率限定范围为300 ~500 nm。
《图2》
图2 连续多重免疫荧光染色的典型图像。如前所述[
成像质谱流式使用金属同位素标记的一抗,同时进行多因子染色,并且可允许同时标记超过30个参数。该方法具有极高分辨率和复杂性,允许根据单张组织切片快速评估组织结构和细胞浸润情况;其类似于高端流式细胞术或质谱流式,即飞行时间细胞计数法(CyTOF),适用于无偏多因子细胞团数据分析[4]。为便于释放组织中的金属同位素以进行分析,成像质谱流式通过激光消融确定空间分辨率(可达1 µm)。
成像质谱流式的主要缺点在于需提供专用检测设备,以及因缺少标准试剂导致成本上涨(表1)。该技术还需针对具体的科学问题单独建立同位素标记的抗体组。根据质谱分析,由于逐点激光诱导消融的过程复杂,使用成像质谱仪可获得的有效视野最大仅限于几平方毫米。与之相比,多重荧光成像技术使用可普遍获取的标准多克隆或单克隆抗体作为共轭试剂直接使用,或与二抗联合使用。在开展大多数课题研究时,可使用设置为多重模式的标准荧光显微镜进行数据采集。因此,该方法适用于大部分研究机构。
《表1》
表1 不同成像平台概述
| Imaging method | Applications and strengths | Limitations |
|---|---|---|
| Histological multiplexing | • Precise segregation of cells • Small sample amounts (e.g., biopsy) needed for multiparameter analysis • High spatial resolution and precise signal allocation • Can be combined with RNAscope and fluorescence • Allows staining of cells, intracellular structures, and extracellular matrix | • Lengthy protocol for fluorescence multiplex • High cost for imaging mass cytometry • Validating antibodies required to target antigens and structures • Complex data structure/high demand on post-processing • Information only limited to the thickness of the section (2D) |
| Cellular tomography | • Deep tissue imaging with the potential to visualize complex anatomical structures in 3D • Applicable to all tissue types and organs: Clearing chemistry can be adopted to the amount of tissue autofluorescence, lipid content, and opacity | • Lengthy protocol with the need for individual optimization for each scientific question/organ • Need for specialized software for complex 3D rendering and visualization • Specifically targeting structures and cells for staining, finding matching antibodies • Need for specialized imaging equipment (light sheet/laser scanning microscope) • Balance between optimal clearing and staining |
| Intravital microscopy | • Visualization of dynamic processes • Functional imaging (metabolic and cell biological) feasible • Cellular adhesion, infiltration, and interaction • Tracking of infection and microbial spreading • Cell signaling and survival | • Penetration depth (< 100 µm) • Successful labeling of target structures and cells • Number of factors for simultaneous imaging • Need for maintenance of physiological conditions • Optimization of surgery protocol and surgical trauma • Validating antibodies required to target antigens and structures |
《3. 视野清晰——化学组织透明化和3D组织断层扫描技术的优势》
3. 视野清晰——化学组织透明化和3D组织断层扫描技术的优势
2D技术的使用,如传统的切片组织学,通常不足以将器官内部复杂的组织构造以及空间相关性可视化。这会提高遗漏局部病理事件(如小肿瘤结节成形、局部炎症或局部感染)或较大范围疾病(如脉管系统或组织结构畸形)的可能性。化学组织透明化技术与使用光片、共焦或多光子显微术的高分辨率3D断层扫描技术相结合,可弥补上述缺点(表1)。组织透明化处理是组织固定后实施的多步过程,包括逐步去除光吸收生色团和散射面(如脂膜)并进行折射率匹配。组织透明化处理会使组织整体透明,透明度可达数毫米(具体取决于使用的透明剂)[5]。3D细胞断层扫描技术面临的最大挑战在于选择合适的透明化程序,以及必须对靶结构进行对比和染色。虽然溶剂型透明化方法[如苯甲醇/苯甲酸苄酯(BABB)或iDisco ]能快速有效地使几乎所有组织透明化,但同时会导致组织脱水,致使组织形态发生重大改变,并破坏使用荧光标记抗体或纳米抗体进行特异性染色所需的靶蛋白结构[6]。此外,醇类往往会破坏荧光蛋白,导致荧光猝灭以及荧光信号部分或完全丢失。水性透明化方法(如SCALE、Clarity或CUBIC)通常需要更长时间才能达到与溶剂型透明化方法相同的半透明度;但一般而言,水性透明化方法经证实能保持较好的组织结构完整性以及报告蛋白[如绿色荧光蛋白(GFP)、红色荧光蛋白和其他蛋白]的内源荧光(图3)[7]。既定的染色程序主要通过浸泡使抗体进入组织,或体内注射荧光标记的抗体,从而依靠蛋白质结构的抗体或纳米抗体靶向性实现染色。光学分辨率与获取显微数据的成像系统密切相关。光片显微镜通常允许在较深组织层中依靠肉眼观察到具有更高各向同性的荧光,其光学分辨率范围通常为5~10 µm。激光扫描系统(包括单光子共聚焦和多光子)可提供更高的光学分辨率,最大范围为200 ~500 nm。但当组织穿透深度超过500 ~700 µm时,二者性能均显著下降,需进行数据后处理和归一化。
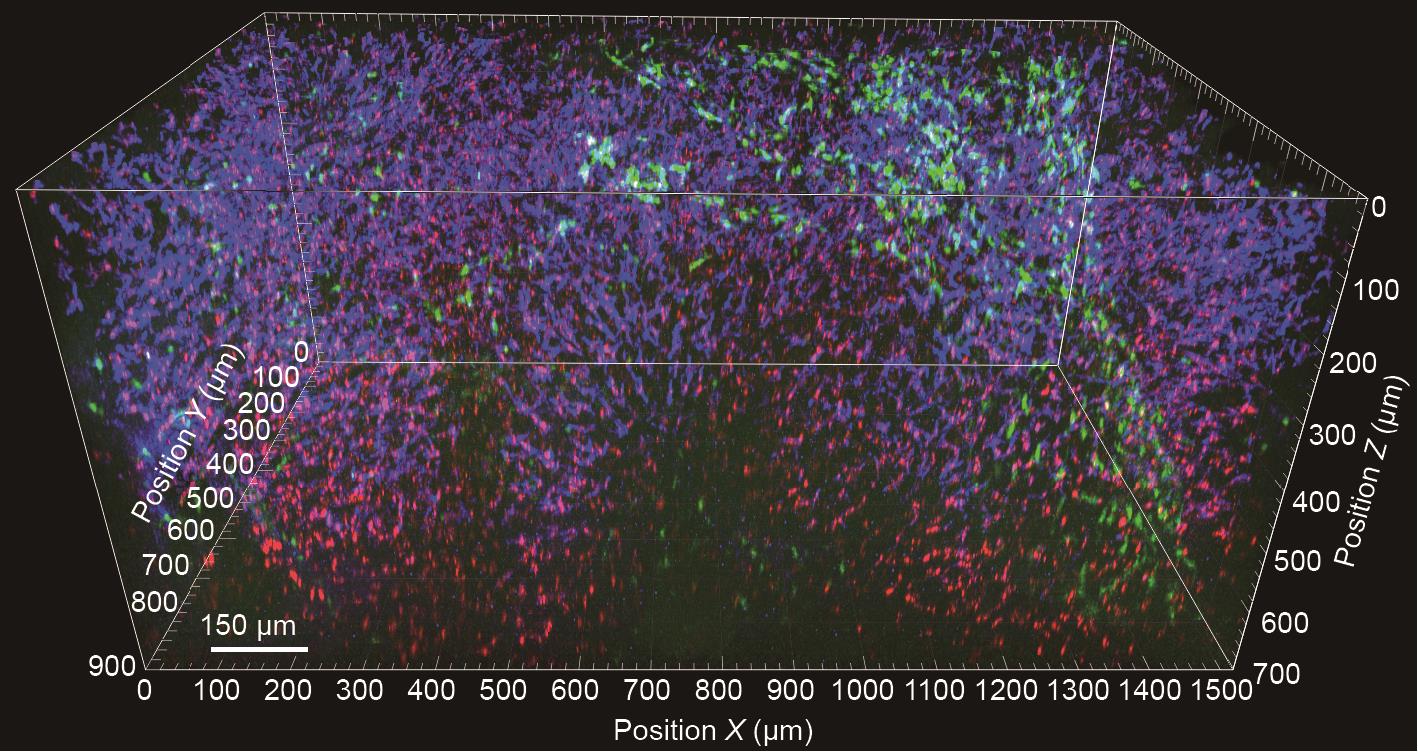
《图3》
图3 离体组织透明化处理后的肝脏组织3D重建。在移取组织前30 min对健康的CX3CR1.gfp小鼠活体注射F4/80抗体(蓝色)和0.5 µm荧光微球(红色),之后分离肝脏组织。将样本固定在4%福尔马林溶液中,随后立即使用CUBIC实施组织透明化处理。使用LaVision Trimscope I多光子显微镜获取图像。
我们的团队根据不同的研究方法开展的数项研究[5,7]和工作表明,尽管组织的生色团初始含量较高,但CUBIC兼具突出的分子结构保存能力和高半透明度,所以最适用于肝脏3D断层扫描技术(图3)。另一种可能是依靠组织内不同自体荧光水平实现的不锈钢结构成像。这些技术与先进的成像技术相结合,如荧光寿命成像(FLIM)、光谱显微术或使用多光子显微术的二次/三次谐波可视化技术,为涉及组织内稳态和疾病的组织结构可视化开辟了另一条道路。
对组织进行化学修饰可以增强靶结构的可视化程度,也可以用来克服Ernst Abbe于19世纪根据任一给定结构的光学衍射效应所描述的物理分辨率限制。作为最新取得的技术进步之一,膨胀显微术已被引进成像领域。不同于旨在提高成像系统光学分辨率的各种超高分辨率显微术,如随机光学重构显微术(STORM)、受激发射损耗显微术(STED)、结构照明显微术(SIM)等,膨胀显微术基于样品的受控等距化学膨胀以及荧光染色实现。简而言之,使用丙烯酰胺或丙烯酸钠等聚合物形成剂进行孵育以制备样品,这会产生聚合作用,从而使样品膨胀。该过程增加了靶分子之间的距离,从而有可能将样品结构的空间分辨率较其天然状态提高4倍[8]。
《4. 活体显微镜检术——增加空间信息的动态变化》
4. 活体显微镜检术——增加空间信息的动态变化
时差显微术是过去数十年中的常用体外检查工具,但近二十年来,体内成像开始应用于更广泛的群体。对病理生理过程、感染和免疫反应进行长期成像,有助于理解病理生理改变以及代谢和稳态保持等稳态功能引起相关事件的顺序。关于肝脏成像,我们与其他研究人员开发了几种在啮齿动物模型中进行短期和长期活体肝脏成像的专用方法[9‒11]。虽然目前最常见的应用是在感染或组织损伤后对炎症过程进行成像(取决于实际所需),但活体显微镜检术还可用于对器官功能成像,如细胞代谢(包括肝细胞代谢活动)[12]。基于荧光寿命成像,对代谢物氧化还原状态进行可视化处理即可实现该成像功能。这类代谢物包括烟酰胺腺嘌呤二核苷酸/烟酰胺腺嘌呤二核苷酸磷酸(NADH/NADPH)或黄素腺嘌呤二核苷酸(FAD),可利用其氧化或还原反应显示的不同自体荧光寿命进行可视化处理。其他功能(如胆汁排泄)可通过全身注射荧光胆汁酸即刻展开评估[13],而定性和定量血流量测定或可视化毛细血管灌注则可通过追踪注射至循环系统中带荧光标记的红细胞或较大颗粒来实现。此外,可使用三次谐波实现红细胞可视化,从而不依赖于外部标记进行量化灌注。
活体成像动态性的主要用途之一在于测定现实生活条件下的细胞募集和胞间接触(表1)。例如,肝脏即使在稳态条件下依然持续询问和培养旁路淋巴细胞,这是保持外周免疫耐受的重要机制[14]。因此,活体显微镜检术是一种独特的技术,适用于研究各类白细胞的募集、组织内的定位和移动,以及细胞间相互作用所涉及的一连串事件(图4)。为治疗传染病,活体显微镜检术可用于理解微生物组织归巢、被白细胞捕获、存活和增殖,从而在对抗传染病时就宿主与微生物之间的相互作用提供宝贵的见解[10]。因为病毒粒子尺寸较小,远低于目前使用的光学系统的分辨率,所以病毒性感染的直接可视化处理仍然面临挑战。但使用携带报告基因的转基因病毒(如GFP)至少有可能将感染细胞与未感染细胞进行可视化对比,并研究感染细胞与感染引发的后续免疫反应之间的相互作用。
《图4》
图4 小鼠四色荧光报告基因(经抗体染色)的光谱活体成像。将携带青色荧光蛋白(CFP)、GFP、黄色荧光蛋白(YFP)和红色荧光蛋白(RFP)的CX3CR1-ER-cre × R26_Brainbow2.1小鼠麻醉后行肝脏活体显微镜检术(使用带光谱检测的Zeiss LSM 980双光子激光扫描显微镜)。将针对各种巨噬细胞标志物(F4/80、Tim4、MHC-II和CD11b)的抗体注射至小鼠体内,以标记肝脏巨噬细胞亚群。(a)抗体染色;(b)荧光蛋白;(c)合并图像。
尽管活体成像具有明显的优势,但以下障碍和局限性也不容忽视(表1)。因实体组织具有不透明性,特别是肝脏等富含生色团的器官,光穿透组织(无论进出)的深度受到极大限制,即使使用红外系统(如多光子显微镜)也仅能到达表面以下50~100 µm。器官的物理稳定对确保成像质量具有至关重要的意义,并且受肝脏的解剖结构位置的限制,维持物理稳定仍然具有挑战性。因为肝脏位于膈膜和肠道之间,这两个器官均会在图像上产生严重的运动伪影。
与光透明化面临的挑战类似,突出相关结构或细胞也可能产生潜在的限制,因而需要通过表达荧光蛋白或用荧光标记的抗体进行特异性标记,而且这些抗体不能有效靶向深埋在组织内、远离循环系统的抗原。此外,因为需要在较长时间内持续取样,所以必须考虑光漂白和光毒性效应。这些效应会随着未知的组织生物学改变而显著改变实验结果。与此类似,当通过活体显微镜检术检查肝脏和其他大部分器官时,有必要通过外科手术暴露器官,以便成像。在成像过程中,麻醉、手术创伤和某些非生理性的环境条件也可能会联合影响成像结果的长期效果。上述障碍均会影响动物的生存率,并将可靠的图像采集时长限制在8 h以内[9]。可通过一种有趣的方案规避即时手术中器官暴露所产生的部分问题,该方案基于长期腹窗植入术的全新理念,能在几周内稳定探查各种腹部器官,如脾、肠、肾脏和肝脏[15‒16]。在大脑研究领域,颅窗植入术在过去数年中被广泛用于活体成像,以研究神经元的功能。先导性研究还揭示了长期脏器成像的巨大潜力,同时也收到了细胞外基质物质过度沉积或慢性炎症等示警。这些研究初步表明,对慢性疾病进展、伤口愈合、血管生成或肿瘤生长等缓慢的生物过程进行重复成像,从理论上来说具有一定的可能性。
使用现有的快速FLIM或荧光光谱检测系统,或使用阵列检测器优化时间和光学性能的近场超高分辨率检测系统,将为克服这些限制带来了前所未有的机遇,人们据此将在不久的将来对复杂的体内过程产生新的见解。
《5. 数据分析——新进展带来新挑战》
5. 数据分析——新进展带来新挑战
上述所有成像研究方法的突破均会产生大量数据,这为数据存储、处理和分析带来了现实挑战。当需要对新成像方法获得的数据开展定性和定量分析时,更有可能面临这种挑战。当前数据处理研究中采用的数字化工具包括基于特征的机器学习、降维、图像分割、无偏聚类分析、空间重构、分割和可视化[2‒3,6]。根据近期工作报道,基于深度学习和人工智能的方法正被快速用于处理从临床或实验样本中不断收集的大量信息[17]。
尽管深度学习方法总体上功能强大,但因为现有训练数据的异构性以及缺乏培养神经元网络的专用连续分类器,所以其在科学图像分析领域的应用依然相对有限。PyTorch和TensorFlow等开源平台以及Aivia等市售工具已被用于满足利用人工智能辅助图像分析日益增长的需求。截至目前,在显微图像分析的常规工作路线中实现深度学习主要面临以下困难:对信息技术的技能要求高、缺乏合适的训练数据集,以及与亟待解决的科学问题相关的个性化问题。
目前使用范围较广并且成功率较高的方法是基于用户引导的机器学习实施图像分割。目前可用的免费软件和商业化工具包括Ilastik、Weka、APEER和Intellisys [18‒19],其中大部分运行原理为,根据用户界面的输入数据生成随机森林决策树,从而产生适合图像分割的预测图,以便随后用于同类的大型图像堆栈。
开发和实施数字化工作流程和新型成像技术的人员需经专业培训,并且通常需要使用专用设备。如图像处理涉及大型复杂数据集,则需要提供具有足够计算能力的基础设施以及合适的软件解决方案;可能还需要单独开发和定制解决方案,这与单细胞分析领域的最新进展非常相似。尽管投资巨大,但为了阐明生物学的复杂性,这些投资均具有合理性,而且未来会在很大程度上通过由其产生的信息量进行补偿,这些信息可以进一步推动科学进步。
















 京公网安备 11010502051620号
京公网安备 11010502051620号




