《1、 引言》
1、 引言
由创伤和疾病造成的大段骨缺损形状各异且难以自愈合,需要植入符合个体需求的骨修复植入体。然而,常用的移植用自/异体骨数量有限,难以满足临床需求[1]。在制造方法上,由于可选材料的多样性和结构的可设计性,3D打印技术适合用于具有个性化外形和内部结构骨修复植入体的定制[2‒6]。打印植入体在临床应用案例中表现出组织修复性能,其内部连通的孔道结构适合于组织的长入并能促进骨整合[7],然而却缺乏促进血管化的功能。在大段骨缺损处,多伴随自体血管网络的破坏;植入体无血管化易导致其内部缺乏细胞生长所需的营养和氧气等,从而引起中心部位坏死和修复失败[8‒9]。因此,促进血管新生是植入体广泛应用于临床的一个主要特性需求。此外,局部血流量和营养物质的多少,与骨再生的速率存在着紧密联系[10‒11]。加速打印植入体内的血管化有望为骨重建提供充足的营养,从而加快组织修复。传统方法通过将具有促进血管新生作用的生长因子,如血管内皮生长因子(VEGF)和纤维母细胞生长因子(FGF)等装载至骨修复材料进行缓释,以直接促进血管形成[12‒13]。虽然通过材料设计可一定程度克服生长因子半衰期短和在局部难以保留导致血管新生失败的问题,然而单独生长因子却并不能促使成熟血管形成。研究表明,局部免疫细胞数量和活性是骨修复植入体能否促进血管新生的一大决定性因素[14‒15]。因此,通过调控局部免疫微环境以促进3D打印骨修复植入体的血管化是一个值得研究的方向。
近来,研究人员逐渐尝试将具有调控单核/巨噬细胞功能的生长因子和生物材料引入3D打印支架以促进血管化和骨修复[16‒19]。巨噬细胞在血管新生中起着重要作用[20‒21]。研究表明,M1型巨噬细胞可促进血管新生,M2型巨噬细胞可促进血管成熟和重构[22‒23]。设计构建顺序释放干扰素-γ(IFN-γ)和硅离子的3D打印支架可诱导巨噬细胞先向M1型极化后再向M2型极化,并在小鼠皮下包埋模型中促进早期血管新生[16]。然而,巨噬细胞的激活根据外部刺激表现为一个连续状态,M1型和M2型在其两极[24‒25]。在体内复杂微环境中,巨噬细胞的极化状态并不完全可控。此外,巨噬细胞对成骨、骨溶解和血管再生等生物学行为都具有调控作用,且相关效应机制不一[22,26‒28]。不适宜的人为调控干预可能会导致组织的损伤。因此,设计3D打印支架,精准调控巨噬细胞表型变化,以促进血管化骨组织重建的机理较复杂。
被忽略却值得关注的是,构建具有T细胞调控功能的3D打印支架同样有潜力用于促进血管化和骨组织再生。T细胞相关的适应性免疫系统在骨缺损修复和促进血管化过程中起着重要作用[29‒33]。虽然T细胞与巨噬细胞具有众多亚型,但是CD4+ T细胞的条件培养液能够显著促进人间充质干细胞的成骨矿化[31]。此外,CD4+ T细胞还被验证可在下肢缺血模型中促进动脉的形成[32‒33]。尤其是CD4+ 2型辅助性T细胞(Th2细胞)在缺血损伤中不仅能直接分泌有助于血管新生的生长因子[34],还能活化嗜酸性粒细胞分泌相关生长因子[35]。由此可见,具有局部募集和活化Th2细胞功能的打印支架能同时促进骨缺损部位的血管化和骨再生。Kwee等[36]将纳米铝/卵清蛋白(OVA)疫苗植入小鼠下肢缺血模型,并观察到释放的OVA抗原能够特异性募集Th2细胞,从而触发局部的血管新生、增加缺血肢体血液灌注并减少肌肉坏死。纳米铝颗粒作为传统疫苗载体和免疫佐剂,能够促进OVA对Th2细胞的募集和激活。然而,在应用于骨缺损部位时,OVA纳米颗粒疫苗容易快速分散进入血液循环,难以起到细胞局部募集的作用。此外,单独的纳米颗粒疫苗体系并不适合用于骨缺损治疗。因此,针对骨缺损患处特点,设计合适的OVA载体和支架结合方式,构建负载OVA疫苗的3D打印支架,进而通过局部释放OVA募集抗原特异性Th2细胞,从而促进血管化和骨组织再生。
前期研究将介孔二氧化硅微棒(MSR)与自固化磷酸钙骨水泥(CPC)结合,配制成生物墨水,成功3D打印构建了个性化骨修复支架,并发现支架中释放的硅离子可有效促进成骨[37]。本研究受T细胞对血管化的调控作用的启发,将MSR、枝状聚乙烯亚胺(PEI)和OVA通过电荷作用层层组装,构建了特异性募集Th2细胞的疫苗,进一步基于席夫碱反应将疫苗与室温下打印的含醛基钙磷基骨修复支架进行稳定的结合,设计构建了能够局部募集Th2细胞并促进血管化的3D打印骨修复支架(图1)。以MSR作为OVA的载体,疫苗体系可激活特异性Th2细胞反应[38]。通过阳性枝状聚合物PEI的修饰,MSR体系作为疫苗载体可更有效促进树突细胞的活化并增强T细胞反应[39]。在自固化磷酸钙打印墨水中引入氧化透明质酸,使得支架带上丰富醛基,含氨基的MSR/PEI/OVA疫苗可快速与之交联并稳定结合;由此实现的OVA局部缓释,可募集分泌成血管相关生长因子的Th2细胞并促进支架内血管化。体外细胞实验研究表明,支架释放的OVA迅速募集并活化树突细胞使之具有抗原呈递功能;而逐渐释放的硅离子有效促进了骨髓间充质干细胞(BMSC)的成骨分化。在体内皮下包埋模型中,负载疫苗的支架可在植入早期迅速活化和募集Th2细胞,显著促进局部血管新生。此外,在体内原位颅骨缺损修复模型中,负载疫苗的3D打印支架表现出优异的促进血管化骨再生作用。
《图1》
图1 负载疫苗的3D打印支架的构建,局部体液免疫反应激活作用和促进血管新生作用的示意图。MSR/PEI/OVA自组装疫苗共价结合于富含醛基的3D打印CPC支架,通过缓释OVA促使体液免疫反应局部激活。免疫反应的激活,可募集抗原特异性CD4+ T细胞以促进早期血管新生。OHA:氧化透明质酸;DC:树突细胞。
《2、 材料和方法》
2、 材料和方法
《2.1 疫苗的制备》
2.1 疫苗的制备
根据先前报道[37],MSR通过溶胶凝胶法,以正硅酸四乙酯为硅源合成。将40 μL浓度为50 mg·mL-1的MSR工作液与100 μL浓度为25 μg·mL-1的PEI溶液在37 ℃下混合并共孵育15 min,制备得到MSR/PEI疫苗载体。将100 μg OVA与MSR/PEI微棒载体于37 ℃恒温振荡培养箱中孵育1 h后获得MSR/PEI/OVA疫苗。上述微棒经冷冻干燥后进行理化检测。通过扫描电子显微镜(SEM; TESCAN, USA)观察MSR和MSR/PEI微棒的外形。通过比表面与孔隙率分析仪(Quantachrome, USA)以及透射电子显微镜(TEM; FEI, Japan)对MSR和MSR/PEI微棒的介孔结构进行分析。通过能谱仪(EDS; TESCAN, USA)对MSR/PEI微棒表面进行元素面扫描检测,分析PEI和MSR的结合情况。用纳米zeta电位仪(Omni, USA)分析各微棒表面的zeta电位。
《2.2 疫苗在支架上的装载》
2.2 疫苗在支架上的装载
氧化透明质酸(OHA)根据先前报道的方法稍作更改合成[39]。通过傅里叶变换红外光谱仪(FTIR; Thermo Scientific Co., USA)对透明质酸(HA)和OHA样品进行红外光谱分析。
1%(质量分数)OHA水溶液与10%聚乙烯醇(Mw = 98 000; Sigma-Aldrich, USA)水溶液混合形成富含醛基的固化黏结液。将CPC粉末与黏结液均匀混合制得可打印浆料,并装入打印机(Cellink, Sweden)料筒,在室温下进行打印。打印的支架在37 ℃、100%湿度环境中水化过夜,再经干燥处理后储存备用。
将1 mg和2 mg MSR/PEI/OVA微棒在磷酸盐缓冲液中重悬,并分别沉积在打印的CPC支架上,制备用于体外和体内实验的载疫苗支架(CPC-MSR/PEI/OVA)。用相同的方法制备负载MSR/PEI微棒的支架,作为负载疫苗载体支架(CPC-MSR/PEI)组。
《2.3 支架中OVA的释放》
2.3 支架中OVA的释放
为测定支架中OVA的释放特征,将每个支架(10 mm × 10 mm × 2 mm)置于1 mL磷酸盐缓冲液中,在37 ℃恒温环境中孵育。设置不同的时间点,收集上清液并替换等体积新鲜磷酸盐缓冲液。用Pierce Micro-BCA蛋白检测试剂盒测定各上清液中OVA浓度,计算其释放量并绘制释放曲线。
《2.4 支架中硅离子的释放》
2.4 支架中硅离子的释放
为测定支架中硅离子的释放特征,将每个支架(10 mm × 10 mm × 2 mm)置于1 mL磷酸盐缓冲液中,在37 ℃恒温环境中孵育。每隔一天收集上清液并替换等体积新鲜磷酸盐缓冲液。用电感耦合等离子体发射光谱仪(Thermo Fisher Scientific)测量上清液中硅离子的含量。
《2.5 树突细胞的分化、激活和抗原呈递性能检测》
2.5 树突细胞的分化、激活和抗原呈递性能检测
根据先前描述的方法[36],从C57BL/6J小鼠(上海吉辉实验动物饲养有限公司)股骨和胫骨收集骨髓细胞,在含10%胎牛血清(Thermo Fisher Scientific)、1%青霉素链霉素和20 ng·mL-1小鼠粒细胞巨噬细胞集落刺激因子(PeproTech, USA)的RPMI培养液(Thermo Fisher Scientific)中诱导培养树突细胞。在诱导培养的第8天收集非贴壁细胞用于实验研究。为评估支架对树突细胞活性的作用,将1 × 106 mL-1未成熟的树突细胞接种到12孔板中的支架上共培养24 h。随后,收集培养液中的树突细胞,用anti-CD11c、anti-CD86和anti-组织相容性复合体 II(MHC II)在冰上染色并使用流式细胞仪检测(BD, USA)。另外,支架上黏附的细胞用anti-MHC II染色标记特征性标记物,用4´,6-二脒基-2-苯基吲哚(DAPI)染液标记细胞核,然后,通过共聚焦显微镜(Zeiss, Germany)观察。
为评估支架对树突细胞交叉呈递功能的激活作用,将0.5 × 106 mL-1树突细胞接种到含支架的孔板中。共培养48 h后,收集上清中树突细胞,用anti-SIINFEKL-H2Kb染色并使用流式细胞仪分析。此外,支架上的细胞用anti-SIINFEKL-H2Kb染色标记特征性标记物,用DAPI染液标记细胞核,然后,通过共聚焦显微镜观察。
《2.6 用于成骨分化检测的细胞和支架浸提液准备》
2.6 用于成骨分化检测的细胞和支架浸提液准备
根据先前报道的方法[40],从C57BL/6J小鼠的股骨和胫骨中分离出小鼠骨髓间充质干细胞(mBMSC),使用含10%胎牛血清(Gibco BRL, USA)和1%青霉素/链霉素的DMEM培养液(Thermo Fisher Scientific)培养。制备大小为10 mm × 10 mm × 2 mm的CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架,每个支架逐一置于24孔培养板并用1 mL α-MEM培养液(Thermo Fisher Scientific)浸泡,每隔一天更换一次培养液。浸泡7天后,取出支架,冷冻干燥后用于后续实验。将处理的冻干的CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架按已报道的方法[37]制备浸提液,置于4 ℃保存备用。
《2.7 细胞黏附》
2.7 细胞黏附
在每个24孔板中的支架上接种5 × 104个mBMSC并共培养24 h。随后,支架经磷酸盐缓冲液清洗、4%多聚甲醛(PFA)固定、梯度乙醇脱水和恒温干燥处理制样,通过扫描电子显微镜观察细胞在支架上的黏附情况。
《2.8 碱性磷酸酶活性检测》
2.8 碱性磷酸酶活性检测
为检测支架对细胞碱性磷酸酶(ALP)活性的作用,在每个24孔板中的各组支架上接种5 × 104个mBMSC共培养,每三天更换一次培养液。培养7天后,用4% PFA固定细胞、ALP试剂盒染色,并用光学显微镜(Nikon, Japan)观察。
《2.9 细胞活性》
2.9 细胞活性
为检测支架对细胞活性的作用,在每个24孔板中接种1 × 104个mBMSC,用正常培养液培养过夜。然后,将正常培养液分别替换为CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架的浸提液。在培养一天、三天后,使用CCK-8试剂盒(Solarbio, China)检测细胞活性。用标准培养基培养的细胞作为对照组。
《2.10 实时定量聚合酶链反应检测》
2.10 实时定量聚合酶链反应检测
将mBMSC按每孔5 × 104个的密度接种于6孔板中,待生长至铺满孔板,将培养液替换为CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架的浸提液培养细胞。培养液每三天更换一次。培养14天后,用磷酸盐缓冲液洗涤细胞,Trizol试剂提取总mRNA。然后,根据说明书将mRNA转换成互补DNA。通过实时定量聚合酶链反应(RT-qPCR)检测成骨相关基因ALP、RUNX2的表达。甘油-3-磷酸脱氢酶(GAPDH)作为内参基因。引物见附录A中的表S1。
《2.11 皮下植入模型》
2.11 皮下植入模型
为进行材料体内免疫调节和血管化性能研究,制备CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA(直径6 mm,高度2 mm),植入钝性分离的皮下包埋区域(n = 6)。将接受空白手术的小鼠用作对照组(n = 6)。所有健康雄性C57BL/6J小鼠(6周龄,15~20 g)购自上海吉辉实验动物饲养有限公司。动物实验流程依据上海交通大学医学院附属瑞金医院动物伦理委员会的管理指导方针和规定执行。
《2.11.1. 体内T细胞活化和募集》
2.11.1. 体内T细胞活化和募集
植入7天后处死动物,取出支架进行固定。取出脾脏,分离出脾细胞,在37 ℃下培养一天后,用抗小鼠CD3e、CD8a和CD4(Biolegend, USA)在冰上染色,固定并通透。然后,经抗小鼠的白细胞介素-4(IL-4)和IFN-γ抗体在4 ℃下染色并用流式细胞仪检测分析。
将取出固定的支架进行脱钙、石蜡包埋和切片。切片经脱蜡、复水后分别用抗CD4和CD31(Abcam, USA)的抗体在4 ℃下孵育过夜;切片再经第二抗体和DAPI染色后,用共聚焦显微镜观察以分析支架的局部免疫调节功能。使用Image J软件(Softonic, Spain)计算平均荧光强度,对募集的细胞进行定量测定。
《2.11.2. 体内血管新生》
2.11.2. 体内血管新生
支架植入14天后,用VEVO LAZR-X多模式超声/光声成像系统(Fujifilm VisualSonics Inc.; Canada)检测支架周围和内部的血流信号。随后处死动物,取出支架进行免疫组化检测。支架样品首先经脱钙、石蜡包埋和切片处理。切片再经去蜡化、复水后用抗CD31的抗体4 ℃孵育过夜。在二抗体和DAPI染色后,用共聚焦显微镜观察。使用Image J软件计算平均荧光强度以定量分析血管新生情况。
《2.12 原位缺损修复模型》
2.12 原位缺损修复模型
为分析支架的体内成骨性能,如前面所述[41]建立一个临界颅骨缺损模型。选取8周龄健康雄性SD大鼠24只,并将这些大鼠随机分为4组:①未处理组;② CPC组;③ CPC-MSR/PEI组;④ CPC-MSR/PEI/OVA组。使用环钻在每只大鼠颅骨上制造直径为4 mm的缺损,小心植入支架(直径4 mm,高度1.5 mm)后闭合切口。材料植入8周后,处死动物,收集颅骨,经4% PFA固定用于进一步分析(n = 6)。
《2.13 micro-CT断层扫描分析》
2.13 micro-CT断层扫描分析
使用micro-CT成像系统(Bruker, Germany)对所有样本进行扫描,用于骨形成情况分析,扫描分辨率为20 μm。扫描后,用DataViewer软件(SR Research, Canada)重建三维图像。基于不同的灰度范围分别重建支架和骨[支架(灰度值175~255)和新形成的骨(灰度值120~174)分别渲染为黄色和白色]。使用DataViewer软件对新生骨进行定量计算。
《2.14 组织学分析》
2.14 组织学分析
为进行组织学分析,样品先经4% PFA固定、脱钙、石蜡包埋,成为组织切片。切片分别用苏木精/伊红(HE)和马松(Masson)三色法染色,再通过光学显微镜TE2000U(Nikon)观察。在马松三色染色结果中,显示为红色的典型骨组织被识别为成熟骨。此外,如前所述[40],对切片进行CD31免疫组化染色以分析支架中新生血管的形态。
《2.15 统计学分析》
2.15 统计学分析
为进行统计学分析,数据用平均数±标准差形式表示。不同组间数据结果的显著性差异用GraphPad Prism 5软件(GraphPad Software, USA)基于单因素方差分析方法进行计算。
《3、 结果和讨论》
3、 结果和讨论
《3.1 负载疫苗的支架》
3.1 负载疫苗的支架
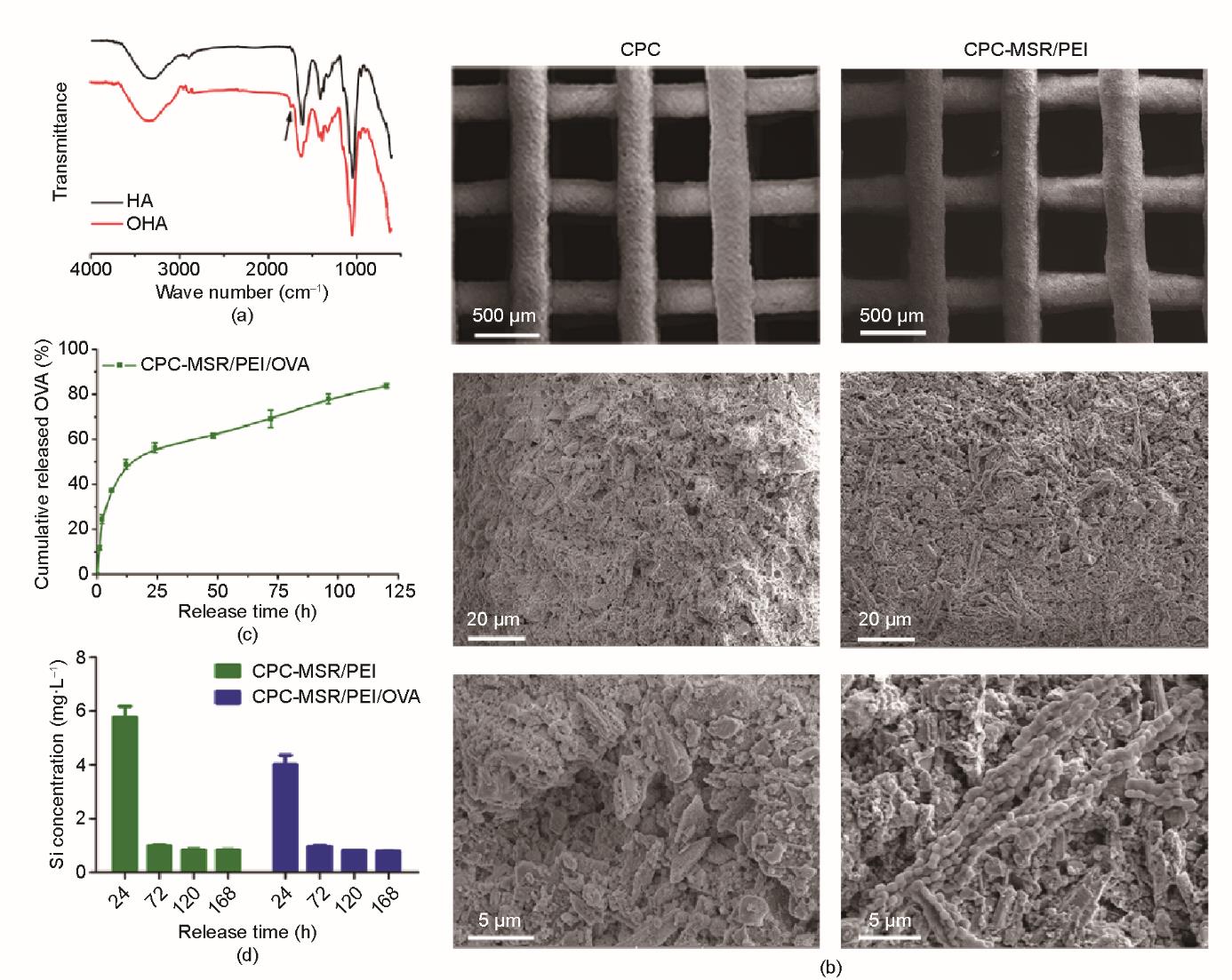
为制备负载疫苗的支架,首先制备自组装疫苗并进行分析。本研究将MSR与支状PEI溶液混合,在37 ℃环境中孵育15 min形成由PEI修饰的MSR/PEI微棒。通过透射电子显微镜观察,可见MSR和MSR/PEI微棒内典型的层状介孔[图2(a)]。根据比表面和孔隙分析结果[图2(a)],MSR和MSR/PEI的吸脱附等温线均为含H1滞后环的IV型等温线,验证了其介孔的有序特性。MSR的介孔孔径为7.8 nm,总孔容积为1.25 cm3·g-1,比表面积为849.9 m2·g-1。如先前报道所述[42],经PEI修饰的MSR/PEI介孔孔径保持不变(7.8 nm),孔容积和比表面积略有减小,分别为0.973 cm3·g-1和618.9 m2·g-1。根据SEM检测结果,MSR微棒由粒径为600 nm的棱柱状纳米棒聚集形成,其平均长度为23.2 µm,直径为3.7 µm [图2(b)]。经PEI修饰的MSR/PEI的外形没有明细变化。通过检测能谱仪面扫描图中PEI的氮(N)元素、MSR的氧(O)和硅(Si)元素的分布来分析PEI和MSR的结合情况。N、O和Si元素相近的分布验证了PEI在MSR上的修饰涂层充足且均匀[图2(c)]。由于具有较高的比表面积和孔容,且带有正电荷,MSR/PEI微棒适合作为抗原的载体实现持续释放。本研究以OVA为抗原模型,将MSR/PEI颗粒分散在OVA抗原溶液中,通过直接吸附制备了MSR/PEI/OVA疫苗微棒。MSR、MSR/PEI和MSR/PEI/OVA微棒的zeta电位分别为(-22.33 ± 1.80) mV、(29.50 ± 0.46) mV和(19.47 ± 1.70) mV [图2(d)],证实了疫苗的成功自组装[图2(e)]。在磷酸盐缓冲液中分散后,硅羟基使MSR表面具有负zeta电位。在聚阳离子PEI修饰涂层良好的情况下,MSR/PEI的zeta电位由负(MSR)变为正。带负电荷OVA的加入,使MSR/PEI/OVA的zeta电位低于MSR/PEI的zeta电位。
《图2》
图2 MSR疫苗的制备和表征。(a)MSR和MSR/PEI的N2吸脱附等温线、孔径分布和TEM图。(b)MSR和MSR/PEI的SEM图。(c)MSR/PEI的EDS面扫描结果。(d)MSR、MSR/PEI和MSR/PEI/OVA的zeta电位分析。(e)支状PEI和抗原逐次在MSR上吸附组装的示意图。
随后制备负载疫苗支架并进行检测。根据FTIR结果[图3(a)],在OHA的谱图1715.3 cm-1附近出现了一个新的与醛基对应的吸收峰,验证了合成的成功。以PVA/OHA溶液作为黏结液,使得CPC基生物墨水可以流畅地从打印喷嘴中挤出。SEM观察结果表明,打印的CPC支架具有可控的外形以及大小为500 μm相互连通良好的大孔。此外,可见MSR/PEI微棒在支架上良好分散[图3(b)]。为了避免疫苗体系被血液快速冲走,本研究设计疫苗与打印支架通过共价键结合。因此,本文仔细观察了抗原和硅离子的释放行为。根据释放实验结果[图3(c)],OVA虽在前24 h有一定突释,但随后能逐渐从支架中释放(7天)。另外,虽然每天更换释放浸泡液,释放液中硅离子浓度在72 h内从6 mg·L-1逐渐下降到1 mg·L-1,并能维持在1 mg·L-1左右[图3(d)]。综上结果表明MSR/PEI与CPC支架的结合相对稳定。
《图3》
图3 载MSR疫苗支架的表征。(a)HA和OHA的FTIR谱图。(b)CPC和负载MSR/PEI微棒CPC支架的SEM图。(c)CPC-MSR/PEI/OVA支架的OVA释放曲线。(d)释放液中的硅离子浓度。
《3.2 负载疫苗支架募集并活化树突细胞》
3.2 负载疫苗支架募集并活化树突细胞
大量树突细胞的激活与体液免疫反应的诱导作用密切相关[43‒44]。因此,本研究分析了负载MSR/PEI/OVA的支架对树突细胞募集、激活和抗原处理的作用。首先,观察树突细胞在负载疫苗支架上的募集情况。通过SEM观察发现,细胞在24 h内募集到装载疫苗的支架上并主要附着在微棒区域,而在CPC支架上仅有少量细胞[图4(a)]。然后,根据之前的报道[45‒46]用共刺激表面标记物CD86和主要组织相容性复合体(MHC)II的表达水平来评估树突细胞的激活情况。共聚焦显微镜观察结果[图4(a)]显示,募集的MHC Ⅱ+细胞分布在MSR/PEI和MSR/PEI/OVA表面,并显示出特征性的微棒形态。此外,培养液中细胞组成的流式细胞检测结果[图4(b)]显示,CPC组、MSR/PEI组和MSR/PEI/OVA组的CD11c+树突细胞表达CD86+的分别有28.7%、36.7%和39.4%,表达MHC Ⅱ+的分别有31.6%、38.7%和41%。共培养48 h后,分析负载疫苗支架对树突细胞抗原呈递的作用。通过显微镜观察,可见支架大孔中释放的MSR/PEI和MSR/PEI/OVA间有树突细胞募集[图4(c)]。此外,通过共聚焦显微镜观察,可见CPC-MSR/PEI/OVA支架上SIINFEKL-H2Kb+抗原交叉递呈树突细胞比CPC-MSR/PEI和CPC支架上多[图4(d)]。用流式细胞术检测培养液中的细胞发现,CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA组CD11c+树突细胞中表达SIINFEKL-H2Kb+的比例分别为10.5%、12.4%和15.0% [图4(e)]。作为一种潜在的生物相容性疫苗佐剂,MSR与人树突细胞共培养后能够增加CD86的表达[47]。研究结果表明,在3D打印支架上负载MSR/ PEI不仅能够促进树突细胞活化,还能促进其呈递抗原。此外,与其他两组相比,CPC-MSR/PEI/OVA组树突细胞在支架上及培养液中SIINFEKL-H2Kb+的数量最多,证实了其有效的树突细胞募集和激活功能。与其他组相比,载MSR/PEI/OVA的支架培养液中活化的细胞更多,也表明从支架中释放出来的抗原仍然保持其功能。
《图4》
图4 负载疫苗支架募集并促进树突细胞活化。(a)与CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架共培养24 h后,树突细胞的黏附(SEM图)和MHC II表面标记物(共聚焦显微镜图)表达情况。(b)流式细胞学分析树突细胞与CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架共培养24 h后的CD86、MHC II表达情况。(c)树突细胞与CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架共培养48 h后的募集情况。(d)黏附于支架表面树突细胞的SIINFEKL-H2Kb表达(共聚焦显微镜)。(e)共培养48 h后,培养液中树突细胞SIINFEKL-H2Kb表达情况的流式细胞学分析。
《3.3 负载疫苗的支架促进mBMSC黏附和成骨分化》
3.3 负载疫苗的支架促进mBMSC黏附和成骨分化
支架对骨髓间充质干细胞活性、黏附和成骨分化的作用对骨修复效果至关重要。之前研究中,发现3D打印支架释放适当浓度硅离子可促进骨髓间充质干细胞的成骨分化[37]。然而,新研发疫苗系统的生物相容性和成骨特性尚不明确。因此,本文考察了负载疫苗对mBMSC功能的影响。用CCK-8试剂盒检测材料对细胞活力的影响[图5(a)],发现mBMSC在与各组共培养期间均保持较高的存活率,没有观察到显著的差异。SEM观察发现[图5(b)],mBMSC紧密附着在各组支架表面,而CPC-MSR/PEI和CPC-MSR/PEI/OVA支架上细胞较CPC组支架上更多。此外,在CPC-MSR/PEI和CPC-MSR/PEI/OVA支架上,mBMSC表现出更伸展的形态。由于三组支架具有相似的表面结构,因此猜测细胞黏附和伸展的促进作用可能与MSR/PEI和MSR/PEI/OVA所带正电荷有关。随后,观察了负载疫苗对细胞成骨分化的影响。在骨髓间充质干细胞与支架共培养7天后检测ALP活性[图5(c)],发现CPC-MSR/PEI和MS-MSR/PEI/OVA支架上的ALP阳性面积明显大于CPC支架,证实了疫苗体系的促成骨作用。CPC-MSR/PEI组比CPC-MSR/PEI/OVA组具有更多的阳性面积;这可能与MSR/PEI/OVA的释放有关。由于加载OVA会导致MSR/PEI/OVA上可与支架上醛基结合的NH2基团减少,MSR/PEI/OVA微棒比MSR/PEI微棒更容易从支架上释放。本文也观察到了CPC-MSR/PEI/OVA支架组培养孔底部的ALP阳性细胞多于CPC-MSR/PEI支架组。CPC支架上几乎看不到ALP阳性区域,但培养孔底部的部分细胞显示出ALP活性。这与之前的报道[48]以及细胞黏附结果一致,虽然支架上黏附的细胞较少,CPC支架释放成分可轻微促进骨髓间充质干细胞成骨分化。此外,PCR结果也证实了疫苗系统对骨髓间充质干细胞成骨分化的促进作用[图5(d)],CPC-MSR/PEI组和CPC-MSR/PEI/OVA组成骨分化相关基因(RUNX2和ALP)表达显著高于CPC组。虽然CPC-MSR/PEI/OVA组基因表达低于CPC-MSR/PEI组,但差异无统计学意义。总之,以上结果表明,负载疫苗系统的支架可以促进骨髓间充质干细胞的黏附和成骨分化。为评估疫苗和CPC支架的结合作用,将装载MSR/PEI和MSR/PEI/OVA的支架用培养液浸泡和冲洗数天后开始以上实验,结果进一步证明了疫苗和支架结合的稳定性。
《图5》
图5 负载疫苗的支架促进mBMSC黏附和成骨分化。(a)mBMSC在CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架浸提液中培养一天、三天后的细胞活性。(b)细胞黏附于CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架上的SEM图。(c)mBMSC与CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架共培养7天后的碱性磷酸酶活性染色照片。(d)mBMSC与CPC、CPC-MSR/PEI和CPC-MSR/PEI/OVA支架的浸提液共培养14天后的RUNX2和ALP成骨相关基因表达水平。***P < 0.001 vs 对照组。
《3.4 负载疫苗的支架在皮下包埋模型中诱导Th2反应并促进血管新生》
3.4 负载疫苗的支架在皮下包埋模型中诱导Th2反应并促进血管新生
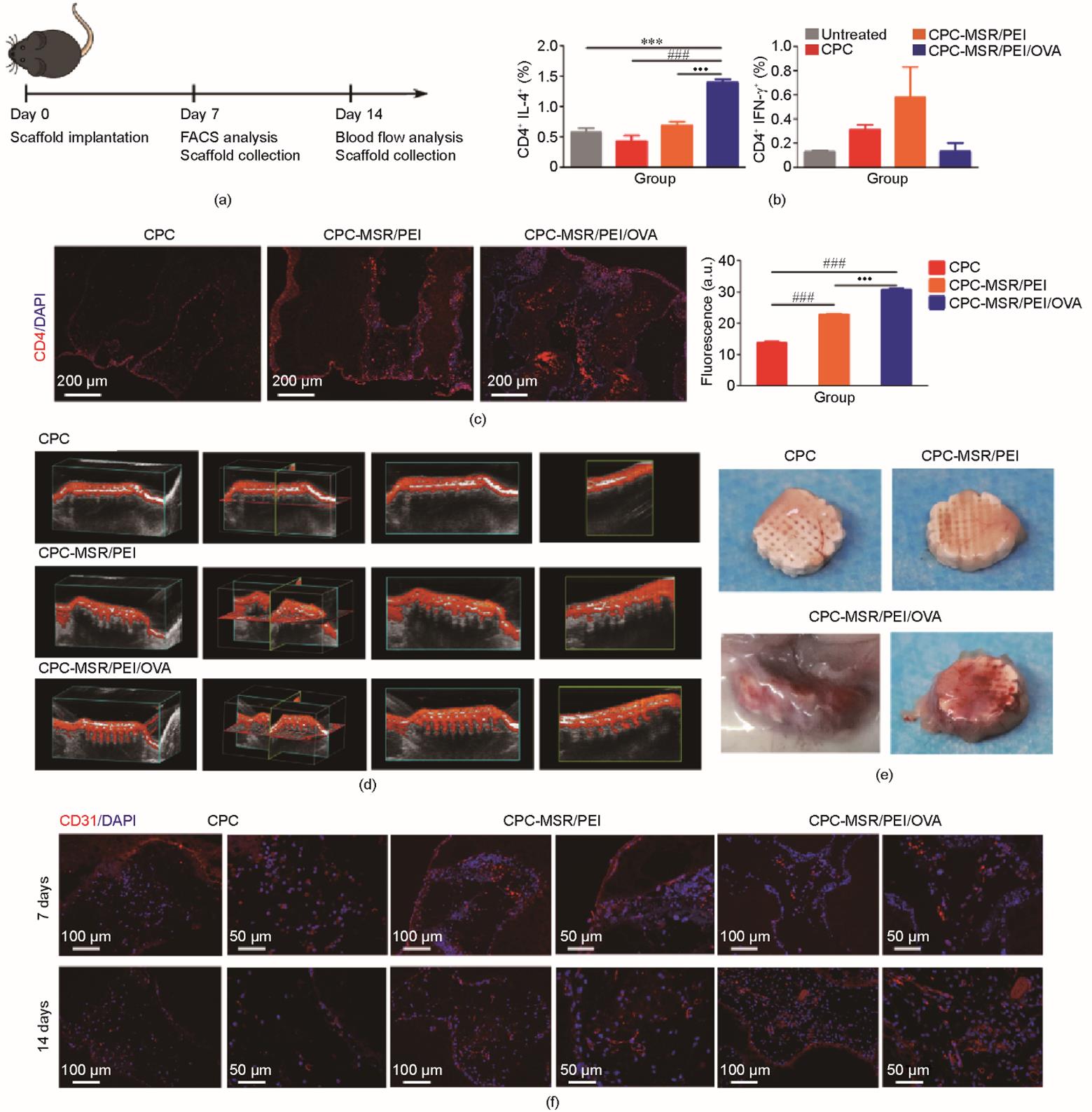
通过C57BL/6J小鼠皮下植入实验考察负载MSR/PEI/OVA的支架在体内产生和募集抗原特异性CD4+ T细胞的能力[图6(a)]。将24只小鼠随机分为4组:①未植入材料组;②植入空白CPC支架组;③植入CPC-MSR/PEI支架组;④植入CPC-MSR/PEI/OVA支架组。为分析支架引起的Th1和Th2细胞反应,在植入后第7天分离脾脏中CD4+ T细胞并分析表达IFN-γ+(一种关键的Th1细胞标记物)和IL-4+(一种关键的Th2细胞标记物)细胞的比例[图6(b)]。结果显示,CPC-MSR/PEI组IFN-γ+和IL-4+细胞比例均较高,表明MSR/PEI可同时触发Th1和Th2反应,这与之前的报道[38]一致。与CPC-MSR/PEI支架相比,CPC-MSR/PEI/OVA支架可使IFN-γ+细胞量降低、IL-4+细胞量显著增加(P < 0.001),表明CPC-MSR/PEI/OVA支架能够有效引发抗原OVA的特异性免疫反应。接着,进一步观察CPC-MSR/PEI/OVA支架募集抗原特异性CD4+ T细胞的能力。从图6(c)可见,在植入后第7天,CPC-MSR/PEI/OVA支架大孔中CD4+ T细胞的聚集量明显高于CPC-MSR/PEI支架和空白CPC支架(P < 0.001);与空白支架相比,CPC-MSR/PEI支架中CD4+ T细胞较多,这一趋势与体外支架对树突细胞活化作用实验的结果一致。
《图6》
图6 负载疫苗的支架促进抗原特异性细胞的募集和血管化。(a)皮下植入实验流程的示意图。(b)IL-4+和IFN-γ+细胞在脾脏CD4+ T细胞中的比例。(c)支架植入体7天后的CD4免疫荧光染色图和相应荧光强度。支架植入体内后14天的超声图像(d)和数码照片(e)。(f)支架植入体内7天和14天后的CD31免疫荧光染色图。***P < 0.001 vs 对照组;###P < 0.001 vs CPC组;•••P < 0.001 vs CPC-MSR/PEI组。
此前研究发现,OVA疫苗基于对CD4+ T细胞的募集作用,可有效促进缺血后肢中的血管新生和血液灌流[36]。因此,本研究又考察了CPC-MSR/PEI/OVA支架植入小鼠体内后促进血管新生的能力。首先,在植入后第14天,使用活体动物多模式超声成像系统检测支架内的血液灌注情况[图6(d)]。由于术中未发生血管破裂,因此将血流形态视为新生血管的形态。从结果来看,CPC-MSR/PEI/OVA支架大孔中自上而下可见血流信号,表明整个支架有贯通血管形成。而CPC支架仅表面可见血流信号,CPC-MSR/PEI支架仅能探测到从表面到支架中部信号。通过肉眼观察收集的支架发现[图6(e)],CPC-MSR/PEI/OVA支架周围和内部新形成的血管比其他支架更多;CPC-MSR/PEI支架比CPC支架可见更多的血管。进一步分析植入后7天和14天支架内CD31+细胞的数量和分布[图6(f)]。植入7天后,CPC-MSR/PEI和CPC-MSR/PEI/OVA支架中CD31+细胞比CPC支架中的多(见附录A中的图S1)(P < 0.001),管状结构尚未形成。植入14天后,与其他两组相比,释放OVA支架组大孔内聚集形成管状形态的CD31+细胞更多(P < 0.001)。以上研究证实,支架植入后的疫苗微环境可促进新生血管迅速长入。根据之前的报道[34],抗原特异性T细胞在微环境中分泌的IL-5和IL-10可能直接促进内皮细胞芽生,从而促进血管生成。本研究中相关作用机制将在后续工作中进行深入探究。虽然适当浓度的硅离子释放可以促进血管生成,本实验结果发现OVA特异性免疫反应产生的促进效果更强。
《3.5 负载疫苗的支架在原位大鼠颅骨缺损修复模型中促进血管化骨再生》
3.5 负载疫苗的支架在原位大鼠颅骨缺损修复模型中促进血管化骨再生
血管是骨再生过程中用于营养扩散、代谢废物排出和信号分子调控的重要器官[6,49]。支架中早期血管化是成骨的先决条件[50]。因此,在大鼠颅骨缺损修复模型中研究了负载疫苗支架对血管化骨再生的作用[图7(a)]。Micro-CT结果显示[图7(b)、(c)],植入8周后,未治疗组、CPC组、CPC- MSR/PEI组和CPC- MSR/PEI/OVA组缺损内新生骨体积比(BV/TV)分别为(5.02 ± 0.35)%、(8.78 ± 0.61)%、(11.13 ± 2.45)%、(12.18 ± 0.39)%。CPC-MSR/PEI/OVA组显示了最好的骨修复效果,具有最高的BV/TV值(P < 0.01)。从3D重建图像上看,CPC-MSR/PEI/OVA支架周围和内部新生骨比其他组多。此外,CPC-MSR/PEI支架比CPC支架具有更好的促成骨作用。随后,通过组织学分析对缺损部位的血管新生和骨组织再生情况进行更详细的分析。根据HE和Masson染色结果[图7(d)],CPC-MSR/PEI/OVA组相比CPC-MSR/PEI组形成了更多的成熟新生骨组织;而在未治疗组和CPC组中几乎未发现新生骨。此外,在CPC-MSR/PEI和CPC-MSR/PEI/OVA组,可见丰富的CD31+细胞在支架大孔和新生骨内聚集成血管。在本研究中,CPC-MSR/PEI支架的促成骨作用与预期一致。由于CPC-MSR/PEI与CPC-MSR/PEI/OVA支架周围的功能性硅离子应该在同一浓度水平,因此推测CPC-MSR/PEI/OVA支架更有效的促成骨效应与植入后快速形成的血管密切相关。
《图7》
图7 负载疫苗的支架促进原位骨缺损中血管化骨再生。(a)支架植入大鼠颅骨缺损的数码照片。(b)支架植入8周后的Micro-CT图:含支架颅骨的3D重建图、含支架颅骨的横向视图和含新生骨支架的3D重建图(白色为新生骨,黄色为支架)。(c)新生骨相对缺损的体积比[各组新生骨体积比总体积(BV/TV)](n = 3)。(d)支架的HE染色、马松染色和CD31免疫组织化学染色切片。*P < 0.05、**P < 0.01、***P < 0.001 vs 未治疗组;#P < 0.05 vs CPC组。
《4、 结论》
4、 结论
通过MSR/PEI/OVA疫苗的稳定装载,本研究成功构建了具有抗原特异性T细胞募集功能的3D打印支架。合成的MSR作为载体具有层状有序介孔和高比表面积,与枝状聚阳离子高分子PEI和抗原OVA逐层组装,制备得到了表面富含氨基的MSR/PEI/OVA疫苗。基于席夫碱基反应,疫苗与支架表面醛基共价交联并稳定结合于支架上,实现了OVA和硅离子的缓释。体外研究表明,负载的疫苗体系不仅能够募集和活化树突细胞使树突细胞处理抗原,还能促进骨髓间充质干细胞在支架上黏附、铺展和成骨分化。体内实验结果表明,负载疫苗支架逐渐释放的OVA快速募集了抗原特异性CD4+ T细胞,促进了局部血管新生并增加了支架中的血流灌注。在增加的血液供应和释放的硅离子共同作用下,负载MSR/PEI/OVA疫苗的3D打印支架还促进了骨组织的再生。总之,本研究研发了一个用于促进血管新生的抗原特异性免疫调控3D打印支架治疗平台。


















 京公网安备 11010502051620号
京公网安备 11010502051620号




