《1、 引言》
1、 引言
国际癌症研究机构2020年《世界癌症报告》(World Cancer Report)显示,癌症约造成960万人死亡,是2018年世界癌症第二大死亡原因。在这些死亡中,169万人(约20%)死于肺癌[1‒2]。研究和开发新的有效的抗癌治疗策略已成为重要问题。中医作为中国几千年的瑰宝,已成为癌症治疗的一个新的研究方向。在丰富的辨证论治和肿瘤患者治疗经验的基础上,中医提出了关于治疗肿瘤的几个主要原则[3‒4]。肿瘤患者有气血两虚、气滞血瘀、热积痰浓、湿阻等方面的证候[5]。活血化瘀是癌症治疗的治则之一[6‒9],许多科研工作者对活血化瘀的内在科学机制进行了深入的研究[10‒11]。研究表明,许多中药及其活性成分可以杀死各种肿瘤,从而证明其抗肿瘤作用。但是,为了满足个性化治疗和精准医疗的需求,对中药药理机制的深入研究确实是有必要的,这也可以更好地促进中医药的国际化。
丹参是一种活血化瘀的中草药。该药的各种现代制剂已经应用于治疗心脑血管疾病多年[12‒13]。丹参的抗肿瘤效果已被广泛研究[14‒15]。丹参及其各种提取物均具有广泛的抗肿瘤活性。丹酚酸抑制肿瘤细胞增殖,促进肿瘤细胞凋亡[16‒19]。丹参酮IIA(Tan IIA)不仅具有上述功能,还能诱导肿瘤细胞自噬[20‒24]。
自噬主要指巨自噬,是一种程序化的细胞过程。这一过程可以在不良环境中避免细胞死亡,然而过度自噬可以诱导细胞死亡。自噬在肿瘤早期抑制细胞突变或突变细胞增殖,从而抑制肿瘤生长[25],在中晚期帮助突变细胞适应肿瘤微环境中的低血供和缺氧,促进肿瘤发展[26]。当化疗杀死肿瘤细胞时,自噬可以帮助肿瘤细胞逃避化疗,参与耐药和肿瘤复发[27]。因此,在癌症治疗中是诱导还是抑制自噬仍存在争议。诱导肿瘤自噬性细胞凋亡(ACD)的药物可能为这一方向相关研究提供线索[28‒31]。
中医活血化瘀理论在治疗肿瘤方面也面临着类似的争议。已有硏究表明自噬抑制剂可拮抗Tan IIA的抗肿瘤作用。自噬是Tan IIA抗肿瘤作用的关键吗?它是如何工作的?相反,Tan IIA的特殊治疗机制是否有助于解释中医活血化瘀的理论?对这一机制的进一步研究可能有助于中医抗癌治疗机制的解释。因此,本研究探索了Tan IIA对肺癌细胞的治疗作用。
《2、 材料与方法》
2、 材料与方法
《2.1 试剂》
2.1 试剂
Tan IIA(纯度高于99%)和顺铂(DDP)(Aldrich Chemical Co.,美国)溶于二甲基亚砜。3-甲基腺嘌氨酸(3-MA)、雷帕霉素、半胱氨酸天冬氨酸蛋白水解酶(caspase)激活剂(PAC)-1和caspase拮抗剂(Z-DEVD-FMK)均来自美国Selleck Chemicals公司。Annexin V-荧光素异硫氰酸酯(FITC)/碘化丙啶(PI)试剂盒(Bestbio,中国)用于细胞凋亡检测。抗甘油醛-3-磷酸脱氢酶(GAPDH)、微管蛋白、轻链3β(LC-3B)、螯合体1(SQSTM1/p62)、Beclin-1、剪切型-半胱氨酸天冬氨酸蛋白水解酶(c-caspases)、B淋巴细胞瘤(Bcl-2)、Bcl-2相关X蛋白(Bax)(Cell Signaling Technology,美国)和辣根过氧化物酶(HRP)偶联抗体(杭州联科生物技术股份有限公司)用于蛋白质检测。
《2.2 细胞培养》
2.2 细胞培养
人肺癌细胞系A549、PC-9、HCC827和H1975在添加了10%胎牛血清(FBS)、100 U青霉素、100 μg·mL-1链霉素的DMEM培养基中培养。
《2.3 细胞活力测定》
2.3 细胞活力测定
肺癌细胞以每毫升5 × 104个细胞的浓度接种,并在适当的环境中(5% CO2, 37 ℃)培养。在加入Tan IIA和溶剂对照(0.1%二甲基亚砜)后的12 h、24 h和48 h,分别用细胞计数kit-8(CCK-8)(DOJINDO,日本)检测细胞活力。以630 nm为参比,测量了450 nm处的光密度(OD450)。将未处理的溶剂对照组设为100%,归一化数据,计算细胞活力指数。
《2.4 细胞凋亡测定》
2.4 细胞凋亡测定
1 × 105个细胞在磷酸氢磷缓冲盐水(PBS)中离心。然后加入Annexin V-FITC和Pl染色缓冲液。样品在4 ℃培养10 min,然后在FASCanto II(Becton Dickinson,美国)上快速检测后,用FlowJo X 10.0.7软件分析。
《2.5 免疫印迹》
2.5 免疫印迹
收集细胞并在冰上裂解,取上清进行蛋白质定量。样品预变性、分离、转膜。膜与抗体共孵育封闭过夜,清洗后与二抗体共孵育。用多功能凝胶成像仪(ChemiDoc XRS+; Bio-Rad,美国)成像。用lmage LabTM软件(适用于PC Version 6.1;Bio-Rad,美国)计算蛋白质表达水平的灰度值比。
《2.6 透射电子显微镜法》
2.6 透射电子显微镜法
细胞用0.5%胰蛋白酶消化,离心至Eppendorf管顶端。加入2.5%预冷戊二醛溶液固定致密细胞团块。分别置于室温、1 h和4 ℃、3 h后,将固定细胞更换到PBS中,根据标准操作程序用透射电镜(TEM)(HT7800;HITACHI,日本)检查。
《2.7 细胞自噬体检测试剂盒法》
2.7 细胞自噬体检测试剂盒法
细胞在爬片上培养,进行后续处理。去除培养基,单丹磺酰戊二胺(MDC)染色。制备1×洗涤缓冲液,并洗涤两次。细胞爬片在MDC染色工作液(1∶9稀释)中避光孵育30 min。1×缓冲液冲洗玻片,荧光显微镜(Eclipse 80i;Nikon,日本)观察。
《2.8 体内异种移植模型》
2.8 体内异种移植模型
本研究经广州中医药大学伦理委员会批准,按照美国国家科学院推荐的指导方法进行。裸鼠(18~20 g)接种A549细胞,建立移植瘤模型。右侧腋下皮下注射5 × 106个A549细胞(200 μL)。每隔一天测量并计算肿瘤体积[肿瘤体积=(宽度)2 × 长度/2]。当肿瘤超过200 m3时,将小鼠随机分组。各组给药方法如下,用0.02 mL·kg-1 PBS作溶剂对照;5 mg·kg-1、10 mg·kg-1和20 mg·kg-1 Tan IIA每天腹腔注射;2 mg·kg-1顺铂(DDP),每隔一天注射。三周后处死小鼠。
《2.9 苏木精和伊红染色》
2.9 苏木精和伊红染色
取出肿瘤组织,在10%福尔马林中固定,石蜡包埋,切片4 μm,然后按照标准操作进行苏木精和伊红(H&E)染色。
《2.10 网络药理学分析》
2.10 网络药理学分析
丹参、川芎、红花、桃仁、姜黄、巴旦木、当归、益母草的有效成分均来源于中药系统药理学数据库(TCMSP)(https://tcmspw.com/tcmsp.php)。PharmMapper服务器可以根据化合物的结构预测可能的药物靶点,为潜在靶点获得评分值,并选择一定数量的靶点进行后续研究。将自噬作为关键词,疾病相关靶点在GeneCard数据库(https://www.genecards.org)中进行检索。基因本体论(GO)富集采用David数据库,京都基因和基因组百科全书(KEGG)信号通路分析采用网络平台(KOBAS)数据库。
《2.11 统计分析》
2.11 统计分析
所有数据来自至少两次独立重复,并由SPSS进行统计分析。结果以平均值±标准差的形式呈现,p<0.05为具有统计学意义。
《3、 结果》
3、 结果
《3.1 Tan IIA对肺癌具有抗肿瘤作用》
3.1 Tan IIA对肺癌具有抗肿瘤作用
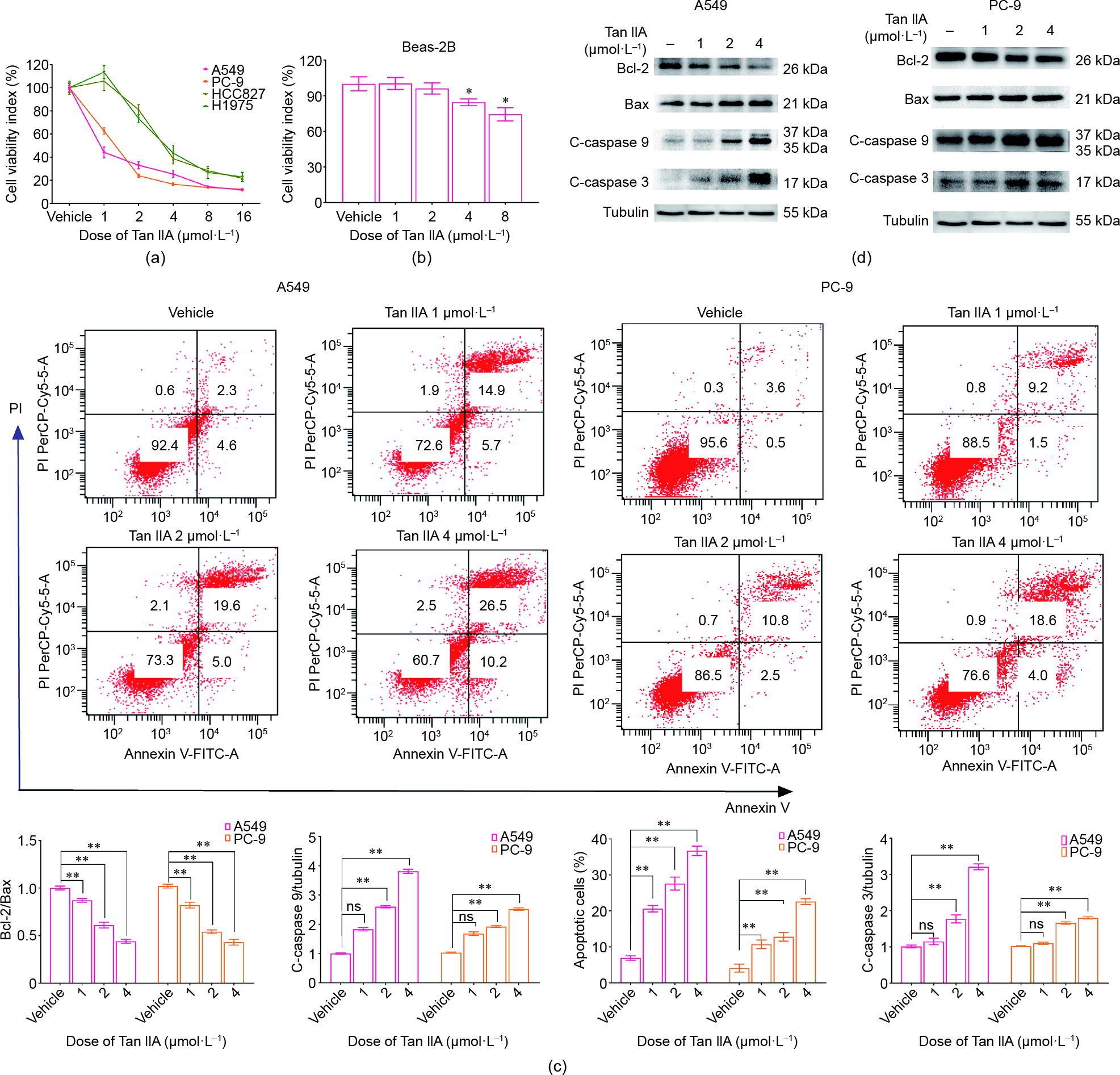
Tan IIA可抑制A549、PC-9、HCC827、H1975四种不同肺癌细胞系的增殖[图1(a)],但A549和PC-9更敏感。因此在后续实验中选择A549和PC-9作为研究对象。Tan IIA时间和剂量依赖性地抑制A549和PC-9增殖。Tan IIA作用于A549 12 h、24 h、48 h后IC50值分别为(10.04 + 2.80) μmol·L-1、(2.58 + 0.91) μmol·L-1、(0.95 + 0.40) μmol·L-1 [见附录A中的图S1(a)],而Tan IIA作用于PC-9的IC50值为(5.26 + 1.27) μmol·L-1、(1.94 + 0.57) μmol·L-1和(0.96 + 0.40) μmol·L-1 [见附录A中的图S1(b)]。在这些实验中,Tan IIA对正常肺支气管上皮细胞没有明显的毒性作用,直到浓度升高到4 μmol·L-1以上。因此,为了安全起见,除验证剂量效应关系外,后续研究中Tan IIA治疗细胞的首选浓度为2 μmol·L-1 [图1(b)]。
《图1》
图1 Tan IIA对NSCLC细胞的影响。(a)四种NSCLC细胞株(A549、PC-9、H1975和HCC827)分别在添加Tan IIA或溶剂对照的培养基中培养。CCK-8检测细胞活力。(b)培养正常肺支气管上皮细跑beas-2B进行细胞毒性评价。(c)流式细胞术研究细胞调亡。各组均为正态分布。(d)用免疫印迹法检测剪切型-半胱氨酸天冬氨酸蛋白水解酶(c-caspases)3和c-caspases 9、Bax和Bcl-2的表达。*:p < 0.05,**:p < 0.01;n = 4。ns:无意义。
Annexin V-FITC/PI染色数据显示,Tan IIA可诱导A549和PC-9细胞凋亡,呈剂量依赖性[图1(c)]。Western blot检测细胞调亡相关蛋白。Tan IIA治疗后,c-caspase 3和c-caspase 9明显升高[图1(d)]。c-caspase 8无明显变化(数据未显示)。这一发现揭示了Tan IIA可诱导肺癌细胞线粒体凋亡。Bcl-2和Bax的检测结果一致。
在Tan IIA处理后的肺癌细胞中,经TEM观察到更多的自噬体[图2(a)]。与溶剂对照组相比,Tan IIA上调LC-3B II/LC-3B I比值,下调SQSTM1/p62表达,说明细胞发生了自噬。该化合物还增加了Beclin-1的表达[图2(b)]。
《图2》
图2 Tan IIA诱导NSCLC细胞自噬。(a)Tan IIA处理后的细胞用2.5%戊二醛/0.1 PBS固定,TEM检测。图中红色箭头表示自噬体。(b)使用Tan IIA对A549和PC-9细胞中LC-3B I、LC-3B II、Beclin-1、SQSTM1/p62和微管蛋白表达进行免疫印迹分析。*:p < 0.05,**:p < 0.01;n= 3。ns:无意义。
《3.2 Tan IIA可减少荷瘤小鼠的肿瘤体积》
3.2 Tan IIA可减少荷瘤小鼠的肿瘤体积
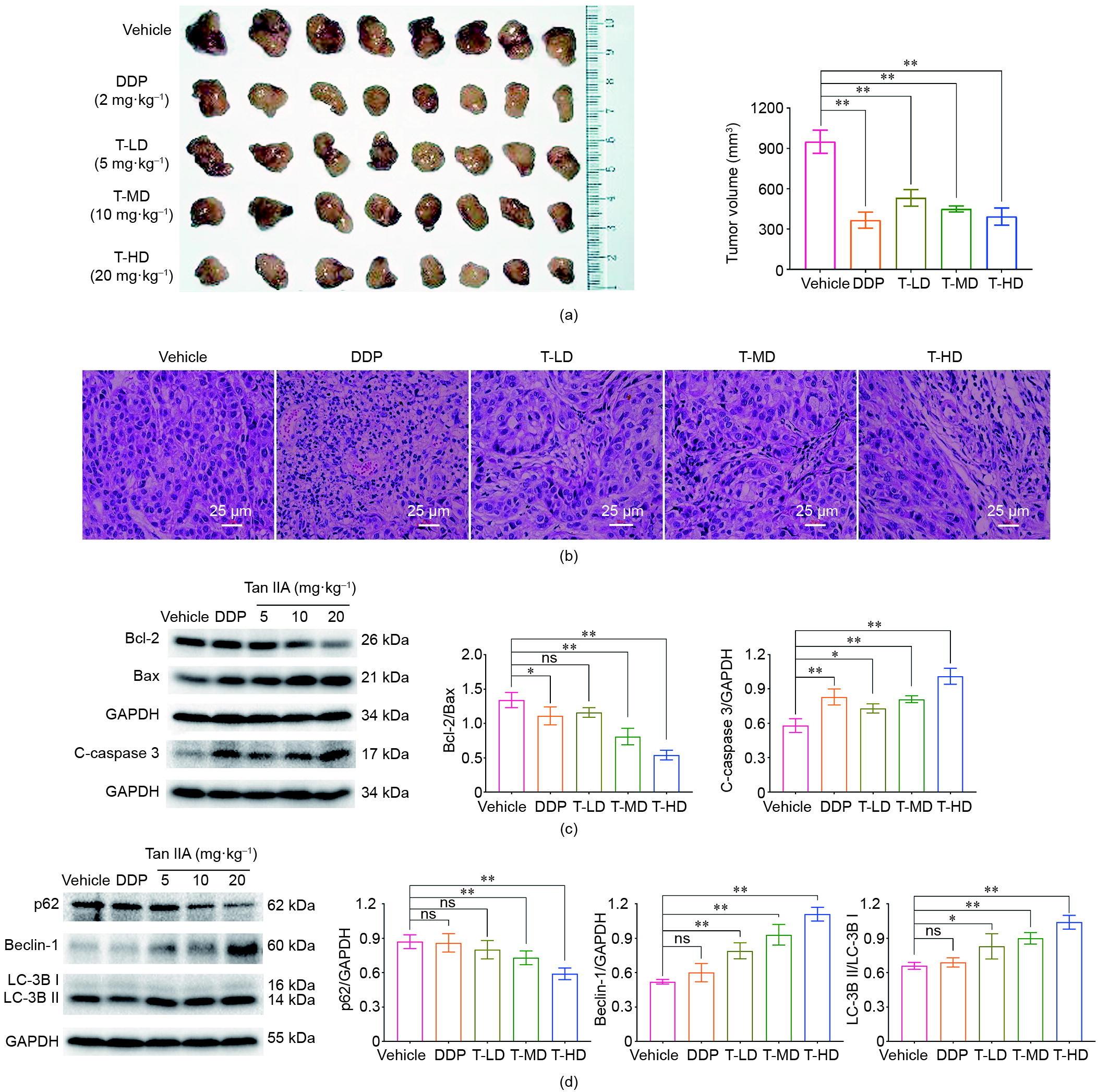
由A549细胞建立的荷瘤小鼠模型在注射Tan IIA后,肿瘤体积和质量均显著减小[见图3(a)和附录A中的图S2(a)],多个器官指数结果显示该制剂无毒性[见图2和附录A中的图S2(b)、(c)]。对荷瘤小鼠肿瘤组织切片进行H&E染色,然后显微镜下观察。对照组肿瘤组织边缘清晰,而Tan IIA组和DDP组肿瘤组织细胞排列松散无序,细胞核固缩[图3(b)],提示两种药物均诱导了细胞凋亡。
《图3》
图3 Tan IIA诱导荷瘤小鼠自噬和凋亡。(a)人肺癌移植模型小鼠肿瘤的照片和体积测量。(b)肿瘤组织切片H&E染色观察。(c)、(d)用免疫印迹法分析凋亡蛋白(Bcl-2、Bax和c-caspase 3)和自噬蛋白(LC-3B I、LC-3B II、SQSTM1/ p62和Beclin-1)。*:p < 0.05,**:p < 0.01;n= 8。ns:无显著性差异;T-HD:Tan IIA高剂量组;T-MD:Tan IIA中剂量组;T-LD:Tan IIA低剂量组。
分离肿瘤组织后进行Western blot检测,分析凋亡相关蛋白。结果显示凋亡相关蛋白(c-caspase 3、 Bcl-2、 Bax)表达增加[图3(c)]。在荷瘤小鼠肿瘤组织中经Tan IIA处理后自噬相关蛋白LC-3B I、LC-3B II、SQSTM1/p62表达升高,表明自噬的发生[图3(d)]。
《3.3 Tan IIA诱导肺癌细胞自噬与凋亡的相互作用》
3.3 Tan IIA诱导肺癌细胞自噬与凋亡的相互作用
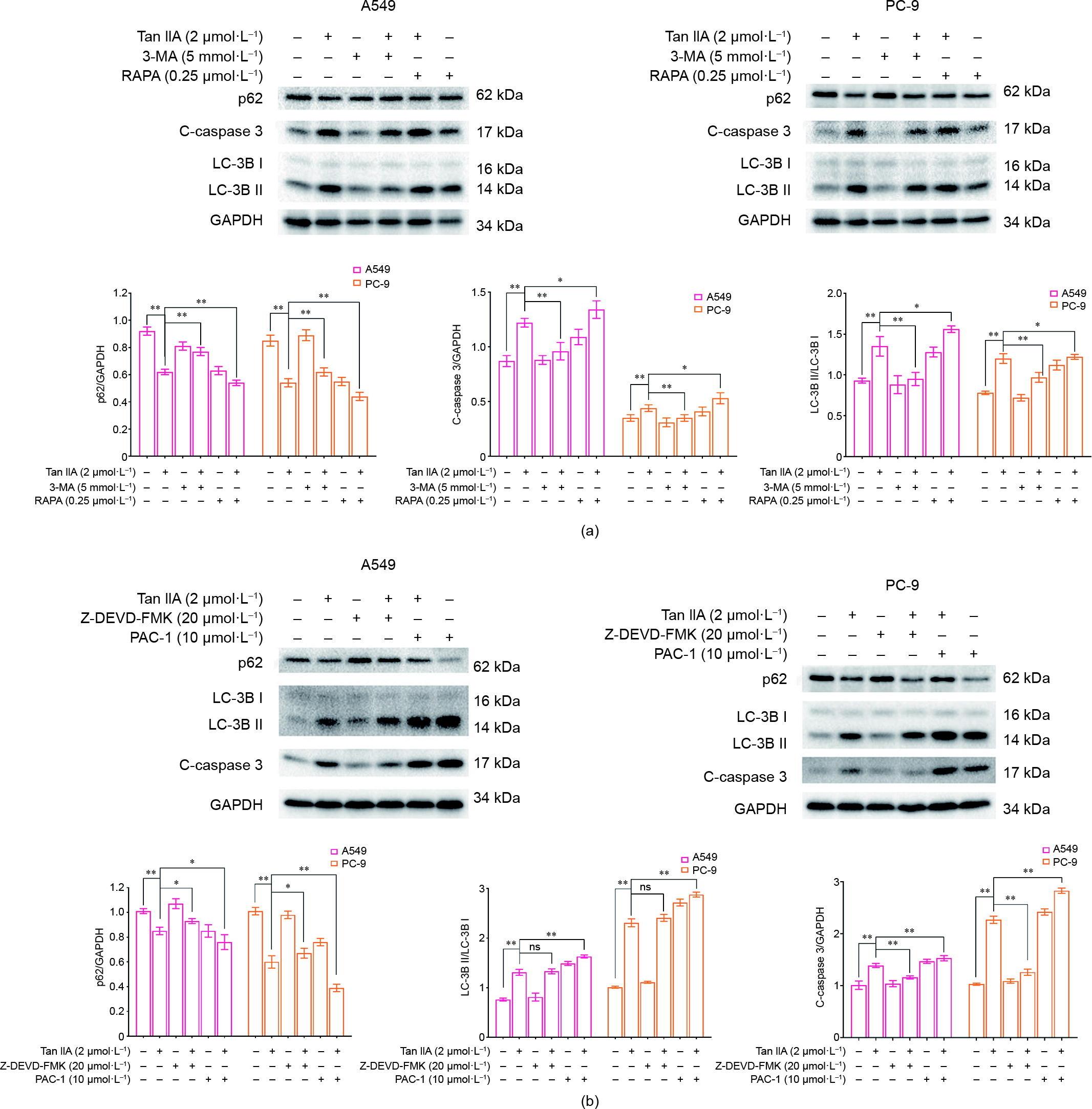
进一步研究细胞自噬与凋亡的关系。自噬是否是肺癌细胞凋亡的保护反应?首先,在Tan IIA处理的不同时间点收集肺癌细胞进行蛋白检测。结果表明,经Tan IIA处理4 h后,A549中LC-3B II的表达显著上调。c-caspase 3在8 h前没有明显变化。这一发现表明自噬可能发生在凋亡之前[图4(a)]。PC-9细胞发生自噬的时间稍晚,但仍先于细胞凋亡[图4(b)]。为探明自噬是否参与了Tan IIA诱导的肺癌细胞凋亡,本研究采用自噬激动剂雷帕霉素(RAPA)和拮抗剂3-MA预处理肺癌细胞。结果表明,RAPA可以提高Tan IIA的c-caspase 3水平。相反,3-MA削弱了Tan IIA的上述作用[图5(a)]。结果初步证明肺癌细胞自噬不是由凋亡诱导的,而是由Tan IIA诱导的。同时,用caspases的激动剂和拮抗剂预处理肺癌细胞。Tan IIA诱导的自噬在caspase拮抗剂(Z-DEVD-FMK)作用下没有明显改变,但在caspase 3激动剂(PAC-1)作用下被加剧[图5(b)]。这一发现证明了Tan IIA诱导的自噬参与介导肺癌细胞凋亡。
《图4》
图4 Tan IIA诱导NSCLC细胞自噬与凋亡的关系。(a)免疫印迹法检测不同Tan IIA(2 μmol·L-1)处理时间下A549细胞的自噬和凋亡标志物(LC-3B I、LC-3B II和c-caspase 3)。(b)免疫印迹法检测不同Tan IIA(2 μmol·L-1)处理时间下PC-9细胞中自噬和凋亡标志物LC-3BI、LC-3B II和c-caspase 3的变化。
《图5》
图5 Tan IIA相互作用诱导NSCLC细胞自噬和凋亡。(a)在Tan IIA处理前1 h加入自噬激动剂[雷帕霉素(RAPA)]和拮抗剂(3-MA),检测A549和PC-9细胞的自噬和凋亡标志物。(b)细胞凋亡激动剂(PAC-1)和拮抗剂(Z-DEVD-FMK)预处理1 h,然后进行同样的操作。*:p < 0.05, **:p < 0.01;n = 3。ns:无意义。
为进一步验证,本文设计并合成自噬基因5(ATG5)-发夹RNA(shRNA),构建慢病毒干扰载体,转染A549细胞(标记为ATG5lo/lo)进行后续研究。MDC染色和LC-3B实验结果表明自噬已经被抑制[图6(a)、(b)]。在这种情况下,A549细胞对Tan IIA的敏感性较低[图6(b)]。
《图6》
图6 Tan IIA诱导NSCLC细胞自噬凋亡。(a)在Tan IIA以2 μmol·L-1L处理24 h后,将随机小干扰RNA(siRNA)和ATG5 siRNA转染A549细胞,进行MDC染色。(b)以同样的方式处理转染A549细胞的随机shRNA、LC3B shRNA和BECN1 shRNA进行MDC染色。(c)、(d)采用免疫印迹法检测ATG5lo/lo、BECN1lo/lo、LC3Bhi/hi和BECN1hi/hi细胞中c-caspase 3、LC-3B和Beclin-1的水平。*:p < 0.05,**:p < 0.01;n = 3。ns:无意义。
建立自噬基因LC-3B(LC3B)稳定过表达的A549细胞株进行进一步检测。MDC染色和免疫印迹检测显示LC3Bhi/hi细胞株自噬上调[图6(c)]。Tan IIA增加LC3Bhi/hi细胞株中LC-3B和c-caspase 3的表达,而Beclin-1表达降低[图6(d)]。这些数据提示Tan IIA可能通过Beclin-1诱导细胞自噬凋亡。
《3.4 Tan IIA通过Beclin-1诱导肺癌细胞自噬凋亡》
3.4 Tan IIA通过Beclin-1诱导肺癌细胞自噬凋亡
在野生型A549细胞、PC-9细胞和LC3Bhi/hi A549细胞中,Tan IIA处理后Beclin-1的表达水平明显升高[图2(b)和图3(d)]。ATG5lo/lo A549细胞中Tan IIA的作用减弱[图6(d)]。因此构建了BECN1hi/hi和BECN1lo/loA549细胞株。结果表明,BECN1hi/hi细胞中LC-3B和c-caspase 3水平升高,BECN1lo/lo细胞中LC-3B和c-caspase 3水平降低。Tan IIA在BECN1hi/hi和BECN1lo/lo细胞中均未增加LC-3B和c-caspase 3水平[图6(b)和(d)]。
《4、 讨论》
4、 讨论
2018年,肺癌在全球1800万新诊断癌症病例中发病率和病死率最高,中国肺癌发病率较低(430万新诊断病例),但死亡率较高(290万癌症死亡),这是由预后不良而导致的[1,32‒33]。如今,因为缺乏良好的治疗,癌症已成为导致死亡的主要原因。中医是中华民族的瑰宝,几千年来在维护人民生命健康方面发挥着重要作用。因此,中医药在肿瘤治疗中的应用越来越受到重视。
在本研究课题组早期关于中药及成分对肺癌影响的研究中,通过网络药理分析,筛选出20多种化合物进行疗效验证。其中,Tan IIA是疗效和安全性较好的成分之一。关于Tan IIA抗肿瘤机制的报道较多,但其中一篇引起了人们的关注,Tan IIA可能导致ACD [30‒31]。遗憾的是,没有进一步的证据证实Tan IIA的治疗机制。
早在半个多世纪前Richard Lockshin就描述过ACD,但关于ACD确实存在激烈的争议[34‒39]。有人认为ACD是第三种细胞死亡途径,没有坏死和凋亡的形态学症状[40‒41]。另一方面,有人试图用三个特征来定义ACD:诱导自噬、自噬平行或先于细胞死亡、抑制自噬可以阻止细胞死亡[34,36,42‒43]。无论如何定义,自噬都是“关键角色”。
自噬是肿瘤发生过程中众所周知的“双刃剑”[27,29,38,44]。在治疗肿瘤时,是诱导还是抑制自噬一直是有争议的问题。在本研究中,Tan IIA诱导自噬促进细胞死亡,发挥抗肿瘤作用。然而,更多的报道表明自噬可以保护肿瘤细胞免受化疗的破坏或介导免疫逃逸,自噬抑制剂氯喹也被报道具有成为抗肿瘤药物的潜力[45‒47]。在中医药治疗肿瘤方面也存在类似的争论。对于活血化瘀能否帮助肿瘤形成更好的供血并促进肿瘤生长或促进肿瘤的血转移,同时治疗肿瘤的问题,有报道称,活血化瘀单味中药促进小鼠Lewis肺癌细胞血管生成,或损害免疫细胞功能,导致癌细胞释放到血液中,加速肿瘤的血液转移[48‒49]。但也发现,与对照组鼻咽癌放疗患者相比,接受活血化瘀治疗的患者5年生存率及复发率均无统计学意义[50‒51]。近年来,越来越多的学者提出活血化瘀可以使肿瘤血管生成和微环境正常化,从而起到治疗癌症的作用[52‒54]。在本研究中,发现丹参的活性成分Tan IIA具有显著的抗肿瘤作用,并且在Tan IIA处理的小鼠中没有发现原位转移的明显增加。综上所述,这样类似的情况让人们相信自噬与Tan IIA具有活血化瘀作用的抗肿瘤作用机制一定存在某种关系。自噬细胞死亡会是关键吗?的确,根据研究结果,Tan IIA确实在人NSCLC细胞中诱导自噬细胞死亡,更具体地说是自噬细胞凋亡。结果表明,Tan IIA可诱导肺癌细胞自噬和凋亡。但自噬发生较早,抑制自噬可阻断细胞凋亡。然而,抑制细胞凋亡并不能阻止自噬,尽管诱导细胞凋亡可以增强自噬。
为了进一步证实,本文选取ACD中的关键信号分子进行干预[55‒56]。Beclin-1是自噬过程中的关键分子,可与Bcl-2结合而失活[57‒59]。一旦从Bcl-2中分离出来,它也可以被unc-51磷酸化,如自噬激活激酶1(ULK1),以增加液泡蛋白分类34(VPS34)复合体的活性[57,60‒61]。这一步对于自噬的发生至关重要。自噬信号释放后,上调的Beclin-1可与多个Bcl-2分子结合,释放出一组促凋亡分子(如Bax、Bad),与线粒体膜结合,引发内源性凋亡。在BECN1hi/hi细胞和BECN1lo/lo细胞中的结果均显示,Tan IIA诱导的凋亡减弱;由于Tan IIA不能诱导肺癌细胞表达更多的Beclin-1去结合Bcl-2,Tan IIA诱导的自噬凋亡作用明显减弱。
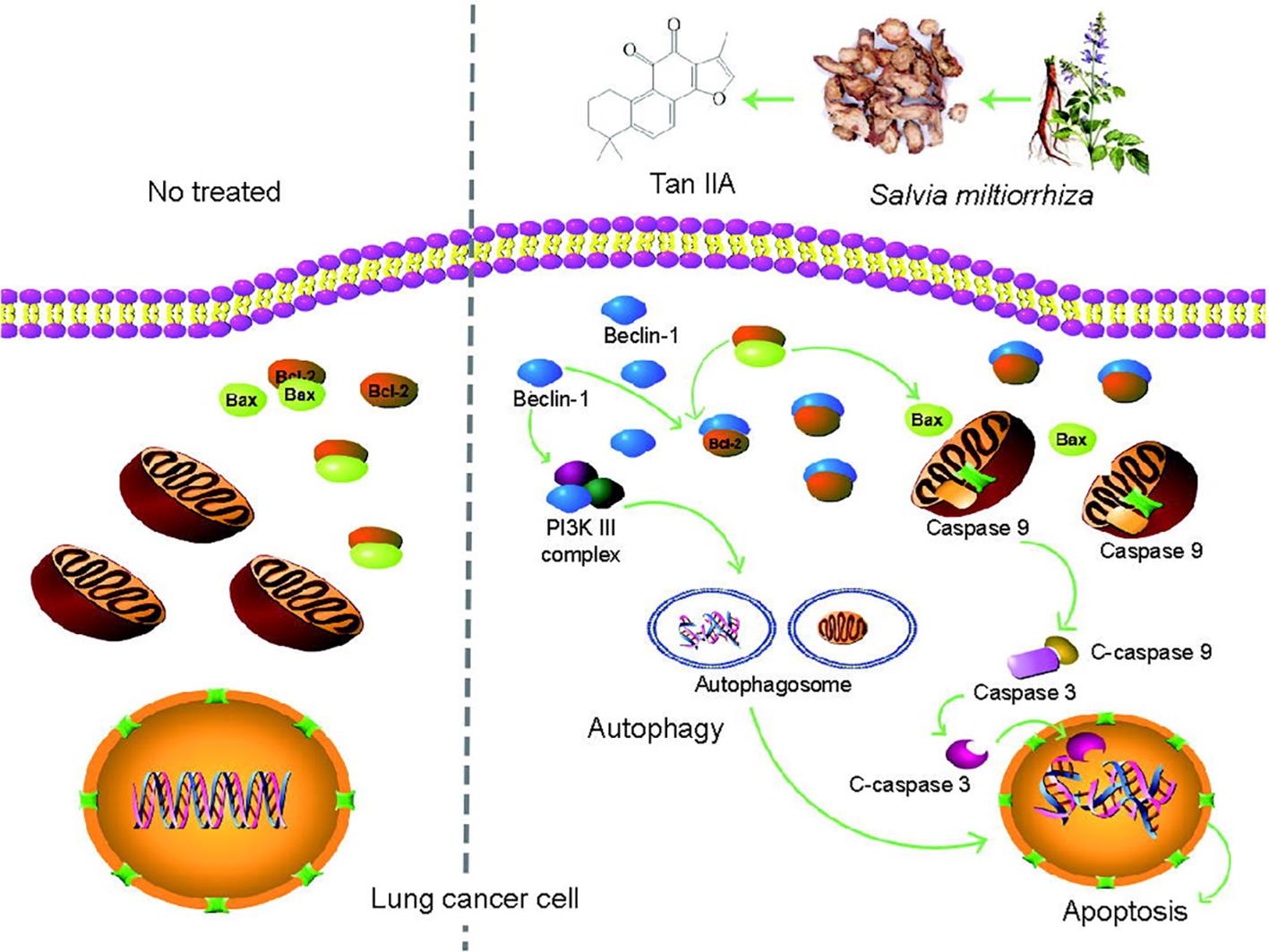
综上所述,本文解释和阐明了Tan IIA抑制肺癌的分子机制。本研究首次较系统深入地研究了Tan IIA中ACD对抗肺癌的作用,为后续研究丹参其他成分的抗肿瘤机制奠定了基础(图7)。根据中药活血化瘀与自噬相关性的网络药理分析结果,中药有效成分与自噬相关的多个靶分子形成了一个非常紧密的相互作用网络(见附录A中的图S3),在GO富集后,在KEGG数据库中可以看到与凋亡相关的多条通路及其调控机制(见附录A中的图S4),同时发现凋亡与肿瘤发生发展相关的多条信号机制被富集(见附录A中的图S5),因此也提示ACD很可能是肿瘤治疗中活血化瘀的“关键角色”。然而,ACD的规律还需要经过更系统的验证。
《图7》
图7 Tan IIA诱导自噬细胞凋亡的分子机制。
“活血化瘀”是中医治疗肿瘤的主要原则之一。解释这一原理的现代科学分子机制,对于肿瘤治疗新方法和新策略的研究及开发至关重要。
《5、 结论》
5、 结论
丹参主要成分Tan IIA可诱导荷瘤小鼠A549和PC-9细胞的ACD,并能减小荷瘤小鼠的肿瘤体积,且无明显毒性。Tan IIA通过诱导自噬细胞凋亡对肺癌有药理作用。
Authors’ contribution
Shasha Bai designed and performed the experiments. Sainan Cui wrote the initial version of the manuscript, and Elaine Lai-Han Leung revised it. Wenhao Wen assisted with the conduct of the experiments and analyzed the data. Huiyuan Lin assisted with animal experiments. Jing Bai and Yongfei Cui contributed to manuscript preparation and assisted with animal experiments. Lei Yang contributed reagents, materials, analysis tools. Yuan Zheng and Rong Zhang formulated the hypotheses. Zhongqiu Liu supervised the study. All authors reviewed the manuscript.
















 京公网安备 11010502051620号
京公网安备 11010502051620号




