《1、 引言》
1、 引言
检测和评价特异性肝损伤主要使用的是组织或细胞特异性的生物标志物,如丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)和碱性磷酸酶(alkaline Phosphatase, ALP)[1]。损伤检测主要基于下述原理:当组织损伤发生时,受损组织细胞内的标志物会释放到血清中,无论损伤是源于有毒物的直接作用,还是有毒物引起炎症的二次攻击。因此,一个理想的损伤生物标志物应该具有辨别直接损伤和炎症引发的间接损伤的能力。损伤前后,同一生物标志物在血清中和受损组织中应呈负相关。本研究建立了一个基本概念和方法,使用术语“损伤生物标志物的回顾性验证”来定义此相互验证方法。
病理形态学分析作为组织损伤后组织变化的金标准,是一种非定量的形态学跟踪或回顾性验证的方法[2]。遗憾的是,病理分析是一种定性分析而非定量分析方法,其精确度和准确性受取样部位、观察者经验、染色方法、粗略的测量方法等因素的严重限制。此外,损伤组织的病理改变可由多种原因引起,包括有毒物导致的直接损伤和继发炎症引起的间接损伤。因此,病理形态学分析不能提供有关损伤机制的准确信息。而且,尽管炎症与损伤是间接相关的,但是炎症生物标志物并不能反映损伤严重程度。即便如此,炎症细胞因子如白介素(interleukin, IL)-1β、IL-18和IL-6经常被用来评估损伤的严重程度。通常,这些标志物在损伤前的组织中丰度较低,只有当损伤组织遭遇二次攻击时才会显著增加。因此,这些细胞因子主要反映炎症发生程度,而无法衡量组织的直接损伤程度[3‒4]。因此,为了表征组织的直接损伤,特别是那些非炎症性损伤,亟需开发具有自身对照性验证能力的特异性生物标志物。
损伤标志物通常应该在损伤组织中丰度更高,损伤后才容易从组织中脱落并进入循环。然而,大多数广泛使用的生物标志物并不具有组织或细胞类型的特异性表达,缺乏组织特异性应有的基本特征。例如,ALT除了在肝脏中表达外,还在肌肉细胞中高表达;AST也在多种其他类型的细胞中表达,包括树突状细胞和单核细胞[5‒6]。此外,这些生物标志物在损伤和炎症刺激后增加的现象更可能与炎症有关,而非细胞损伤的直接结果。因此,这些生物标志物不具有区分损伤和炎症的能力。此外,由于缺乏有关初始条件的相关信息,因此很难通过这些生物标志物或它们的组合来定量评估组织损伤的程度。因此,有必要找到新的生物标志物,能够同时反映损伤的来源和损伤的程度。
为了确定某些组织或器官是否经历了特定形式的损伤,理论上应该同时跟踪与组织损伤前后相对应的生物标志物水平的变化,通过观察生物标志物在血清水平的增加与组织水平的减少,确保损伤的来源。在组织或细胞损伤后,释放到血液中的一些高丰度蛋白质或酶的活性会在相应的受损组织或器官中降低,而不受炎症等其他因素的干扰。在本研究中,提出了一种全新的追溯验证方法,包括检测组织中特定生物标志物的残留活性或量,比较它们在损伤前后血清和组织中的活性变化。该方法将有助于提高候选生物标志物的准确性和特异性。通过比较组织正常与受损后的目标生物标志物水平的变化,可识别出受损伤影响的组织,并评估特定组织损伤的程度。结合其他机制,如炎症生物标志物,这种方法将有助于确定所涉及损伤的潜在机制,并提供准确和更优的治疗策略。
羧酸酯酶1(carboxylesterase 1, CES1)是一种在肝脏细胞中高表达的膜蛋白,有可能成为一种评估肝损伤程度[7]的肝特异性生物标志物。二肽基肽酶4(dipeptidyl peptidase 4, DPP-IV)存在于肾脏、脾脏、小肠组织和淋巴细胞[8]的表面。这两种蛋白可因组织损伤而释放到血清中,然而,它们所涉及的病理生理学意义是完全不同的。损伤后血清中DPP-IV活性的增加可能是由炎症[9]所引起的。因此,DPP-IV和CES1可互为交叉性对照,以确定肝内和肝外组织损伤程度,以及损伤中是否有肝脏炎症参与。从理论上讲,与传统的血清标志物,如ALT、ALT、ALP和AST相比,CES1在肝脏[10‒11]中的表达更丰富,有可能成为特异性更高的肝损伤生物标志物。在先前的研究中,使用了体外细胞培养模型进行实验损伤研究,发现细胞中CES1的残留活性与释放到培养基[12]中的游离CES1活性呈负相关。然而,细胞水平的干扰因素较少,有必要在系统水平的模型中验证CES1作为肝损伤生物标志物的作用。
有研究报道,新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)合并肝损伤的诊断是临床实践中需要亟待解决的问题[13‒15]。特别是,对于已住院的COVID-19患者或已有代谢性肝病的患者[16‒17],早期精准肝损伤诊断非常重要。根据Cai等[18]的研究,318例COVID-19住院患者的肝功能检测显示,肝细胞型损伤占20.75%、胆汁淤积型损伤占29.25%、混合型损伤占43.40%。这些数据表明,COVID-19患者会出现肝和胆管内皮细胞受损。此外,有多项研究报道DPP-IV参与了重型急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2))的感染过程[19‒20],因此,DPP-IV抑制剂可能对COVID-19患者有益[21]。中医药在治疗和预防COVID-19感染方面发挥了积极作用,炎症抑制患者恢复更快,住院时间更短[22‒23]。在中华人民共和国国家卫生健康委员会2020年2月18日发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》中,清肺排毒汤(Qing Fei Pai Du Decoction, QFPDD)被推荐作为COVID-19患者的中药治疗常用方剂[24‒25]。然而,关于QFPDD的肝损伤解毒及其治疗作用尚不清晰,有待进一步的系统性研究。α-萘异硫氰酸酯(α-naphthylisothiocyanate, ANIT)是一种公认的肝胆系统的特异性损伤剂,常用于诱导啮齿类动物[26]的急性肝内胆汁淤积性肝损伤。ANIT由细胞色素P450酶代谢,也可直接与谷胱甘肽(glutathione, GSH)结合,后者经由多药耐药相关蛋白2(multidrug resistance associated protein 2, Mrp2)[27]等转运体特异性地转运到胆汁中,进入胆管的ANIT可造成胆管上皮细胞损伤,导致胆汁流量减少、胆汁酸肝内蓄积、肝脏组织细胞坏死[28]。因此,ANIT是特异性诱导大鼠肝损伤的理想方法,所得到的ANIT模型一定程度上可再现COVID-19引发的肝胆汁淤积性损伤的病理特征。
本研究旨在评估CES1和DPP-IV这两种生物标志物在准确跟踪特异性肝损伤方面的潜力,并评估QFPDD是否对急性胆汁淤积性肝损伤有治疗保护作用。为此,本文建立了ANIT诱导的大鼠特异性肝损伤模型,并将CES1和DPP-IV的血清和组织残余水平与相应的病理变化、常规损伤的血清学生物标志物水平、肝损伤后的炎症和胆汁酸谱进行了比较。
《2、 材料与方法》
2、 材料与方法
《2.1 试剂》
2.1 试剂
将QFPDD药材(1 kg)溶于10 L水中,浓缩成102 g粉末,制备水提取物。该药材由中国科学院大连化学物理研究所梁鑫淼实验室提供。根据国家QFPDD质量标准,将方剂制备成10倍的浓缩精华提取物(批号:QFP1-10NS + XX-PG-20062),用UHPLC-Q-TOF-HRMS分析QFPDD的成分谱(见附录A中的图S1)以及进行成分的鉴定(见附录A中的表S1)。其余试剂如下:熊去氧胆酸(ursodeoxycholic acid, UDCA;梯希爱(上海)化成工业发展有限公司);ANIT(Sigma-Aldrich,美国);戊巴比妥钠(pelltobarbitalum natricum;国药集团化学试剂有限公司);二甲亚砜(dimethylsulfoxide, DMSO;国药集团化学试剂有限公司);CES1探针(N-alkylated D-luciferin methyl ester, NLMe)[12]和DPP-IV探针(glycyl-prolyl-N-butyl-4-amino-1,8-naphthalimide, GP-BAN)[9]由本实验室自己合成;荧光素检测试剂(LDR; V8291; Promega,美国);IL-1β、IL-6、IL-18 ELISA试剂盒购自杭州联科生物技术股份有限公司(简称联科生物);ALT、AST、ALP和(γ-glutamyl transpeptidase, γ-GT)活性检测试剂盒购自潍坊鑫泽生物科技公司。
《2.2 ANIT诱导胆汁淤积型肝损伤大鼠模型及给药》
2.2 ANIT诱导胆汁淤积型肝损伤大鼠模型及给药
雄性SD大鼠[(200 ± 20) g]购自浙江维通利华实验动物技术有限公司。所有动物研究(包括大鼠安乐死过程)均由浙江维通利华实验动物技术有限公司批准。适应性喂养5 d后,将动物用于实验研究。对于时程(Time-cross)的研究(见附录A中的图S2),将大鼠随机分为两组:ANIT溶解在玉米油中,其中一组为ANIT造模组(ANIT, n = 8),另一组为正常对照组(n = 8),被给与同体积玉米油。按照200 mg·kg-1剂量灌胃给予大鼠ANIT后,在6个时间点从眼眶收集血液,直到72 h,然后腹腔注射戊巴比妥钠(200 mg·kg-1)进行大鼠安乐死。分离得到血清,用于传统及新血清学生物标志物的检测。
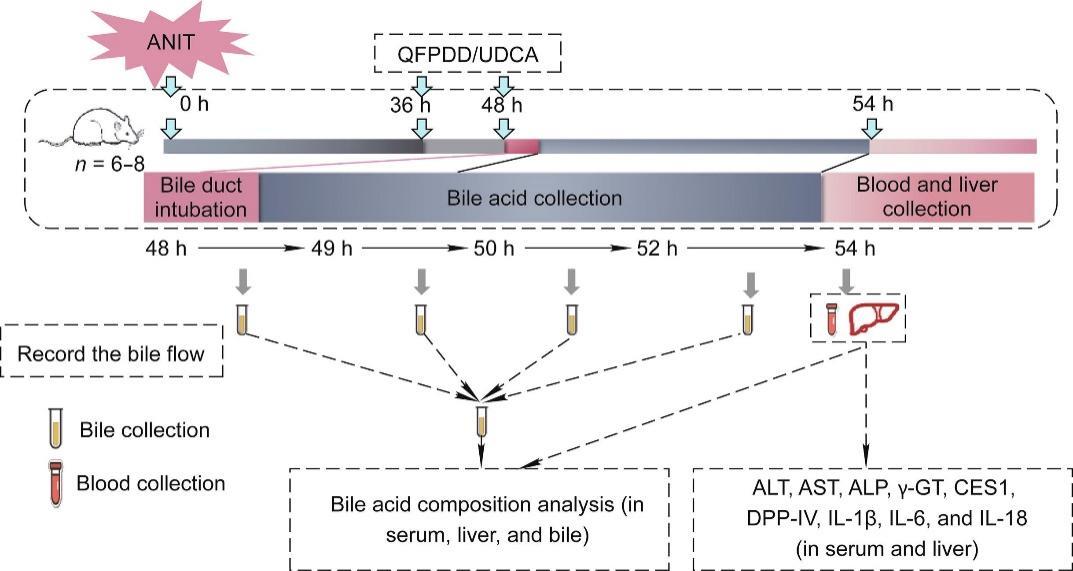
对于药物治疗性研究(图1),将大鼠随机分成6组(n = 6~8),UDCA或QFPDD预先溶解于去离子水中,ANIT溶解在玉米油中。给予正常对照组动物10 mL玉米油,清肺排毒汤高剂量组(QFPDD-H)按照1800 mg·kg-1灌胃给予QFPDD;其余对用于建立胆汁淤积模型的动物均灌胃给予ANIT(200 mg·kg-1),并在ANIT给药后分别灌胃给予各治疗药物,包括清肺排毒汤高剂量治疗组(QFPDD-H; 1800 mg·kg-1)、清肺排毒汤低剂量治疗组(QFPDD-L; 900 mg·kg-1)、UDCA治疗组(UDCA; 60 mg·kg-1)。ANIT造模和给药方案按照图1进行:ANIT灌胃给药后,分别于36 h和48 h两次灌胃给药UDCA或QFPDD,在第二次给药结束的同时(即48 h),腹腔注射戊巴比妥钠(50 mg·kg-1)麻醉大鼠行胆管插管手术,然后收集49~54 h 四个时间段(48~49 h、49~50 h、50~52 h和52~54 h)排出的胆汁,并测量胆汁体积,计算胆汁总量。在6 h内进行手术,以确保胆管插管手术对动物造成的创伤最小。在收集腹主动脉的全血及肝脏后对大鼠进行安乐死。记录每只大鼠的肝脏质量。将一小块肝脏组织固定在10%福尔马林溶液中进行病理分析,其余部分用于检测胆汁酸谱和生物标志物。
《图1》
图1 生物标志物验证和药物治疗的方案。在0 h给予大鼠ANIT(200 mg·kg-1)。分别在36 h和48 h时灌胃给予高剂量QFPDD(1800 mg·kg-1)或低剂量QFPDD(900 mg·kg-1)或UDCA(60 mg·kg-1)。在QFPDD或UDCA给药后分别在四个时间段(48~49 h、49~50 h、50~52 h和52~54 h)收集胆汁,并测定胆汁容量。分析血清和肝组织S9中AST、ALT、ALP、γ-GT、CES1、DPP-IV和炎症标志物(IL-1β、IL-6、IL-18)的水平。分别采用超高效液相色谱串联质谱(UPLC-MS/MS)法分析大鼠血清、肝脏和胆汁中的胆汁酸组成。
《2.3 肝组织病理分析》
2.3 肝组织病理分析
固定的肝组织用苏木精和伊红(H&E)染色,显微镜下观察切片染色,评价肝脏的病理变化,包括变性、炎症和坏死[29‒30]。对肝脏和胆管损伤进行评分,标准如下:肝细胞无坏死或变性,无炎性细胞浸润为0分;汇管区和中央静脉周围散布的孤立肝细胞变性、坏死或炎性细胞浸润为1分;汇管区周围中度分散,变性、坏死、炎性细胞浸润,胆管可见胆道上皮细胞坏死,记2分;汇管区周围斑片状肝细胞有大量变性、坏死或炎性细胞浸润,浸润达汇管区和中央静脉周围,记3分。分别计算变性、坏死或炎症的评分。
《2.4 血清及肝组织S9样本中传统标志物的检测》
2.4 血清及肝组织S9样本中传统标志物的检测
根据制造商(潍坊鑫泽生物科技公司)的说明,采用全自动生化检测仪(Hitachi,日本)检查ALT、AST、ALP和γ-GT。血清中标志物活性单位为U·L-1。肝脏中各标志物的活性计算如下:
肝脏组织总活性(U/个肝脏)=比活性(U/毫克蛋白)×总蛋白(mg/个肝脏)。
《2.5 胆汁酸成分分析》
2.5 胆汁酸成分分析
大鼠胆汁酸谱测试的样本有胆汁、血清和肝组织S9。使用10 mg大鼠肝组织在0.02 mL H2O2中制备细胞悬液,然后加入0.18 mL乙腈和甲醇混合溶液(V/V = 8∶2)[31];血清及胆汁样本用50%甲醇-水稀释1000倍;取0.05 mL上述样品,添加到0.4 mL乙腈和甲醇混合溶液(V/V = 8∶2)中,然后在4 ℃下以4000g(g = 9.8 m·s-2)离心30 min(FiberliteTM F21-48X2;Thermo,美国)。冷冻上清液(0.25 mL),用0.04 mL乙腈和甲醇溶液(V/V = 8∶2)以及0.06 mL去离子水重新溶解,然后离心。通过超高效液相色谱串联质谱仪(UPLC-MS/MS; ACQUITY UPLC-Xevo TQ-S; Waters,美国)检测胆汁酸,并用Masslynx软件(v4.1; Waters,美国)平台分析及进行胆汁酸定量[32]。
《2.6 血清细胞因子分析》
2.6 血清细胞因子分析
ELISA试剂盒按照制造商(联科生物,中国)的说明检测血清和肝组织S9中IL-1β、IL-6和IL-18的水平。通过酶标仪(Thermo,美国)读取450 nm处的吸光度。
《2.7 肝组织S9的制备》
2.7 肝组织S9的制备
对磷酸盐缓冲液(PBS)中的肝组织进行低温匀浆,并在4 °C下以9000g离心20 min,分离线粒体后,收集上清液即为S9。
《2.8 CES1和DPP-IV检测》
2.8 CES1和DPP-IV检测
CES1催化NLMe的反应体系总体积为0.1 mL,其中包括0.002 mL本实验室自主研发的 CES1特异性探针底物NLMe [12]、0.005 mL的肝脏S9或血清样本、0.093 mL的PBS(pH = 6.5)。血清或S9样本与PBS缓冲液在37 °C下预孵育3 min,加入荧光素酶开始发光反应,反应时间为10 min。测试使用白色96孔板,通过全波长扫描得到信号值,代表每分钟由NLMe产生产物N-烷基化D-荧光素(N-alkylated D-luciferin, NL)的量,这也是CES1的酶活性。在本研究中,测试了血清和肝脏S9中的CES1,而肝脏S9中CES1的酶活性以总活性表示。CES1总活性(U/个肝脏)= CES1比活性(U/毫克蛋白)×总蛋白(mg/个肝脏),总活性单位(U)为 NLMe每分钟被CES1水解的代谢速度(μmol·min-1)。
用于检测DPP-IV酶活性的探针底物GP-BAN由本实验室研发并合成[9]。总体积为0.2 mL的孵育系统包括0.002 mL GP-BAN、0.002 mL血清或组织S9样本和0.196 mL的PBS(pH = 7.4)。血清或S9样本与PBS缓冲液在37 °C下预孵育3 min,然后加入0.002 mL GP-BAN开始反应,并在37 °C下反应20 min。为了停止反应,加入0.2 mL冰乙腈,然后剧烈振荡0.5~1 min。测试使用黑色96孔板,通过Ex430 nm/Em535 nm检测。在本研究中,检测了血清和肝脏S9中的DPP-IV,而在肝脏S9中DPP-IV的酶活性以总活性表示。DPP-IV总活性(U/个肝脏)= DPP-IV比活性(U/毫克蛋白)×总蛋白(mg/个肝脏)。总活性单位(U)为GP-BAN每分钟被DPP-IV水解后的代谢速度(μmol·min-1)。
《2.9 统计分析》
2.9 统计分析
所有统计分析均使用SPSS 21.0版(IBMCorp,美国)和GraphPad Prism 8.0版(GraphPad Software,美国)软件进行。结果以均值±标准误差(SEM)表示,使用单因素或双因素方差分析(ANOVA)分析差异的统计学显著性(P < 0.05),各组比较采用多重比较。然后通过相关矩阵分析将结果成对相关。相关分析主要通过iMAP软件(V1.0; Metabo-Profile,中国)进行。
《3、 结果》
3、 结果
《3.1 ANIT诱导大鼠胆汁淤积性肝损伤模型血清标志物的经时变化》
3.1 ANIT诱导大鼠胆汁淤积性肝损伤模型血清标志物的经时变化
为了观察不同血清学标志物在ANIT诱导肝损伤后随时间的动态变化,检测了在ANIT给药后传统血清学标志物(ALT、AST、ALP和γ-GT)和新型血清学标志物(CES1和DPP-IV)在不同时间点的浓度。如附录A中图S3(a)~(d)显示,在ANIT处理后第36~54 h,血清中ALT、AST、ALP、γ-GT活性显著升高,但从第54 h开始各标志物浓度逐渐降低(P < 0.05 vs 0 h),其中AST浓度甚至恢复到正常水平。然而,在ANIT给药后第54~72 h,CES1和DPP-IV的浓度缓慢升高并一直维持在高水平[见附录A中的图S3(e)、(f)],表明CES1和DPP-IV可能比传统血清学标志物能更好地反映持续性肝损伤的状态。
《3.2 QFPDD或UDCA对ANIT诱导大鼠胆汁淤积性肝损伤的影响》
3.2 QFPDD或UDCA对ANIT诱导大鼠胆汁淤积性肝损伤的影响
如附录A中图S4(a)所示,正常组大鼠肝细胞在肝中央静脉周围呈放射性排列,小叶呈规则形状。ANIT组门静脉区可见明显胆管坏死和中性粒细胞浸润,中心静脉周围可见肝细胞内脂滴聚集。此外,研究发现QFPDD治疗组和ANIT组之间存在明显的病理改变。根据病理评分显示,高剂量QFPDD(QFPDD-H)的治疗可以显著减轻肝细胞变性、坏死和炎症,而低剂量QFPDD(QFPDD-L)治疗减少了肝细胞变性和炎症,对肝脏坏死也有一定的治疗趋势;而UDCA治疗仅仅减轻了肝细胞变性[见附录A中的图S4(b)]。研究结果表明,QFPDD-H和QFPDD-L治疗均可能对ANIT诱导的肝损伤发挥保护作用。
《3.3 QFPDD或UDCA治疗对ANIT诱导胆汁淤积性肝损伤大鼠胆汁流量的影响》
3.3 QFPDD或UDCA治疗对ANIT诱导胆汁淤积性肝损伤大鼠胆汁流量的影响
在QFPDD或UDCA给药后,从第48~49 h(定义为49 h#)、第49~50 h(定义为50 h#)、第50~52 h(定义为52 h#)和第52~54 h(定义为54 h#)的4个时间间隔收集胆汁,并测量从不同治疗组收集的胆汁量(见附录A中的图S5)。结果表明,正常大鼠在第48~49 h的平均胆汁流量约为每小时500 μL,从第50~52 h胆汁流量增多至每小时830 μL,在第52~54 h平均胆汁流量下降为每小时650 μL。
ANIT造模组大鼠的胆汁流量较正常组显著减少,第48~54 h收集的平均胆汁流量为每小时3.5 μL(与正常对照组相比,P < 0.01),结果证明大鼠胆汁淤积模型造模成功。在QFPDD-H治疗组,每只大鼠在49 h#平均胆汁流量为130 μL·h-1,在52 h#时平均胆汁流量增多至400 μL·h-1,但在54 h#平均胆汁流量下降为70 μL·h-1。和ANIT造模组相比,QFPDD-H治疗组胆汁流量显著恢复(与ANIT组相比,P < 0.01)。在QFPDD-L治疗组,每只大鼠在49 h#的平均胆汁流量为80 μL·h-1,在52 h#时平均胆汁流量增多至160 μL·h-1,但是在54 h#平均胆汁流量降低为35 μL·h-1。与造模组相比,QFPDD-L治疗组胆汁流量恢复无统计学差异(与ANIT组相比,P > 0.05),但是仍高于ANTI组。总之,这些数据表明,QFPDD-H对胆汁淤积具有较好的治疗作用,QFPDD-L治疗组在较小程度上也有一定的治疗趋势。
在UDCA组,在49 h#平均胆汁流量为200 μL·h-1,在52 h#平均胆汁流量增加到370 μL·h-1,在54 h#平均胆汁流量下降为110 μL·h-1。与ANIT造模组相比,UDCA治疗组胆汁流量明显恢复(与ANIT组相比,P < 0.05、P < 0.01)。结合QFPDD-H治疗组与QFPDD-L治疗组数据,结果显示,UDCA在胆汁淤积后对胆汁流量的恢复能力处于QFPDD-H与QFPDD-L之间。在QFPDD-H对照组,每只大鼠在49 h#平均胆汁流量为640 μL·h-1,在52 h#平均胆汁流量增加为650 μL·h-1,在54 h#平均胆汁流量下降为320 μL·h-1。值得注意的是,各组大鼠经胆管插管手术后胆汁流量均会出现明显下降,甚至有少数大鼠死于术后虚弱。
《3.4 QFPDD和UDCA对ANIT诱导胆汁淤积性肝损伤大鼠胆汁酸谱的影响》
3.4 QFPDD和UDCA对ANIT诱导胆汁淤积性肝损伤大鼠胆汁酸谱的影响
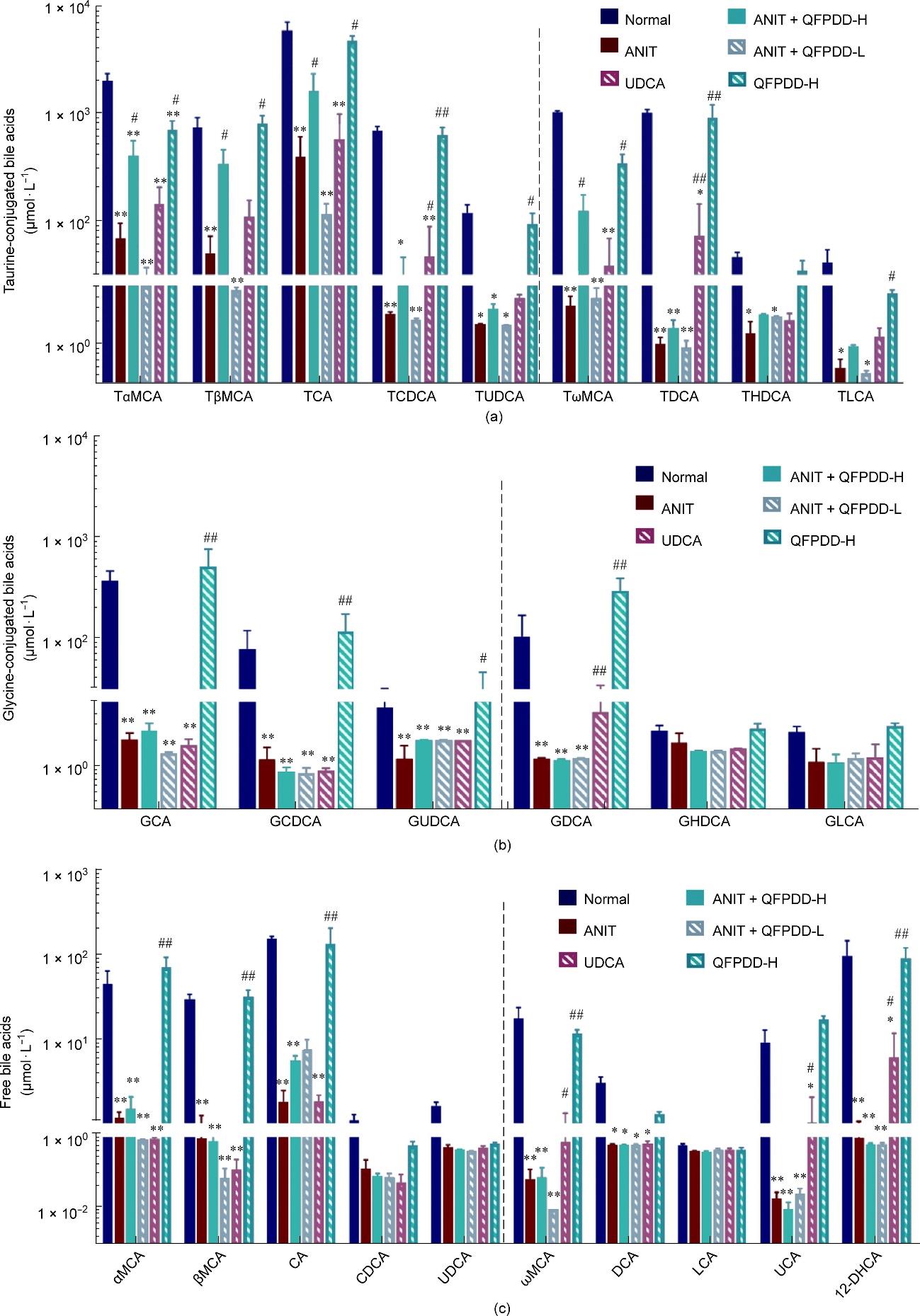
对大鼠胆汁、血清和肝脏中的胆汁酸(61种)谱进行了“靶向”定量分析,其中血清中检出34种胆汁酸,肝脏中检出30种,胆汁中检出29种(图2至图4)。在正文中,只展示了在ANIT损伤和治疗后发生显著变化的胆汁酸数据,其他胆汁酸结果见附录A中的图S6。
《图2》
图2 QFPDD或UDCA治疗后ANIT诱导胆汁淤积性肝损伤大鼠血清胆汁酸谱的变化。54 h时采集血清,用于胆汁酸谱分析。(a)血清中牛磺酸结合型胆汁酸水平的变化;(b)血清甘氨酸结合型胆汁酸水平的变化;(c)血清中游离胆汁酸水平的变化。图中虚线前的柱状图表示初级胆汁酸,虚线后的柱状图表示次级胆汁酸。*:与正常对照组相比,P < 0.05;**:与正常对照相比,P < 0.01;#:与ANIT组相比,P < 0.05;##:与ANIT组相比,P < 0.01。
《图3》
图3 QFPDD或UDCA治疗后ANIT诱导胆汁淤积性肝损伤大鼠肝脏胆汁酸谱的变化。54 h时收集肝脏组织,用于胆汁酸谱分析。(a)肝脏中牛磺酸结合型胆汁酸水平的变化;(b)肝脏甘氨酸结合型胆汁酸水平的变化;(c)肝脏中游离胆汁酸水平的变化。图中虚线前的柱状图表示初级胆汁酸水平,虚线后的柱状图表示次级胆汁酸水平。*:与正常对照组相比,P < 0.05;**:与正常对照组相比,P < 0.01;#:与ANIT组相比,P < 0.05;##:与ANIT组相比,P < 0.01。
《图4》
图4 QFPDD或UDCA治疗后ANIT诱导胆汁淤积型肝损伤大鼠胆汁中胆汁酸谱变化。将从大鼠所有时间点收集的胆汁混合用于胆汁酸谱分析。(a)胆汁中牛磺酸结合型胆汁酸水平的变化;(b)胆汁中甘氨酸结合型胆汁酸水平的变化;(c)胆汁中游离胆汁酸水平的变化。图中虚线前的柱状图表示初级胆汁酸水平,虚线后的柱状图表示次级胆汁酸水平。*:与正常对照组相比,P < 0.05;**:与正常对照组相比,P < 0.01;#:与ANIT组相比,P < 0.05;##:与ANIT组相比,P < 0.01。
在血清中,与正常大鼠相比,ANIT给药后,8种牛磺酸结合胆汁酸显著增加(与正常对照组相比,P < 0.05、P < 0.01)[图2(a)]。这些胆汁酸水平由高到低依次为:牛磺酸脱氧胆酸(tauroursodeoxycholic acid, TUDCA; 26.6%)<牛磺酸鼠酸(tauro-α-muricholic acid, TαMCA; 62.6%)<牛磺酸脱氧胆酸(tauroursodeoxycholic acid, TDCA; 67.5%)<牛磺酸ω鼠酸(tauro-ω-muricholic acid, TωMCA; 78.9%)<牛磺酸β鼠酸(tauro-β-muricholic acid, TβMCA; 88.1%)<牛磺酸脱氧胆酸(taurochenodeoxycholic acid, TCDCA; 124.0%)<三羧酸(tricarboxylic acid, TCA; 66.3%)<牛磺猪去氧胆酸(taurohyodeoxycholic acid, THDCA; 9631.1%)。4种主要甘氨酸结合型胆汁酸水平均有统计学意义的升高和变化(与正常对照组相比,P < 0.05、P < 0.01)[图2(b)],如下所示:糖脱氧胆酸(glycodeoxycholic acid, GDCA; 6.0%)<甘氨鹅脱氧胆酸(glycochenodeoxycholic acid, GCDCA; 58.0%)<甘氨熊去氧胆酸(glycoursodeoxycholic acid, GUDCA; 250.3%)<甘氨胆酸(glycocholic acid, GCA; 392.5%)。血清中检测到20种游离胆汁酸水平(与正常对照组相比,P < 0.05、P < 0.01)[见图2(c)和附录A中的图S6(a)],其中9个在ANIT给药后有统计学意义的增加(与正常对照组相比,P < 0.05、P < 0.01)。依次为:鹅去氧胆碱酸(chenodeoxycholic acid, CDCA; 1.7%)< α鼠胆酸(α-muricholic acid, αMCA; 1.8%)< ω鼠胆酸(ω-muricholic acid, ωMCA; 3.8%)<熊胆酸(ursocholic acid, UCA; 4.7%)< β鼠胆酸(β-muricholic acid, βMCA; 12.2%)<胆酸(cholic acid, CA; 14.5%)< 7-脱氢胆酸(7-ddehydrocholic acid, 7-DHCA; 20.8%)<熊去氧胆酸-7-硫酸盐(ursodeoxycholic acid-7-sulfate, UDCA-7S; 24.0%)<鹅去氧胆酸-3-β-D-葡萄糖醛酸(chenodeoxycholic acid-3-β-D-glucuronide, CDCA-3 Gln; 683.0%)。其他胆汁酸水平呈上升趋势,但无统计学差异。
与ANIT组比较,QFPDD-H治疗后血清中大部分胆汁酸水平均显著降低(与ANIT组比,P < 0.05、P < 0.01)(图2)。牛磺酸结合型胆汁酸水平由高到低依次为:TDCA(75.3%)> THDCA(48.7%)> TCDCA(29.0%)> TCA(19.0%)> TωMCA(14.4%);甘氨酸结合型胆汁酸水平顺序为:GDCA(71.1%)> GCA(54.3%);游离胆汁酸水平顺序为:CDCA(90.3%)> UCA(88.3%)> CA(82.8%)> UDCA(74.1%)> βMCA(68.8%)。其他胆汁酸水平则出现下降,但无统计学意义。QFPDD-L治疗仅使以下胆汁酸水平显著降低(与ANIT组相比,P < 0.05、P < 0.01):CDCA(91.0%)> βMCA(73.3%)> CA(73.0%)> GCA(17.0%)。UDCA处理后,仅GCA和CA水平显著降低(分别为58.6%和44.3%;与ANIT组比,P < 0.05、P < 0.01),而TUDCA、GUDCA、UDCA水平升高。与ANIT组相比,QFPDD-H治疗可显著降低血清中12种胆汁酸的水平,提示其治疗效果明显强于UDCA,特别是在降低结合型次级胆汁酸方面。
在肝组织中,与正常大鼠相比,ANIT模型显示4种牛磺酸结合型胆汁酸水平显著增加(与正常对照组相比,P < 0.01)[图3(a)]。依次为TωMCA(11.7%)< TαMCA(22.8%)< TβMCA(38.1%)< TCA(46.5%)。甘氨酸结合胆汁酸水平在GCA中显著升高(1.9%)和在GDCA中显著降低(78.4%)(与正常对照组相比,P < 0.05)[图3(b)]。肝脏中十种游离胆汁酸水平显著降低(与正常对照组相比,P < 0.05、P < 0.01)[图3(c)];这些胆汁酸水平按降序依次为:脱氧胆酸(deoxycholic acid, DCA; 98.5%)> CDCA(98.1%)> 12-酮石胆酸(12-keto lithocholic acid, 12-ketoLCA; 98.0%)> αMCA(97.6%)> UCA(95.3%)> CA(86.2%)> ωMCA(85.0%)> βMCA(84.4%)> 12-脱氢胆酸(12-dehydrocholic acid, 12-DHCA; 82.5%)> UDCA(80.6%)。其他胆汁酸水平变化如附录A中的图S6(b)所示。
与ANIT组相比,QFPDD-H处理后,牛磺酸结合型胆汁酸水平显著降低(P < 0.05)[图3(a)],由高到低依次为:TωMCA(64.0%)> TβMCA(47.0%);甘氨酸结合型胆汁酸GCDCA(56.6%)和GCA(48.9%)水平显著降低(P < 0.05)[图3(b)];而GUDCA在UDCA处理后显著升高(450%;与ANIT组对照,P < 0.05)。游离胆汁酸水平明显升高(P < 0.05)[图3(c)],由低到高依次为:αMCA(345.2%)< CA(369.4%)< CDCA(470.5%)< βMCA(1222.3%)。其他胆汁酸水平均呈上升趋势,但差异无统计学意义。QFPDD-L与UDCA治疗后游离胆汁酸水平无明显差异,仅βMCA水平有所升高(P < 0.05)。一般而言,肝脏胆汁酸水平升高的幅度小于血清胆汁酸水平升高的幅度,肝脏胆汁酸水平低于血清胆汁酸浓度。ANIT给药主要诱导结合型初级胆汁酸水平升高和游离型初级胆汁酸水平降低。仅QFPDD-H治疗显著降低了肝脏中结合型初级胆汁酸水平,并增加了游离型初级胆汁酸水平。
ANIT给药后,胆汁中各种牛磺酸结合型胆汁酸水平比正常组均显著降低(P < 0.05, P < 0.01),降低程度由高到低依次是:TDCA(99.9%)> 牛磺石胆酸(taurolithocholic acid, TLCA; 99.4%)> TCDCA(99.1%)> TωMCA(99.1%)> TUDCA(97.2%)> TαMCA(96.5%)> THDCA(95.8%)> TCA(93.3%)> TβMCA(93.1%)[图4(a)];部分甘氨酸结合型胆汁酸水平显著降低,依次为:GCA(98.9%)> GDCA(98.5%)> GCDCA(98.1%)> GUDCA(93.5%)[图4(b)];降低的游离胆汁酸水平顺序为:UCA(99.8%)> ωMCA(99.6%)> 12-DHCA(99.0%)> CA(98.7%)> αMCA(97.3%)> βMCA(97.0%)> DCA(81.1%)[图4(c)]。附录A中的图S6(c)为胆汁中其他胆汁酸浓度的变化情况。QFPDD-H治疗组结合型胆汁酸水平明显升高(P < 0.05),由低到高依次为:TωMCA(122.3%)< TβMCA(359.0%)< TαMCA(419.0%)< TCA(1708.0%)。然而,ANIT和QFPDD-H之间甘氨酸结合型胆汁酸和游离胆汁酸水平没有明显变化。经QFPDD-L处理后,ANIT与QFPDD-L之间胆汁酸含量无明显变化。UDCA处理后部分胆汁酸水平显著升高,包括TDCA(7068.0%)、GDCA(1060.9%)、ωMCA(942.9%)、TCDCA(681.5%)、12-DHCA(585.1%)(与ANIT组相比,P < 0.05)。
《3.5 QFPDD和UDCA治疗后ANIT诱导胆汁淤积性肝损伤大鼠血清标志物的变化》
3.5 QFPDD和UDCA治疗后ANIT诱导胆汁淤积性肝损伤大鼠血清标志物的变化
如图5(a)~(d)所示,ANIT模型组大鼠血清AST、ALT、ALP、γ-GT水平均显著高于对照组正常大鼠。UDCA治疗不能抑制除ALT外的其他血清学指标的升高,QFPDD治疗仅能降低AST和ALT水平,常规血清学指标组间差异较大。因此,常规血清学标志物不能准确地反映UDCA或QFPDD的治疗效果。
《图5》
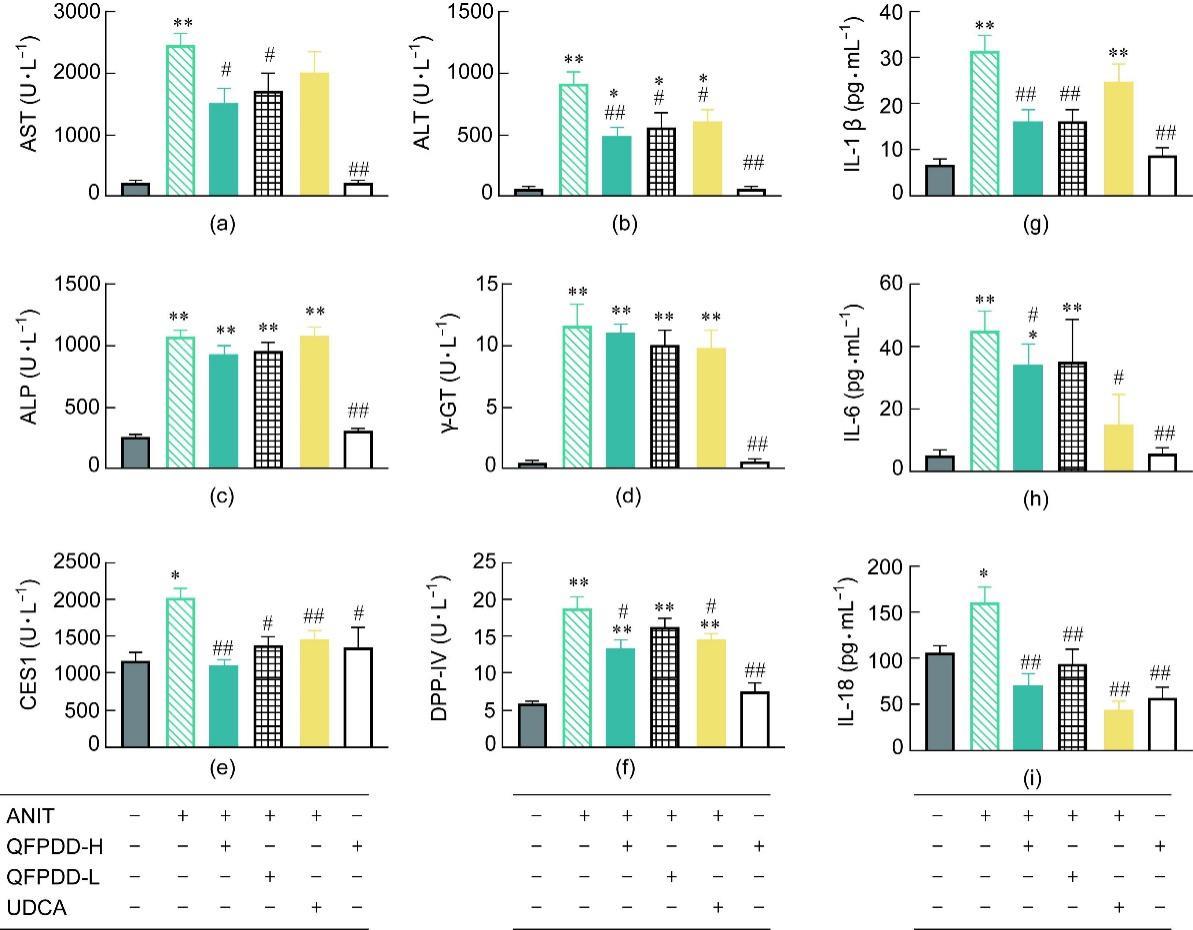
图5 QFPDD或UDCA治疗后ANIT诱导胆汁淤积性肝损伤大鼠血清中不同标志物的变化。(a)~(d)传统血清学标志物(ALT、AST、ALP和γ-GT)。(e)、(f)新的血清学标志物(CES1和DPP-IV)。(g)~(i)炎症因子(IL-1β、IL-6、IL-18)。*:与正常对照组相比,P < 0.05;**:与正常对照组相比,P < 0.01;#:与ANIT组相比,P < 0.05;##:与ANIT组相比,P < 0.01。
为了进一步评估血清中CES1和DPP-IV的诊断潜力,检测了血清中CES1和DPP-IV的活性[图5(e)、(f)]。与正常大鼠比较,ANIT模型大鼠CES1和DPP-IV活性显著升高(P < 0.05, P < 0.01),UDCA或QFPDD-H治疗后,血清CES1和DPP-IV水平与ANIT组相比均显著降低(P < 0.05, P < 0.01)。
如图5(g)~(i)所示,ANIT模型大鼠IL-1β、IL-6和IL-18水平高于正常大鼠(与正常对照组相比P < 0.05、P < 0.01),而QFPDD-H治疗组血清IL-1β、IL-6、IL-18水平显著降低(与ANIT组相比,P < 0.05、P < 0.01)。UDCA治疗组血清IL-18、IL-6水平明显降低(与ANIT组相比,P < 0.05、P < 0.01),IL-1β水平呈下降趋势,但无统计学意义。这些数据表明QFPDD和UDCA对ANIT诱导的炎症反应具有治疗作用。
《3.6 QFPDD和UDCA对ANIT诱导胆汁淤积性肝损伤模型大鼠肝脏血清学标志物残余活性的影响》
3.6 QFPDD和UDCA对ANIT诱导胆汁淤积性肝损伤模型大鼠肝脏血清学标志物残余活性的影响
为了追踪血清学标志物的来源,检测了肝组织S9中AST、ALT、ALP和γ-GT的总活性[图6(a)~(d)]。与正常大鼠比较,ANIT给药后肝组织中AST、ALT、ALP总活性显著升高(P < 0.05, P < 0.01);γ-GT出现相反的血清学变化,其活性显著降低(P < 0.05)。QFPDD-H、QFPDD-L或UDCA治疗显著降低AST和ALT活性(与ANIT组相比,P < 0.05、P < 0.01)。与QFPDD相比,UDCA更明显降低肝脏中ALP的活性,QFPDD-H和UDCA均提高肝脏中γ-GT的活性(与ANIT组相比,P < 0.05)。值得注意的是,正常大鼠经QFPDD-H治疗后肝内ALP水平显著降低(与正常对照组比,P < 0.05),而γ-GT水平显著升高(与正常对照组相比,P < 0.05)。这些结果表明,肝内酶是不稳定的,容易被这些药物诱导。
《图6》
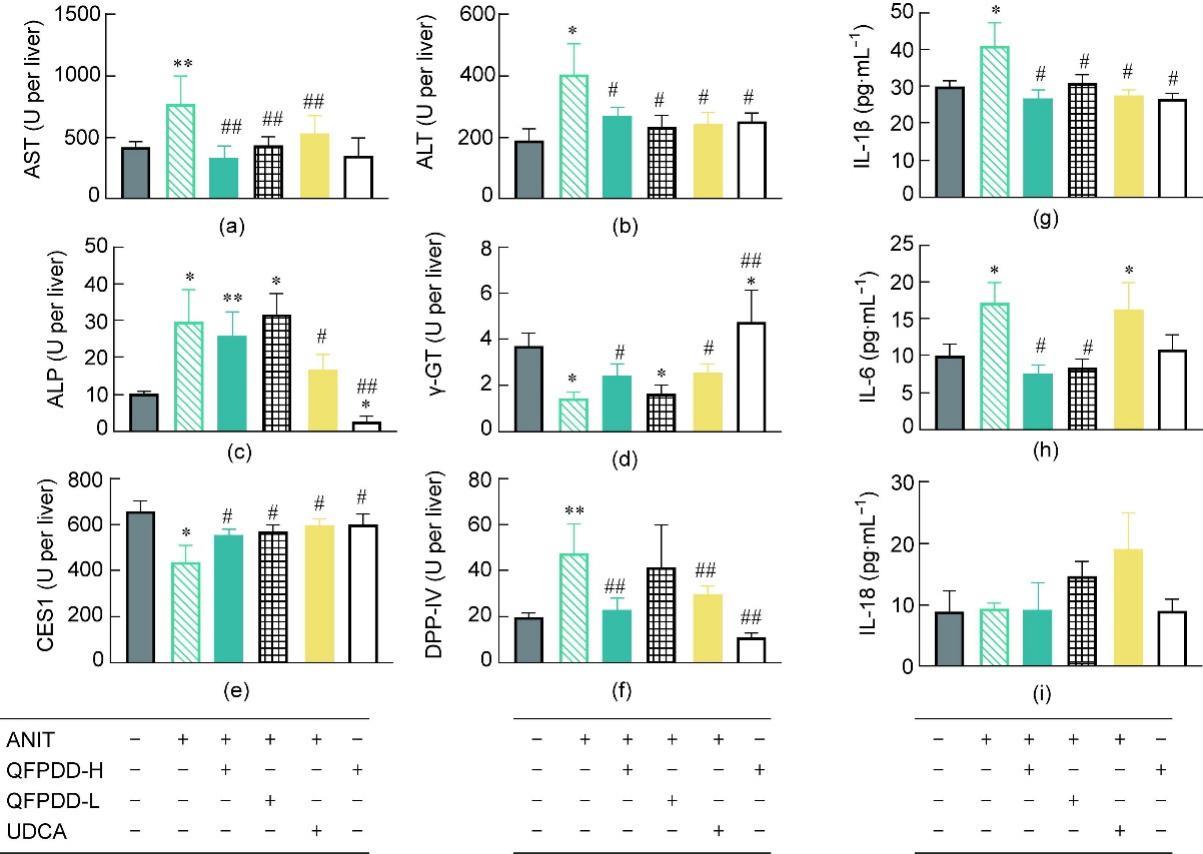
图6 QFPDD或UDCA治疗后ANIT诱导胆汁淤积性肝损伤大鼠肝脏中不同标志物残留活性的变化。(a)~(d)传统血清学标志物(ALT、AST、ALP和γ-GT)。(e)、(f)新的血清学标志物(CES1和DPP-IV)。(g)~(i)炎症因子(IL-1β、IL-6和IL-18)。*:与正常对照组相比,P < 0.05;**:与正常对照,P < 0.01;#:与ANIT组对照,P < 0.05,##:与ANIT组对照,P < 0.01。
接下来,追踪了肝内CES1和DPP-IV活性,并对它们作为新的血清学生物标志物的价值进行了评估[图6(e)、(f)]。如图6(e)所示,研究发现ANIT模型中大鼠肝内的CES1活性与正常大鼠相比显著降低(P < 0.05),与血清CES1活性的升高相对应。经QFPDD-H、QFPDD-L或UDCA治疗后,CES1活性水平的下降明显逆转(与ANIT组比,P < 0.05),并可以接近正常水平。QFPDD-H给药对正常大鼠的CES1水平无明显影响。如图6(f)显示,DPP-IV的活性变化与血清学生物标志物的变化一致,即与正常大鼠相比,ANIT模型中DPP-IV和这些血清学生物标志物浓度显著增加(P < 0.01),QFPDD-H和UDCA治疗导致ANIT模型大鼠肝脏中DPP-IV活性显著降低(与ANIT组比,P < 0.01),而QFPDD-L对DPP-IV活性无明显逆转作用。QFPDD-H对正常大鼠DPP-IV活性无明显影响。
本研究还追踪了组织中炎症因子的变化[图6(g)~(i)]。与DPP-IV活性变化一致,ANIT给药后肝脏中IL-1β和IL-6水平显著升高(与正常对照组相比,P < 0.05)。但是,QFPDD-H或QFPDD-L处理可显著降低组织中IL-1β和IL-6水平(与ANIT组比,P < 0.05),UDCA治疗只能降低组织中IL-1β水平(与ANIT组比,P < 0.05),而对IL-6没有影响;这些变化与血清中相关因子的水平完全不同。QFPDD-H给药对正常大鼠炎症因子无影响。
《3.7 CES1、DPP-IV与损伤标志物的相关性分析》
3.7 CES1、DPP-IV与损伤标志物的相关性分析
对本研究中检测的所有标志物进行相关性分析(见附录A中的图S7),r值在0.5~1之间表示中度至良好的正相关,在-0.5~-1之间表示中度至良好的负相关。三种病理评分与血清ALT、AST、ALP、γ-GT、CES1、DPP-IV、IL-1β、GCA、GHDCA、GCDCA、TLCA、TCDCA、TCA水平及肝脏TCDCA和TCA水平呈正相关(r > 0.5; P < 0.05)。相反,这些评分与肝脏CES1、γ-GT水平和血清DCA以及胆汁中全部胆汁酸水平呈负相关(r < -0.5; P < 0.05)。值得注意的是,尽管传统的血清学生物标志物可以反映器官损伤,但很难确定它们是否来自肝脏,因此特异性的回顾性验证是非常必要的。病理评分与肝脏CES1水平和γ-GT水平呈负相关,与血清CES1水平呈正相关,提示CES1作为肝损伤标志物的潜力。
血清CES1水平与血清和肝脏中AST、DPP-IV、IL-1β水平均呈正相关(r > 0.48; P < 0.05)。相反,肝脏中CES1水平与AST、ALP、DPP-IV、胆汁酸水平呈负相关,包括血清和肝脏中的TCDCA、TCA(r < -0.5; P < 0.05),但与肝内γ-GT和胆汁中大多数胆汁酸水平正相关(r > 0.5; P < 0.05)。血清CES1水平的升高与常规血清学标志物一致,并与目前用于诊断肝损伤的生物标志物呈正相关。总体而言,血清中CES1水平与血清中GCA、肝脏中IL-6、AST、DPP-IV的相关性最佳,相关系数分别为0.8、0.7、0.7、0.7。肝脏中CES1与炎症、坏死、变性评分的相关性最佳;与胆汁中TCDCA、TDCA、THDCA、CDCA、TCA水平,血清中AST、ALP、TCA、γ-GT水平正相关,系数值均在0.8左右。这些结果表明,CES1水平可以反映肝损伤程度和肝脏合成多种结合型胆汁酸的能力。肝脏和血清CES1水平呈负相关,说明血清中的CES1确实是由肝脏释放的。
血清DPP-IV水平与血清AST、ALT、ALP、IL-1β、IL-18、TCDCA、TCA、TDCA、THDCA、GHDCA、TLCA、HCA水平呈正相关(r > 0.5; P < 0.05),与肝内AST、ALT、ALP、IL-1β、IL-6水平也呈正相关(r > 0.5; P < 0.05)。此外,血清DPP-IV与胆汁中所有的胆汁酸含量呈负相关(r < -0.5; P < 0.05)。血清DPP-IV与肝脏DPP-IV水平呈正相关,与肝脏CES1水平呈负相关(r < -0.5; P < 0.05)。肝脏中DPP-IV与IL-1β、IL-6、IL-18水平呈正相关;与血清中AST、ALT、γ-GT和胆汁酸GCA、GCDCA水平呈正相关;与肝脏中TCA、TCDCA水平均呈正相关(r > 0.5; P < 0.05)。肝脏中DPP-IV水平与肝脏CES1水平呈负相关(r < -0.5; P < 0.05),与炎症标志物呈最佳相关性。总体而言,血清中DPP-IV与三种病理评分相关性最好,与血清中GCA、GHDCA、TCA、ALP、IL-1β相关性最好,与肝脏中CES1相关性最好,与胆汁中TCA、TCDCA、TDCA、THDCA相关性好,相关系数绝对值均大于0.8。而肝脏中DPP-IV与血清中CA、CES1水平、肝脏中AST的相关性最好,相关系数绝对值分别为0.8、0.7、0.7。这些数据表明,血清DPP-IV可以作为炎症标志物,而不仅仅是从受损组织释放的标志物。
《4、 讨论》
4、 讨论
通过病理评分和血清学生物标志物评估组织损伤的相互验证方法应满足以下标准:
(1)生物标志物本身的组织特异性和相对丰度是否满足生物标志物的既定要求?
(2)定量方法和定性方法的特征是否相同?例如,不应对用于表征损伤与表征炎症的方法进行直接对比。
(3)血清与组织生物标志物之间的因果关系是否需要相互回顾性验证或确认?
(4)是否存在炎症或其他损伤因素引起的生物标志物表达上调及渗漏?
病理方法已被公认为是评价组织损伤的金标准,并已用于现有标志物的相互验证。本研究的结果显示,在ANIT诱导损伤后的不同时间点,这两种生物标志物表现出不同于常规血清学标志物的动态变化模式。传统生物标志物含量先于CES1和DPP-IV在血清中出现升高。ANIT诱导54 h后,传统血清学生物标志物含量显著降低,难以表征和监测持续性损伤。相比之下,CES1和DPP-IV在54 h后仍保持较高水平。研究发现传统生物标志物(γ-GT除外),包括ALT、AST、ALP、IL-1β、IL-6、IL-18和部分胆汁酸含量在进行组织追溯性检测时均出现同步升高。ANIT给药后,血清和肝脏DPP-IV水平也明显升高,可能是由于DPP-IV在肝外组织的高表达或炎症刺激所致。当肝脏系统接受药物或病毒等第一次外源性损伤攻击时,肝脏的代谢转化能力受到一定程度的限制和破坏。这导致体内内源性物质如胆汁酸的正常代谢状态被破坏,引发全身免疫攻击,产生大量活性氧(reactive oxygen species, ROS),最终诱导免疫系统攻击其他组织器官[33‒35]。对于特定组织中生物标志物的相对丰度,研究发现肝脏中CES1的丰度最高,其次是小肠、肾脏和脾脏[11]。同时,CES1在肝脏中的残留活性降低,这与CES1血清水平的变化呈负相关。这些结果表明,血清中CES1水平的升高可能是由于CES1在组织中的残余活性降低所致;CES1是跟踪肝细胞特异性损伤的良好标志物,血清中CES1水平的升高仅由肝细胞破坏引起,而不是由于细胞增殖或表达增加。
上述传统血清学生物标志物均为多脏器分布,特异性较差,且在肝脏中的丰度与CES1不在一个数量级[36]。因此,损伤后,传统生物标志物的升高可能是由于它们从多个器官/组织中释放,或者是由于生物标志物在肝脏中的诱导表达[35]。此外,很难确定损伤剂是否会导致细胞中传统生物标志物的表达升高或细胞破坏性渗漏,或两者兼有,从而导致对肝损伤的潜在误导评估。DPP-IV以前被认为是一种炎症标志物[8]。在本研究中,发现血清中DPP-IV水平升高,且与肝脏炎症评分密切相关,进一步验证了DPP-IV作为炎症生物标志物的潜力。值得注意的是,正常大鼠肝脏中DPP-IV残余活性水平较低,但在ANIT诱导的肝损伤后DPP-IV活性显著升高。因此,血清中DPP-IV水平的升高可能不仅仅源于肝脏组织,还可能是由于炎症细胞在血清和肝脏组织的浸润。与炎症因子相似,在炎症细胞浸润后,DPP-IV在血清和肝脏中的水平升高,因此DPP-IV作为标志物更加持续和稳定。本文研究结果表明,CES1(肝损伤的肝内生物标志物)和DPP-IV(炎症的肝外生物标志物)的联用可以准确地评估和跟踪肝脏特异性损伤(包括持续性损伤),也可以反映肝脏中的炎症状态。
一般认为,肝损伤可分为三个阶段:
(1)外源性因素如药物或病毒对肝细胞的直接破坏。
(2)第一阶段后,从肝脏排出的毒素(包括胆红素、胆汁酸、肠道细菌、细菌毒素等)引起继发性肝损伤。
(3)以上两类损伤导致免疫系统失衡和激活,导致自身免疫攻击。
这三个阶段并不是完全分开的,在大多数情况下是重叠的。在本研究中,选择了不同的生物标志物来反映肝损伤的不同阶段。例如,CES1代表第一阶段,胆汁酸代表第二阶段,DPP-IV代表最后阶段。ANIT给药后,发现这些标志物都发生了变化,而且相互交叉覆盖。可用标志物区分不同的机制和阶段,进而清楚地识别ANIT引起的肝损伤的三阶段的重叠覆盖关系。在本实例中,ANIT引起的肝损伤状态在一定程度上接近于COVID-19感染引起的肝损伤的病理特征,是由炎症引发的损伤。
QFPDD是一种多成分中药配方,在中国广泛用于治疗COVID-19 [22]。然而,QFPDD对肝损伤的保护作用仍不明确。在本研究中,为了模拟冠状病毒感染引起的急性肝损伤,采用了单次给药ANIT诱导大鼠肝损伤模型。综合分析病理变化、胆汁流量、胆汁酸水平变化以及传统和新的血清生物标志物,发现QFPDD对ANIT引起的肝损伤具有治疗作用。值得注意的是,与UDCA相比,QFPDD对损伤和炎症减弱作用更好,经QFPDD治疗后肝组织中CES1和DPP-IV的活性表现出明显差异。QFPDD中的小柴胡汤已被广泛用于中医治疗慢性肝病,并在D-半乳糖胺诱导的小鼠肝损伤模型中显示出较强的治疗作用[37‒39]。此外,Chen等[40]报道,小柴胡汤可显著减轻胆管结扎大鼠的胆汁淤积。ANIT给药可导致血清和肝脏中结合胆汁酸和游离胆汁酸水平的整体增加,胆汁中结合胆汁酸和游离胆汁酸的水平显著降低,尤其是次级胆汁酸。然而,QFPDD-H治疗改变了血清中游离初级胆汁酸和结合型次级胆汁酸的水平,改变了肝脏中结合型初级胆汁酸和游离初级胆汁酸的水平,以及牛磺酸结合型初级胆汁酸和游离初级胆汁酸的水平。
总的来说,在胆汁酸代谢方面,QFPDD治疗通过引起胆汁酸谱的更多变化来改善胆汁淤积,同时逆转牛磺酸结合型初级和次级胆汁酸水平变化。本研究表明,在ANIT诱导的损伤后,肝脏中胆汁酸的结合反应大大增加,可能是由于胆汁淤积期间作为底物的游离胆汁酸水平显著增加。然而,QFPDD治疗可以保护胆管细胞免受损伤,并通过抑制炎症来恢复胆汁排泄,从而减轻胆汁淤积。Wang等[41]在给药前使用甘草酸进行预防性治疗,发现甘草酸可降低ANIT模型中牛磺酸结合型胆汁酸的丰度。然而,牛磺酸结合型胆汁酸的增加可能是对急性毒性作用的补偿。有报道称,牛磺胆酸盐在肝脏中积累导致肝纤维化,甚至RöhrL等[42]发现牛磺胆酸盐可以促进HepG2细胞中抑癌基因的表达。因此,牛磺酸结合型胆汁酸水平的降低可能反映了QFPDD对肝细胞炎症损伤的保护作用。从治疗角度而非预防角度[43],本研究结果证实了QFPDD可降低结合型胆汁酸水平,从而发挥对抗肝损伤的作用。在本研究结果中,肝脏CES1水平与损伤的病理评分呈负相关。结合相关性分析发现,肝损伤后CES1在肝脏中的活性降低,提示CES1是肝损伤的实用生物标志物。DPP-IV与肝脏或血清中的许多生物标志物具有良好的相关性。其中,与胆汁酸的相关性主要与结合型胆汁酸相关,也和炎症因子尤其是IL-6相关。与CES1不同,IL-6与胆汁酸水平呈高度负相关。本研究还观察到IL-1β、IL-6和IL-18水平与血清中的胆汁酸水平呈负相关,这与DPP-IV和炎症因子的相关性是一致的。
《5、 结论》
5、 结论
综上所述,与本研究新开发的生物标志物CES1和DPP-IV相比,血清中传统的血清学生物标志物只能提供有限的信息来表征肝脏特异性损伤的程度。显然,仅用传统血清学生物标志物难以甚至无法做出具体的机制性或阶段性判断。相比之下,监测肝脏中特定酶的残余活性可能是一种更准确和直接的追溯方法,可以区分炎症和损伤,从而避免个体差异、给药途径、建模因素、炎症和内源性毒素造成的干扰。本研究表明,CES1的酶活性可以反映直接肝细胞损伤,而DPP-IV是炎症浸润及其相关机制性生物标志物。本研究的追溯验证方法采用血清和组织之间的对照互证,揭示了联合使用CES1和DPP-IV可成为最有效评估肝损伤及其特异性程度的标志物。这种方法似乎是最方便、有效和稳定的终点方法之一。















 京公网安备 11010502051620号
京公网安备 11010502051620号




