《1、 引言》
1、 引言
多光子(multiphoton, mP)显微成像技术使用近红外脉冲激光器,具有成像深度大、光漂白少、光毒性小的优点,因此已广泛应用于活细胞、厚组织和器官的成像研究[1‒5]。然而该技术的空间分辨率受光学衍射极限限制,不能应用于活体样品的超微结构成像。随着高功率激光器、高灵敏度探测器、荧光探针和相关光电器件的快速发展,超分辨远场光学显微技术取得了显著成就。目前超越衍射极限的超分辨方法包括光激活定位显微成像(photoactivated localisation microscopy, PALM)[6‒7]、随机光学重建显微成像(stochastic optical reconstruction microscopy, STORM)[8‒10]、受激辐射耗尽显微成像(stimulated emission depletion, STED)[11‒12]和结构光照明显微成像(structured illumination microscopy, SIM)技术[13‒14]。
在PALM和STORM中,荧光分子以可控的方式稀疏地发出荧光,通过对单个荧光分子的精确定位重建出荧光超分辨图像——在每个成像面衍射受限的局部区域内,仅有单个分子发出荧光并被记录,随后以纳米或亚纳米的精度确定单个分子的位置。获得这样的超分辨图像需通过PALM和STORM获取数千张原始图像。尽管这两种方法可实现约10 nm的分辨率[15‒16],但对于以超分辨成像的方式对活细胞快速运动过程进行实时成像或对细胞过程进行长期监测仍然是一个难题。
在STED中,激发光的衍射受限焦点与STED光重叠,利用斯托克斯红移的甜甜圈形状的光(即STED光)抑制激发态处的荧光分子发光,仅STED光束的中空中心区域(该区域小于激发光束的衍射受限焦点)内的荧光分子可被激发产生荧光 [11‒12],从而突破衍射极限。尽管STED能够实现20~30 nm分辨率的细胞成像,并可用于厚样品成像[17‒20],但它通常需要一个高功率STED激光器,比STORM或PALM的激发光功率要高4~6个数量级;因此用STED对活细胞成像可能使活细胞受到损害,在活细胞实验中必须权衡空间分辨率和光毒性之间的关系。
SIM是另一种超分辨成像技术,该技术不需要特定的荧光团(如STORM中的“开-关”荧光分子或STED中的特定荧光分子)。在SIM中,莫尔效应用于提高显微成像分辨率[13];SIM通常通过结构光照明激发样本,从而将不可探测的高空间频率信息转移到显微成像系统的可探测通频带内。在线性SIM中,通过将不同相移和不同方向的结构光条纹投射到样本上获得原始图像,然后进行反卷积运算和图像重构,重建图像的分辨率比宽场显微成像提高了两倍。饱和结构光照明显微成像(saturated structured-illumination microscopy, SSIM)通过荧光饱和激发形成高频条纹,以获得更高的分辨率,但饱和激发导致了显著的光漂白和对细胞的光损伤[21‒22]。最近,基于可开关的荧光蛋白的SSIM实现了分辨率约为40 nm的细胞成像[23‒24]。在线性SIM中,重建一幅超分辨图像所需的原始图像数量远少于STORM或PALM所需的原始图像,所需激光功率也明显小于STED;这些优势使SIM适用于活细胞的快速成像[25‒27]。研究者已成功利用光栅[13]、空间光调制器[23]或数字微镜器件[28]在样本中实现了结构光照明。SIM可灵活应用于各种生物结构成像,包括线粒体[27,29]、细菌[30‒31]和其他样本[32‒34]。
虽然超分辨显微技术取得了显著的进步,但mP超分辨显微技术的发展仍然很缓慢[35]。mP效应来源于样本对激发光强度的非线性响应。例如,双光子(2P)荧光强度与激发光强度的平方成正比,因此由正弦结构照明图案激发的均匀荧光溶液产生的2P荧光图案是一种非正弦结构,该图案由所有频率叠加而成,包括基频及其振幅不等的高阶谐波。为了解决mP显微成像中荧光团的非线性响应问题,研究者开发了用于2P-SIM的扫描结构照明成像(scanning patterned illumination, SPIN)和扫描结构探测成像(scanning patterned detection, SPADE)两种成像方法[36]。在SPIN中,通过去除2P光学传递函数(optical transfer function, OTF)通频带内的谐波(2
在此,本文提出了利用非正弦结构荧光照明图案的mP-SIM和相应的超分辨重建算法;当荧光团在mP激发过程中的非线性响应阶数m足够多时,在理论上mP-SIM可实现无限分辨率。mP-SIM类似于SPIN,均使用EOM对激发光进行正弦强度调制。扫描正弦结构照明图案可以激发出样本中的非正弦结构荧光照明图案,其原理是在非饱和激发的前提下,将直流项、基频和荧光团在mP激发中因非线性响应产生的一系列谐波叠加在一起。谐波与样本结构相互作用,将更高频率的信息转移到探测荧光OTF的通频带内,从而进一步提高分辨率。本文还研发了所需的超分辨重建算法,可根据所要求的分辨率选择合适的谐波数量来重建超分辨图像。理论结果表明,与传统2P显微成像(2P microscopy, 2PM)相比,mP-SIM最高可将横向分辨率提高m + 1倍,且不需要特定的荧光团或高功率激光。此外,本研究展示了2P-SIM在纳米颗粒和牛肺动脉内皮细胞(bovine pulmonary artery endothelia, BPAE)内染色F-肌动蛋白上的应用。2P-SIM和二次谐波产生(second-harmonic-generation, SHG)-SIM分别可实现86 nm和72 nm的横向分辨率。据了解,上述分辨率是迄今为止在2P-SIM中实现的最高分辨率。
《2、 材料与方法》
2、 材料与方法
《2.1 光学成像系统》
2.1 光学成像系统
光学成像系统(图1)主要由Nikon倒置显微镜,60×油浸物镜(CFI Plan Apochromat Lambda, Japan)和中心波长被调至810 nm的锁模钛蓝宝石激光器(Mai Tai DeepSee, Spectra-Physics, USA)组成。激光脉冲宽度为100 fs,输出功率为2.7 W。使用EOM(Model 350, Conoptics, USA)对激光光强进行正弦调制。由数据采集卡(data acquisition, DAQ; NI-PCI6110)产生锯齿波信号,并以此信号驱动二维振镜(two-dimensional galvo scanner, 2D GS; Model 6210H, Cambridge Technology, USA)对激光进行逐行扫描。扫描透镜的焦距为60 mm。激发光照明图案是通过扫描激发光光束与对激发光光强进行正弦调制产生的。通过控制EOM改变正弦波的相位和周期,可以改变照明图案的相位和方向。荧光经过物镜后由二向色镜反射,并用2P滤光片(ET625SP-2P, Chroma, USA)过滤以阻挡激发光,随后荧光信号通过一个短焦透镜聚焦到光电倍增管(photo multiplier tube, PMT; H7422-50, Hamamatsu, Japan)。对于SHG成像,需将荧光发射滤光片替换为SHG滤光片(ET405/10×, Chroma)以对后向SHG信号进行滤波,随后SHG信号被聚焦到PMT。
《图1》
图1 光学成像系统示意图。锁模近红外钛蓝宝石激光(红色)经EOM进行光强正弦调制,由2D GS逐行扫描,随后通过60×物镜到达样本以激发样本产生荧光。荧光(绿色)经物镜后被二向色镜反射离开激发光路,并被PMT检测。M1、M2:反射镜1、反射镜2;f:焦距;Ex:激发; HWP:半波片;DM:二向色镜;OBJ:物镜;PMT:光电倍增管。注:图片不按比例绘制。
《2.2 系统控制与数据采集》
2.2 系统控制与数据采集
该系统由个人计算机控制。通过基于LabVIEW编写的自定义控制程序同步控制EOM、2D GS和PMT。正弦波和锯齿波信号由型号为NI-PCI-6110的数据卡产生,分别用于控制EOM和2D GS。PMT的输出电压信号由低噪声前置放大器(Model SR570, Stanford Research Systems, USA)放大,并通过相同的数据卡获取,获得的数据用于重建原始的结构荧光图像。在不旋转样品的情况下,通过改变正弦波信号的初始相位和周期,可得到相对于2D GS快轴方向15°、75°和135°的扫描结构照明图案。对于每个方向上的扫描结构照明图案,至少需要5种不同的初始相位(即0、2π/5、4π/5、6π/5、8π/5)。在实验中扫描速率设置为每秒一帧。
《2.3 数据处理》
2.3 数据处理
通过用MATLAB(MathWorks, USA)编写的自定义程序对原始图像进行处理以获得超分辨图像。数据处理主要包括以下几个步骤:①重新调整原始图像。为了补偿光源光强波动和光漂白,对原始图像进行了强度调整,以使所有图像在减去背景后总强度相等。②通过每个方向的5幅原始图像计算出分离的各个频率分量。利用切趾法略微调整频谱,以减少离散傅里叶变换引入的噪声和边缘伪影。③将在三个方向上分离出来的频率分量移动到频谱实际位置,并根据它们的权重进行线性叠加。④对叠加频谱进行维纳滤波,重建超分辨图像。
《2.4 荧光微珠制备》
2.4 荧光微珠制备
黄绿色荧光微珠(直径75 nm;Fluoro-Max, G75; Thermofisher Scientific, Germany)用于评定系统的横向分辨率。荧光微珠按1∶1300的比例稀释(蒸馏水中为1∶100,乙醇中为1∶13),并分散在清洁过的常规盖玻片上。风干几分钟后,盖玻片上的乙醇和水都被蒸发。随后,用清水轻轻清洗盖玻片,以去除多余和未固定的荧光微珠。再次风干后,荧光微珠被分散在硅油中并沉积在盖玻片上,最后将盖玻片覆盖在载玻片上并用指甲油密封。
《2.5 BPAE 细胞样本》
2.5 BPAE 细胞样本
FluoCells® 玻片#1(F36924, Thermofisher Scientific)上的BPAE细胞被多种荧光染料染色。线粒体用红色荧光染料MitoTracker® Red CMXRos标记,F-肌动蛋白用绿色荧光染料Alexa Fluor® 488 phalloidin标记,细胞核用蓝色荧光染料4′,6-diamidino-2-phenylindole(DAPI)标记。
《2.6 胶原纤维样本》
2.6 胶原纤维样本
从Balb/C小鼠尾巴上取出尾腱,并在磷酸盐缓冲液中保存10 min。载玻片和盖玻片用乙醇超声清洗10 min,用氮气吹干,并用氧气等离子清洗5 min。从尾腱上切下10 mm长的切片,放置在载玻片上,盖上盖玻片,用口腔胶合剂密封。甘油用于匹配样本和盖玻片之间的折射率。
《3、 理论》
3、 理论
在附录A的注释A中详细介绍了基于mP激发过程中荧光非线性响应的mP-SIM的广义理论。理论表明,在扫描mP-SIM中,将正弦结构图案激发产生的非正弦结构荧光图案的谐波完全利用起来可以实现无限分辨率。理论方程中不足以影响结果的常数因子被省略。由于mP激发过程是非线性的,在宽场模式下难以激发mP荧光。可通过同步激发光的正弦强度调制与扫描,产生正弦结构激发照明图案。
随后以一维分辨率提高为例进一步阐释:在利用扫描正弦结构激发光图案激发荧光团时,荧光团在mP激发过程中通过非线性响应产生高达m阶的谐波频率,从而在mP显微成像中提高一维分辨率。探测器逐点累积获取荧光信号以生成最终的图像(见附录A中的注释A)。
(1)
式中,
为了更直观地计算,傅里叶空间中图像
(2)
式中,
由于在mP激发过程中的荧光非线性响应,谐波首先出现在激光激发的峰值处,代表精细的结构信息。根据式(2),更高阶谐波与样本结构的相互作用将更高的不可探测的频率信息转移到显微系统的通频带内。谐波频率越高,可实现的分辨率越高。因此,在mP-SIM重建算法中,可以根据需要提高的分辨率,选择合适的谐波数量来重建超分辨图像。
随后以4P-SIM为例,对mP-SIM理论的广泛性进行更详细地阐述。将直流项、基频(
根据矩阵方程可知,4P4-NLSIM至少需要9帧不同相位
《4、 实验结果》
4、 实验结果
为了验证mP-SIM成像理论,本研究仿真了不同成像图案下的纳米颗粒成像,包括传统2PM、2P1-LSIM、2P2-NLSIM、3P3-NLSIM和4P4-NLSIM,并比较了这些成像图案的PSF(见附录A中的注释B)。可通过提高非线性效应阶数m(以m = 1、2、3和4为例)来研究mP-SIM的分辨率提高程度。以数字生成了一个理想样本(见附录A中的图S1),该样本包含了随机分布在物平面上的纳米颗粒。纳米颗粒的尺寸为1 nm,其大小远小于衍射极限,与仿真物平面的像素大小相当。同时,图像像素均为512 × 512。在物平面上,将被纳米颗粒占据的像素的灰度值设为1,其他像素的灰度值设为0。随后用显微系统的艾里斑表示纳米颗粒在成像平面上的成像图案。此外将所有成像图案的发射波长设置为535 nm。仿真实验使用60×物镜,其数值孔径(numerical aperture, NA)为1.4,并采用空间周期为210 nm的正弦结构照明图案。为了更清楚地比较这些成像图案的分辨率差异,本研究只给出了两个颗粒的仿真图像(见附录A中的图S1),并提供了衍射图像中沿粒子中心黄线的归一化横向强度分布(见附录A中的图S2)。结果表明,衍射图像的PSF随着非线性阶数的增加而缩小。传统2PM、2P1-LSIM、2P2-NLSIM、3P3-NLSIM和4P4-NLSIM的归一化光强分布的半高宽(full-width at half maximum, FWHM)分别为210 nm、112 nm、74 nm、53 nm和43 nm。另外,为了直接比较上述方法的分辨能力,使用了常用荧光团的激发波长和发射波长的真实值,并给出相应的Siemens星靶仿真图像(见附录A中的图S3)。与传统2PM相比,4P4-NLSIM的分辨率提高了约5倍。为了更好地说明mP-SIM的超分辨能力,仿真了mP-SIM的OTF(见附录A中的图S4)。根据仿真结果,在mP-SIM中非线性效应阶数m与重建图像分辨率d之间的关系可表示为
(3)
式中,d为mP-SIM的最高分辨率;
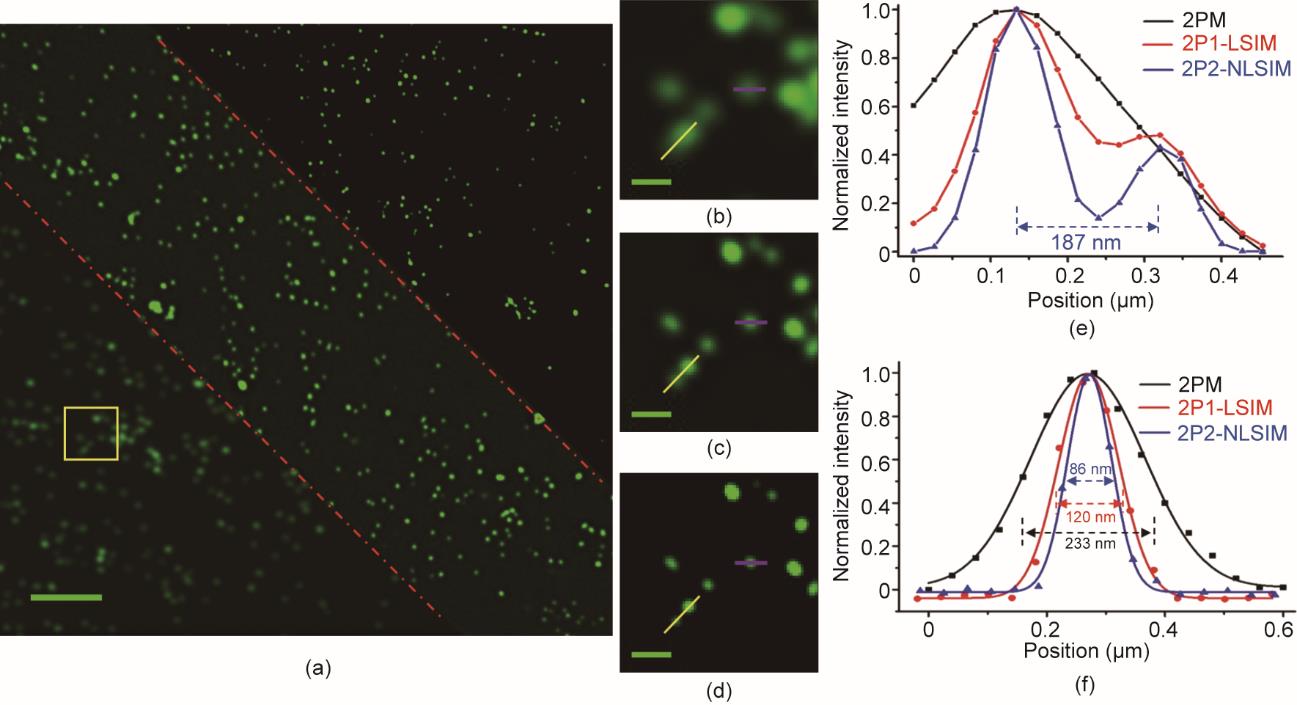
为了通过实验证明2P-SIM(图1)的分辨率提高程度,使用传统 2PM、2P1-LSIM和2P2-NLSIM对75 nm荧光微珠成像。控制信号由DAQ产生:生成频率分别为32.3 kHz、120.8 kHz和88.49 kHz的正弦波,使得EOM分别产生15°、75°和135°方向的结构照明图案。同时,采用1 kHz和1 Hz的锯齿波控制2D GS运行。每帧非正弦结构荧光照明图案原始图像的采集时间为1 s。在每个方向上由5种相位间隔为2 π/5弧度的正弦结构激发照明图案激发样本产生荧光,以获取五帧非正弦结构荧光原始图像。对于三个方向,共记录了15帧非正弦结构荧光原始图像。图2展示了在不同成像图案下采用mP-SIM算法获得的重建图像,以及沿黄线和紫线并经衍射像点中心的归一化强度曲线。图2(a)为2PM(左下)、2P1-LSIM(中)和2P2-NLSIM(右上)的75 nm荧光微珠图像。图2(a)内的黄框放大图如图2(b)~(d)所示。提高的分辨率如图2(e)所示,其中2P1-LSIM无法区分开的两颗荧光微珠可以通过2P2-NLSIM辨别分开。在图2(f)中,2PM、2P1-LSIM和2P2-NLSIM的横向分辨率分别为(233 ± 10) nm、(120 ± 8) nm和(86 ± 4) nm。与传统2PM相比,2P2-NLSIM将横向分辨率提高了2.7倍。
《图2》
图2 2PM、2P1-LSIM和2P2-NLSIM 对75 nm荧光微珠成像。(a)由传统2PM(左下)、2P1-LSIM(中)和2P2-NLSIM(右上)成像的75 nm荧光微珠图像。放大的黄框区域用于比较三种成像图案:(b)2PM;(c)2P1-LSLM;(d)2P2-NLSIM。(e)、(f)(b)~(d)中黄色和紫线的归一化强度分布图,显示平均FWHM分别为(233 ± 10) nm、(120 ± 8) nm和(86 ± 4) nm。扫描荧光条纹基频周期为273 nm。比例尺:(a)2 µm;(b)~(d)0.3 µm。
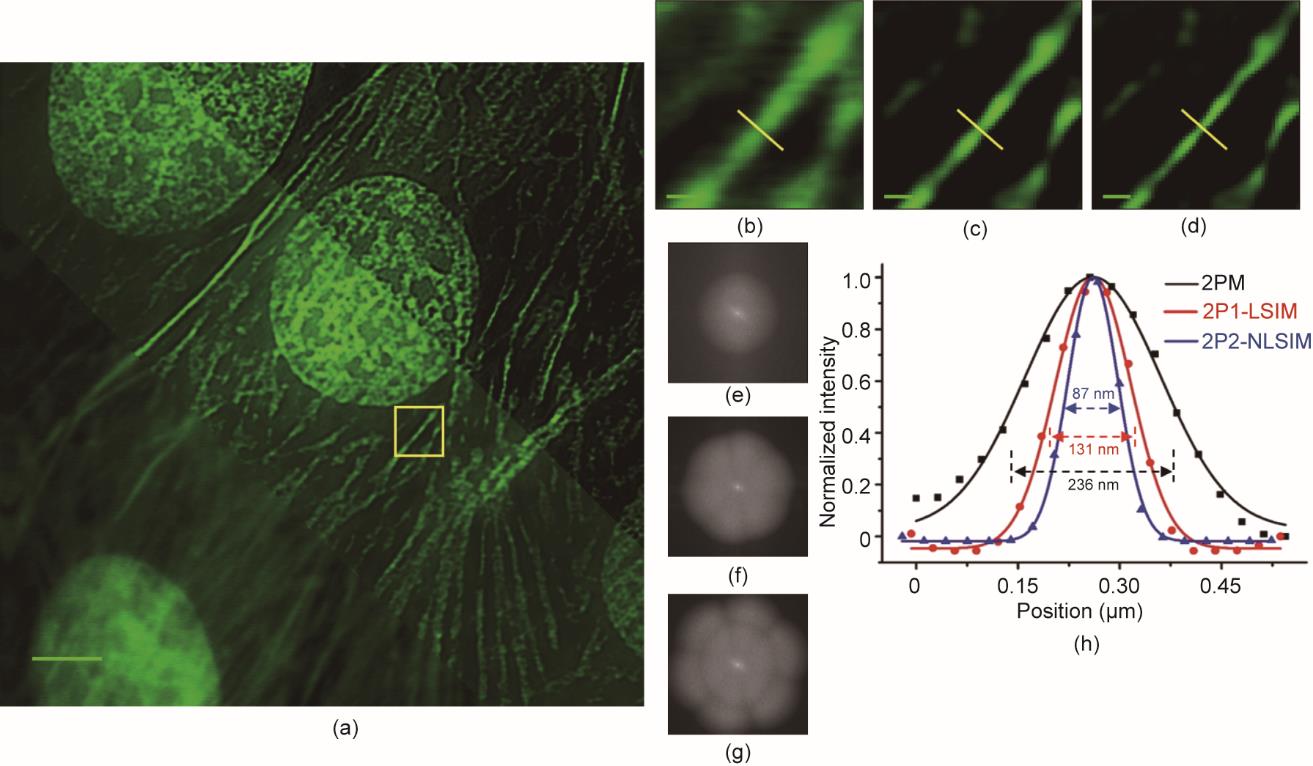
为了验证mP-SIM在生物成像方面的潜力,使用与上述相同的显微系统和参数,并以不同的成像图案对BPAE细胞中由荧光染料标记的细胞核和F-肌动蛋白进行成像(图3)。与传统2PM和2P1-LSIM相比,2P2-NLSIM提高了图像的分辨率和对比度。F-肌动蛋白微丝的FWHM为87 nm,其分辨率相比于传统2PM提高了2.7倍。
《图3》
图3 由2P2-NLSIM实现的分辨率提高。(a)对BPAE细胞中F-肌动蛋白微丝和细胞核成像得到的传统2PM(左下)、2P1-LSIM(中)和2P2-NLSIM(右上)图像。(b)~(d)(a)中黄框区域的放大视图,突出显示了由2PM(b)、2P1-LSIM(c)和2P2-NLSIM(d)获取的图像之间的分辨率差异。(e)~(g)传统2PM(e)、2P1-LSIM(f)和2P2-NLSIM(g)分别为对(b)~(d)的图像进行傅里叶变换后获得的可观测空间频谱。(g)更大的可观测空间频谱代表重建样本图像具有更高的空间分辨率。(h)三幅图像中沿同一黄线的强度分布。结果表明,传统2PM、2P1-LSIM和2P2-NLSIM的FWHM分别为236 nm、131 nm和87 nm。扫描荧光条纹基频周期为273 nm。比例尺:(a)3 µm;(b)~(d)0.3 µm。
接下来,将mP-SIM应用于对小鼠尾腱胶原纤维的SHG成像。胶原纤维具有非中心对称结构,可产生强烈的SHG信号。本次实验探测到的是后向SHG信号。图4为传统SHG显微成像(SHG microscopy, SHGM)、SHG1-LSIM和SHG2-NLSIM之间的比较;可观察到SHG2-NLSIM在分辨率和对比度方面有显著改善。传统SHGM、SHG1-LSIM和SHG2-NLSIM的胶原纤维FWHM分别为195 nm、98 nm和72 nm。对比SHGM,SHG2-NLSIM的分辨率提高了三倍,与理论分辨率值相近。
《图4》
图4 SHG2-NLSIM中的分辨率和对比度提高。(a)对小鼠尾腱胶原纤维成像得到的传统SHGM(左下)、SHG1-LSIM(中)和SHG2-NLSIM(右上)图像。(b)~(d)(a)中黄框区域的放大视图,突出显示了由传统SHGM(b)、SHG1-LSIM(c)和SHG2-NLSIM(d)获取的图像之间的分辨率和对比度差异。(e)三幅图像中沿同一黄线的强度分布。结果表明,传统SHGM、SHG1-LSIM和SHG2-NLSIM的FWHM分别为195 nm、98 nm和72 nm。扫描荧光条纹基频周期为273 nm。比例尺:(a)3 µm;(b)~(d)0.3 µm。
《5、 讨论》
5、 讨论
虽然超分辨显微技术近年来进展迅速,但mP超分辨显微技术的发展却很缓慢。本文提出了非线性效应的mP-SIM超分辨成像方法,其横向分辨率随着非线性效应阶数m增大而提高。虽然在惠更斯图像处理软件(Scientific Volume Imaging, the Netherlands)的反卷积过程中可能使用了不恰当的维纳参数并造成了重建图像中的伪影,但本研究首次利用mP非线性效应将传统2PM和SHGM的横向分辨率提高了约三倍。实验证实:2P-SIM可实现86 nm的横向分辨率和SHG-SIM可实现72 nm的横向分辨率。此外,mP-SIM具有以下优点:首先,可以在现有的mP显微镜上插入激发光强度调制器来实现mP-SIM的光学成像系统。其次,mP-SIM可以使用在传统2PM中常用的荧光团和激发光功率。再次,mP-SIM可以直接应用于其他相干非线性光学显微成像技术,如相干反斯托克拉曼散射(coherent anti-stokes Raman scattering, CARS)和受激拉曼散射(stimulated Raman scattering, SRS)成像。值得注意的是,mP激发和SHG是不同的物理过程:2P成像是一个包含非相干PSF的非相干过程,SHG成像是一个包含相干PSF的相干过程。因此,不能利用宽场SIM原理提高SHG成像分辨率[40‒41]。但对于点扫描SIM,可通过扫描成像在样本相邻点引入时间延迟,使得SHG的相干特性无效。因此可以直接将点扫描SIM理论应用在SHG成像上以此提高点扫描SHG显微技术的分辨率。
《6、 结论》
6、 结论
在本研究中,首先通过mP显微系统以较低的激发光功率产生荧光和激发光之间的非线性效应,而不需要使用饱和激发的高功率。其次,将扫描与正弦强度调制相结合,在仿真物平面上生成时间累积的条纹结构图案。由于mP成像系统的荧光非线性响应,因此正弦结构图案(如ω)触发了非正弦荧光结构图案(如2P的2ω)。荧光结构与样品结构叠加混合,混合后的荧光信息直接由PMT检测。mP-SIM可以直接解调谐波,因此不需要锁相探测器[42]。最后,mP-SIM图像重建算法的核心是在常规SIM重建原理的基础上增加了谐波项运算。由于荧光团在mP激发过程中的非线性响应,谐波首先出现在激光激发的峰值处,因此具有更精细的结构信息。与传统的mP显微成像相比,mP-SIM中的谐波将分辨率提高了m + 1倍。在mP-SIM重建算法中,可以根据需要提高的分辨率来选择谐波数量。分辨率越高,所需谐波的阶数就越多。然而使用更多的谐波,需要更多具有不同相位的荧光结构原始图像。例如,在2P2-NLSIM或SHG2-NLSIM中,至少需要15帧相移图像(每个方向5帧)来重建一幅各向同性分辨率,理论分辨率分别为74 nm或58 nm。因此,期望在未来可通过共振镜或多焦点方案来提高成像速度。此外,利用声光偏转器对感兴趣的区域成像也能提高局部成像速度。















 京公网安备 11010502051620号
京公网安备 11010502051620号




