《1、 引言》
1、 引言
氢气(H2)作为能源载体具有碳排放为零的环境效益[1‒4]。然而,当前世界范围内超过95%以上的H2仍然是以化石燃料作为原料进行生产的,该方式带来的二氧化碳(CO2)排放甚至高于直接利用化石燃料提供能源的过程[5]。因此,减少对于化石燃料的依赖和采用可再生清洁资源作为原料对于制氢过程至关重要[6‒7]。生物乙醇(C2H5OH)是目前来源于可再生生物质的应用最广的液体燃料。乙醇分子具有较高的H/C比,是一种极具潜力的制氢原料[8]。经过3 d的过渡金属催化,乙醇可以直接与水发生蒸汽重整反应,产生富氢气体[公式(1)] [9]。这一过程利用生物乙醇生产过程中的粗产物,避免了能耗巨大的乙醇-水共沸混合物的蒸馏分离过程[9‒11]。
(1)
然而,乙醇蒸汽重整反应是一个强吸热反应,需要依赖外界热量来驱动反应发生。化学链蒸汽重整(chemical looping steam reforming, CLSR)是一种过程强化技术,可以提升蒸汽重整过程的效率[12‒13]。在乙醇化学链蒸汽重整过程中,载氧体(oxygen carrier, OC)首先在重整反应器中与乙醇发生氧化还原反应。例如,当将NiO作为载氧体时,C2H5OH与NiO的氧化还原反应如公式(2)所示。
C2H5OH + 6NiO (s) → 2CO2 + 3H2O +
(2)
随着氧(O)的消耗,NiO中的Ni2+被还原为金属Ni。接下来,乙醇蒸汽重整反应在金属Ni的催化作用[公式(1)]下开始进行。当反应条件的水碳比(steam-to-carbon ratio, S/C)较低时,Ni表面会同时发生乙醇的热分解反应[公式(3)]:
(3)
公式(1)~(3)均为吸热反应。Ni随后在再生反应器中被空气重新氧化[公式(4)]。在乙醇蒸汽重整反应中生成的积碳也同样发生气化[公式(5)]。
(4)
(5)
蒸汽重整过程所需热量可以由再生反应器中载氧体[公式(4)]和积碳[公式(5)]的氧化反应提供。因此可以将需要额外提供给重整反应器的热量最小化。乙醇化学链蒸汽重整的总反应可以被看作乙醇蒸汽重整反应和乙醇完全氧化反应的加和[公式(6)]。
(6)
载氧体通常是可还原的金属氧化物,在乙醇化学链蒸汽重整反应中发挥着至关重要的作用。采用金属氧化物替代氧气(O2)可以大大降低操作过程中的安全风险[8]。载氧体提供的氧还可以显著降低化学链蒸汽重整过程中的水碳比,并能在合适的C2H5OH/H2O进料比下实现自热产氢,从而使过程能耗显著降低。化学链过程中的载氧体必须满足一系列实际应用的要求[14‒15],其中最重要的是载氧体材料需要具有长周期的氧化还原稳定性,并能提供具有适宜活性的氧物种[16]。NiO是一种性能较好的载氧体,被用于多种化学链过程进行研究[17]。Jiang等[18]将NiO/蒙脱石应用于乙醇化学链蒸汽重整过程,并在20个循环中实现了大于60%的H2选择性。然而,由于体相NiO的氧释放过程过于剧烈,由体相NiO还原得到的Ni分散度通常较差,无法提供足够的活性表面积以实现反应物种的活化以及长周期的操作,大大限制了Ni基载氧体的稳定性[19‒21]。因此,调节氧释放过程的还原动力学是实现Ni物种高度分散并进而提升Ni基载氧体性能的关键。
由于Ni2+(69 pm)与Mg2+(72 pm)具有相近的尺寸,二者可以在合适的焙烧温度下形成全浓度范围内的取代型NiMg1-O固溶体(0 ≤ x ≤ 1)[22‒24]。在NiMg1-O固溶体中,Ni-Ni边界被Mg2+隔离开,进而抑制了Ni2+在晶格中的快速扩散[25]。固溶体的还原速率与体相Ni2+的扩散速率有关,并可以通过Ni2+在NiMg1-O中的浓度进行调节[26]。Huang等[27]设计了具有固溶体结构的Mg-Ni-Al-O载氧体,并在化学链燃烧过程中取得了优异的性能。NiMg1-O固溶体在化学链过程中展现了巨大的潜力,然而将该固溶体作为载氧体应用于乙醇化学链蒸汽重整过程中的性质尚不明确。
本研究合成了具有不同化学组成的NiMg1-O固溶体,并将该固溶体作为载氧体应用于乙醇化学链蒸汽重整过程,研究了Mg2+对NiMg1-O固溶体性质的调节作用。Ni基载氧体的氧释放性质随着Mg2+的引入可以实现可控调节。然后,研究了NiMg1-O固溶体的结构转变与表面反应机理之间的关系。通过乙醇-水脉冲和H2程序升温还原(H2-temperature-programmed reduction, H2-TPR)研究了NiMg1-O固溶体的氧释放行为,并采用原位漫反射傅里叶变换红外光谱(diffuse reflectance infrared Fourier-transform spectroscopy, DRIFTS)表征了乙醇化学链蒸汽重整反应过程中中间体的变化。
《2、 材料和方法》
2、 材料和方法
《2.1 载氧体的制备》
2.1 载氧体的制备
一系列NiMg1-O (x = 0.2, 0.4, 0.6, 0.8)固溶体通过共沉淀的方法进行制备。将总金属浓度为2 mol‧L-1的Mg(NO3)2·6H2O(98%;百灵威科技有限公司,中国)和Ni(NO3)2·6H2O(99%;阿拉丁生化科技股份有限公司,中国)溶解于150 mL的去离子水(18.25 MΩ·cm)中。随后将100 mL浓度为6 mol‧L-1的NaOH(99%;阿拉丁生化科技,中国)溶液作为沉淀剂加入。待生成的沉淀老化12 h,过滤分离沉淀并用热去离子水多次清洗以去除钠离子。获得的样品在125 ℃的烘箱中干燥24 h,随后在空气气氛中以10 ℃‧min-1的速率升温至700 ℃焙烧4 h。NiO和MgO同样通过上述的沉淀法制备以作为参比样品。
《2.2 载氧体的表征》
2.2 载氧体的表征
样品的晶相结构通过粉末X射线衍射仪(X-ray diffraction, XRD;布鲁克公司,美国)进行表征,XRD配备了带有Cu靶(λ = 1.54056 Å, 1 Å = 10-10 m)的Bruker D8 Focus。衍射角2θ的范围为20°~80°,扫描速度为8(°)·min-1。样品的形貌在JEM-2100F透射电子显微镜(transmission electron microscopy, TEM;日本电子材料公司,日本)中进行观察,工作电压为200 kV。用于TEM表征的样品在乙醇中进行超声分散后负载在铜网支撑的碳膜上。透射电子显微镜配备了Ultim Max能量色散X射线谱仪(energy-dispersive X-ray spectroscopy, EDS;牛津仪器公司,英国),可用于元素分析。
载氧体的比表面积和孔容在Micromeritics Tristar II 3020分析仪(麦克仪器公司,美国)上通过在-196 ℃下的氮气(N2)吸附-脱附实验进行测量,并分别依据Brunauer-Emmett-Teller(BET)和Barrett-Joyner-Halenda(BJH)方法进行计算。在测试前,样品在300 ℃下脱气3 h。载氧体的元素组成通过电感耦合等离子体发射光谱(inductively coupled plasma optical emission spectroscopy, ICP-OES;VISTA-MPX,瓦里安公司,英国)进行测量。测量前样品在硝酸溶液中进行消解。
载氧体的还原性质通过H2-TPR实验进行测量。实验在配备了热导池检测器(thermal conductivity detector, TCD)的Micromeritics Autochem II 2920仪器(麦克仪器公司,美国)上进行。在实验过程中,样品(100 mg)首先在流动的氩气(Ar; 30 mL‧min-1)气氛下300 ℃预处理1 h。待样品冷却到100 ℃,分析以10 ℃‧min-1的速率从100 ℃升温至950 ℃的流动的H2(体积分数为10 % 的H2)-Ar混合气体(30 mL‧min-1)。
为测量乙醇化学链蒸汽重整过程中的氧传递过程,将Micromeritics Autochem II 2920与Hiden QIC-20在线质谱仪(海德分析公司,美国)联用,分别进行了C2H5OH与H2O或与O2的混合物脉冲实验。在脉冲实验前,所有样品首先在流动的Ar(30 mL‧min-1)气氛下300 ℃原位预处理1 h。接下来,将Ar气流中的C2H5OH与H2O脉冲以及氦气(He)气流中的C2H5OH与O2脉冲引入反应器。定量环的体积为0.5031 mL,相邻脉冲之间的时间间隔为3 min,以排除相互之间的干扰。反应器尾气通过在线质谱进行实时分析,气相组成由质谱不同质荷比(mass-to-charge ratio, m/z)的信号来确定。质荷比m/z为44、31、29、28、27、18、16和2,分别对应CO2、C2H5OH、乙醛(CH3CHO)、一氧化碳(CO)、乙烯(C2H4)、水(H2O)、甲烷(CH4)和H2。
为观测化学链蒸汽重整过程中中间体的转变,原位的DRIFTS实验在装备了漫反射附件和碲镉汞检测器(mercury-cadmium-telluride, MCT)的Nicolet iS50红外光谱仪(赛默飞世尔科技公司,美国)上进行。所有样品首先在Ar气气流中600 ℃预处理0.5 h,随后用Ar吹扫1 h并降温至400 ℃来采集背景光谱。背景光谱用于与在化学链蒸汽重整条件下采集的谱图进行差谱。
载氧体上生成的积碳通过热重分析(thermogravimetric analysis, TGA;TGS-2A,渊博智能科技公司,中国)和程序升温氧化(temperature-programmed oxidation, TPO)实验进行表征。在TGA实验中,将反应后约20 mg的载氧体装入氧化铝坩埚,随后记录载氧体在空气气流中(50 mL‧min-1)以10 ℃‧min-1从50 ℃升温至900 ℃过程中的温度和质量变化。反应后载氧体的TPO实验在前述脉冲实验的装置上进行。样品(50 mg)首先在流动的Ar(30 mL‧min-1)中300 ℃预处理0.5 h。随后载氧体降温至50 ℃,并在体积分数为10%的O2/He混合气体中以30 mL‧min-1的速度从50 ℃升高至900 ℃进行程序升温氧化。尾气中生成的CO2通过在线质谱仪进行记录。
《2.3 化学链蒸汽重整性能评估》
2.3 化学链蒸汽重整性能评估
化学链蒸汽重整测试在一个内径为20 mm、长度为400 mm的不锈钢管式固定床反应器中进行。将2 g载氧体(尺寸为20~40目)用于单次的化学链蒸汽重整测试。在测试之前,首先在200 mL‧min-1的N2气流中将载氧体600 ℃预处理1 h。随后将催化剂床层温度调整至设定温度。S/C为1的乙醇-水的液体混合物通过微量泵(P230;大连依利特公司,中国)以0.03 mL‧min-1的速率引入预热室(200 ℃),混合物完全蒸发后随100 mL‧min-1的N2进入反应器并进行化学链蒸汽重整反应1 h。随后,将反应器加热到适宜的氧化反应温度,并在空气气流(200 mL‧min-1)中再生载氧体10 min。气相产物通过Agilent 490微型气相色谱进行在线分析。该气相色谱具有两个不同的通道用于气相产物分析。通道1装备了长度为10 m的5A分子筛色谱柱,以Ar为载气用于对除CO2外的永久气体(H2、N2、CO和CH4)进行定量。通道2装备了长度为10 m的PoraPlot Q色谱柱,以He为载气用于分析CO2和C1~C3的碳氢化合物。所有的气相产物通过不同通道的微机械热导池检测器(micro-machined thermal conductivity detectors, μTCD)进行定量。在配备了火焰离子化检测器(flame ionization detector, FID)的Agilent 7890A气相色谱仪上对收集后的液相产物进行分析。可能的液相产物包括C2H5OH、CH3CHO和丙酮(CH3COCH3),在N2载气中经过Porapak-Q色谱柱分离后在FID上对这些产物进行定量。含碳产物的选择性(S)通过下式进行计算:
(7)
式中,i表示产物中的不同物种;[i]表示i在所有产物中的摩尔分数。
H2选择性(
(8)
式中,
产物分布(P)由下式计算:
(9)
《3、 结果与讨论》
3、 结果与讨论
《3.1 NiMgO的结构表征》
3.1 NiMgO的结构表征
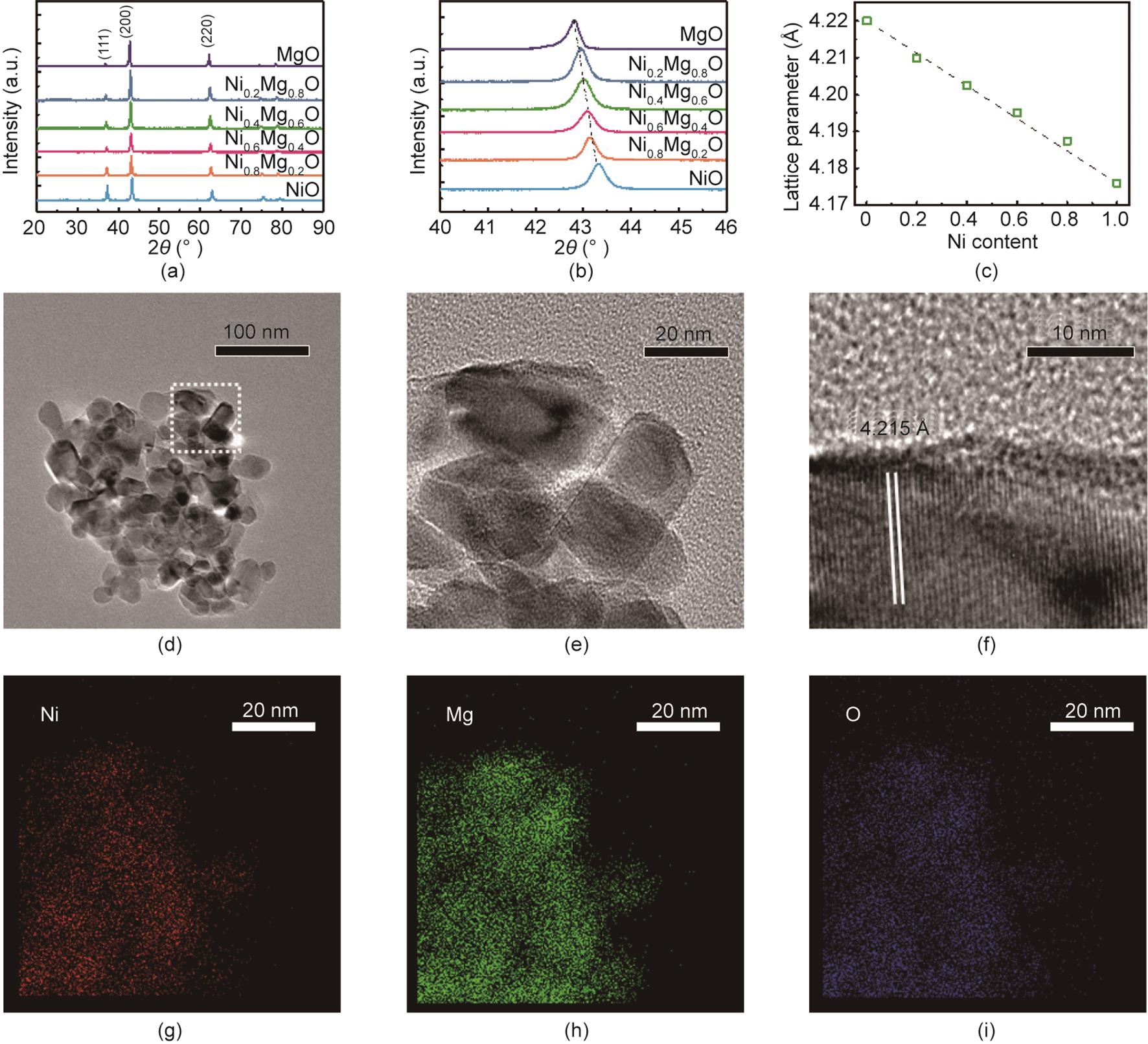
制备的NiMg1-O的物理化学性质见表1。NiMg1-O的BET比表面积为15~30 m2‧g-1,孔容为0.03~0.06 cm3‧g-1。NiO、MgO和NiMg1-O的XRD测试结果如图1(a)所示。NiO、MgO和NiMg1-O均呈现岩盐型晶体结构。根据Scherrer公式计算晶粒尺寸,结果显示不同组成的NiMg1-O晶粒尺寸大致相当。为了观察固溶体中Ni含量对晶格参数的影响,40°~46°范围内的XRD谱图如图1(b)所示。随着样品中Ni含量的提升(从MgO到NiO),NiMg1-O的(200)衍射峰逐渐从42.8°偏移至43.2°。NiMg1-O的晶格参数可以根据XRD峰的位置由Bragg方程进行计算(表1)。将NiMg1-O的晶格参数与固溶体中的Ni含量进行关联,可以得到线性关系[图1(c)],印证了在对应的Ni/Mg比例下NiMg1-O固溶体的生成[22]。
《表1》
表1 不同组成的NiMgO固溶体的物理化学性质
| Sample | Degree of reduction (%) h | Oxygen storage capacity ([O]: mmol‧g-1) h | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Ni0.2Mg0.8O | 27.9 | 0.053 | 7.3 | 12.7 | 0.218 | 4.2090 | 42 | 1.8 | 9.3 |
| Ni0.4Mg0.6O | 19.9 | 0.035 | 7.0 | 13.6/14.5 e | 0.408 | 4.2034 | 67 | 5.0 | 6.9 |
| Ni0.6Mg0.4O | 18.3 | 0.039 | 8.0 | 10.8 | 0.621 | 4.1950 | 72 | 7.1 | 4.2 |
| Ni0.8Mg0.2O | 15.5 | 0.031 | 8.2 | 11.0 | 0.828 | 4.1874 | 78 | 9.2 | 2.3 |
《图1》
图1 NixMg1-xO固溶体的晶相结构和形貌。(a)所制备的MgO、NixMg1-xO (x = 0.2, 0.4, 0.6, 0.8)和NiO样品的XRD图。(b)MgO、NixMg1-xO和NiO的(200)晶面的衍射峰。(c)通过MgO、NixMg1-xO和NiO (200)晶面的衍射峰位置计算的晶格常数;虚线代表晶格常数与NixMg1-xO中Ni含量线性拟合的结果,R2 = 0.993。(d)~(f)Ni0.4Mg0.6O的TEM图像。(g)~(i)Ni0.4Mg0.6O的EDS元素面扫结果。
将Ni0.4Mg0.6O作为例子来表征固溶体的形貌结构。Ni0.4Mg0.6O的TEM图像在图1(d)~(f)中给出。根据图1(d)、(e),Ni0.4Mg0.6O颗粒的尺寸为10~20 nm,同时并没有观察到聚集的NiO晶体。在图1(f)中可以观察到,NiMg1-O (200)晶面的晶格间距为4.215 Å,这与XRD表征的结果一致。EDS面扫可以提供元素分布的信息。由图1(g)~(i)的结果可知,Ni、Mg和O元素在NiMg1-O颗粒中呈现均一分布,印证了取代型Ni-Mg固溶体氧化物的生成。
《3.2 乙醇化学链蒸汽重整》
3.2 乙醇化学链蒸汽重整
为实现高效制氢,本研究选择400 ℃作为乙醇化学链蒸汽重整的反应温度(热力学分析见附录A中的图S1)。反应条件中的S/C固定为1。含碳产物及H2的选择性如图2(a)所示。随着固溶体中Ni含量的增加,CH4的选择性提升,同时导致H2的选择性显著下降。这一现象可以归因于还原后固溶体Ni分散度的下降(表1)。Ni0.2Mg0.8O在不同组成的固溶体中表现出最高的CO选择性,然而CO的生成降低了H2的纯度。在本研究工作中,Ni0.4Mg0.6O表现出了最高的H2选择性,为4.72 mol·mol-1(mol·mol-1代表每摩尔乙醇产生H2的物质的量)。
《图2》
图2 NixMg1-xO固溶体的乙醇化学链蒸汽重整性能。(a)不同NixMg1-xO固溶体在400 ℃下单个循环第二阶段的H2选择性和含碳产物分布;S/C = 1,乙醇转化率大于95%。(b)Ni0.4Mg0.6O在400 ℃下单个循环中乙醇化学链蒸汽重整性能随时间的变化。(c)Ni0.4Mg0.6O在30个循环的稳定性测试中的表现。(d)Ni0.4Mg0.6O在30个循环的稳定性测试后的TEM图像及EDS元素面扫结果。
本文进一步研究了Ni0.4Mg0.6O的性质。400 ℃下单个循环内Ni0.4Mg0.6O在化学链重整过程中的产物随时间的变化情况如图2(b)所示。根据产物分布变化的特点,可以将乙醇化学链蒸汽重整过程分为三个阶段。在第一个阶段(从反应开始到6 min),CO2是最主要的产物。这一阶段乙醇被Ni0.4Mg0.6O的表面氧物种完全氧化。在第二个阶段(6~33 min),随着更多的Ni2+被逐渐还原为金属Ni,乙醇开始在Ni表面分解产生H2和CH4。各气相产物的选择性逐渐保持稳定,此时H2的选择性达到最高值,且CO的浓度被抑制在1%以下。在第三个阶段(33 min之后),乙醇的转化率以及H2和CO2的选择性开始下降,同时更多的CO和CH4开始生成。Ni0.4Mg0.6O在这一阶段逐渐失活。
对Ni0.4Mg0.6O进行循环稳定性测试。在化学链蒸汽重整反应(400 ℃条件下)后,被还原的Ni0.4Mg0.6O和生成的积碳在空气氛围和600 ℃的条件下进行10 min的氧化再生操作。这一过程即研究中的再生步骤(regeneration step)。本研究中,循环测试由60 min的乙醇化学链蒸汽重整和10 min的再生步骤组成。Ni0.4Mg0.6O在循环稳定性测试中的表现如图2(c)所示。在30个循环中,Ni0.4Mg0.6O的H2选择性仅仅下降了3%,说明Ni0.4Mg0.6O的结构可以在再生步骤中较好地复原。30个循环后的NiMg1-O通过TEM和XRD进行表征[见表1、图2(d)以及附录A中的图S2]。Ni0.4Mg0.6O的形貌和晶相结构在长周期的循环后仍得以保持。固溶体的载氧体以颗粒的形式存在,并没有发生明显的烧结。Ni0.4Mg0.6O的晶粒尺寸在稳定性测试后为14.2 nm,与新鲜的Ni0.4Mg0.6O样品相当。这一结果证实了Ni0.4Mg0.6O的结构可以通过再生步骤复原,同时说明固溶体载氧体在乙醇化学链蒸汽重整中具有优异的稳定性能。
《3.3 NiMgO的氧释放行为》
3.3 NiMgO的氧释放行为
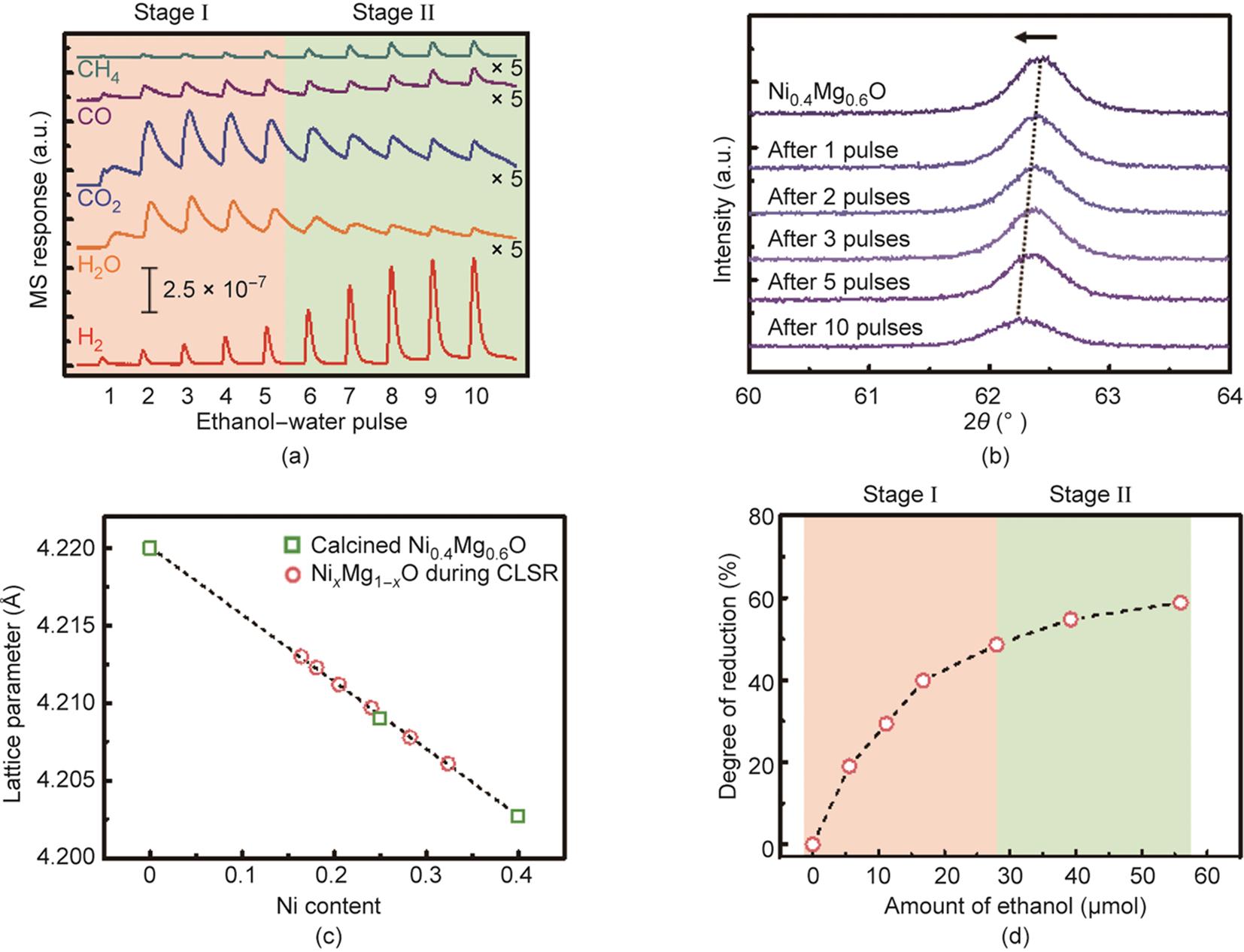
为了研究NiMg1-O的氧释放行为,在400 ℃下对Ni0.4Mg0.6O进行了乙醇-水混合物(S/C = 1)的脉冲实验[图3(a)]。在前5个脉冲中,H2的质谱信号峰并不明显,同时CO2是主要的产物。这一现象说明乙醇和Ni0.4Mg0.6O之间的氧化还原反应是这一阶段的主要过程,这与在产物随时间变化中观察到的第一个反应阶段相对应[图2(b)]。随后,H2的质谱信号峰逐渐变大并保持稳定。CO2仍为主要的含碳产物,对应于第二个反应阶段的特征。
《图3》
图3 乙醇存在条件下Ni0.4Mg0.6O的氧释放行为。(a)Ni0.4Mg0.6O的乙醇-水混合物脉冲实验。(b)脉冲实验中Ni0.4Mg0.6O (220)晶面衍射峰的XRD图。(c)由(220)晶面衍射峰位置计算的Ni0.4Mg0.6O的晶格常数在脉冲实验中的变化。(d)Ni0.4Mg0.6O在脉冲实验中的还原程度。
利用XRD表征脉冲实验中Ni0.4Mg0.6O的组成变化。由于金属Ni在44°左右的位置存在衍射峰,可能会干扰NiMg1-O信号最强的(200)晶面的衍射峰,因此选择强度第二高的(220)面的衍射峰进行分析。Ni0.4Mg0.6O在60°~64°范围内的XRD衍射峰位置随乙醇-水混合物的脉冲次数变化,具体如图3(b)所示。被逐步还原的Ni0.4Mg0.6O的晶格参数可以由峰位置进行计算。若Ni2+和Mg2+在NiMg1-O中的分布是均一的,则固溶体中Ni的含量x可以依据Vegard定律进行计算[28]。
(10)
式中,
Ni0.4Mg0.6O还原程度的变化与前述的脉冲实验结果互相印证。在第一个反应阶段,Ni0.4Mg0.6O的还原程度快速增加。这一阶段乙醇的完全氧化是主导反应,并伴随CO2的生成。在第二个反应阶段,H2在最后三个脉冲中持续稳定地生成。同时,Ni0.4Mg0.6O的氧释放行为仍在继续,从而使其还原程度进一步提高。但相比于第一个阶段,氧释放速率在第二个阶段下降,说明在这一阶段来自Ni0.4Mg0.6O的氧物种参与了乙醇和水的反应并协助H2的生成。H2选择性的提高得益于水气变换反应的发生。乙醇蒸汽重整反应 [公式(1)]中S/C为1.5,高于化学链蒸汽重整反应和脉冲反应条件下的S/C。因此,额外的氧是实现第二个反应阶段稳定产氢的必要条件。第二个反应阶段的化学链蒸汽重整反应如下所示:
(11)
式中,[O]代表来自于NiMg1-O的氧物种。
当来自Ni0.4Mg0.6O的活性氧物种消耗殆尽时,低S/C的反应条件不足以提供蒸汽重整反应所需的氧化能力,从而导致H2和CO2选择性下降(对应第三个阶段)。同时,乙醇分解为积碳,覆盖载氧体的表面并导致其失活。采用TGA和O2-TPO实验来表征这一过程中积碳的生成(见附录A中的图S3)。对历经化学链蒸汽重整三个阶段后的Ni0.4Mg0.6O样品进行TGA分析,开始阶段的质量上升可以归结于Ni的氧化[见附录A中的图S3(a)]。随后观察到的质量下降与O2-TPO中观察到的CO2生成的质谱信号峰对应的温度相一致,对应于表面积碳的气化过程[见附录A中的图S3(b)]。积碳被认为是第三个阶段失活的原因。这一结果同样表明,在乙醇化学链蒸汽重整反应中生成的积碳可以在再生步骤中在600 ℃下实现消除。
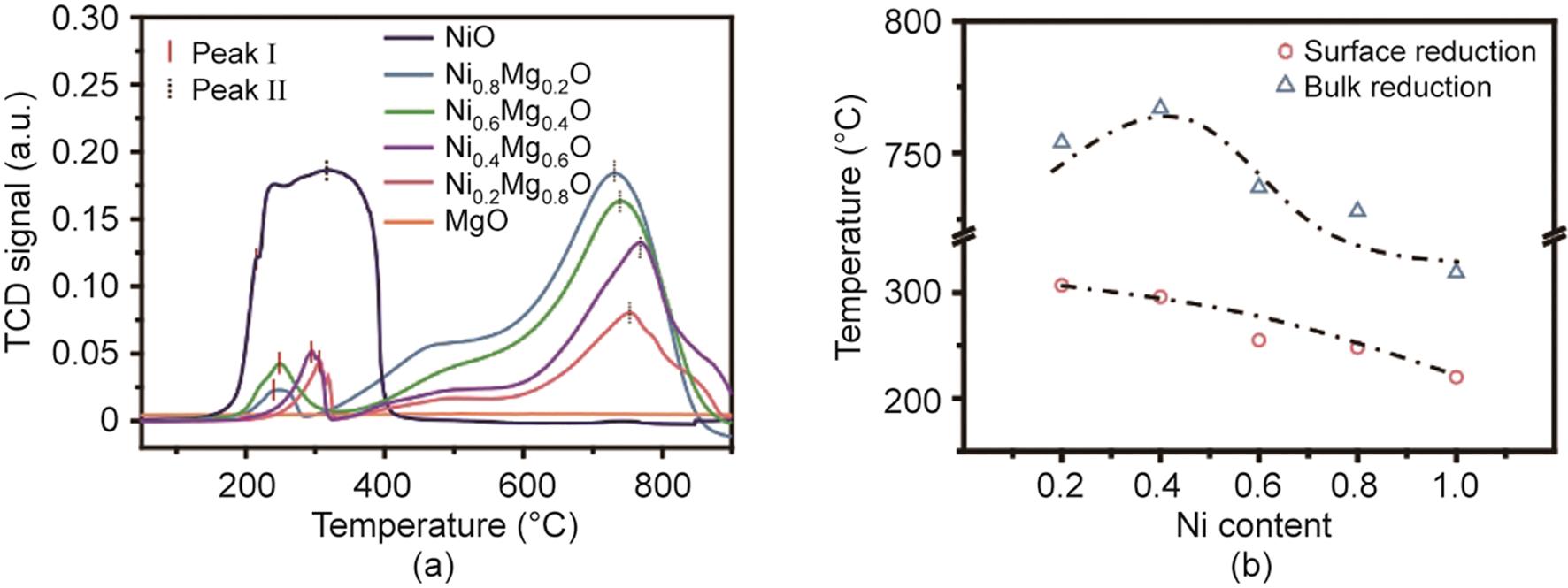
为进一步研究Mg2+对NiMg1-O固溶体性质的调节作用,通过H2-TPR实验测试不同组成固溶体中氧物种的反应活性[图4(a)]。在室温到900 ℃的范围内,在纯MgO上并没有观察到还原峰。纯NiO在200~400 ℃的范围内呈现出一个很宽的还原峰。NiMg1-O的H2-TPR曲线主要包含一个300 ℃左右的面积较小的还原峰和一个400~800 ℃面积较大的还原峰,说明固溶体中包含两种具有不同反应活性的氧物种。根据NiO的还原性质以及NiMg1-O的结构,NiMg1-O的低温还原峰应归属于表面氧的释放;而高温下面积较大的还原峰则对应于NiMg1-O中体相Ni2+的还原[29]。将NiMg1-O不同还原峰的温度总结于图4(b)。可以发现,表面氧的反应活性随NiMg1-O中Ni含量的增加而增加。金属氧化物的还原性与其价带和导带之间的带隙相关[30]。更紧密的价带和导带会使得金属氧化物更加易于被还原[30]。先前的研究表明,当固溶体中Ni含量x大于0.074,NiMg1-O的带隙会随着x线性降低[31]。因此,NiMg1-O的氧释放行为会随着Mg2+含量的提高而受到抑制,这与由H2-TPR观察到的实验结果一致。此外,空气气氛中Ni2+-Mg2+的相互扩散系数会随着Ni2+的浓度呈指数级增长[32]。综上所述,NiMg1-O中Ni2+的扩散会因Mg2+的晶格限域效应而受到抑制,因此,随着NiMg1-O中Mg2+浓度的提高,固溶体体相氧的反应活性降低,对应的还原温度升高。对于Ni0.2Mg0.8O样品,其体相氧还原温度略低于Ni0.4Mg0.6O。这可能是由于还原生成的MgO形成了Ni0.2Mg0.8O的表面层,抑制了体相Ni0.2Mg0.8O后续的深度还原,从而降低体相氧的表观还原温度,并导致还原度降低(表1)。
《图4》
图4 程序升温过程中NixMg1-xO的氧释放行为。(a)NiO、NixMg1-xO (x = 0.2, 0.4, 0.6, 0.8)和MgO的H2-TPR图。(b)NixMg1-xO (x = 0.2, 0.4, 0.6, 0.8)的表面氧和体相氧释放温度。
《3.4 NiMgO反应路径》
3.4 NiMgO反应路径
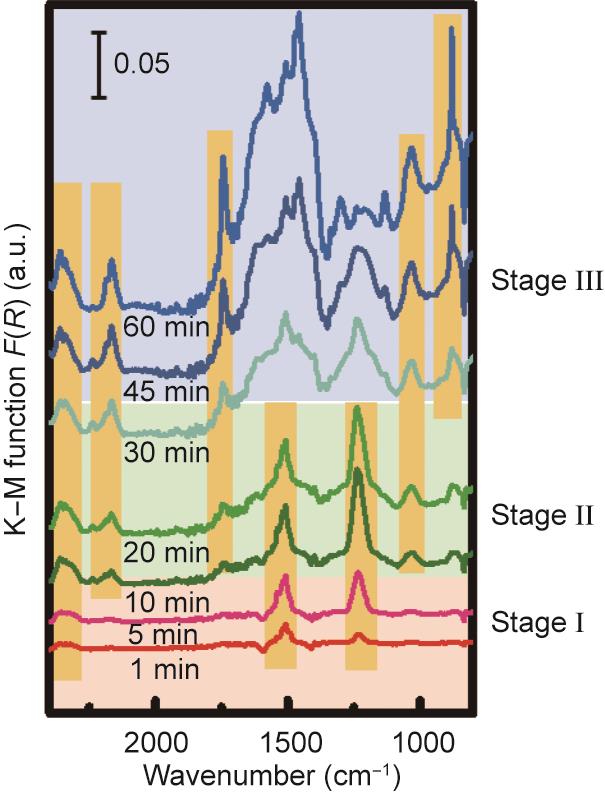
为研究NiMg1-O的反应路径,本文进行了原位DRIFTS实验(见附录A中的图S4)。将不同时间采集的光谱图依据其特点分为三个不同的阶段。为观察Ni0.4Mg0.6O表面含碳物种的变化趋势,将2400~800 cm-1范围内的原位DRIFTS谱图绘制成图5。
《图5》
图5 400 ℃、乙醇-水混合物(S/C = 1)条件下Ni0.4Mg0.6O的原位DRIFTS谱图。K-M:库贝尔卡-蒙克方程。
在反应的开始阶段,可以观察到气相CO2在2350 cm-1以及CO32-在1510 cm-1和1240 cm-1的红外峰[33]。CO2和CO32-的产生可以归因于乙醇被表面氧完全氧化,对应于先前观察到第一个反应阶段。随着反应的进行,CO逐渐生成,对应新出现的2170 cm-1处的红外峰。同时可以观察到1030 cm-1对应CH3CH2O*中的C—O键红外峰[34]。1740 cm-1和1580 cm-1的红外峰归属于CH3COO*中的C——O键,其中CH3COO*是一种典型的Ni基乙醇蒸汽重整催化剂表面的中间体[35];此时对应于第二个反应阶段。红外峰的结果显示,乙醇首先在金属Ni表面分解为CH3CH2O*,随后CH3CH2O*被进一步氧化为CH3COO*。结合第二个反应阶段中固溶体还原速率变慢的现象,水分子或许与NiMg1-O的体相氧在第二个反应阶段中协同氧化乙醇。在第三个反应阶段,CO32-的红外峰逐渐消失,乙酸对应的红外吸收峰的强度逐渐提升。此外,与880 cm-1对应的气相CH4振动峰在这一阶段开始出现。在1600~1400 cm-1范围内出现的多重峰则对应于积碳的C—H振动[36]。中间体的变化表明在这一反应阶段乙醇开始分解产生甲烷和积碳。这一现象是由于反应条件中较低的S/C不足以支持将表面碳物种氧化为CO2。上述提出的NiMg1-O表面的乙醇化学链重整反应机理与先前观察到的固溶体结构的变化相互印证(图6)。
《图6》
图6 乙醇化学链蒸汽重整反应中NixMg1-xO氧物种与表面反应路径关系示意图。
《4、 结论》
4、 结论
NiMg1-O固溶体可作为一种新型的载氧体用于乙醇化学链重整制氢技术。NiMg1-O的氧释放行为可以通过Mg2+的晶格限域效应进行调节。实验结果显示,经过优化的载氧体Ni0.4Mg0.6O在S/C为1的条件下表现出优良的制氢性能(4.72 mol·mol-1)和循环稳定性。本文根据实验结果提出一个化学链蒸汽重整反应三阶段的反应机理。在第一个反应阶段,乙醇被NiMg1-O的表面氧完全氧化。随着表面氧的消耗和表面Ni位点的生成,乙醇在H2O和NiMg1-O体相氧的协同作用下高效制氢,该过程对应第二个反应阶段。在第三个反应阶段,NiMg1-O的氧物种不再参与反应,乙醇蒸汽重整过程为主导过程。采用NiMg1-O作为载氧体的乙醇化学链蒸汽重整过程相比传统的乙醇蒸汽重整催化过程大大降低了S/C,实现了外界供热最小化的可再生H2的生产。这一发现为设计具有良好性能和结构稳定的化学链载氧体提供了切实可行的策略。
















 京公网安备 11010502051620号
京公网安备 11010502051620号




