《1、 引言》
1、 引言
大多数临床生物标志物和治疗药物都是小分子化合物[1]。因此,对干血斑(dried blood spot, DBS)[2]、血浆[3]、尿液[4]和其他体液中这些小分子化合物浓度水平进行监测具有重要意义。肌酸(creatine, CRE)代谢性疾病可能是由于缺乏肌酸转运载体,或缺乏精氨酸-甘氨酸氨基转移酶(arginine‒glycine amidinotransferase, AGAT)和重组胍酰乙酸-N-甲基转移酶(recombinant guanidinoacetate-N-methyltransferase, GAMT),这两种酶均参与CRE合成[5]。CRE代谢性疾病的实验室诊断是检测血浆和尿液中的胍基乙酸(GAA)和肌酸(CRE)[6]。免疫分析是检测常用方法之一,在临床分析中发挥着重要作用,目前仍被用于新生儿筛查[7]。但是,谱图重叠和难以避免的背景干扰限制了多种分析物的检测。
质谱(mass spectrometry, MS)以其高分辨率和特异性克服了多种物质同时检测的难题[8‒11]。线形离子阱(linear ion trap, LIT)是一种具有高效离子捕获和离子富集特点的质量分析器[12]。与三维离子阱不同,在单LIT或双LIT中,离子聚焦在一条线上,而非聚集在一个点上,有效避免了三维离子阱的固有缺陷[13‒15]。最终提高了离子捕获效率,削弱了空间电荷效应,大大提高了质谱分析的特异性和灵敏度[16]。然而,当分析复杂基质中目标物时,空间电荷效应仍然存在并影响质谱检测[17‒19]。因此,简便、高效、自动化而不损失灵敏度地进行临床样本中多种分析物的测定,仍然是LIT-MS的挑战。
四极杆质量分析器是一种动态质量过滤器,在质谱研究中具有众多优势,应用极其广泛。四极杆可单独或串联用以隔离目标离子。单四极杆质谱仪只能测量母离子或源内裂解产生的碎片离子,因此,单四极杆质谱提供的结构信息有限,特异性不如串联四极杆质谱。近年来,三重四极杆串联质谱(triple quadrupole, QqQ)广泛应用于定量分析,被称为“金标准”[5,9,20]。同时,线形四极杆具有稳定性好和使用简便等优点,为离子隔离提供了最有效的解决方案[13]。与单四极杆的局限性类似,QqQ只能提供二级质谱信息,无法区分复杂基质中的同分异构体。还有其他形式的串联质谱仪,如复合线形离子阱三重四极(QTRAP)[21],QTRAP性能优越,但系统结构较为复杂。
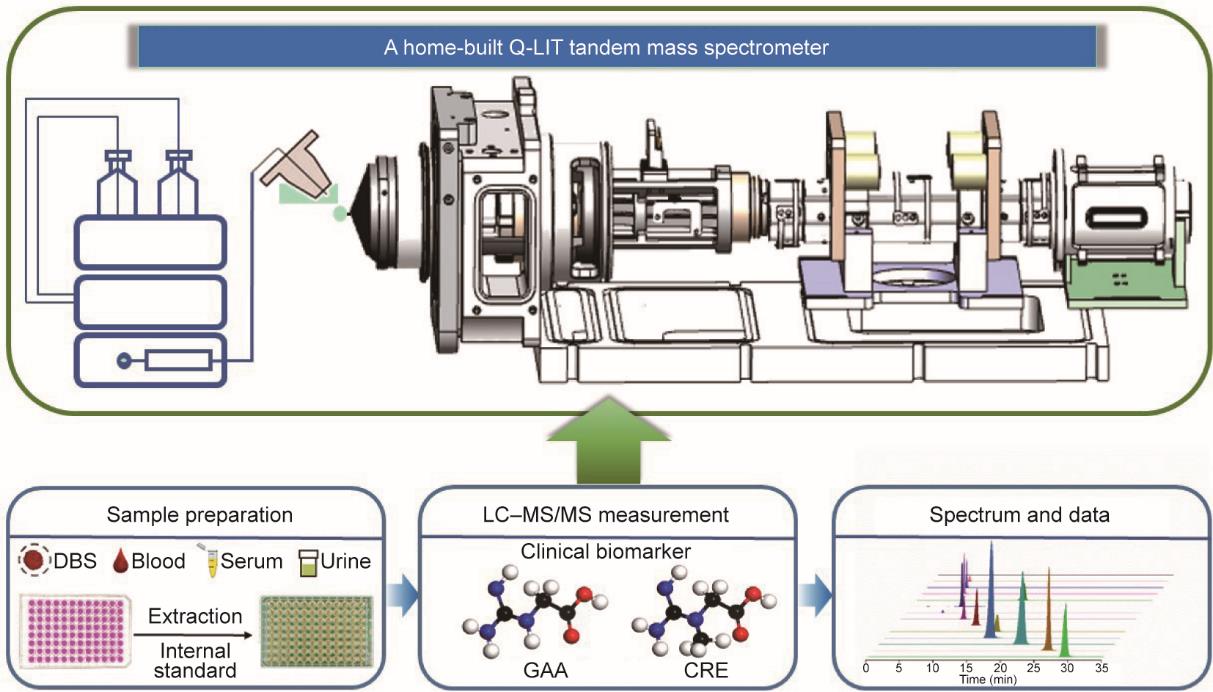
本研究自主研制了一种四极杆-线形离子阱(quadrupole-linear ion trap, Q-LIT)串联质谱仪,可用于测量复杂样本中小分子疾病标志物(图1)。通过四极杆筛选功能,分离目标母离子,消除背景干扰,从而减少进入线形离子阱的离子数量,减弱了空间电荷效应,提高了灵敏度。在线形离子阱中进行母离子碎裂和子离子捕获,无需碰撞池,从而简化了仪器系统结构。同时,在线形离子阱中仍然可以实现多级碎裂(MS, n≥3,其中,n为碎裂级数),并通过精确离子操控实现高准确度定量分析。总之,Q-LIT既不依赖色谱分离,也不需复杂前处理,可显著提升复杂生物样品分析的通量和效率。
《图1》
图1 自主研制Q-LIT串联质谱仪示意图及其应用。LC:液相色谱(liquid chromatography)。
《2、 材料和方法》
2、 材料和方法
《2.1 试剂》
2.1 试剂
GAA、CRE、D2-GAA和D3-CRE标准品(纯度≥99%)购自Dr. Ehrenstorfer GmbH(德国奥格斯堡)。质谱级甲醇、乙腈和甲酸来自赛默飞世尔科技公司(美国宾夕法尼亚州匹兹堡)。其他分析级化学试剂购自国药集团化学试剂有限公司(中国北京)。新生儿干血斑GAA和CRE定量试剂盒(MS/MS法)由中国质谱生物科技有限公司提供。提取液为含0.05%甲酸的甲醇水(80∶20)。GAA和CRE的内标储备液是通过提取液溶解二者粉末混合物制备的,置于棕色玻璃瓶中,4 °C冰箱保存,至少可稳定保存30天。工作标准液用提取液将储备液按1∶110稀释配制,4 °C冰箱保存,最多稳定24 h。
《2.2 仪器设备》
2.2 仪器设备
Q-LIT V2串联质谱仪,由中国计量科学研究院前沿计量科学中心,国家市场监管技术创新中心(质谱)研制。
Q-LIT外观图和内部剖视图如图2(a)所示。仪器整机的长、宽、高分别为65 cm、55 cm、54 cm。关键部件包括四极杆和线形离子阱,如图2(b)所示。四极杆由四个圆柱电极组成,为不锈钢加工而成,场半径(r)为6 mm。每根杆分为三段,长度分别为20 mm、130 mm、20 mm。四极杆阵列的场半径均为5.31 mm。本研究中采用的线形离子阱的几何形状与已报道的相近[22‒23]。线形离子阱的长度为100 mm,x和y两对射频(RF)电极之间的半距离均为6.76 mm。在每个x电极的中心位置有一个宽0.28 mm、长70.0 mm的狭缝。
《图2》
图2 Q-LIT串联质谱仪外观和剖视图(a)关键部件(四极杆,线形离子阱)(b)的示意图。x电极间半距离为6.76 mm, y电极间半距离为6.76 mm,z轴长度为100.0 mm,狭缝长70.0 mm,宽0.28 mm。RF:射频(radio frequency)。
Q-LIT原理如图3(a)所示。利用两个电子倍增器,检测从线形离子阱发射出的离子。在x和y两对电极上分别使用了一个RF线圈,使用平衡的两相射频电压。采用自主开发的独立控制软件(TinyTrap,中国计量科学研究院)来控制Q-LIT系统。本仪器使用的氦气通过聚碳酸酯支架上的孔直接引入线形离子阱,以实现阱内高压。所有实验中,线形离子阱外的压力为2.67×10-3 Pa。四极射频频率为922 kHz,而LIT射频频率为1149 kHz。四极杆RF/直流电(direct current, DC)用于筛选母离子。交流电(alternating current, AC)辅助波形耦合到线形离子阱射频,并应用到x电极进行离子隔离、激发和共振激发。本实验中碰撞诱导解离(CID)的无量纲马修方程参数(q)值为0.40。根据已报道研究[24],隔离和共振激发均选择q值0.83。Q-LIT串联质谱系统的扫描功能示意图如图3(b)所示,通过增加四极射频电压,母离子首先被分离,然后被捕获在LIT中,施加单频交流波形打碎母离子,最后,通过扫描LIT射频电压对子离子进行分析。
《图3》
图3 (a)Q-LIT原理图:(i)毛细管,(ii)管透镜,(iii)离子提取透镜,(iv)短方四极,(v)长方四极,(vi)三段四极杆,(vii)线形离子阱,(viii)电子倍增器,(ix)气体入口,(x)涡轮分子泵,(xi)机械泵。(b)Q-LIT扫描功能。CID:碰撞诱导解离;AC:交流电。
在性能测试实验中,将校正液以10 μL·min-1的流速通过注射泵注入Q-LIT以验证质量范围。将利血平溶液以10 μL·min-1的流速注入Q-LIT,改变扫描速度测试分辨率。通过共振激发进行碰撞诱导解离,观察利血平(m/z 609.30)子离子(m/z 448.05和397.19)质谱图并进行优化。通过改变离子富集时间,观察到利血平离子峰的质量位移和峰宽变化,表明Q-LIT可以有效地降低空间电荷效应。
《2.3 应用》
2.3 应用
Q-LIT在选择反应监测模式(single reaction monitoring, SRM)下,采用正离子电喷雾电离模式对干血斑中的GAA和CRE进行分析。离子源条件:离子源温度为120 °C,吹扫气(氮气)压力为3.45×103 Pa,大气接口温度为305 °C,辅助气(氮气)压力为1.38×103 Pa;鞘气(氮气)压力为6.89×104 Pa,毛细管电压为4.9 kV。GAA和D2-GAA离子富集时间为1800 ms,CRE和D3-CRE离子富集时间为150 ms。优化四极杆射频和离子阱射频,从而尽可能提高灵敏度。母离子、子离子和SRM参数,包括四极杆射频和离子阱射频,如附录A中的表S1所示。使用流动注射分析(FIA)检测GAA和CRE,无色谱柱分离,通过流速改变(附录A中的表S2)形成面包峰,流动相为甲醇/水(80:20, V/V,含0.05%甲酸),进样量为5.0 μL,进样室温度为4 °C。
样品前处理:质控样品和干血斑样品进行打孔,每个样品的直径约为3.2 mm。将每个打孔得到的样品转移到一个干净的96孔板上。每孔加入100 μL工作液,45 °C振荡45 min,转速为750 r∙min-1。收集提取液75 μL,采用FIA-Q-LIT串联质谱检测,进样量为5.0 μL。
采用上述方法对质控品和77个实际样品进行分析。
《3、 结果和讨论》
3、 结果和讨论
《3.1 性能测试》
3.1 性能测试
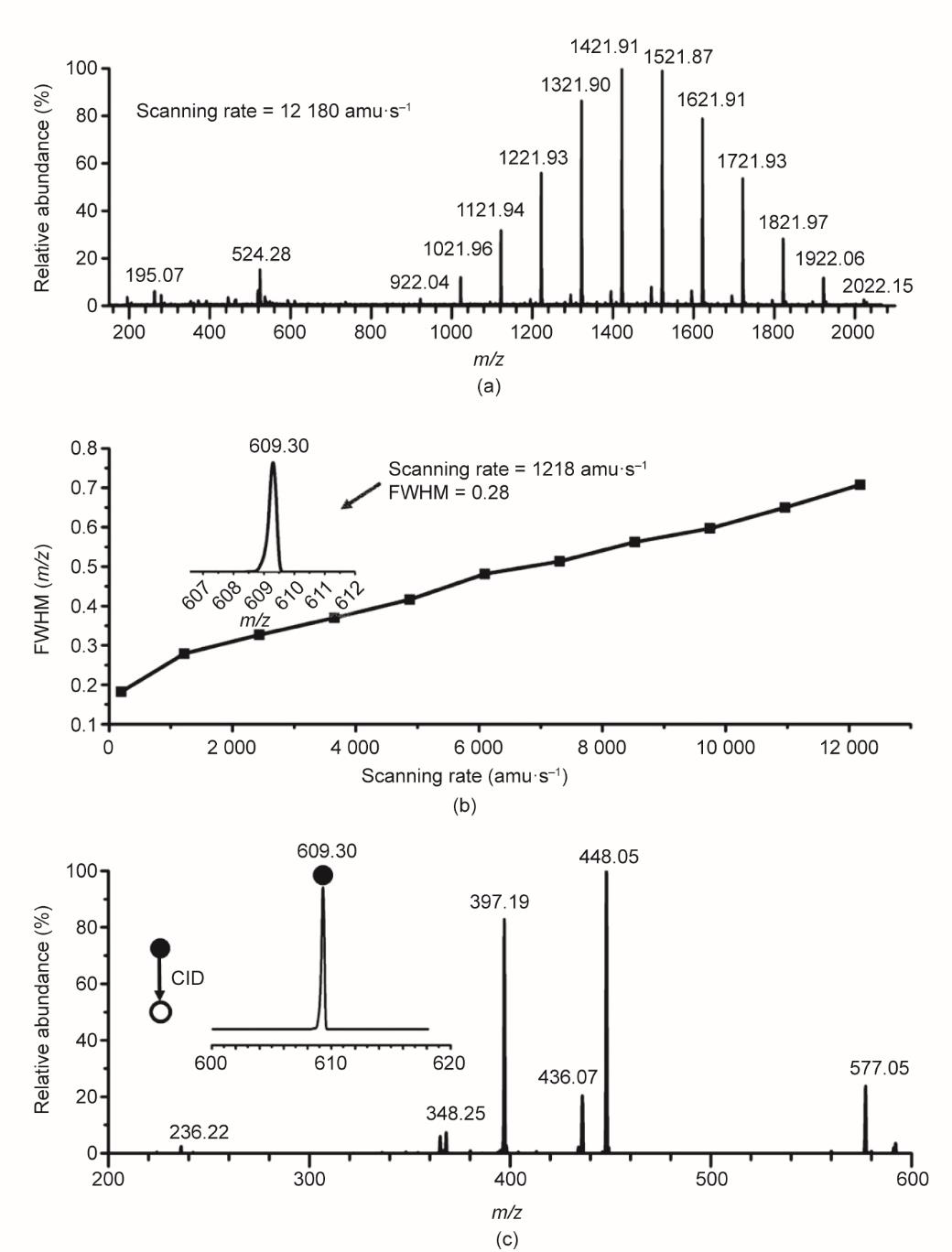
采用Q-LIT测试质荷比(m/z)已知化合物,验证质量范围。该校正溶液中含有质量范围为m/z 195~2022的化合物。在射频扫描过程中,偶极辅助交流电压(405.9 kHz)的幅值从0.21 V提高到8.20 V,促进离子的有效逐出,质量范围在m/z 48~2000之间。图4(a)为扫描速度12 180 amu·s-1的质谱图,在m/z 2000以内,半峰宽小于0.8 amu。
《图4》
图4 (a)Q-LIT扫描校正液的质谱图,扫描范围达m/z 2000;(b)利血平(m/z 609.30)半峰宽,Q-LIT扫描速度与半峰宽的变化关系;(c)Q-LIT获得的利血平二级子离子质谱图,碎裂效率为64%。FWHM:半峰宽(full-width peaks at half-maximum)。
提高Q-LIT质量分辨率的常用方法是降低扫描速度。考虑到在固定质量范围内,基于射频电压的增量数量增加,分离相邻质荷比离子所需时间增加,这些离子在其稳定阈值处会被一起逐出。研究了扫描速度对分辨率的影响,在400~12 000 amu·s-1的不同扫描速度下,采集利血平的质谱图,绘制峰宽与扫描速率关系的函数,如图4(b)所示。质量分辨率随着扫描速度降低而增加,当扫描速度为1218 amu·s-1,利血平半峰宽可达0.28 amu。
研究了离子筛选和碎裂效率。四极杆选择母离子,优化了q值0.25、0.30、0.35、0.40、0.45和0.50,q值为0.30时解离效率最高。因此,在q = 0.30时,CID被共振激发,在碎裂离子的低质量截止点和径向赝势阱深之间提供了良好的平衡。利血平(m/z 609.30)子离子质谱图如图4(c)所示。激活时间为50 ms,CID效率为64%。
《3.2 空间效应》
3.2 空间效应
与相同截面积的三维离子阱相比,二维离子阱的z向延伸使捕获的离子体积增大[8]。当离子从二维离子阱(如线形离子阱)中被逐出时,离子云沿着z轴扩散[22,25],离子不会像在三维离子阱中聚集成直径约为1 mm的球体[26]。本研究使用利血平测试Q-LIT降低空间电荷效应的效果。如图5所示,隔离或碎裂前的离子(红线,未隔离)受空间电荷影响较大。空间电荷通常是通过隔离目标母离子来解决的。为了表征空间电荷对自研Q-LIT串联质谱仪的影响,我们对四极滤质器和线形离子阱两种隔离方法进行了比较。使用1.0 μg·mL-1的利血平标准溶液,根据捕获离子的数量测量质量分辨率、质量位移和响应强度。如图5(a)所示,在不损失质量分辨率的情况下,线形离子阱隔离时间可以从0.1 s提高到0.8 s,四极杆隔离时间从0.1 s提高到0.4 s。当四极杆隔离时间为0.6 s时,分辨率先下降约100,然后保持不变。当离子阱隔离时间从1.0 s增加到8.0 s,分辨率不断下降200。此外,通过隔离可以有效地改善质量漂移,如图5(b)所示。例如,两种分离方法在0.1~8.0 s时,质量偏移均约为0.38 amu。另外,图5(c)定量表征了空间电荷效应引起的响应强度变化。从0.1 s到0.8 s,随着离子注入时间的增加,离子阱隔离的响应强度逐渐增大,当离子注入时间大于0.8 s时,响应强度急剧下降。离子注入时间小于7 s时,四极杆隔离的响应强度一直在逐渐增加。在100 μg·mL-1的蛋氨酸-精氨酸-苯丙氨酸-丙氨酸(MRFA)溶液(m/z 524.56)中添加10 ng·mL-1利血平,检测利血平,也得到了类似的结果。因此,对于离子阱动态范围内的相对纯溶液分析,离子阱的存储波形反傅里叶变换(SWIFT)分离在分辨率和响应强度上优于四极杆隔离,且质量偏移与四极杆隔离相同。然而,在复杂基质分析中,如在2 mL干血斑提取液中加入20 ng利血平(其浓度为10 ng·mL-1),离子阱隔离会受到强烈基质干扰的影响,从而直接导致空间电荷效应,完全无法检出利血平。而四极杆隔离可有效检出,且响应强度随着离子注入时间增加而继续增加,如图5(d)所示。以上结果表明,对于复杂的样品基质,实际样品的基质效应过大,单离子阱分析容易产生空间电荷效应。此外,实际样品中目标化合物浓度未知,需要较大的线性动态范围。因此,Q-LIT具有优势,可以选择性地将母离子从复杂基质样品中分离出来,以减少基质干扰和空间电荷效应,同时可免除复杂样品的色谱分离,从而简化前处理过程。
《图5》
图5 Q-LIT串联质谱的空间电荷研究(利血平,正离子m/z 609.30)。(a)由空间电荷效应引起的利血平标准液的质量分辨率的变化;(b)由空间电荷效应引起的利血平标准液的质量偏移;(c)利血平标准溶液的质量强度随离子注入时间的增加而变化;(d)干血斑中添加10 ng·mL-1利血平的响应强度随离子注入时间而变化。
《3.3 应用》
3.3 应用
质谱作为分析方法中的金标准,在新生儿筛查和其他领域应用中具有重要意义[7]。在Q-LIT V2串联质谱分析中,首先在四极杆中选择目标物母离子,同时在线形离子阱中注入、捕获、碎裂获得并富集目标子离子。多级碎裂离子直接被一起富集。每个分析物选择一个离子对,GAA、D2-GAA、CRE和D3-CRE的子离子分别为m/z 101.12、103.12、90.11和93.10。如图6和图7所示,GAA和D2-GAA的母离子分别为m/z 118.11和m/z 120.09,丢氨(NH3)产生的子离子分别为m/z 118.11和m/z 120.09 [27]。CRE和D3-CRE的质谱图也反映了这一现象,但信号响应不足,明显低于CRE的m/z 90.11离子和D3-CRE的m/z 93.10离子,如附录A中的图S1和S2所示。这些子离子的形成过程被认为丢失氰胺基团(CN2H2)。此外,如图6所示,未经四极杆选择而直接进入LIT的母离子在离子阱中引起空间电荷效应问题。然而,四极杆选择的母离子会大大降低空间电荷效应,如图7所示。最后,对相应的管透镜、离子导引Q0直流偏压、预四极PreQ直流偏压和杆ROD的直流偏压进行了优化,以提高检测灵敏度,如附录A中的图S3所示。
《图6》
图6 未经四极杆筛选而直接注入线形离子阱的离子质谱图。(a)GAA标准溶液的所有离子质谱图;(b)GAA的碎裂离子质谱图;(c)D2-GAA标准溶液的所有离子质谱图;(d)D2-GAA的碎裂离子质谱图。[M+H]+:母离子。
《图7》
图7 经过四极杆筛选后注入线形离子阱的离子质谱图。(a)GAA的母离子质谱图;(b)GAA的碎裂离子质谱图;(c)D2-GAA的母离子质谱图;(d)D2-GAA的碎裂离子质谱图。
FIA-ESI-MS/MS方法被广泛用于测定不同生物基质中的多种生物标志物[7,28]。由于FIA-ESI-MS/MS方法对每个样品的分析时间仅为1.0~2.5 min,如附录A中的表S3所示,因此该方法在多种疾病的高通量筛查中具有很大的潜力。FIA-ESI-MS/MS方法已被用于分析和检测临床样本中的氨基酸、酰基鸟嘌呤、CRE、GAA以及其他生物标志物[27,29‒30]。为了提高灵敏度,一些目标物通常衍生为丁基酯,如氨基酸、GAA、CRE和25-羟基维生素D [27,31‒32]。Carducci等[27]率先建立了FIA-ESI-MS/MS法,即1.0 min测定干血斑提取物中GAA和CRE的方法。然而,该方法使用衍生化法,前处理步骤烦琐且耗时。液相色谱-串联质谱法(LC-MS/MS)也广泛用于检测GAA和CRE,但耗时5~10 min [5,33]。本研究开发的FIA-ESI-Q-LIT方法的总采集时间为1.5 min,使得分析快速且高效。与液相色谱方法相比,所需的时间减少了三倍以上。此外,与文献报道的用于检测GAA和CRE的FIA-ESI-MS/MS方法相比[27],我们建立的方法无需衍生化,用于质谱分析的样品制备只需要一步固液萃取。综上所述,FIA-ESI-Q-LIT方法适用于新生儿GAMT和AGAT疾病的高通量筛查。
在最佳实验条件下(附录A中的表S1和S2),对Q-LIT V2方法的线性范围、灵敏度、准确性和平方回归系数进行了验证。在1.20~9.84 μmol·L-1范围内,GAA的线形相关系数(R2)为0.9908。CRE在122.05~656.76 μmol·L-1范围内,R2为0.9902。全血中GAA的加标浓度为3.0 μmol·L-1和8.0 μmol·L-1,CRE的加标浓度为150.0 μmol·L-1和300.0 μmol·L-1时,平均回收率为112.4%~119.9%,变异系数≤7.73%。此外,低质控和高质控重复测定10次,用日内精密度评估方法重复性,低质控的GAA和CRE日内精密度分别为6.38%和8.19%,而高质控的日内精密度分别为6.88%和8.40%。当信噪比为3时,GAA和CRE的检出限分别为0.35 nmol·L-1和0.07 nmol·L-1,信噪比为10时,定量限分别为1.0 nmol·L-1和0.2 nmol·L-1。此外,使用美国赛默飞世尔科技公司的TSQ Altis质谱仪,方法如附录A中的表S5所示,验证数据列于附录A中的表S4,表明Q-LIT和TSQ Altis的灵敏度、线性、质控和回收率具有同等水平。虽然Q-LIT的重复性满足临床要求,但对其稳定性仍需在未来进行深入研究。
方法验证后,对77例实际样品进行分析。这些实际样本是人干血斑。采用Q-LIT V2和TSQ Altis对样品进行检测。Q-LIT V2检测结果与TSQ Altis检测结果一致,Q-LIT检测结果均在TSQ Altis结果均值±标准差范围内。详细结果见附录A中的表S6。此外,提取离子质谱图和FIA色谱图见图8。通过多例真实临床样本的检测,表明Q-LIT V2具有良好的定性和定量能力。
《图8》
图8 FIA-ESI-Q-LIT检测真实干血斑样本所得提取离子质谱图和色谱图。(a)GAA;(b)CRE;(c)D3-CRE;(d)D2-GAA。
《4、 结论》
4、 结论
自主研制Q-LIT串联质谱可用于临床生物标志物分析。对其质量范围、扫描速度和碎裂效率进行了评估。实验结果表明,该技术可以减少进入LIT的离子数量,有效降低空间电荷效应。此外,该技术还解决了液相色谱法样品分析过程复杂、耗时的缺点。本文所开发和验证的FIA-ESI-Q-LIT方法也可以作为一种快速、简单、可靠的工具,应用于复杂临床基质中痕量或超痕量化合物的定量分析。



















 京公网安备 11010502051620号
京公网安备 11010502051620号




