《1、 引言》
1、 引言
在由严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)引起的新型冠状病毒肺炎(COVID-19)的毁灭性公共卫生危机期间,瑞德西韦引起了全世界的关注。这种磷酸酰胺核苷酸类似物,被称为Veklury [1‒2],仍在全球的许多临床试验中被单独或联合使用治疗COVID-19 [3]感染患者,因为对其有效性存在不同观点[1‒2,4]。在第一波[1]大流行期间,瑞德西韦在美国和日本获准紧急使用,在欧盟(EU)、新加坡、澳大利亚、韩国和加拿大获准有条件使用,允许住院的成人和儿童COVID-19患者接受瑞德西韦治疗。截至2021年6月,COVID-19已导致全球约1.75亿例感染和380万人死亡[5]。更糟糕的是,全球COVID-19确诊病例数量仍在上升,几种更具传染性的变异在全球发出了新的警报[6‒7]。鉴于该大流行的全球规模和对瑞德西韦生产所需的活性药物成分(API)的潜在天文数字需求,确保这种化合物的充足供应可能是一个紧迫的问题[8]。虽然人们在改进瑞德西韦的合成方法方面已经付出了相当大的努力,但目前使用的批量生产仍然是一个漫长的、资源密集型的过程,必须依次完成,并且受到几个难以大规模操作且产量低的特定有机化学步骤的严重阻碍[9]。复杂的批处理过程似乎影响了在COVID-19大流行等紧急情况下迅速生产大量瑞德西韦的能力;此外,它还导致成本高,因此限制了这种药物的广泛使用[9]。因此,需要开发一种高效和可扩展的合成方案来制备瑞德西韦。
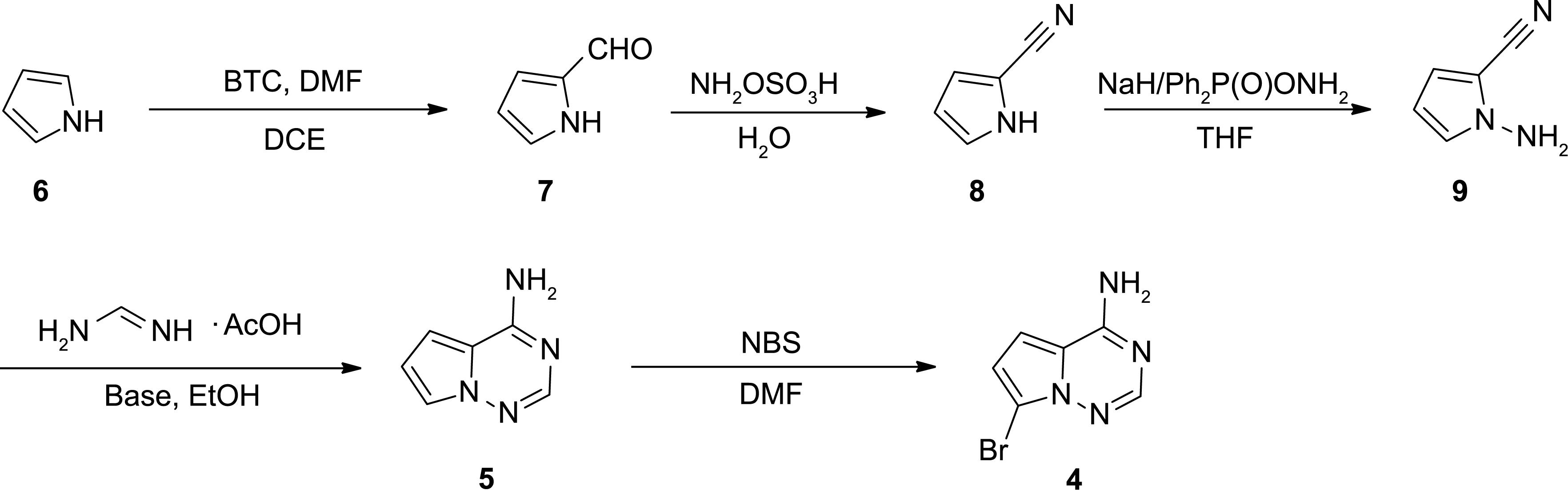
根据逆合成分析(图1),瑞德西韦可以由三个不同的结构单元组装而成,包括一个核糖内酯单元2、一个具有立体磷中心的磷酰胺单元3和一个模仿腺嘌呤的核碱基单元4,即7-溴吡咯[2,1-f][1‒2,4]三嗪-4胺[10‒11]。由于在后期进行关键的c糖基化步骤需要大量的核碱基单元4,因此我们首先关注核碱基单元4的合成,作为我们正在进行的合成计划的一部分,该计划旨在开发快速和可扩展制备瑞德西韦的下一代合成方案。
《图1》
图1 瑞德西韦的逆合成分析(
已经报道了几种合成途径来获得关键的中间体吡咯[2,1-f][1‒2,4]三嗪-4-胺(5)[12‒16]。5的简单溴化或碘化可以得到目标化合物4。作为一个典型的例子,本研究描述了7-溴吡咯[2,1-f][1‒2,4]三嗪-4胺(当X=Br时为4)的合成。O´Connor等[12]和Dixon等[13]公开了一种由2,5-二甲氧基四氢呋喃与肼基甲酸叔丁酯反应,生成NH-叔丁氧羰基(BOC)保护的1-氨基吡咯的途径。随后用氯磺酰异氰酸酯和N,N-二甲基甲酰胺(DMF)进行氰化,得到NH-BOC保护的1-氨基-1H-吡咯-2-甲腈。BOC脱保护,然后用乙酸甲胺(FAA)和磷酸钾在乙醇中回流环化,得到所需的5 [12‒13]。Knapp等[14]报道了一种类似的方案,其中5-二甲氧基四氢呋喃通过与2-氨基异醇-1,3-二酮或肼基甲酸叔丁酯反应转化为1-氨基吡咯或NH-BOC保护的1-氨基吡咯。在甲酸中用NaOAc处理1-氨基吡咯或在甲酸中用乙酸酐处理NH-BOC保护的1-氨基吡咯,均可得到N-(1H-吡咯-1-烷基)甲酰胺。N-(1H-吡咯-1-烷基)甲酰胺与氰酰胺缩合得到Nʹ-氰基-N-(1H-吡咯-1-烷基)甲脒酰胺;经路易斯酸环化后,得到5 [14]。Patil等[15]报道了一种两步路线,用羟胺-O-磺酸(HOSA)和氢氧化钾处理,生成1-氨基-1H-吡咯-2-甲腈。在碳酸钾存在下,用FAA在回流乙醇中进行1-氨基-1H-吡咯-2-甲腈处理,得到5 [15]。遗憾的是,这些方法的实际应用受到了非商品原材料有限的可用性和相对较高的成本,以及对快速柱色谱分离相关中间体的要求的阻碍。Paymode等[16]最近发表了一种方法,首先使用磷酰氯(POCl3)和DMF通过Vilsmeier-Haack反应对吡咯进行甲酰化。随后生成的吡咯-2-甲醛通过与羟胺、乙酸酐和吡啶反应,氧化转化为吡咯-2-甲腈。随后N-胺化和环化得到了所需的5。有利的是,这种策略采用了容易获得且廉价的商品材料。然而,POCl3的使用导致了含磷废水的产生,从而对环境产生了严重的不利影响。使用羟胺、乙酸酐和吡啶的使用[3.5~5.0当量(equiv.)]进行氧化转化,不仅增加了产品纯化的难度,而且增加了制备5的总成本。此外,氯胺直接N-胺化需要复杂的氯胺提取和浓缩过程,以提高通量,这将导致提取溶剂和能量的高消耗。
基于之前的研究,我们改进了合成方案,以无色谱的方式从廉价和容易获得的吡咯中获得核碱基单元4,如图2所示。单元改进的方法首先是通过Vilsmeier-Haack反应将吡咯(6)转化为吡咯-2-甲醛(7)。我们使用双(三氯甲基)碳酸酯(BTC)和DMF形成Vilsmeier盐,而不是使用传统的Vilsmeier-Haack试剂POCl3/DMF,从而避免了含磷废水的产生。随后,用成本较低的HOSA在水中处理吡咯-2-甲醛(7),令人满意地完成了甲酰基官能团的氧化转化,得到吡咯-2-甲腈(8)。然后用O-(二苯基次磷基)羟胺(DPPH)进行N-胺化,并与FAA环化,得到关键中间体吡咯[2,1-f][1‒2,4]三嗪-4-胺(5)。最后,用N-溴代琥珀酰亚胺(NBS)溴化得到目标化合物7-溴吡咯[2,1-f][1‒2,4]三嗪-4-胺(4),具有较高的区域选择性和收率。
《图2》
图2 改进的合成方案制备7-溴吡咯[2,1-f][
从实际应用的角度来看,传统的批量处理方法在扩大规模时可能会受到一些限制。首先,Vilsmeier-Haack和N-胺化反应是高度放热的,两者都涉及极其危险的化学品,在批量处理条件下不易控制。传统上,这些类型的反应是在补料分批模式下进行的,在低温下缓慢地将其中一种试剂注入反应混合物中,以防止由于间歇式反应器中混合不充分和散热缓慢而导致的失控情况[17]。这适用于小规模批量处理,但似乎不适合大规模生产,因为随着表面积与体积比的降低,可能需要过长的添加时间。因此,大规模的批量操作可能是耗时和低效的。此外,由于反应快速和混合不充分,保证间歇式反应器的均匀温度是一个主要挑战[18‒19]。因此,可能会引发副反应和进一步的二次反应,造成产率损失和安全问题。其次,在不混溶的液-液两相混合物中,将吡咯2-甲醛(7)氧化转化为吡咯2-甲腈(8)。传质速率在双相反应中起着重要的作用,其总反应速率受到两相间活性物质转移速率的影响。因此,氧化转化会受低质量传递的影响,因为在传统的间歇式反应器中只能实现有限的表体积与体积比(最高约2000 m2∙m-3)[20‒21],这反过来导致有限的表观动力学。此外,众所周知,间歇式反应器中的两相流体动力学是反应器形状、尺寸、叶轮结构、搅拌速度等方面的复杂函数。这使得反应器的扩大规模变得困难,并将大规模商业生产推迟数年,直到反应动力学和液-液流体动力学得到很好的理解。第三,生产目标化合物4的溴化反应需要严格的低温条件(从-20 ℃到-78 ℃)以确保高选择性。对于传统的间歇式反应器来说,大规模地有效且一致地保持低温是困难的,因为当间歇式反应器升级到更大尺寸时,体积的增加速度远远快于外表面积的增加速度[22]。因此,间歇式反应器的低表面积与体积比实际上限制了生产容器的尺寸。最后但并非最不重要的是,间歇过程是明显的逐步操作,包括多步骤反应顺序、分离和纯化[23]。通常,在每个合成反应完成后,人工从反应混合物中分离出产物并纯化,然后将得到的纯产物用于下一个反应。这种方法是劳动密集型、资源密集型、耗时且通常是浪费的[23]。因此,从原材料生产最终API产品(如瑞德西韦)可能需要12个月,并且在几个阶段都有大量中间体库存[9]。
近年来,制药行业向持续生产发展的趋势日益明显[24‒26]。微反应器的采用无疑在推动从间歇式处理向连续流处理的转变中发挥了核心作用[27‒28]。与传统的间歇反应器相比,微反应器本身具有较小的反应体积、可快速混合及优良的传质和传热能力,可以提高反应性能,安全性得到提高,更准确地控制反应变量[29]。此外,对于连续过程,扩大规模通常比间歇处理容易得多,因为可以通过增加流动装置的数量或扩大反应体积来提高通量[29]。此外,通过使用流程处理,可以将多个合成步骤压缩到流线型系统中,避免费力的人工分离和中间体纯化过程[30]。因此,通过使用最先进的连续流技术,可以节省大量的资源、空间、时间和能源。
设想通过采用连续流技术可以克服上述间歇合成的局限性。在此背景下,我们的目标是开发一种本质安全、高效、可扩展的目标化合物4的连续流合成方法。该方法促进了涉及危险和不稳定中间体的反应,放热反应得到了很好的抑制,液-液两相反应明显增强。此外,低温反应适应性良好。此外,后处理程序被完全集成到反应序列中,形成了一个精简的连续流系统,最大限度地提高了整个工艺的效率。
《2、 实验部分》
2、 实验部分
《2.1 材料和试剂》
2.1 材料和试剂
除非另有说明,表1中所列试剂和化学品未经纯化。
《表1》
表1 本工作中使用的试剂和化学品
| Reagents and chemicals | Abbreviation | Source | Purity |
|---|---|---|---|
| Ammonium chloride | NH4Cl | RICHJOINT Chemical Reagents Co., Ltd. (Shanghai, China) | 99.95% |
| Argon | Ar | Shanghai Tomoe Gases Co., Ltd. (Shanghai, China) | > 99.95% |
| Bis(trichloromethyl) carbonate | BTC | 9DINGCHEM (Shanghai, China) | 99% |
| Dichloromethane | DCM | Jiangsu Huai’an Chemical Technology (Huai’an, China) | ≥ 99.5% |
| Ethyl acetate | EtOAc | Jiangsu Huai’an Chemical Technology (Huai’an, China) | ≥ 99.5% |
| Ethanol | EtOH | Jiangsu Huai’an Chemical Technology (Huai’an, China) | ≥ 99.9% |
| Formamidine acetate | FAA | Aladdin Biochemical Technology Co., Ltd. (Shanghai, China) | 99% |
| Hydroxylamine- |
HOSA | Aladdin Biochemical Technology Co., Ltd. (Shanghai, China) | 97% |
| Methanol | MeOH | Jiangsu Huai’an Chemical Technology (Huai’an, China) | > 99.9% |
| DMF | Sinopharm Chemical Reagent Co., Ltd (Shanghai, China) | 99% | |
| Nitrogen | N2 | Shanghai Tomoe Gases Co., Ltd. (Shanghai, China) | > 99.95% |
| NBS | BIDEPHARM (Shanghai, China) | 98% | |
| DPPH | BIDEPHARM (Shanghai, China) | 98% | |
| Petroleum ether | PET | Jiangsu Huai’an Chemical Technology (Huai’an, China) | ≥ 99.5% |
| Potassium |
BIDEPHARM (Shanghai, China) | 98% | |
| Potassium carbonate | K2CO3 | RICHJOINT Chemical Reagents Co., Ltd. (Shanghai, China) | 99.5% |
| Pyrrole | PYL | MACKLIN (Shanghai, China) | > 98% |
| Sodium chloride | NaCl | RICHJOINT Chemical Reagents Co., Ltd. (Shanghai, China) | 99.5% |
| Sodium hydride | NaH | MACKLIN (Shanghai, China) | 60%a |
| Sodium sulfate | Na2SO4 | Shanghai Dahe Chemicals Co., Ltd. (Shanghai, China) | > 99.9% |
| Sodium sulfite | Na2SO3 | Shanghai Dahe Chemicals Co., Ltd. (Shanghai, China) | > 99.9% |
| Tetrahydrofuran | THF | Rhawn Reagents (Shanghai, China) | 99% |
| 1,2-dichloroethane | DCE | MACKLIN (Shanghai, China) | 98% |
| 1,8-diazabicyclo[5.4.0]undec-7-ene | DBU | BIDEPHARM (Shanghai, China) | 99.5% |
| 1,3-dibromo-5,5-dimethylhydantoin | DBDMH | BIDEPHARM (Shanghai, China) | 98% |
a Sodium hydride (NaH) was in the form of a 60% dispersion in mineral oil.
根据规定,1,2-二氯乙烷(DCE)和乙醇(EtOH)用分子筛(4 Å, 1 Å=10-10 m)进行干燥。DMF和四氢呋喃(THF)采用Vigor溶剂净化系统VSPS-7(Vigor气体净化技术有限公司,中国)进行干燥。
《2.2 一般方法和分析》
2.2 一般方法和分析
在紫外(UV)线(254 nm)下采用60 F254硅胶薄层色谱(TLC)法监测反应。快速色谱采用硅胶60(230~400目,青岛海洋化工有限公司)。有机溶液在IKA旋转蒸发器(RE;RV10,德国)上进行减压浓缩。气相色谱(GC)/质谱(MS)在配备Agilent 7830A MSD 的Agilent 5977B GC(HP-5MS色谱柱,美国)上进行。GC分析在配备氢火焰离子化检测器的 Agilent 7890B(DB624 色谱柱)上进行。熔点是在MP450数字熔点仪(济南海能仪器股份有限公司)上测量的。1H(400 MHz)和13C(100 MHz)核磁共振(NMR)在Bruker Avance 400光谱仪(德国)上于环境温度下进行分析。化学位移以相对于四甲基硅烷(TMS)的δ(ppm)单位给出。耦合常数(J)值以Hz为单位。多重性由以下缩写表示:s.单峰;d.双峰;t.三重态;q.四重态;br.宽的;m.多重性。
《2.3 实验设置和方法》
2.3 实验设置和方法
反应器I、反应器II、反应器IV和反应器V由全氟烷氧基(PFA)管组成,内径(ID)为0.6 mm,外径(OD)为1.6 mm。反应器III是一种Coflore搅拌槽反应器(ACR;AM技术公司,英国),其特点是具有安装在横向振动电机上的Hastelloy反应块[31]。反应块中的中心流动板包含反应室、相互连接的通道和搅拌器。反应室由一系列约9.8 mL的独立单元组成,每个单元内部都有一个自由移动的搅拌器。单个单元由长30 mm、宽4 mm的互联通道连接。当反应块被震动马达震动时,搅拌器在单元内快速逆转横向运动[32]。原则上,反应室模拟一个毫升级的连续搅拌槽反应器(CSTR),以提高活塞流性能。有关ACR的更多细节,感兴趣的读者可以参考它的用户手册[31]。除非另有说明,在本工作中采用T型微混合器来混合流体。结果发现,对混溶流体使用简单的T型微混合器可以得到良好的混合(步骤1、4和5)。然而,当两个反应流不混溶时,使用T型微混合器会导致反应流的混合不理想。因此,在步骤2中,采用所谓的两相错流微混合器(CFMM)来混合不混溶性液体。此外,使用其他几种类型的设备和装置,包括气液分离器(GLS)、连续流动固体过滤器(CFSF)、微型连续搅拌槽反应器(m-CSTR)、液液膜分离器(LLMS)、环形离心萃取器(ACE)和固定床反应器(FBR),将后处理程序集成到反应序列中。本工作中使用的连续流设备和装置的详细描述见附录A中的S3节。
溶液采用注射泵(Fusion 101、Fusion 200,Fusion 4000、Fusion 6000;Chemyx,美国)或高效液相色谱(HPLC)泵(SF1005A,Sanotac,中国)。使用蠕动泵(77200-60型,Masterflex,德国)泵送灌浆。背压调节器(BPR)是从Chemtrix(荷兰)购买的。标准1/4″-28在线检查值(IDEX Health & Science,美国)用于防止逆流。流体连接采用标准1/4″-28螺纹配件及1/16″油管和联合接头(Runzefluidsystem,中国)。
《3、 结果和讨论》
3、 结果和讨论
步骤1涉及吡咯(6)与DMF和BTC的Vilsmeier-Haack反应,形成吡咯-2-甲醛(7)。DMF与BTC之间的接触导致Vilsmeier复合物的快速形成,该复合物具有热不稳定性,在加热时可以产生高而快速的温度和压力上升[33‒34]。这就产生了安全问题,特别是在大规模操作时[18‒19]。因此,在间歇模式下,这种转化是通过在0 ℃下将BTC溶液缓慢加入到吡咯和DMF的混合物中进行的[17]。加入完成后,将反应混合物加热到更高的温度(45 ℃)进行进一步反应。在间歇模式下完成一个毫摩尔级的反应需要5 h以上(详细描述见附录A中的S2.1节)。我们最初尝试在反应器I的出口不安装GLS的情况下进行流动反应,当两股反应物(DCE中1.0当量PYL与1.05当量DMF,DCE中0.35当量BTC)通过T型微混合器混合,理论停留时间(即反应器I的内部体积除以总流速)为30 min(图3中步骤1)时,6到7的转化率为95%。然而,我们观察到气体在流动反应器中迅速形成,导致反应混合物的流速不稳定,并导致实际停留时间不可控。为了解决这个问题,在反应器I之后连接了GLS,通过其加压气体入口将氮气(N2)送入GLS,并在其气体出口上安装了一个可调的BPR。在这种方法中,上游的反应器I在BPR控制的设定压力下通过N2稳定加压。从GLS中排出的反应混合物流入m-CSTR-1中(图3),同时加入饱和Na2CO3水溶液,以促进中间体铵盐水解,得到甲酰基化合物7。
《图3》
图3 两步连续流动合成吡咯-2-甲腈(
基于改进后的流动系统,进一步优化(表2)发现,35 ℃的较低温度和3 bar(1 bar=105 Pa)的背压可以在5 min的停留时间下实现6到7的完全转化。
《表2》
表2 反应器I中连续流合成的优化
| Entry | Conversionb | |||||
|---|---|---|---|---|---|---|
| 1 | 0.11 | 0.19 | 10 | 45 | 2 | 100% |
| 2 | 0.22 | 0.38 | 5 | 45 | 2 | 87% |
| 3 | 0.11 | 0.19 | 10 | 45 | 3 | 100% |
| 4 | 0.22 | 0.38 | 5 | 45 | 3 | 100% |
| 5 | 0.22 | 0.38 | 5 | 45 | 4 | 100% |
| 6 | 0.22 | 0.38 | 5 | 35 | 3 | 100% |
| 7 | 0.22 | 0.38 | 5 | 30 | 3 | 96% |
| 8 | 0.22 | 0.38 | 5 | 25 | 3 | 97% |
| 9 | 0.22 | 0.38 | 5 | 18 | 3 | 97% |
FP1: flow rate of the P1 pump; FP2: flow rate of the P2 pump; P: back pressure.
a Molar ratios were maintained when varying residence time.
b The conversion of 6 was determined by the GC/MS peak area percentage.
通过一个满意的流程方法得到7,我们接下来试图将步骤2与步骤1相结合(图3)。随着m-CSTR-1中形成固体盐,收集的液流随后被泵入CFSF-1,以清除堵塞下游反应器II的固体。在步骤2中,吡咯-2-甲醛(7)与HOSA的氧化转化得到吡咯-2-甲腈(8)。在初步实验中,将CFSF-1的滤液和HOSA(1.2当量)水溶液通过两相CFMM直接流入反应器II中。这样,我们发现,在停留时间为30 min时,7的最佳结果的转化率仅为79%。这是一个令人不满意的结果。CFSF-1滤液中水相的存在可能损害了在随后的第2步中7的反应性。因此,我们后来在CFSF-1之后加入了LLMS-1。滤液通过m-CSTR-2输送至LLMS-1,以连续方式去除水相。然后通过CFMM将从LLMS-1流出的有机相与HOSA水溶液混合,并通过反应器II处理所得的混合物。经过仔细的优化,该修订后的方案在室温下将7 100%地转换为8,停留时间为5 min(表3)。
《表3》
表3 反应器II中连续流合成的优化
| Entry | Conversionb | ||||
|---|---|---|---|---|---|
| 1 | 0.101 | 0.024 | 20 | rt | 100% |
| 2 | 0.203 | 0.047 | 10 | rt | 100% |
| 3 | 0.253 | 0.059 | 8 | rt | 100% |
| 4 | 0.406 | 0.094 | 5 | rt | 100% |
FP5: flow rate of the P5 pump; FP6: flow rate of the P6 pump.
a Molar ratios were maintained when varying residence time.
b The conversion of 7 was determined by the GC/MS peak area percentage.
然后,反应器II的输出与进入的饱和Na2CO3水溶液一起流入m-CSTR-3。由于在m-CSTR-3中形成了固体盐,然后将混合物通过CFSF-2来去除会阻断LLMS-2的固体。LLMS-2的安装允许将有机相从双相混合物中快速分离出来。优化后的两步反应-后处理集成流程产生了8,分离收率为47.6%,产量为3.02 g∙h-1。
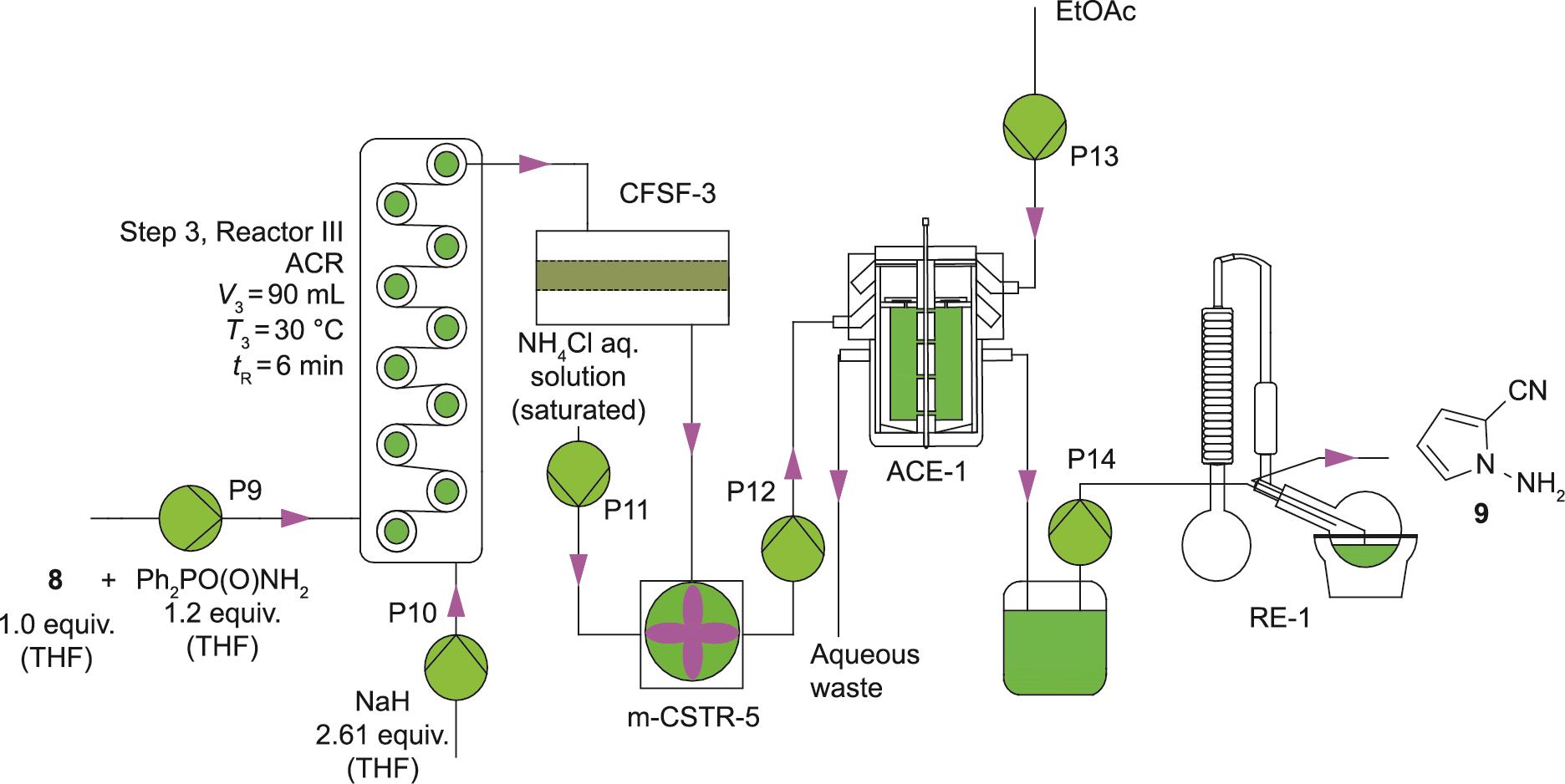
步骤3涉及吡咯-2-甲腈(8)的N-胺化,得到1-氨基-1H-吡咯-2-甲腈(9)。NaH参与这一反应将带来潜在的安全危害,特别是在大规模操作时。因此,间歇反应是通过将干燥THF中的底物8缓慢加入NaH-THF混合物中,然后滴加THF中的Ph2P(O)ONH2来实现的(详细描述参见附录A中的S2.3节)。因此,间歇操作的效率和生产力水平较低。由于NaH和Ph2P(O)ONH2不溶于THF并且产生了固体副产物,将该反应转化为基于微通道的流动过程的最初努力受到了阻碍。为了解决这个问题,我们采用了Coflore ACR来促进浆料的流动处理。考虑到将ACR直接耦合到之前的两步流动序列中的复杂性,我们首先使用纯化的吡咯-2-甲腈(8)检查了独立的流动处理(图4)。两种反应物流[1.0当量8和1.2当量Ph2P(O)ONH2的THF溶液,以及1.40~3.47当量的NaH的THF溶液]以精确控制的流速送入ACR。结果发现,化学计量学和停留时间对流动中的反应有显著影响,因此考察了其影响(表4)。
《图4》
图4 流动中1-氨基-1H-吡咯-2-甲腈(
《表4》
表4 反应器III中连续流合成的优化
| Entry | Molar ratio of |
Conversionb | ||||
|---|---|---|---|---|---|---|
| 1 | 2.843 | 2.879 | 1.0:1.2:2.24 | 10 | 30 | 45% |
| 2 | 3.781 | 2.401 | 1.0:1.2:1.40 | 11 | 30 | 40% |
| 3 | 3.781 | 2.401 | 1.0:1.2:1.40 | 16 | 30 | 44% |
| 4 | 2.843 | 2.879 | 1.0:1.2:2.24 | 12 | 30 | 50% |
| 5 | 2.843 | 3.357 | 1.0:1.2:2.60 | 6 | 30 | 100% |
| 6 | 2.843 | 3.357 | 1.0:1.2:2.60 | 10 | 30 | 100% |
| 7 | 2.139 | 3.357 | 1.0:1.2:3.47 | 6 | 30 | 100% |
| 8 | 2.139 | 3.357 | 1.0:1.2:3.47 | 10 | 30 | 100% |
FP9: flow rate of the P9 pump; FP10: flow rate of the P10 pump.
a Because the formed gas affected the actual total flow rate, this was the measured actual residence time.
b The conversion of 8 was determined by the GC peak area percentage.
结果表明,NaH与Ph2P(O)ONH2的摩尔比小于1.87时,尽管在相对较长的停留时间为16 min,但8的最大转化率为50%。此外,当使用一个当量的底物8时,一个更高的摩尔比2.17 [NaH:Ph2P (O)ONH2]导致8在仅6 min内完全转化。在30 ℃的最佳流动条件下,停留时间为6 min,我们获得了9的97%的分离收率。值得注意的是,流动中的反应时间只有6 min,而间歇过程需要超过5 h(详细描述见附录A中的S2.3节)。此外,通过ACR可以很容易地维持连续处理超过10 h。因此,事实证明,利用ACR可以成功地实现浆料的连续流处理。
随后,我们在一个三步完全连续的流动过程中研究了从6到9的合成过程。由于反应器II的流出物是DCE和水相的不混溶的液-液混合物,水的存在无疑会使NaH失活,从而阻碍步骤3的反应。因此,CFSF-2和LLMS-2依次偶联到反应器II(图5)。连续过滤反应器II的输出液,然后将滤液流入LLMS-2中,以分离出有机相。按照步骤3的优化流程方案,从LLMS-2中输出的有机相与进入的THF中的Ph2P(O)ONH2(1.2当量)和THF中的NaH(2.61当量)一起流入ACR,以实现9的三步完全连续流合成。从ACR流出的悬浮液立即通过CFSF-3过滤;同时,滤液与进入的饱和NH4Cl水溶液一起流入m-CSTR-5。然后将收集的混合物与EtOAc一起泵入ACE-1,以便将产物9连续萃取到有机相中。ACE-1的有机相输出随后被泵入RE-1,在减压下工作,以快速去除溶剂。三步连续合成,在总停留时间为34 min和2.6 g∙h-1的通量下,对9的分离收率为44.3%。
《图5》
图5 三步连续流合成1-氨基-1H-吡咯-2-甲腈的示意图(
在步骤4中,在碱促进下,FAA将1-氨基-1H-吡咯-2-甲腈(9)环化得到吡咯[2,1-f][1‒2,4]三嗪-4-胺(5)。初始间歇环化反应是通过纯化的9在乙醇中与FAA和K2CO3在85 ℃下组合进行的。间歇反应需要10 h才能达到完全转化(详细描述见附录A中的S2.4节)。由于Na2CO3在乙醇中以固体形式存在,我们试图将Na2CO3加载到FBR中,然后将9和FAA溶液通过泵泵入其中,以便将间歇过程转化为连续过程。遗憾的是,在任何条件下,在这种模式下都没有检测到任何反应。然后,我们尝试使用1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)作为碱,因为它完全可溶于乙醇。它的间歇操作在4 h内实现了完全转换,比Na2CO3介导环化快得多(有关详细描述见附录A中的S2.4节)。基于间歇方案,DBU介导的环化首先在流中独立检测。9(1.0当量)、FAA(12当量)和DBU(13当量)的EtOH溶液通过反应器IV,通过BPR加压以避免沸点限制(图6)。最初,在85 ℃和5 bar的背压下,停留时间为20 min,导致转化率较差(小于10%)。当我们将反应温度提高到120 ℃时,转化率提高到75%。反应温度的进一步升高需要同时增加背压,以保持乙醇为液体。进一步优化,在140 ℃和10 bar背压以及30 min的停留时间下实现了良好的转换(表5)。因此,在低沸点溶剂中进行高温流动操作的能力得到了很好的利用。
《图6》
图6 吡咯[2,1-f][
《表5》
表5 反应器IV中连续流合成的优化
| Entry | Conversiona | ||||
|---|---|---|---|---|---|
| 1 | 0.130 | 20 | 85 | 5 | < 10% |
| 2 | 0.130 | 20 | 120 | 5 | 75% |
| 3 | 0.130 | 20 | 140 | 10 | 90% |
| 4 | 0.083 | 30 | 140 | 10 | > 95% |
FP15: flow rate of the P15 pump.
a Conversion was determined by the GC/MS peak area percentage.
具有得到5的可行的流程方案后,接下来我们将重点放在通过四步过程从起始材料6制备吡咯[2,1-f][1‒2,4]三嗪-4-胺(5),通过将反应单元与分离单元结合,进一步努力实现我们完全连续的合成目标。RE-1的输出与FAA(12当量)和DBU(13当量)的EtOH溶液一起流入T型微混合器,所得混合物通过反应器IV进行处理(图7)。反应器IV的产物与进入的饱和NH4Cl水溶液一起流入m-CSTR-6(图7)。然后将合并的产物与EtOAc一起泵入ACE-2,以便将产物5连续萃取到有机相中。随后将ACE-2的有机相输出泵入RE-2,在减压下工作,以快速去除溶剂(图7)。在总停留时间为74 min的最优四步连续流动操作下,我们得到了5的27.7%的分离收率。
《图7》
图7
最后一个反应(步骤5)是吡咯[2,1-f][1‒2,4]三嗪-4-胺(5)的溴化反应,以生成目标化合物7-溴吡咯[2,1-f][1‒2,4]三嗪-4-胺(4)。在我们的早期尝试中,我们使用1,3-二溴-5,5-二甲基乙内酰脲(DBDMH)作为溴化剂,进行了间歇溴化反应(详细描述见附录A中的S2.5节)。结果在转化率和选择性方面都很差(附录A中的表S1)。要么在底物完全转化时发生过溴化,要么仅实现底物的适度转化(68%~64%),而目标化合物4的区域选择性相对较低(63%~84%)。然后我们实验用NBS作为溴化剂。在间歇过程中,NBS在-40 ℃下溴化时获得了良好的转化率和区域选择性,而当反应温度降低到-78 ℃时,转化率下降到81%(附录A中的表S2)。在获得4的反应条件后,我们使用纯化的5检查了流动中的溴化步骤。间歇过程很好地转化为连续过程,在-40 ℃停留时间为5 min下观察到5完全转化(表6)。
《表6》
表6 反应器V中连续流合成的优化
| Entry | Conversiona | Selectivityb | |||||
|---|---|---|---|---|---|---|---|
| 7-bromopyrrolo[2,1- |
5-bromopyrrolo[2,1- |
5,7-dibromopyrrolo[2,1- |
|||||
| 1 | 0.25 | 0.25 | 5 | 100% | 83% | 10% | 5% |
| 2 | 0.42 | 0.41 | 3 | 94% | 85% | 11% | 3% |
| 3 | 1.26 | 1.23 | 1 | 91% | 86% | 11% | 2% |
FP20: flow rate of the P20 pump; FP21: flow rate of the P21 pump.
a Conversion was determined by the GC/MS peak area percentage.
b Selectivity was determined by the GC/MS peak area percentage.
最后,我们研究了在一个五步完全连续流的过程中从6到4的合成。在将步骤5连接到前面建立的4个步骤时,RE-2的输出与NBS(1.05当量)的DMF溶液一起流到T型微混合器,然后将合并的混合物通过反应器V。反应器V的产物被收集并离线纯化。总的来说,五步流程产生了7-溴吡咯[2,1-f][1‒2,4]三嗪-4-胺(4),分离收率为14.1%,总停留时间为79 min,通量为2.96 g∙h-1。
连续流方法的显著优点有两个。首先,与传统的间歇方法相比,在流动中的反应时间大大减少(表7)。间歇法总反应时间大于19 h,而连续流法总反应时间仅为51 min。由于间歇过程涉及耗时的后处理程序,因此,间歇合成中消耗的总时间(即反应时间加反应后后处理时间)超过26.5 h(相应的后处理程序总共至少需要7.5 h)。相比之下,连续处理过程中的总停留时间只有79 min,从而目标化合物7-溴吡咯[2,1-f][1‒2,4]三嗪-4-胺(4)的合成效率很高。其次,与间歇方法相比,连续流条件下的安全性显著提高。
《表7》
表7 传统间歇法与连续流法的比较
| Reaction steps | Reaction timea | |
|---|---|---|
| Conventional batch approach (h) | Continuous-flow approach (min) | |
| Step 1 | 5.50‒5.75 | 5 |
| Step 2 | 1.00 | 5 |
| Step 3 | 5.75 | 6 |
| Step 4 | 4.00 | 30 |
| Step 5 | 2.75 | 5 |
| Steps 1‒5 | > 19.00 | 51 |
a The post-reaction workup time was not included.
《4、 结论》
4、 结论
总之,我们基于改进的方案,从广泛使用且廉价的起始材料吡咯开始,开发了一种五步完全连续流合成7-溴吡咯[2,1-f][1‒2,4]三嗪-4-胺(4)(抗病毒药物瑞德西韦的核碱基单元)的方法。在最佳流动条件下,我们在总停留时间为79 min、通量为2.96 g∙h-1时,目标化合物4的分离收率为14.1%。连续处理过程中的总停留时间明显短于间歇方法中消耗的总停留时间(大于26.5 h)。涉及危险和不稳定中间体的放热反应、液-液两相氧化转化和低温反应在流动中得到促进。值得注意的是,通过部署完全集成到反应序列中的专用设备和设备,不断解决包括固体过滤、液-液分离、液-液萃取和减压蒸发在内的后处理程序。将后处理程序和多个化学转换集成到一个简化的连续流系统可以规避费力和耗时的分离和净化过程,从而以最少的资源和能源消耗实现快速生产,并最大限度地减少废物产生。这项工作标志着朝着开发用于快速和可扩展地制备瑞德西韦的下一代合成方案的发展方向迈进了一步。



















 京公网安备 11010502051620号
京公网安备 11010502051620号




