《1、 引言》
1、 引言
自1996年第一只克隆羊多利诞生,克隆技术就引起了人们的极大关注[1],因为该技术在动物育种中具有巨大的潜力[2‒7]。体细胞核移植(somatic cell nuclear transfer, SCNT)是一种创建克隆体的技术,包含多种操作步骤,如卵母细胞的吸持、拨动、刺入和去核操作,体细胞的抽吸以及注射操作[8]。然而,SCNT的效率极其低下,在参考文献[9]中,研究人员对2000年到2006年30多个猪的SCNT实验进行了调查,克隆成功率(每个移植胚胎对应的成活后代数量)各不相同,平均成功率仅为0.73%。例如,在参考文献[10]中,使用两组供体细胞产生308个核移植胚胎,通过手术将这些胚胎移植到三只代孕母猪身上,其中一名代孕者经剖腹产出5只克隆仔猪,克隆成功率为1.6%。在参考文献[11]中,2918个核移植胚胎被移植到20只代孕母猪身上,最终产生6只活的克隆仔猪,成功率仅为0.21%。尽管技术不断进步,但自从第一只克隆动物诞生以来,克隆成功率基本上保持不变[12],这种低成功率严重阻碍了克隆技术的广泛应用。
在生命科学研究中,通过选择不同的细胞类型[13]、改变细胞周期[14]、使用不同的激活和融合模式[15‒16]、移植不同数量的克隆胚胎[17]等方法,SCNT技术得到了许多改进。然而,人们对如何提高操作技能的关注相对较少。SCNT是一种复杂的细胞手术,操作技能水平的高低对细胞后续活力有显著影响[18]。因此,改进SCNT的操作技能将有效地提高成功率。
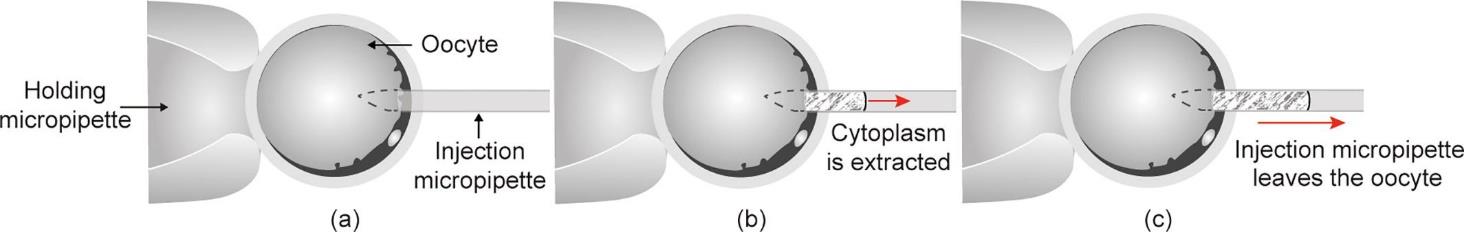
卵母细胞去核是SCNT的关键步骤,该步骤需使用注射针从卵母细胞中提取包括细胞核和极体在内的遗传物质。图1显示了卵母细胞去核的过程。在去核过程中,细胞质被迅速撕裂,卵母细胞失去部分细胞质,导致卵母细胞受到巨大损伤。在之前的研究中,设计了注射针在卵母细胞内的路径,分析了完全去除细胞核时的胞质损失,实现了基于滑模自适应模型的定量去核控制[19‒20]。这些方法减少了胞质损失,增加了细胞的发育潜力。然而,卵母细胞去核是一个复杂的动态过程,去核操作对卵母细胞生存能力的影响尚不清楚。
《图1》
图1 卵母细胞去核。(a)去核前,通过吸持针固定卵母细胞,用注射针刺入卵母细胞;(b)去核过程中,细胞质被抽取到注射针中;(c)去核后,注射针撤出卵母细胞,此时,被抽出的细胞质仍在针管内移动。
在卵母细胞去核过程中,注射针通过注射器产生的负压对卵母细胞施加外力,使卵母细胞产生巨大变形,导致细胞内应力过高。最近有研究人员开发了几种细胞力传感器[21‒23],但这些力传感器测量的是施加在细胞上的应力,而非细胞内应力。由于细胞内应力无法被直接测量,因此研究了细胞内线性应变,细胞内线性应变与变形物体长度的变化有关[24]。一些物理标记物,包括荧光微珠[25]和磁珠[26],已应用于细胞内应变的测量。本文研究团队也曾提出一种基于计算机视觉的简单且无标签的细胞内应变测量方法[27‒28]。
已有研究表明,机械应变会影响细胞的生存能力。例如,Scott曾证实,短期和高应变机械负荷可能会导致细胞凋亡[29];Gladman也曾发现,机械损伤(20%的拉伸应变)会导致神经元细胞显著死亡[30]。本文研究团队也曾通过评估细胞内应变来分析卵母细胞刺入的动态过程。实验结果表明,细胞发育潜力与细胞内应变呈强烈负相关性[27‒28]。因此,细胞内应变连接了细胞操作和细胞发育潜力。减少卵母细胞去核过程中的细胞内应变,进而减少潜在的细胞内损伤,具有重要意义。
本研究中,通过优化卵母细胞去核初始化状态和去核动态过程来减少细胞内的大应变。研究中使用了气动注射器,而不是传统手动去核时的液压注射器。尽管使用液压注射器进行卵母细胞去核的速度非常快,但是,液压注射器内灌装的油的惯性较大,去核过程中的细胞质运动不稳定,会导致细胞内的大应变。对于气动注射器,需要额外的压力,称为平衡压力,以平衡毛细管力。初始平衡压力会影响施加在卵母细胞上的初始力,并进一步影响去核过程中的细胞内应变。本文评估了整个去核过程中细胞内应变的统计数据,并优化了去核初始化参数。
细胞质提取的动态过程是卵母细胞去核最重要的步骤。在这个过程中,施加在卵母细胞内部的力发生动态变化,导致细胞内产生大的应变。然而,由于内应变检测过程中存在较大误差,因此直接基于细胞内应变进行在线去核控制是很难实现的。由于细胞内的动态应变受到注射器压力变化以及细胞质运动的影响,因此本文根据细胞内应变的评价结果,分析了细胞内应变与注射针中细胞质运动的关系。然后,通过细胞质运动的轨迹规划实现了去核控制,以减少这一动态过程中的最大细胞内应变。
最后,将本文提出的去核方法应用于整个SCNT流程,并实现了机器人批量SCNT。实验结果表明,本文所提出的卵母细胞去核方法减少了细胞内大应变的数量。与手动操作方法相比,最大应变降低了60.8%(从0.79降至0.31)。使用本文所提出的去核方法和手动去核操作方法对113个卵母细胞进行了SCNT。实验结果表明,与手动去核操作相比,使用本文所提出的方法时,囊胚率从10.0%提高到了20.8%,这是重构胚胎体外发育的最后阶段,也是克隆成功的标志。最后,使用机器人批量SCNT系统对525个卵母细胞进行了SCNT。平均成功率和存活率分别为99.1%和97.1%。共有510个重构胚胎被移植到6个代孕母猪体内。两名代孕母猪怀孕,分别产下10头和7头克隆小猪。与手动操作相比,克隆成功率从平均0.73%显著提高到2.50%。通过改进去核操作方法和减少细胞内应变,大大提高了细胞发育潜力,首次实现了机器人克隆方法优于手动操作方法的结果。
《2、 材料和方法》
2、 材料和方法
《2.1 去核过程中的细胞内应变计算》
2.1 去核过程中的细胞内应变计算
《2.1.1. 去核过程中的视觉检测》
2.1.1. 去核过程中的视觉检测
根据细胞质的运动,卵母细胞去核可分为两个步骤。
步骤1:胞质运动前。通过调节注射针中培养液的体积来设定初始平衡压力。当注射针刺穿细胞后,逐渐降低注射针中的压强,从而产生吸入压,直至细胞质在注射针中开始移动。
步骤2:细胞质运动。通过连续控制吸持压,将细胞质从卵母细胞中吸入注射针中,如图1(b)所示。
使用注射针吸取足够多的细胞质,以确保遗传物质被去除。之后,将注射针针尖从卵母细胞中撤出,使针管内外的细胞质分离。同时,增加压强以防止细胞质在针管中移动,如图1(c)所示。
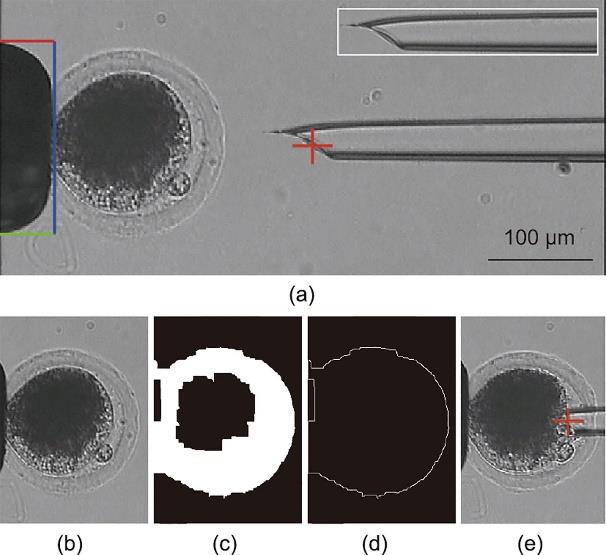
本研究结合一系列图像处理方法,自动检测卵母细胞的位置、吸持针和注射针的针尖位置以及注射针中细胞质的运动。首先,本文通过图像扫描确定吸持针区域的位置,并利用模板匹配算法检测注射针针尖位置。如图2(a)所示,为了便于后续的应变分析,将注射针针尖位置设置在注射针针尖斜角的中间位置。其次,根据吸持针针尖位置获得卵母细胞的感兴趣区域(region of interest, ROI)。为了识别细胞区域,本文使用Canny边缘检测算法对卵母细胞边缘进行检测,经过数学形态学开运算得到卵母细胞轮廓,如图2(b)~(d)所示。注射针刺穿卵母细胞后,根据针管移动距离估计其针尖位置,如图2(e)所示。
《图2》
图2 微针和卵母细胞视觉检测。(a)基于图像扫描和模板匹配算法的微针检测;(b)卵母细胞图像感兴趣区域;(c)基于Canny检测算法和形态学开运算的边缘检测;(d)基于轮廓检测算法绘制卵母细胞轮廓;(e)根据注射针刺入卵母细胞后的移动距离定位注射针针尖位置。
在卵母细胞去核的步骤1中,在卵母细胞上施加一定时间的吸入压后,细胞质开始移动并进入注射针。本文使用帧差法来确定细胞质是否进入了注射针。图3(a)显示了细胞质运动检测的ROI。通过连续帧图像相减得到帧差图像,然后使用Otsu二值化算法将帧差图像变换为二值图像,如图3(b)所示。当二值图像的前景面积大于设定阈值时,步骤1完成,实验中设置阈值为200 pixel(像素)。
《图3》
图3 卵母细胞去核过程中细胞质运动视觉检测。(a)细胞质运动检测ROI;(b)基于Otsu算法的帧差图像二值化,当前景面积大于阈值时去核步骤1结束;(c)根据步骤1结束时的帧差结果选择跟踪点;(d)基于Lucas-Kanade光流算法的胞质面跟踪。
在卵母细胞去核的步骤2中,细胞质迅速从卵母细胞中进入注射针。本文使用Lucas-Kanade光流法[31]实时检测针管中胞质面的位置。如图3(c)所示,根据步骤1结束时的帧差结果,在前景最右侧选择100个初始跟踪点,计算各点在x轴上的平均位置作为胞质面的初始位置。然后,将Lucas-Kanade光流法用于胞质面跟踪,逐帧计算跟踪点的平均位置,更新胞质面位置,如图3(d)所示。当胞质面移动到注射针中的设定位置,即当抽出足够的细胞质时,认为步骤2完成(附录A中的视频S1显示了胞质面的跟踪结果)。
《2.1.2. 基于速度场的细胞内应变场计算》
2.1.2. 基于速度场的细胞内应变场计算
使用提出的稠密光流法来检测细胞内运动进而计算细胞内应变场。如图4(a)所示,根据细胞质颗粒的大小,将细胞内区域中每间隔10 pixel的一个点视为细胞内点,通过光流法计算所有细胞内点的速度场和卵母细胞变形,如图4(b)和(c)所示。使用前向-后向追踪,得到光流检测的平均误差为0.67 pixel,追踪检测结果确保了细胞内应变场计算的准确性。此外,还进行了拉伸弹性橡胶的额外实验,以验证光流算法。实验结果表明,拉伸过程中的检测误差平均小于1 pixel,表明光流方法可以应用于大型变形物体。(如附录A中的图S1和视频S2所示)。
《图4》
图4 基于速度场的细胞内应变场计算。(a)细胞内区域的细胞内点(红色点);(b)连续两帧图像形成的细胞内速度场(黄色),带箭头的线表示速度的大小和方向;(c)连续两帧图像中的卵母细胞变形;(d)细胞内应变场,红色和蓝色分别表示高、低值。选取靠近注射针针尖应变最大的3 × 3细胞内点区域,作为应变ROI(红框)进行进一步分析。
细胞内应变场ε可由式(1)得到:
(1)
式中,L是两个相邻细胞内点之间的初始距离;ΔL是变形后的距离变化。在卵母细胞去核过程中,将细胞质转移到注射针中,并垂直于注射针针尖的斜口放置。卵母细胞的变形以及细胞内应变主要发生在这个方向上。由于在SCNT中,注射针针尖斜口通常为45°,因此以45°角方向计算了应变场。
(2)
式中,L0是两个相邻细胞内点之间的距离;[x(i), y(i)]和[x(i+1), y(i+1)]是使用细胞内点的速度场计算的下一帧中相邻点的坐标。图4(d)显示了细胞内应变场。当应变大于0时,表明细胞内结构被拉伸,而当应变小于0时,表明细胞内结构被压缩。为了减少卵母细胞去核过程中的大细胞内应变,选择在注射针针尖附近具有最大应变的3 × 3细胞内点区域作为应变ROI作进一步分析,如图4(d)中的红框所示。
《2.2 基于细胞内应变评估的卵母细胞去核》
2.2 基于细胞内应变评估的卵母细胞去核
在细胞操作中,大的细胞内应变意味着大的细胞间变形。例如,当应变值大于0.5时,表明细胞内结构拉伸大于0.5倍。此外,当从卵母细胞中提取细胞质时,高比例的负应变意味着卵母细胞内产生了振荡,并主导了去核过程。大的细胞内应变和细胞内部振荡对细胞发育潜力有不利影响。本研究中,分析了去核和细胞内应变分布之间的关系,设置了初始平衡压力,并基于细胞内应变评估实现了动态去核过程中细胞质运动轨迹规划,以避免细胞内的大应变并减少负应变。
《2.2.1. 基于细胞内应变评估的去核初始化》
2.2.1. 基于细胞内应变评估的去核初始化
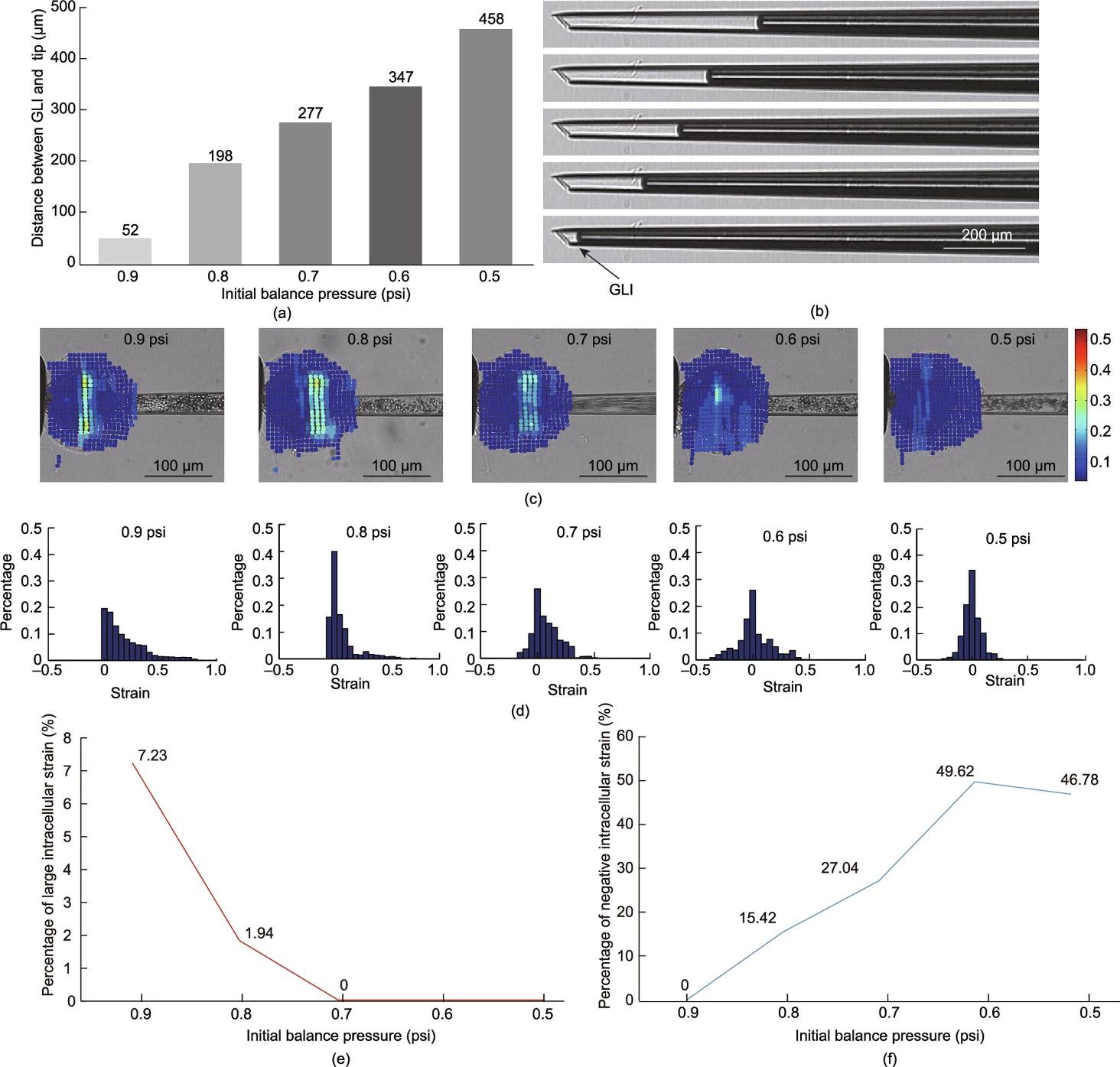
在注射针刺入卵母细胞之前需要设定初始平衡压力。之前的研究表明,注射针内的平衡压力会随着更多的培养液被吸入而降低[33]。因此,通过将不同体积的培养液吸入注射针,为去核提供不同的初始平衡压力。如图5(a)所示,选择5种平衡压力(0.9 psi、0.8 psi、0.7 psi、0.6 psi和0.5 psi;1 psi = 6.895 kPa)作为初始平衡压力,图5(b)显示了气液交界面(gas-liquid interface, GLI)的相应位置。
《图5》
图5 具有不同初始平衡压力的细胞内应变。(a)通过吸入不同体积的培养液形成5种典型的平衡压(0.9 psi、0.8 psi、0.7 psi、0.6 psi和0.5 psi)(1 psi = 6.895 kPa);(b)不同初始平衡压对应的气液交界面位置;(c)不同初始平衡压下,进行去核形成的细胞内应变场;(d)不同初始平衡压下,ROI中应变值的归一化直方图;(e)不同初始平衡压下,细胞内大应变(应变值分布于[0.5,1])的百分比;(f)不同初始平衡压下,细胞内应变负值的百分比。
将同一批次的50个卵母细胞随机分为5组,用于细胞内应变评估实验。去核过程中,注射针中的压力从初始平衡压力开始持续下降。为了确保一致性,将注射针放置在卵母细胞内的相同位置,并保持恒定的压力变化率。在卵母细胞刺入过程中,注射针以50 μm·s-1的速度水平刺入至卵母细胞直径的3/4处,以刺破细胞;随后,将注射针撤回卵母细胞直径的1/2处进行去核。在卵母细胞去核的步骤1中,压力变化率设定为0.5 psi·s-1。在步骤2中,在最大加速度下,压力变化率从0.5 psi·s-1线性降低到0.1 psi·s-1,这降低了细胞质运动的速度并减少了细胞质损失。
本研究中,逐帧计算了去核过程中的细胞内应变场。图5(c)显示了去核过程中,产生最大细胞内应变的细胞内应变场。实验结果表明随着去核过程中初始平衡压力的减小,细胞内应变的最大值减小,并且范围缩小。
本文获得了每个初始平衡压力的应变ROI中所有细胞内应变的归一化直方图。图5(d)中的每个图分别显示了整个去核过程,包括步骤1和步骤2中的10个细胞去核实验的应变值。图5(e)和(f)分别显示了不同初始平衡压力下,应变值在[0.5, 1]范围内的大细胞内应变的百分比和负细胞内应变的百分比。当初始平衡压力较高时,大多数应变值分布在直方图的正半平面,表明细胞内结构处于拉伸状态,并且有足够的动力进行去核。然而,在直方图中也观察到了大细胞内应变区域([0.5, 1]),表明已经产生了大的细胞变形。随着初始压力的降低,大应变区和细胞内大变形减少,而负应变的比例增加,意味着卵母细胞中产生了振荡,并且吸力不足以实现顺利去核。综合考虑大应变比例和负应变比例,将初始平衡压力设置为0.7 psi,完全避免了细胞内大应变,并降低了负应变的比例。此时,细胞内拉伸主导了去核过程,可以用较小的细胞内应变和较少的细胞内振荡来完成去核,这可能会导致较少的细胞内损伤。
《2.2.2. 注射针内的胞质轨迹规划》
2.2.2. 注射针内的胞质轨迹规划
在卵母细胞去核步骤2中,细胞质从卵母细胞移到注射针中。根据胞质面的加速度变化将去核过程分为多个时间间隔,并分析了不同时间间隔的应变分布(详见附录A中的图S2)。结果表明,应变与加速度变化呈正相关,加速度变化越大,应变越大。
进一步,本文以初始平衡压力0.7 psi为例进行去核,进而分析了细胞内应变与胞质面运动之间的关系。首先,本文在给定的时间间隔内得到每个时间间隔的最大应变值,并计算胞质面加速度的标准差。其次,在细胞质运动期间进行直线拟合。由于从胞质面运动到细胞产生内应变会有一定的时间延迟,因此分析了特定时间延迟下细胞内应变与胞质面的关系。根据线性拟合的优度选择最优延迟时间。表1列出了不同时间间隔的直线拟合结果。实验结果表明,最大应变与胞质面加速度标准差之间存在明显的线性关系。对于不同的时间间隔,延迟时间几乎是固定的。由于应变测量误差的影响,当时间间隔较大时,拟合结果较好。对于不同的初始平衡压力(0.9 psi、0.8 psi、0.7 psi和0.6 psi),本文在0.4 s的时间间隔内获得了近似线性的拟合结果,如图6所示。
《表1》
表1 不同时间间隔下细胞最大内应变与胞质面加速度标准差的直线拟合
《图6》
图6 不同初始平衡压下时间间隔为0.4 s的线性拟合结果。STD:标准偏差。
为了减小细胞去核过程中的大应变,应限制胞质面加速度的变化。为此,本文在卵母细胞去核步骤2中,将胞质面的加速度设为常数
(3)
式中,T是细胞质抽取的总时长。式(4)和式(5)给出了胞质面的速度和位移轨迹。
(4)
(5)
在实验中,本文使用Lucas-Kanade光流法实时检测胞质面的运动,并基于自适应滑模控制器进行控制[19]。与人工操作类似,轨迹规划结束时胞质面的速度不为零。一旦胞质面移动到设定位置,注射针撤离卵母细胞,停止卵母细胞去核,同时增加压强。
《2.3 机器人化批量SCNT》
2.3 机器人化批量SCNT
《2.3.1. 机器人化SCNT平台》
2.3.1. 机器人化SCNT平台
机器人化批量SCNT是使用课题组自主开发的NK-MR601显微操作系统实现的,如图7所示。它由以下部分组成:一台倒置显微镜(Olympus,BX-51,日本)作为系统的基本平台;一对自主开发的电动X-Y-Z三自由度微操作臂,用于定位注射针和吸持针;一台自主开发的电动X-Y二自由度平台,用于定位培养皿;一台自主开发的气动显微注射器,用于提供注射针和吸持针内的正、负压;一台自主开发的用于电机控制的多轴控制器;一个用于视觉检测的CCD相机(Panasonic,W-V-460,日本);用于显微图像处理、数据采集和运动控制的主机。电动微操作臂的行程范围为50 mm × 50 mm × 50 mm,定位精度为1 μm,最大速度为1 mm·s-1。电动载物台的行程范围为100 mm × 100 mm,定位精度为1 μm,最大速度为2 mm·s-1。气动显微注射器的负压范围为-3 ~ 0 kPa,细胞吸持的分辨率为10 Pa,正压范围为0 ~ 200 kPa,细胞注射的分辨率为10 Pa。注射阀连接到电机,可以实现注射压力的实时控制。所有图像均使用×4和×10物镜(Olympus,日本)拍摄,分辨率为768 × 576 pixel,帧速率为20 Hz。在实验中,将注射针和吸持针分别安装在左右微操作器上,并分别连接到注射器的注射通道和吸持通道。
《图7》
图7 自主研发的NK-MR601 SCNT微操作机器人系统。(a)微操作机器人系统的主要组成部分;(b)机器人化SCNT系统;(c)平台和微操作手臂。CCD:电荷耦合器件。
《2.3.2. 机器人化批量SCNT流程》
2.3.2. 机器人化批量SCNT流程
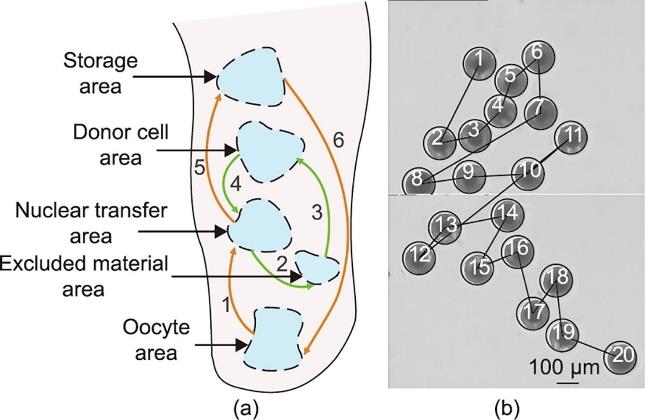
在手动SCNT中,操作员使用低倍物镜找到卵母细胞和供体细胞,再使用高倍物镜进行核移植。整个SCNT过程中,操作员需要转换和聚焦物镜4次,切换到不同的操作区域6次,导致批量SCNT的效率较低。在机器人化SCNT中,设计了一个全局地图,并获得了批量卵母细胞的全局视野,从而以优化的操作序列实现批量SCNT。首先,通过人机交互设置了5个操作区域位置,并在低倍物镜中建立了全局地图,如图8(a)所示。然后,通过显微图像拼接获得卵母细胞区域的全局视野,并自动检测卵母细胞的全局位置。最后,规划卵母细胞的操作顺序,以在不与微针发生碰撞的情况下实现最短路径操作,如图8(b)所示。
《图8》
图8 机器人化批量SCNT中的全局地图和全局视野。(a)批量SCNT中的操作区域和切换顺序,通过人机交互设定了5个操作区域的位置,并构建了全局图;(b)卵母细胞的全局视野,图中显示了卵母细胞检测结果和卵母细胞操作顺序。
此外,将机器人化SCNT流程分为多个步骤(见附录A中的图S3),并在机器人化SCNT中使用基于细胞内应变评估的卵母细胞去核方法。首先,在注射针刺入卵母细胞之前,通过将培养液吸入注射针,将初始平衡压调节至0.7 psi。然后逐渐降低针内压力,直到针尖处的细胞质开始移动。其次,根据注射针中的胞质面轨迹规划,抽取细胞质、细胞核和极体。在抽取足够量的细胞质后,以100 μm·s-1的速度水平地从卵母细胞中撤出注射针。
《3、 结果》
3、 结果
《3.1 卵母细胞去核控制结果》
3.1 卵母细胞去核控制结果
根据去核实验,式(3)~(5)中胞质抽取的时间T设为4.0 s,
《图9》
图9 胞质面轨迹与跟踪结果。
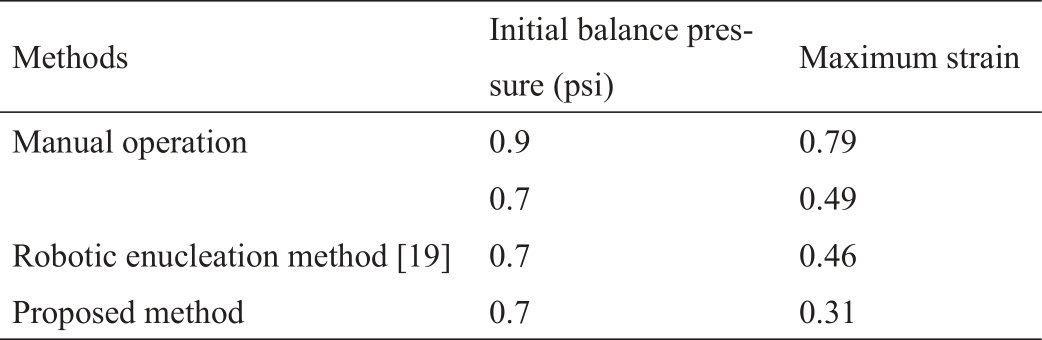
表2显示了去核方法的比较。附录A中的视频S3~S5分别展示了人工、机器人去核方法[19]和本文去核方法的去核过程及应变分布。实验结果表明,本文方法的去核过程更加稳定,去核过程中的细胞最大内应变最小。与初始平衡压力为0.9 psi的典型手动去核操作相比,最大应变从0.79降至0.31,降低了60.8%。
《表2》
表2 去核方法对比
《3.2 机器人化批量SCNT结果》
3.2 机器人化批量SCNT结果
机器人化批量SCNT有两个主要部分。首先,在低倍物镜(×4)下构建全局图,然后在高倍物镜(×10)下操作卵母细胞,如附录A中的视频S6所示。每次SCNT的操作流程如下。图10显示了操作结果。
《图10》
图10 机器人化SCNT流程。(a)微针和卵母细胞定位;(b)卵母细胞吸持并旋转到所需的去核方向(极体在4点钟方向);(c)去核初始化后的卵母细胞刺入;(d)降低平衡压,直到细胞质开始移动;(e)从卵母细胞中抽取细胞质、细胞核和极体;(f)去核结束;(g)遗传物质排出;(h)供体细胞抽取;(i)供体细胞注射。
(1)移动吸持微针与注射微针至显微视野,移动载物台使卵母细胞移至显微视野中心。图10(a)为吸持微针和卵母细胞定位的结果。
(2)用吸持微针吸持、固定住卵母细胞,调整注射微针内的平衡压,为卵母细胞去核做准备。图10(b)为吸持微针固定住卵母细胞的结果。
(3)利用注射微针拨动卵母细胞,使卵母细胞旋转到所需要的姿态。本实验中将卵母细胞旋转到极体在4点钟区域的姿态,为细胞刺入做准备。图10(c)为卵母细胞旋转的结果。
(4)利用注射微针刺入卵母细胞,本实验中以50 μm·s-1的速度沿细胞中心方向水平刺入卵母细胞,最终实现面向提高发育率的细胞刺入。图10(d)为卵母细胞刺入的结果。
(5)利用基于帧差法的自动化去核技术,用注射微针对卵母细胞进行自动化去核,检测出胞质已开始运动,并进入注射微针。图10(e)为去核开始的图片。
(6)实现面向提高发育率的卵母细胞自动化去核,图10(f)为去核结束的图片。
(7)将抽取的细胞质、细胞核、极体等从注射微针中吐出到吐核区,如图10(g)所示。
(8)选取一个合适的体细胞,将其吸入注射微针中,图10(h)为体细胞在注射微针中的结果。
(9)将体细胞注入去核后的卵母细胞内,图10(i)为体细胞在去核后的卵母细胞内的图片。
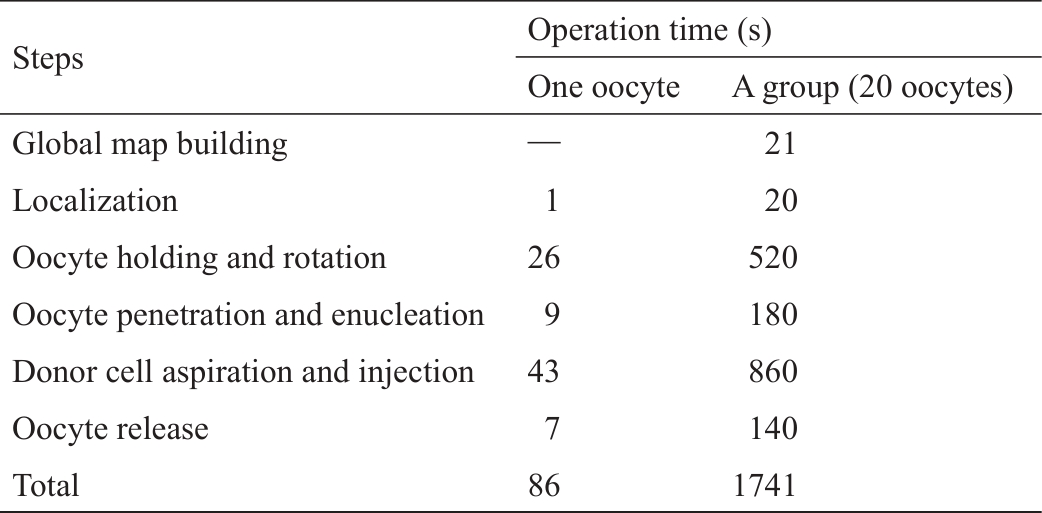
在机器人化批量SCNT中,不需要转换物镜,并且因为使用了基于全局地图的机器人化SCNT系统,将物镜聚焦次数减少了一半。以操作20个卵母细胞为例,花了大约21 s来构建全局地图,但物镜转换和物镜聚焦次数分别减少了40次和20次。对于每次SCNT,操作一个卵母细胞大约需要86 s。表3列出了在SCNT的关键步骤上花费的时间。操作20个卵母细胞需要1741 s,意味着操作速度约为每个细胞87 s。
《表3》
表3 机器人化SCNT各步骤的操作时间
为了验证该去核方法对细胞发育潜力的影响,使用本文提出的方法和手动操作对113个卵母细胞进行了批量SCNT。在本文提出的方法中,初始平衡压力设置为0.7 psi,并依据注射器中胞质面规划的轨迹,从卵母细胞中提取细胞质、细胞核和极体。在此过程中产生的最大细胞内应变为0.31。在手动操作中,为了确保视野中出现气-液交界面,方便操作人员去核,初始平衡压力设置为0.9 psi。人工去核过程中的最大细胞内应变为0.79。
SCNT操作后的重构胚胎被激活、融合并培养7 d。利用本文提出的方法,53个重构胚胎中有11个发育成囊胚;与之对应,人工操作的60个重构胚胎中仅有6个发育成囊胚。囊胚是重构胚胎体外发育的最后阶段,是成功克隆的象征。利用本文方法,囊胚率从10.0%增加到20.8%。表明大的细胞内应变会对细胞发育造成损害并影响细胞发育潜力。
《3.3 机器人化SCNT获得的克隆猪》
3.3 机器人化SCNT获得的克隆猪
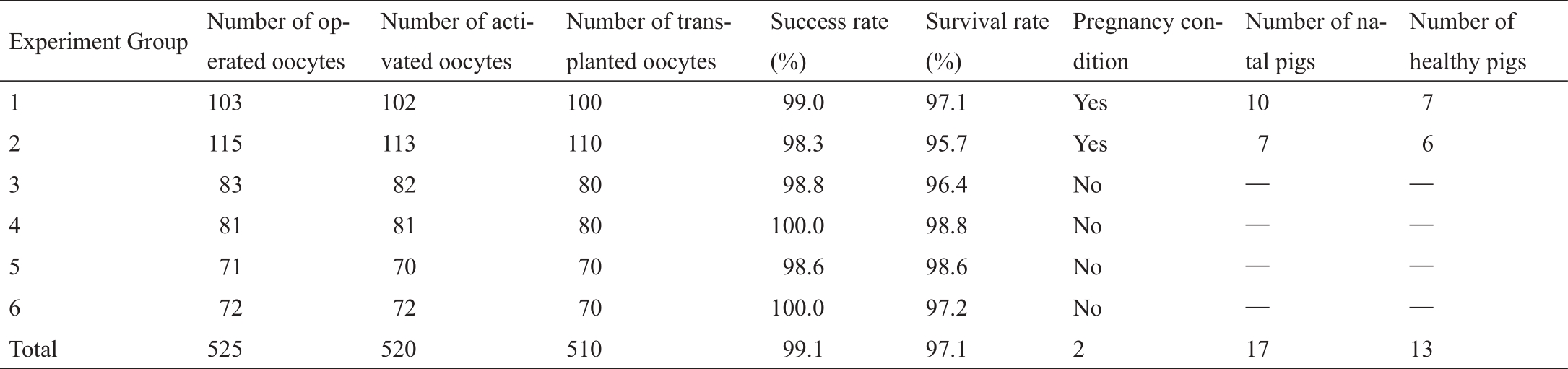
利用该微操作机器人系统对6组共525个卵母细胞进行了SCNT,其中对520个卵母细胞进行成功操作并进行激活,510个卵母细胞发育成了胚胎。表4给出了机器人化SCNT操作结果与克隆结果。本文方法的平均操作成功率为99.1%,平均成活率为97.1%。随即,将510个重构胚胎移植到6头代孕母猪体内,最终,两头代孕母猪怀孕(见附录A中的图S4)。两头代孕母猪分别于妊娠的第103天和110天诞下了世界首批由机器人系统操作得到的17头克隆猪。其中一头代孕猪(编号206)于妊娠的第103天分娩,诞下10只仔猪。其中健康仔猪7只,弱仔三只,三只弱仔陆续在2~3 d内死亡。所有仔猪的平均出生体重为1.32 kg(具体范围为1.25~1.46 kg)。另外一头代孕猪(编号14304)于妊娠的第110天,诞下7只仔猪。其中健康仔猪6只,弱仔一只,该弱仔于出生29 d后死亡。所有仔猪的平均出生体重为1.62 kg(具体范围为1.51~1.85 kg)。实验结果表明,与人工操作相比,通过机器人操作,克隆猪的成功率从0.73%提高到了2.5%(13/510)。图11给出了13头健康的克隆猪在诞下三个月后的图片。
《表4》
表4 机器人化SCNT操作结果和克隆结果
《图11》
图11 机器人化SCNT生产13头健康仔猪。
对每个样本的基因组DNA进行了微卫星分析(见附录A中的表S1)。结果表明,13只经SCNT获得的克隆猪均来源于供体细胞系B301,对所有8个微卫星标记具有100%的同一性。所有克隆猪与代孕母猪(编号206和编号14304)均有显著差异。更多详细信息请参阅附录A中的“材料和方法”部分。
《4、 讨论》
4、 讨论
本文详细分析了卵母细胞去核过程,开发了一种基于细胞内应变评估的卵母细胞去核方法。由于细胞内应变关联了细胞操作和细胞发育潜力,因此通过改进去核操作,以减少大的细胞内应变,进而降低卵母细胞去核过程中潜在的细胞内损伤。本研究评估了整个去核过程中细胞内应变的统计数据,得出了合理的去核初始化参数,即初始去核平衡压力。此外,分析了去核动态过程中细胞内应变与细胞质运动之间的关系,并根据对细胞内应变的评估设计了注射针中细胞质运动的轨迹。实验结果表明,本文提出的方法显著减少了细胞内的大应变。与初始平衡压力为0.9 psi的手动操作相比,最大应变降低了60.8%(从0.79降至0.31)。
此外,本研究评估了去核后卵母细胞的发育潜力。重构胚胎在细胞核移植后发育成囊胚。本文提出的方法将囊胚率从10.0%提高到20.8%,这是一个巨大的成就,因为囊胚是成功克隆的象征。
最后,将卵母细胞去核方法应用于SCNT,并实现了机器人化批量SCNT;成功生产了17头克隆仔猪,13头克隆仔猪发育到足月,克隆成功率2.5%,首次取得了优于人工操作的操作效果。机器人化的SCNT确保了操作过程和操作结果的一致性,从而使克隆过程中的生物化学操作环境和条件受益最大。
更高的发育潜力意味着所提出的方法减少了操作过程中的细胞内损伤。一些研究已经在细胞水平上评估了细胞内损伤。例如,显微注射引起的细胞机械损伤可以通过计数断裂键的数量来分析[35],或者基于荧光染色来评估冷冻引起的细胞内损伤[36]。然而,微操作导致细胞内损伤的机制尚不清楚。本研究为探索细胞内损伤的机制和减少损伤的方法提供了一个平台。
从操作对象的角度来看,本研究将细胞内应变引入微操作,并提供了一种优于手动操作效果的方法。这将促进克隆技术和许多其他生物操作的应用,如单精注射和极体基因组移植。用于生物操作的机器人系统,如手术机器人,也会对组织和器官造成生物损伤。然而,由于生物体的复杂性,因此评估损伤比较难。本研究在细胞水平上探索了机器人操作、细胞内应变和潜在的细胞内损伤之间的联系,这也为探索手术机器人操作过程中的损伤打开了大门。
在未来,将进一步改进机器人化SCNT。如表3所示,在机器人化的SCNT过程中,卵母细胞拨动和供体细胞抽取需要很长时间。本文研究团队将在运动学建模和流体建模的基础上设计新的卵母细胞拨动和体细胞抽取方法,以提高操作效率。此外,将分析卵母细胞的几何和力学特性,并将机器人化SCNT扩展到其他动物,如小鼠和绵羊上。





















 京公网安备 11010502051620号
京公网安备 11010502051620号




