《一、 前言》
一、 前言
居民饮食消费结构不断升级,对动物性产品的消费需求持续增加;大规模养殖业导致的资源环境、公共健康等问题凸显,驱动发展更高效、可持续、更安全的食品生产新技术。细胞农业技术通过细胞培养来生产农业产品,能够生产肉、蛋、奶等由完整细胞构成的细胞产品,蛋白质、脂肪酸等有机分子的非细胞产品;将农业产品的生产主体由植物或动物等完整生命体简化为细胞(构成生命体的最小单元),利用细胞工厂高效、精准地生产目标产品,将显著提高资源利用率、物质转化率,减少土地、水等资源消耗以及温室气体排放[1]。
细胞培养肉作为细胞农业技术的应用场景之一,在提出“双碳”战略目标、实施农业绿色发展的时代背景下得到了广泛关注和迅速发展。细胞培养肉又称生物培育肉、培育肉,通过体外培养动物细胞的方式生产可供食用的动物组织(如肌肉、脂肪、皮等)[2]。细胞培养肉的优势在于提供真实的动物源营养物质(如蛋白、脂肪、微量元素等),产品种类在理论上可涵盖所有的畜禽水产动物;相应的工业化生产技术体系根植于生物技术与食品、农业产业的深度融合,是未来食品技术的发展“高地”。
近年来,培养肉领域发展迅速,针对细胞培养肉的生产流程、核心工艺、法规与监管、经济及环境效应等进行了广泛探讨与深入研究[3,4];细胞培养肉相关的基础理论和应用技术研究,在种子细胞分离与培养、细胞功能维持及调控、细胞支架与组织塑形等方面都取得了关键性突破,产业化进程不断推进[5]。国际主流研究团队完成了实验室阶段的工艺开发,进入了规模化工艺验证、中试生产阶段;标志性的中试工厂已经建成并投产,最大产能达100 t/a[,7];细胞培养肉的生产成本快速下降,如使用培养基过滤再生技术将细胞培养鸡肉的价格降到3.6美元/100 g [3]。在我国,一些高校和科研院所正在开展细胞培养肉技术攻关,关键技术研发得到了公共资金支持;成立了近10家细胞培养肉初创企业,部分企业进入了中试工艺研发阶段,正在建设千升级的反应器生产平台。
由国内外细胞培养肉的主流进展可见,细胞培养肉技术正在从实验室研发迈入产业化应用阶段;在继续加强核心科技攻关的同时,还需超前关注细胞培养肉产业的基础能力、布局规划和未来发展。细胞培养肉产业作为战略性新兴产业,快速和优质发展的前提条件是坚实的产业基础能力(细分为科技基础、人才基础、环境基础)。其中,科技基础居于第一层次,也是细胞培养肉产业形成和发展的基本前提,具体包括基础原料及工艺、基础装备设施、基础产品与技术体系等。因此,从产业发展角度剖析我国培养肉科技基础态势和薄弱环节,构思“促长板、补短板”策略,是推进细胞培养肉产业健康稳定发展的重要内容。
本文围绕细胞培养肉产业技术发展课题,从基础原料与试剂、基础装备设施、产业技术体系方面展开调研,总结工业化生产所需核心原料及装备的种类、功能,分析生产技术体系及产品市场竞争格局,进而形成有关产业发展的思考与建议,以期为新兴产业发展、细胞农业技术等研究提供基础参考。
《二、 细胞培养肉基础原料和试剂》
二、 细胞培养肉基础原料和试剂
细胞培养肉生产涉及种子细胞获取、体外大规模增殖、三维分化产生肌纤维 / 脂肪等组织、食品化加工等环节,主要的生产原料有供体动物、种子细胞、培养基、支架材料。
《(一) 良种动物》
(一) 良种动物
培养肉生产技术旨在实现利用最少的动物资源来获得最大化的蛋白质资源。动物细胞是细胞培养肉生产的核心原料,通常需要从活体动物中分离获得。种子细胞具有与供体动物相同的遗传性状,在获取或建立培养肉生产用种子细胞(系)之前,需对供体动物的质量进行评估。养殖动物良种通常指具有优良生产性能的品种、品系或种群,多数具有生长速度快、生产性能好、产品质量及营养价值高等特点。选择具有优良生长和营养特性的供体动物作为种子细胞来源,是生产高品质培养肉产品的关键因素,有利于提高消费者的接受度。
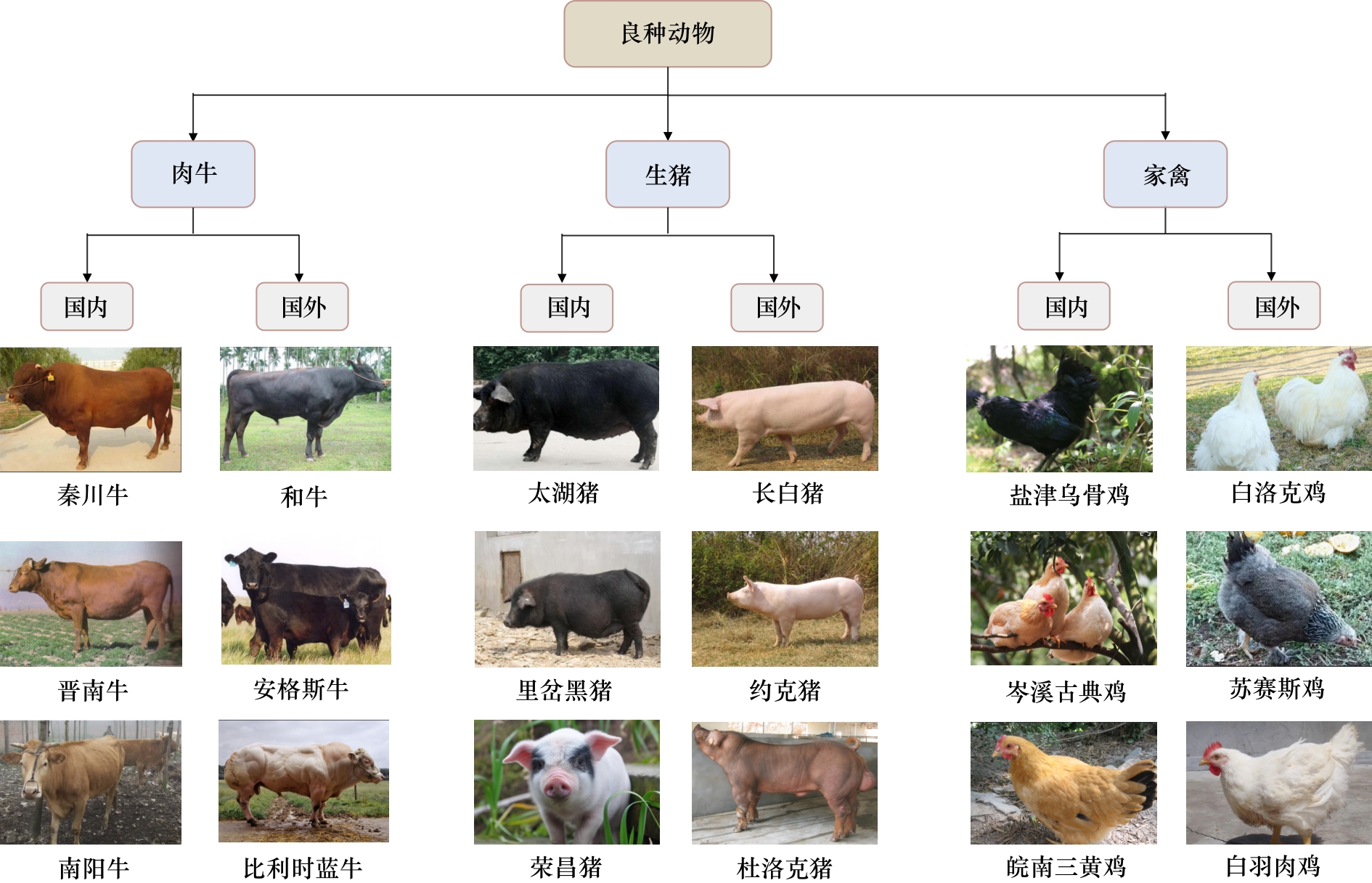
在畜牧业,已利用杂交育种等方式获得许多优良的动物品种(见图1)。① 在良种肉牛方面,国际公认的优质肉牛有原产自日本的和牛、苏格兰的安格斯牛[8]:前者肉质好,肌肉脂肪中的饱和脂肪酸含量极低,营养价值很高;后者具有早熟、肉质好、高饲料转化率的特点。黄牛是我国的主要牛种,其中秦川牛、晋南牛、南阳牛、鲁西牛、延边牛为知名品种。② 在生猪良种方面,国际公认的优良猪种有长白猪、约克猪、杜洛克猪。我国也有许多良猪品种,如繁殖力高的太湖猪、繁殖率高且肉质鲜嫩的里岔黑猪等。皮薄骨细的金华猪、适应性强且瘦肉率高的荣昌猪。③ 在家禽良种方面,国际公认的优良鸡种有美国的白洛克鸡、浅花苏赛斯鸡、白羽肉鸡。我国有许多极具地方特色的优良土鸡品种,如盐津乌骨鸡、岑溪古典鸡、皖南三黄鸡等。
《图1》
图1 细胞培养肉产业良种动物
《(二) 种子细胞》
(二) 种子细胞
在细胞培养肉生产过程中,首个步骤是分离和提取种子细胞,相应的质量和数量对后续的增殖、分化步骤均有重要影响。种子细胞需具备体外增殖能力,能够产生肌纤维、脂肪细胞、基质蛋白等构成肌肉组织的成熟体细胞,目前主要有原代种子细胞、永生化细胞系两大类型。
原代种子细胞指从动物组织分离、具有体外增殖能力的原代细胞,分为胚胎干细胞、间充质干细胞、肌肉干细胞、成纤维细胞等。胚胎干细胞是具有发育全能性、无限增殖和多向分化潜能的细胞,但并非所有物种都能建立稳定、可长期传代的胚胎干细胞系,细胞干性维持和诱导分化的培养条件也较苛刻[9]。成体干细胞如肌肉干细胞、间充质干细胞、成纤维细胞等是当前细胞培养肉生产的主要种子细胞类型,位于肌肉、脂肪、皮肤等组织中,具有来源及分布广泛、分离提取工艺成熟、易于体外培养等优势[10]。此外,肌肉干细胞、间充质干细胞和成纤维细胞具有体外增殖、产生肉类组织终末细胞的能力,如肌纤维、脂肪、基质蛋白(胶原蛋白、弹性蛋白)等[10,11],但它们的体外生存周期、增殖能力有限,细胞功能也随着体外培养时间的延长而显著降低[12]。因此,深入研究细胞增殖及分化过程,挖掘关键作用分子并基于此建立高效的体外调控策略,是实现培养肉种子细胞体外长期稳定增殖的重要途径。我国研究团队在猪、牛等大动物干细胞研究方面取得进展,发现了具有促进动物肌肉干细胞增殖作用的食品或药品级化合物(如维生素C [13]、胰岛素样生长因子-1[14]、2,3-二羟基黄酮[15]),为建立高效的种子细胞大规模培养体系确立了基础条件。
永生化细胞系指经过自发突变、理化诱变或基因工程技术获得的具有体外无限分裂生长能力的细胞。自发或诱变永生化技术通过非“转基因”方式建立永生化细胞系,支持细胞培养肉的大规模、长期稳定生产,更易被公众接受以及通过上市审批。以色列的研究团队利用鸡胚成纤维细胞建立了自发永生化的细胞系,进行了细胞的悬浮驯化并在搅拌式反应器中实现高密度培养[16]。然而对于哺乳动物细胞,自发或诱变永生化的概率较低;常规手段是利用基因工程技术将外源永生化基因导入目的细胞内以增加永生化的发生率,进而建立永生化细胞系。例如,利用CRISPR/Cas9技术进行牛肌肉干细胞的周期蛋白和端粒酶相关基因的靶向修饰,能够提高细胞的增殖能力并维持端粒酶的高活性,获得永生化牛成肌细胞系[17]。需要注意的是,通过基因编辑技术建立的永生化细胞系可能将被贴上“转基因”标签,在上市审批、市场应用方面面临更大的难度。此外,种子细胞无论是否经过基因改造,体外长期培养均有引发细胞基因组不稳定、核型改变的风险[18],因此在培养肉生产各阶段对细胞以及最终产品进行全面深入的研究及安全评估,是保障细胞培养肉食品质量与安全的重要方式。
《(三) 培养基》
(三) 培养基
培养基指人工模拟细胞生长的营养环境,由不同营养物质组合配制,提供营养并促进细胞生长增殖的基础基质;为种子细胞的体外存活生长提供营养物质,是细胞培养肉生产的重要原料。动物细胞培养基通常包括基础细胞培养基、血清两部分。基础细胞培养基是由多种氨基酸、维生素、碳水化合物、脂类、无机盐等经一定配比制成的合成培养基。细胞仅在基础培养基中无法存活,还需额外添加血清。血清富含生长因子、血浆蛋白、多肽、维生素、微量元素、激素等大量细胞生长与增殖所必需的成分,但价格昂贵、成分复杂且不完全明确,使用血清也违背了培养肉技术不宰杀动物的原始目的。因此,针对特定种子细胞开发无血清培养基是培养肉技术研发的重点任务。
目前,市场上的无血清培养基主要是针对生物制药应用场景的主要细胞(如HEK293、CHO、Vero)研制的,并不适用于细胞培养肉的种子细胞。研制支持动物干细胞、成纤维细胞体外生长的低成本无血清培养基,是细胞培养肉规模化生产的重要前提。近期研究报道了一种将种子细胞与改造后可分泌细胞因子的生物工程细胞共培养的方法,可减少甚至消除种子细胞增殖过程中对血清的依赖,降低了培养基中血清和外源因子的使用量[19]。此外,植物或酵母蛋白水解物富含多种氨基酸、矿物质、活性肽等,筛选蛋白水解物并与关键生长因子结合,可开发高效的鸡成肌细胞无血清培养基;其中的成分已被美国食品药品监督管理局(FDA)、美国农业部、欧洲食品安全局批准可用于食品[20]。在产业方面,我国细胞培养基市场规模超过40亿元,绝大部分市场份额被赛默飞、默克等国外品牌占据,尚无针对细胞培养肉应用场景的无血清培养基上市销售;国内企业可把握机遇,积极拓展细胞培养肉领域的无血清培养基市场。
《(四) 支架材料》
(四) 支架材料
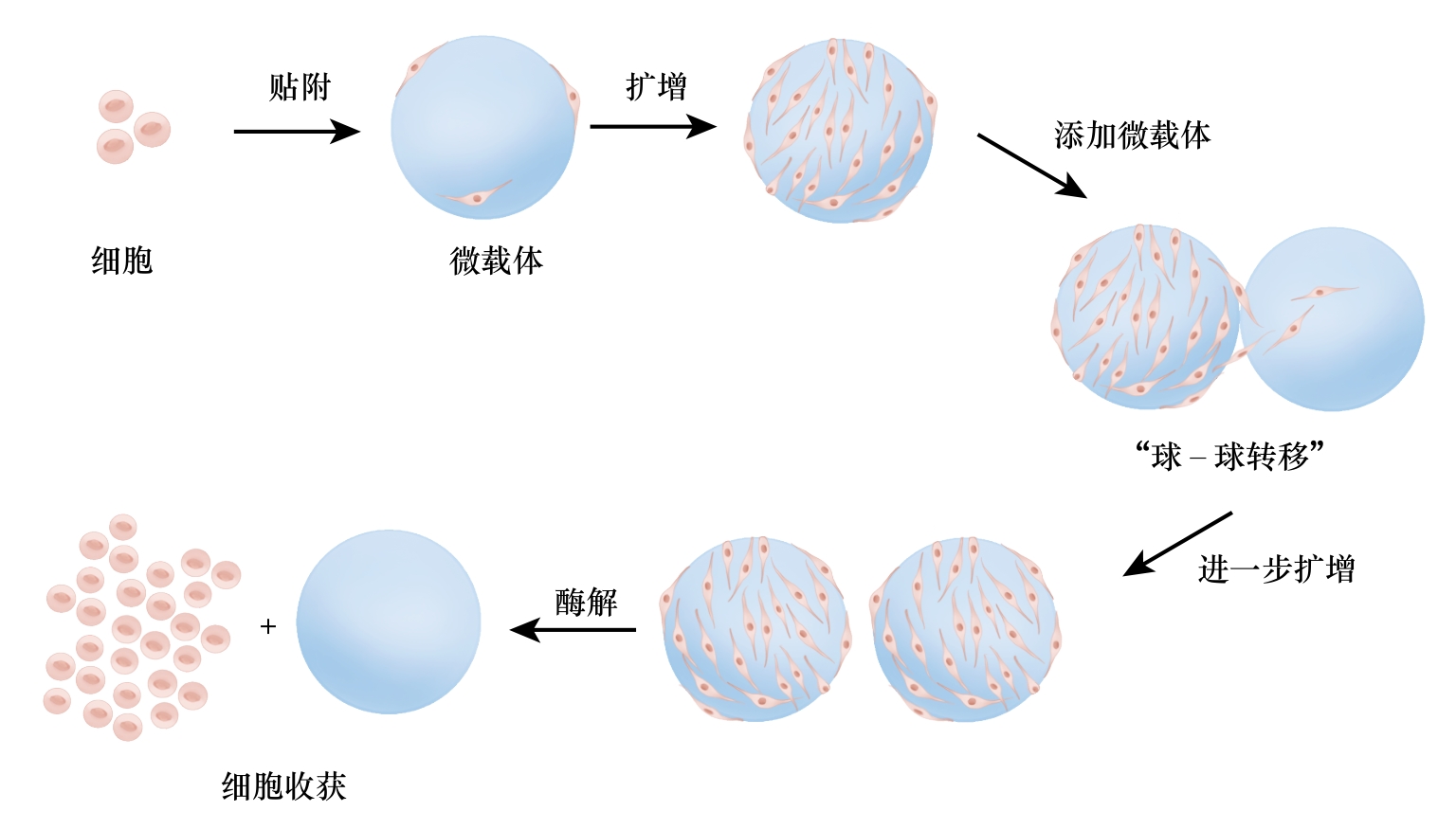
用于培养肉生产的种子细胞大部分需贴壁生长,在生物反应器中进行大规模、高密度培养,制作具有宏观尺寸的培养肉产品时都需使用细胞支架材料,主要分为微载体、三维支架两类。① 微载体是支持细胞生长的球形或片状微型固体基质,支持生物反应器系统中贴壁细胞的生长[21]。在使用微载体时,先将细胞与微载体共同孵育,使细胞在微载体的表面贴附;随后细胞在微载体上增殖并长满微载体的表面,加入新的微载体时还可通过“球 ‒ 球转移”进一步扩增;最后通过酶解、物理搅动等方法收获细胞[22](见图2)。② 三维支架是制造组织化细胞培养肉产品的重要原料,模拟自然组织中支持细胞生长和功能的细胞外基质成分,内部为多孔结构,可满足O2、营养素、代谢废物的运输,为细胞的生长、增殖、分化等过程提供生理环境和媒介[23]。将成肌细胞、成脂细胞等按照仿生结构和排布接种于可食用的三维支架中,在一定的培养条件下使细胞分化产生肌纤维、脂肪细胞,可制造出接近真实肉外观、纹理、风味的细胞培养肉产品。
《图2》
图2 细胞贴附微载体过程
在早期,多数微载体或三维支架由合成聚合物制成,如聚乳酸 ‒ 羟基乙酸、聚羟乙基甲基丙烯酸酯、聚苯乙烯、聚氨酯等[24]。近年来,天然聚合物及其衍生物(如明胶、胶原蛋白、纤维素、壳聚糖、海藻酸钠),因其良好的细胞相容性和可降解性成为新兴的微载体材料[25]。以作为原料的明胶为例,部分跨国企业的产量约占市场总量的60%以上,亚洲众多中小型明胶企业的产量占比约为20%。目前市场上已有商品化的微载体产品,但多由外国品牌所垄断;国内相关技术研发起步较晚,仅有数家企业(如北京华龛生物科技有限公司、北京霍尔斯生物科技有限公司)具有生产能力,但市场份额不足10%。
可食用的细胞支架材料及其制造技术成为细胞培养肉领域的研究热点。由大豆等植物蛋白制成的多孔蛋白支架,具有成本低、可大规模生产、质构接近肉制品等优势,成为新兴的细胞培养肉支架材料[26]。在制造技术方面,基于纺丝技术生产的纤维细丝支架,可模拟真实肌纤维的形状及排布,利于诱导细胞的定向排布及分化以形成肌纤维,提高体外产生肌肉组织的结构精细度和成熟度[27]。此外,三维生物打印技术可按需定制结构及尺寸,精确控制细胞、生物墨水的分布位置,利于制造含有多种类型细胞、拟真组织结构的细胞培养肉产品[28]。
《三、 细胞培养肉基础装备设施》
三、 细胞培养肉基础装备设施
《(一) 生物安全柜》
(一) 生物安全柜
细胞培养过程涉及细胞复苏、传代、换液、冻存等基础操作,需要生物安全柜提供无菌操作环境[29]。生物安全柜的工作原理是将柜内空气向外抽吸,在柜内保持负压状态:外界空气经过高效空气(HEPA)过滤器后进入生物安全柜内,防止样品被污染;柜内的空气也经HEPA过滤器过滤后再排放到大气中,以保护环境。生物安全柜分为Ⅰ级、Ⅱ级、Ⅲ级,分别适应不同的生物安全等级要求;Ⅱ级生物安全柜通常可满足细胞培养肉生产操作的基本需求。HEPA过滤器是生物安全柜的重要部件,可除去空气中99.97%以上0.3 µm直径的颗粒。此外,气流控制也是提供无菌操作环境的关键技术,需使进气流从安全柜前窗开口处径直流向安全柜的进风格栅,同时气流速度处于合适的范围。
在高端生物安全柜市场,近年来国内企业发展迅速,代表性的有海尔生物、苏净安泰、博科等品牌,国内市场份额攀升至30%左右。但是,核心控制技术及零部件仍被优势国际企业掌控,如国内市场上气流控制模块、HEPA过滤器等零部件的进口比例超过70%。
《(二) 生物反应器》
(二) 生物反应器
在实验室规模的细胞培养肉生产技术逐步成熟后,开发以生物反应器为核心装备的大规模细胞工艺成为培养肉工业化生产的关键环节。生物反应器通过内部的培养基以及通入CO2、O2等,为细胞创造类似于体内环境的三维空间;配置探针或传感器,自动检测细胞的生长环境并进行动态调整,实现高密度动物细胞的培养[30]。主流的生物反应器有波浪式、搅拌式、鼓泡式等类型。① 波浪式生物反应器采用非介入的波浪式摇动混合方式,提供温和低剪切力、高溶氧的细胞培养微环境,形成易于维持的细胞生长理想环境(细胞密度超过1×107个/mL),是种子细胞小规模放大的首选反应器类型[31];但工作体积通常小于200 L,不便开展更大规模的细胞培养。② 搅拌式生物反应器开发较早,是研究、中试、生产中应用最为广泛的一类生物反应器;通常由马达带动桨叶来混合培养液,利用搅拌器的旋转来驱动细胞培养液的流动混合,使细胞、养分在培养液中均匀分布;能够培养各种类型的动物细胞,培养工艺容易放大,最大体积达2.5×104 L,是工业化生产的主流反应器类型。③ 鼓泡式生物反应器利用气体鼓泡进行供氧及混合,罐内液体流动温和均匀、剪切力小,对细胞损伤较小且氧传递率高,同样适用于大规模生产。
应对细胞培养肉的工业化生产需求,广泛应用于生物医药行业的搅拌式生物反应器是研究重点。径高比(直径∶高度)是搅拌式反应器的重要参数,用于动物细胞培养的反应器通常取为1∶2;搅拌桨的类型也需考虑低速、低剪切力、低通气率等效果。生物反应器内部结构复杂,而保证反应器无菌是大规模生产的关键因素。蒸汽灭菌法获得FDA批准可用于细胞培养肉的制造[32],但随着生物反应器体积的增大、内置部件的增多、灭菌成本的提高,常规蒸汽灭菌方法的缺陷逐步暴露。近年来,一次性生物反应器在细胞工艺过程中的应用逐渐增多,表现为前期投入少、工艺灵活性高、污染及交叉污染风险低、适合多个品种及多类工艺研发等优点[33],但生产过程中一次性耗材成本较高,可能不适用于细胞培养肉的规模化生产。研制用于反应器、培养基消毒的装置系统,通过流体泵控制器将无毒的二氧化氯气体在密闭空间中循环停留以达到充分消毒目的,在细胞培养肉等需要使用大规模生物反应器的领域具有应用前景[34]。
目前,我国生物反应器市场上的进口产品占比超过80%,而自主研发起步较晚(2010年后才陆续出现规模化生产线),目前在关键零配件、控制系统、系统验证等方面仍有明显的短板。传感器、阀门、称重仪、磁力搅拌机等生物反应器的关键零配件明显依赖进口,国内配套产品在质量、精度、稳定性等方面差距较大;控制系统较多基于国外品牌的工控计算机、可编程逻辑控制器、操作系统、组态软件进行二次开发与集成;国产系统验证特别是电算化验证进展缓慢,而国外标准推陈出新,抬高了生物反应器的验证难度和市场准入门槛。因此,生物反应器的国内自主制造需要精密制造、芯片、软件、控制等多方面的技术水平提升和紧密配合。
《(三) 其他常用装备》
(三) 其他常用装备
细胞培养肉的生产过程还需CO2培养箱、灭菌装置、倒置显微镜等其他常用设备。CO2培养箱通过稳定的温度(37 ℃)和CO2水平(5%)、恒定的酸碱度(pH值为7.2~7.4)、较高的相对饱和湿度(95%),为初始分离的种子细胞提供良好的生长环境;还具有HEPA过滤、自动灭菌循环系统以控制微生物污染,配置风扇辅助系统、气流控制系统以改善操作环境。我国的CO2培养箱市场基本被国外品牌占据,单一国外品牌的占有率接近40%。
压力蒸汽灭菌器利用高温饱和水蒸气的持续作用,使微生物的蛋白质变性导致微生物死亡,达到对耐湿、耐热物品进行灭菌的目的。细胞培养肉生产所需的耗材,如移液枪头、离心管、玻璃器皿等,大多需要经过压力蒸汽灭菌器进行灭菌处理,避免在操作过程中造成污染。在我国的压力蒸汽灭菌器市场上,致微仪器、伯能仪器、上海申安等国产品牌占有率较高,合计份额超过了国外品牌。
倒置显微镜是观察细胞形态、增殖或分化状态,评估细胞数量的关键仪器,工作原理是对细胞内各种亚细胞结构、质膜、细胞器等进行相差显微成像。倒置显微镜属于精密光学仪器,技术壁垒较高,国内高端市场的75%以上由国外品牌占据。对应地,国产倒置显微镜在光学系统、物镜、机械稳定性等方面与进口产品存在明显差距,表现为产品功能单一、成像质量与对比度不佳、机械故障率较高。
《四、 细胞培养肉技术体系》
四、 细胞培养肉技术体系
《(一) 种子细胞库建立》
(一) 种子细胞库建立
获取适用于制备细胞培养肉的种子细胞并建立细胞库,是细胞培养肉工业化生产的首要任务。建立种子细胞库的主要流程有种子细胞的分离纯化、细胞鉴定、微生物与病原体检测,随后将符合标准的种子细胞分类冻存并标记。在种子细胞的分离纯化环节,不同类型种子细胞的提取或者细胞系构建方法存在差异性。对于胚胎干细胞,一般使用囊胚内细胞团培养法进行分离和建系。在成纤维细胞等体细胞中过表达关键转录因子(OSKM因子)可建立诱导多能干细胞系[35],也可以利用小分子化学刺激[36]、mRNA技术[37]实现重编程诱导。肌肉干细胞、间充质干细胞等成体干细胞主要从组织中分离获取,通用方法有组织块贴壁法、酶消化法等,进一步采用密度梯度离心法[38]、差速贴壁法[11]、流式分选法[39]、免疫磁珠分选法[40]等进行细胞纯化。我国研究团队在肌肉干细胞的分离、纯化等方向已开展系统研究,比较了多种蛋白酶(如链霉蛋白酶、分散酶、胰蛋白酶、胶原蛋白酶)对肌肉组织的消化效力,建立了适用于细胞培养肉工业化生产的细胞分离纯化方法[11]。
在初步获得较纯的种子细胞后,需对种子细胞进行鉴定,可选方法有:利用聚合酶链式反应(PCR)检测法鉴定种属、通过细胞形态观察、免疫特异性检测确定细胞类型、采用标记染色体检测遗传标志、通过细胞培养验证细胞活力及均一性。由于原始种子细胞来源于动物个体,极易受到外部环境污染,也需进行微生物和病原体检测,可采用接种观察法、镜检法,基因探针、PCR技术等分子诊断方法进行检测。待种子细胞检定合格后,需标记并放置于液氮或-130 ℃以下环境中以便稳定储存。种子细胞库的稳定运行及良好维护,将为细胞培养肉的大规模生产提供检定合格、质量一致、持续稳定的细胞资源。
《(二) 低成本培养基研制》
(二) 低成本培养基研制
作为细胞培养肉生产的重要原料,细胞培养基需满足3个基本要求:能够有效维持并促进目标细胞的体外增殖 / 分化,不含有动物源成分且符合食品安全要求,可规模化生产、大量供应且成本低廉。近年来,规格标准化、完全不含动物源性成分的无血清培养基受到更多重视[14,41],与含血清培养基相比具有质量稳定可控、安全性高的特点。无血清培养基的研发难度较大,主要表现在:血清中含有保护杀菌的蛋白,故无血清培养条件下对操作、环境的无菌要求更高;无血清培养基中往往需要额外添加大量生长因子、维生素、脂肪酸及微量元素等,成本相对较高[42]。因此,开发出成分明确、效果良好、成本较低的无血清培养基,对细胞培养肉工业化生产至关重要。无血清培养基的研制方法主要有培养过程分析方法、分子生物技术方法、统计学方法。
培养过程分析方法以细胞代谢分析为基础,利用代谢组学、蛋白质组学等检测分析手段,对细胞培养过程中的葡萄糖、氨基酸、维生素、脂肪酸、微量元素等进行实时监控,寻找细胞生长不同阶段的关键营养物质,进而开发细胞特异性的无血清培养基。例如,利用转录组技术检测了牛肌肉干细胞在成肌分化过程中基因表达图谱的变化情况,分析出了分化起始时的关键上调表面受体,随后补充相应配体并建立了化学成分明确的分化培养基[43]。
分子生物技术方法借助基因组学、蛋白组学等技术,对体外培养过程中细胞内的基因或蛋白表达进行辨析,通过细胞生长和代谢状态来预测细胞的营养需求,针对性开发无血清培养基。例如,通过在线监测系统实时收集细胞的营养摄取和代谢信息[44],掌握细胞在增殖分裂或分化过程中的代谢特点,在培养基中补充细胞偏好的小分子物质;据此优化培养基的配方,促进细胞增殖和功能基因表达。
基于统计学方法进行成分和浓度的优化是无血清培养基研发的重要方法,主要分为筛选实验方法、优化实验方法:前者以细胞生长速率和密度作为参考,筛选对细胞增殖或分化有显著影响的营养物质[13,45,46];后者对感兴趣的数个因子进行建模(函数拟合),考虑因子之间的交互关系以获得最优响应效果。近年来,随着人工智能技术的迅速发展,利用机器学习算法来建立培养基组分及浓度的预测方法、构建较为完善的样本数据库,是开发无血清培养基配方的新策略[47]。
《(三) 大规模培养工艺》
(三) 大规模培养工艺
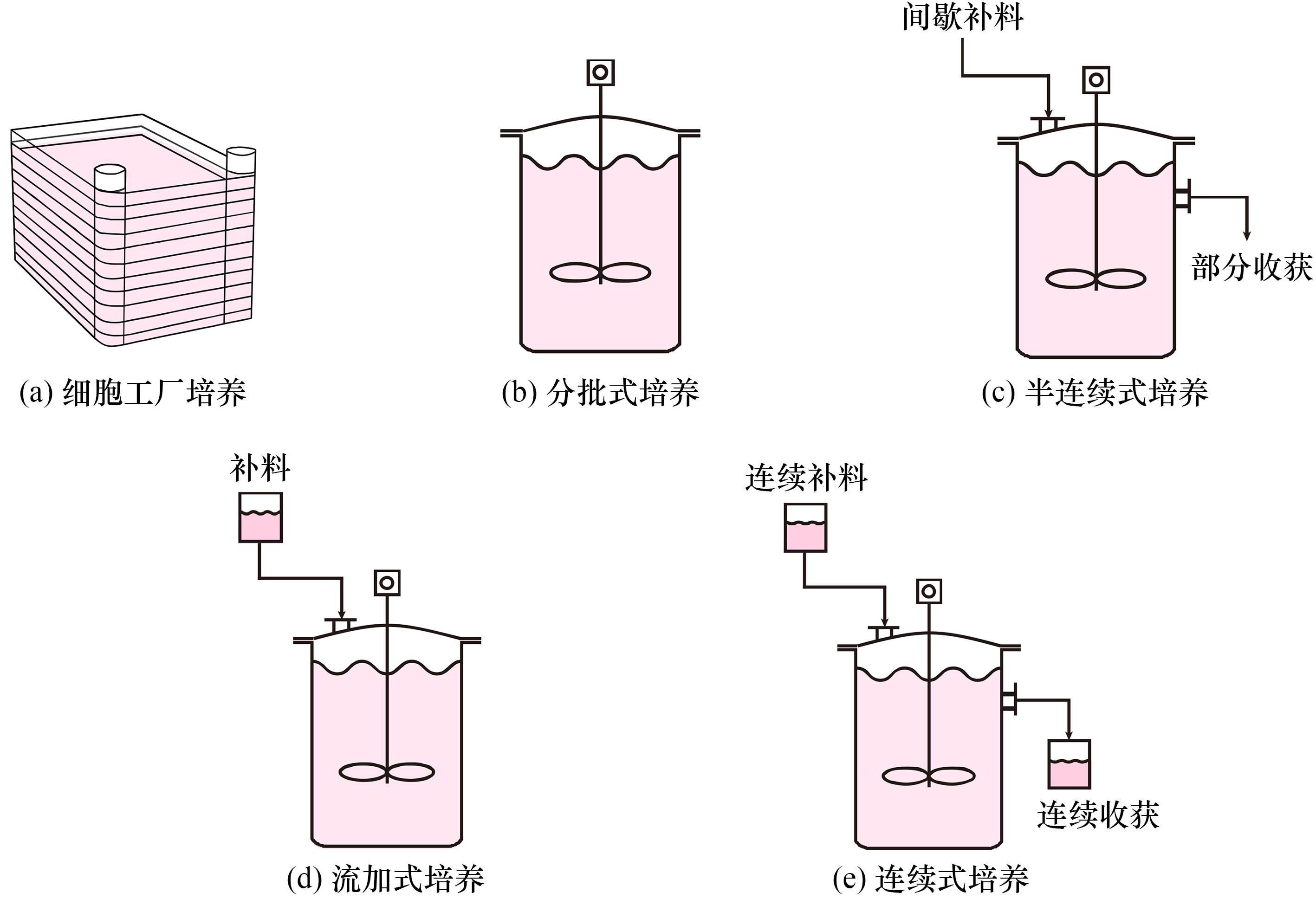
动物细胞的大规模培养是生物技术的重要分支,也属细胞培养肉规模化生产的核心技术[48],常用的形式有细胞工厂培养、分批式培养、流加式培养、半连续式培养、连续式培养(见图3)。不同的培养形式各具优缺点,需针对性改良优化以适应细胞培养肉生产。
《图3》
图3 细胞大规模培养技术形式
在细胞培养的初级放大阶段,通常需使用细胞工厂系统,实现细胞培养瓶到生物反应器的过渡。细胞工厂又称多层细胞培养器,用作初级放大规模的细胞培养耗材,特别适用于贴壁细胞,可提供1层、2层、10层、40层的培养体系。利用细胞工厂获得一定数量的细胞后,将细胞接种于生物反应器中进行大规模培养,培养形式分为分批式、半连续式、流加式、连续式。① 分批式培养指在反应器中一次性投入培养基及细胞,在适当条件下培养一定时间后再一次性放出全部培养物进行后处理的培养方法,操作简单、在工业生产中应用广泛[49]。② 半连续式培养是在分批式培养的基础上,间隔一段时间取出部分培养物,再补充新的培养液,以分批操作的方式进行培养。③ 流加式培养指在培养过程中补加新鲜的营养物质,整个过程结束前不取出反应物的培养过程,突出特点是能够调节培养环境中营养物质的浓度,避免过高的初始营养成分浓度产生的抑制作用,同时防止营养成分被耗尽后产生的限制作用[50]。④ 连续式培养将新鲜培养液不断加入反应器内,同时不断取出培养液、通过截留装置将细胞留在反应器中,使反应条件处于恒定状态[51];细胞获取充分的营养并及时排出代谢废物,实现较高的细胞密度和产率,但培养成本较高,存在易染菌、截留装置易堵塞等不足。
细胞培养工艺过程的精准优化、高效放大等技术是细胞培养肉大规模生产的核心。目前,已发展了多种生物反应器控制系统,能够快速、可靠地模拟放大过程并获得准确的控制参数。放大过程的关键控制参数分为两类:与体积无关的参数(如温度、溶氧、pH值),受体积和几何尺寸影响的参数(如搅拌速度、通气流量)[52]。为了保持培养环境的一致性,多采用以下几种放大原则。① 恒定叶端速度。搅拌桨剪切力是影响反应器中细胞生长的重要因素(以叶端速度来体现),恒定叶端速度可使细胞在同样的剪切力环境下生长。② 恒定混匀时间。搅拌混合使气体与液体充分接触,形成稳定的气体传质;也使液体中的有效成分浓度在体系中均匀分布,形成稳定的液体培养环境。③ 恒定体积传质系数(KLa)。KLa表征O2从气相进入到液相的速率,受到搅拌速度、通气流量等因素的影响;恒定的KLa为细胞提供了相同的氧传递环境,是细胞正常生长和代谢的基础。④ 恒定单位体积功耗比(P/V)。P/V影响培养体系的混合和传质,与搅拌功率、罐体直径、搅拌桨直径、工作体积、液体密度等因素有关,恒定P/V是较多采用的放大策略[53]。
《(四) 食品化加工技术》
(四) 食品化加工技术
为使细胞培养肉产品具备与真实动物肉相近的颜色、风味和营养,需在细胞培养结束后进行食品化加工。肌红蛋白、血红蛋白与真肉的肉色形成关系密切,但通过细胞培养体外产生的肌管成熟度不如真实肉中的肌纤维,因而肌红蛋白表达量低、无法呈现与真实肉相近的颜色,故细胞培养肉的食品化加工中仍需额外的增色、调味等工序。国内机构在食品合成生物技术研究方面取得了良好进展。构建了毕赤酵母重组菌株高效表达的血红素,不同来源的肌红蛋白、血红蛋白等[54,55],添加到培养肉制品中可增强其色泽和风味。
利用组织工程技术并与细胞支架结合,在体外生产出具有一定规模、组织结构的块状细胞培养肉产品,但是产品尺寸多为厘米级,距离大规模应用仍有差距。利用食品加工的相关技术和设备,借助酪蛋白粉、谷氨酰胺转氨酶等黏合剂,将收集得到的细胞(肉糜状)重新塑形,是改善细胞培养肉产品形态品相的可行方法[56,57]。目前开发出了多种细胞培养肉的产品形式,如细胞培养五花肉、牛排、鸡排、肉丸、鱼肚、鹅肝等。将细胞培养肉制成休闲食品的系列技术也处于研发过程中,如将动物肌肉细胞、水凝胶等组合制成脱水薄片食物,在口感上可替代油炸膨化薯片,作为高蛋白、高纤维、高钙、低脂肪的休闲食品[58]。
《五、 细胞培养肉产业技术发展的思考与建议》
五、 细胞培养肉产业技术发展的思考与建议
《(一) 加快试剂装备国产化进程,完善培养肉产业链》
(一) 加快试剂装备国产化进程,完善培养肉产业链
目前,国内细胞培养肉生产的核心原料试剂(如血清、细胞培养基、细胞因子)多为进口产品,主要原因是国内产品的效能、质量稳定性等存在不足;尤其是无血清培养基、定制化解决方案等高端应用,国内市场仍由大型跨国企业所主导。在细胞培养肉生产的核心装备(如生物反应器、CO2培养箱、倒置显微镜)方面,进口产品占绝对份额;国内制造商尽管可自主生产部分装备,但核心零部件多为进口。不同于其他食品制造,细胞培养肉生产所需的大部分原料和装备都来源于生命科学领域。我国生物制造行业起步晚,具有企业数量多、规模小、布局散的特点,行业集中度偏低;上市产品多是基础通用试剂、小型仪器设备,在高端市场上处于明显滞后态势。
针对核心试剂和装备过度依赖进口的问题,国内企业、高校、科研机构需积极开展技术研发规划、加大资源保障力度,同时坚持自主创新、着眼“卡脖子”技术突破,以自主产品的质量提升来增强市场竞争力。这是降低细胞培养肉综合生产成本的重要途径。还需及时针对细胞培养肉产业链开展分析和布局。细胞培养肉技术的知识体系学科跨度大、技术壁垒高,仅靠某单一企业或科研机构难以在短期内全面攻克。合理细分细胞培养肉的产业链,明确细分行业的核心方向和研发重点;强化企业的科技创新主体地位,支持和鼓励优势企业牵头并与高校、科研机构联合,围绕细胞培养肉技术体系中的比较优势方向开展技术攻关,有望快速取得成效。
《(二) 完善培养肉技术体系,加强知识产权国际布局》
(二) 完善培养肉技术体系,加强知识产权国际布局
快速推进细胞培养肉产业化进程,需要以完善的技术体系为保障。从目前已公开专利的技术领域、发表论文的研究选题来看,我国细胞培养肉的技术研发虽然覆盖种子细胞提取、培养基开发、三维组织成型、食品化加工等方向,但在规模化生物反应器装备、放大工艺等方面相对缺乏。国内企业、高校、科研机构虽已申请一定数量的中国发明专利,但细胞培养肉相关的国际专利稀少。与之相对,国外的优势企业和高校均积极开展世界范围内的专利布局(包括在中国进行专利申请与保护),可能对我国细胞培养肉技术的自主构建、企业可持续发展等造成冲击。
细胞培养肉相关的知识产权覆盖领域广、技术性强、涉及多学科交叉,需要系统性布局并开展深化研究。国内企业和科研机构在合理借鉴国际先进生产技术的基础上,可集中资源攻关薄弱技术环节,以生物反应器装备及控制参数优化、放大生物过程工艺体系建立等为重点内容。细胞培养肉属于食品领域的前沿产业,国内企业和科研机构可结合自身的技术与资源优势,注重开展细胞培养肉知识产权的国际布局,尤其是加大在重点国家和地区的专利申请力度,为未来参与国际合作和竞争筑牢基础;合理和充分利用专利布局,壮大产业链、形成产业集群,以自有知识产权为支撑提升我国细胞培养肉产业的国际竞争力。
《(三) 优化学科专业布局,校企融合双元育人》
(三) 优化学科专业布局,校企融合双元育人
细胞培养肉技术作为新兴研发方向,需要细胞生物学、发育生物学、生物材料、组织工程等背景知识来实现种子细胞的体外生长调控,发酵工程、计算机科学等学科能力以构建智能化细胞培养肉生产体系,食品科学与工程、营养与食品卫生学等基础应用以保障细胞培养肉产品的安全、美味、营养[59]。目前,国外许多高校成立了创新研究机构,将细胞培养肉技术研发列为重点方向;开设了细胞培养肉相关课程,为学生提供较完备的细胞培养肉知识体系。但国内尚无高校或科研机构专门针对细胞培养肉开设本科、研究生课程,不利于培养专业技术人员队伍、培育细胞培养肉高层次人才。
培育细胞培养肉专业人才,需要多学科合作。高校是人才培养的主渠道,可适时优化学科布局、革新学生选课机制,增设细胞培养肉专业方向;聚合基础生物学、工程学、食品科学等背景的师资力量和技术人员成立教研团队,制定培养方案、传授基础理论知识;融合细胞培养肉行业的新理论、新技术进展,对课程体系设置进行及时调整和必要补充。企业是细胞培养肉行业的主体,需充分掌握产业发展所需的知识及技能,可强化“产学研”合作模式,建立联合实验室或研发中心,深入参与细胞培养肉的人才培养过程;以校企联合实验室的形式,为企业技术人员提供培训条件,高效提升细胞培养肉行业的人才培养质量,实现行业发展与人才培养的融通互促。
《(四) 完善产品风险评估,论证和发布团体标准》
(四) 完善产品风险评估,论证和发布团体标准
细胞培养肉与传统肉类食品在生产原料、工艺过程、产品构成等方面具有显著的差异性,不宜套用现行的肉类食品检测指标、质量控制标准进行风险评估。专门发布细胞培养肉安全评价与监管的政策文件或在现行政策法规的基础上进行更新,是国际通行做法,很多国家和地区已启动实质性工作。然而我国作为世界最大的肉类产品消费国、肉类产品进口国,细胞培养肉相关的监管制度、标准等仍不明确;建立和完善细胞培养肉食品安全监管体系以及相关的法律规章,确保符合国情并反映实际,成为产业发展亟需。
在我国现行的食品安全监管体系下,细胞培养肉产品的上市需要经历严格的审批过程,主要由国家食品安全风险评估中心负责实施。种子细胞、培养基、支架等细胞培养肉的主要生产原料,部分成分(如氨基酸、维生素)已被批准作为食品生产的原辅料,部分成分(如细胞因子、白蛋白、激素)属于药用原辅料但未有食品使用史。因此,需要组建科学家联合团队,广泛调研生产工艺和原辅料,就重点环节开展风险评估,提出生产原料、生产过程中的潜在危害及风险因子;在此基础上,企业和科研机构联合研究并制定团体标准、行业指南等,作为细胞培养肉企业在产品研发、生产过程中应遵守的基本准则。这些举措将为政策法规、管理标准等的制定提供科学依据。
《(五) 加强科学知识普及,提高公众接受度》
(五) 加强科学知识普及,提高公众接受度
细胞培养肉产业的稳健发展与大众消费者的认可度、喜好程度密切相关,但自细胞培养肉概念诞生以来,关于安全、伦理方面的争论从未停止。在我国,细胞培养肉的消费者熟悉度、市场接受度都不高[60],这是细胞培养肉产业基础的薄弱之处,将显著制约产业的可持续发展。只有提高公众的接受度、激发消费需求,才能打破成见,使这项新兴食品技术获得充分的发展空间。
提高公众对细胞培养肉的接受度,需要管理部门、企业、专家学者的共同努力。聚集各方力量,广泛开展科学有效的普及宣传,引导公众树立对细胞培养肉的正确认知;积极培育和维护细胞培养肉的目标消费群体,逐步扩大消费群体的范围,整体性提高公众对细胞培养肉的接受度。面向社会各界开展有关细胞培养肉的看法和评价调研,加强专家学者、产业界、监管部门、消费者等多方利益主体的沟通交流,建立各方信息的融合与反馈机制。唯有各方共同努力,积极建设和维护细胞培养肉市场,才能提高公众对细胞培养肉的接受度,切实推进细胞培养肉的产业化进程。
利益冲突声明
本文作者在此声明彼此之间不存在任何利益冲突或财务冲突。
Received date: January 17, 2023; Revised date: March 1, 2023
Corresponding author: Chen Jian is a professor from the Science Center for Future Foods, Jiangnan University and a member of Chinese Academy of Engineering. His major research field is fermentation engineering and food biotechnology. E-mail: jchen@jiangnan.edu.cn
Funding project: Chinese Academy of Engineering project “Strategic Research on the Development of Technology and Equipment for the Cultured Meat Industry” (2022-XY-22)













 京公网安备 11010502051620号
京公网安备 11010502051620号




