《1. 引言》
1. 引言
副猪嗜血杆菌(H. parasuis)是一种烟酰胺腺嘌呤二核苷酸(NAD)依赖性革兰氏阴性细菌,可引起猪的格拉瑟氏病(Glässer’s disease),表现为肺炎、关节炎、多发性浆膜炎和脑膜炎等症状,给全世界的养猪业造成巨大经济损失[1–3]。据报道,近几年由该病原菌引起的疫情在欧洲、亚洲和北美洲急剧增加[4–8]。副猪嗜血杆菌存在大量不可分型菌株和血清型多样性,导致疫苗的交叉免疫保护较差[2]。
在目前,抗生素治疗仍然是控制猪格拉瑟氏病的有效治疗方法之一。大量的抗菌药物,包括β -内酰胺类、氨基糖苷类、大环内酯类、氯霉素类、四环素类、喹诺酮类和磺胺类药通过加入到饲料、饮水或注射的方式被用于猪格拉瑟氏病的防控。低剂量的抗菌药物也被广泛用于促生长和疾病防控[9]。但是,这些大量的抗菌药物的使用被认为是抗生素耐药性积累的主要原因[10–12]。目前已经有了一些关于不同区域的副猪嗜血杆菌的耐药性和相关耐药基因的报道[13–17]。这些研究结果表明,副猪嗜血杆菌拥有β-内酰胺类药物抗性(耐药基因包括blaROB-1 、blaTEM-1 等)[18]、四环素类药物抗性(耐药基因包括tetB 、tetC、tetH 等)[17]、磺酰胺类药物抗性(耐药基因包括sulI、sulII 等)[19]以及氟喹诺酮类药物抗性[耐药基因包括qnrA1、qnrB6、aac(6′)-Ib-cr、gyrA、gyrB 等] [20]。
越南是全球第五大生猪生产国。目前尚没有关于越南副猪副嗜血杆菌分离株的耐药性表型与耐药性基因之间相关性的报道。在本研究中,我们检测了从越南广平省和顺化省猪中分离的56株副猪嗜血杆菌对25种抗菌药物的敏感性以及相关的耐药性基因的存在情况,并分析了耐药表型与耐药基因之间的相关性。这些结果首次揭示了越南中部地区副猪嗜血杆菌耐药性流行情况,对越南格拉瑟氏病的临床防控,以及对制定相关政策和提供临床用药指导以减少越南养猪业中抗生素耐药性具有重要意义。
越南是全球第五大生猪生产国。目前尚没有关于越南副猪副嗜血杆菌分离株的耐药性表型与耐药性基因之间相关性的报道。在本研究中,我们检测了从越南广平省和顺化省猪中分离的56株副猪嗜血杆菌对25种抗菌药物的敏感性以及相关的耐药性基因的存在情况,并分析了耐药表型与耐药基因之间的相关性。这些结果首次揭示了越南中部地区副猪嗜血杆菌耐药性流行情况,对越南格拉瑟氏病的临床防控,以及对制定相关政策和提供临床用药指导以减少越南养猪业中抗生素耐药性具有重要意义。
《2. 材料与方法》
2. 材料与方法
《2.1. 细菌分离株》
2.1. 细菌分离株
本研究共使用了56株副猪嗜血杆菌。这些菌株于2017年6~9月从越南中部(顺化省和广平省)的养猪场和屠宰场的猪中分离得到,菌株的信息已经在我们之前的研究中进行了详细描述[21]。副猪嗜血杆菌使用含有10 μg·mL–1NAD和5%牛血清的胰蛋白酶大豆琼脂培养基(TSA, BD DifcoTM, BD Biosciences, USA)进行培养。
《2.2. 抗菌药物敏感性测定》
2.2. 抗菌药物敏感性测定
本研究使用美国临床和实验室标准协会(CLSI)推荐的肉汤微量稀释方法测定副猪嗜血杆菌分离株的最低抑菌浓度(MIC)[22]。总共使用了25种抗菌药物,分别是庆大霉素(GEN)、卡那霉素(KAN)、链霉素(STR)、妥布霉素(TOB)、壮观霉素(SPE)、阿莫西林(AMX)、头孢氨苄(CFL)、头孢呋辛(CFX)、青霉素(PEN)、恩诺沙星(ERF)、诺氟沙星(NOR)、环丙沙星(CIP)、泰妙菌素(TIA)、泰乐菌素(TYL)、红霉素(ERY)、林可霉素(LIN)、氯霉素(CHL)、氟苯尼考(FFC)、磺胺甲嘧啶(SDM)、磺胺甲恶唑/甲氧苄氨嘧啶(TXT)、强力霉素(DOX)、四环素(TET)、金霉素(CTET)、黏菌素(CL)。抗菌药物的折点是根据CLSI指南设置[22]。实验记录了菌株的耐药性范围以及MIC50 和MIC90 值。使用流感嗜血杆菌ATCC 49247作为质控菌株。将对两种及两种以上不同类型的抗菌素耐药的菌株定义为多重耐药(MDR)菌株。
《2.3. 耐药基因扩增》
2.3. 耐药基因扩增
利用常规聚合酶链反应(PCR)检测了32个耐药基因的存在情况,包括8个氨基糖苷类耐药基因、2 个β-内酰胺类耐药基因、7个氟喹诺酮类耐药基因、4个大环内酯类耐药基因、5个氯霉素类耐药基因、2个磺胺类耐药基因和4个四环素类耐药基因。耐药基因、引物序列以及扩增片段大小见表1 [17,19,23–29]。PCR体系总体积为25 µL,包括12.5 µL 2×Taq PCR预混液(CW Biotech, China)、上下游引物各1 µL(25 µmol·L–1 )、超纯水8.5 µL以及2 μL gDNA(> 10 ng·μL–1 )。使用Eppendorf热循环仪进行PCR扩增,扩增条件针对每个目标基因进行优化(表 1)。PCR产物经1%琼脂糖凝胶电泳后,在紫外成像系统中观察电泳条带。
《表1》
表1 耐药基因扩增引物



(续表)


F: forward;R: reverse.
《2.4. 数据分析》
2.4. 数据分析
采 用SPSS软 件(IBM SPSS Statistics version 18.0, IBM, USA)进行统计分析,并记录必要的变量以进行统计建模。主要结果和反应变量包括检测率超过2%的单个抗性基因。将对两种或两种以上抗菌药物耐药的菌株定义为多重耐药菌株,将单一菌株中具有两种或两种以上耐药基因的菌株定义为多重耐药基因菌株。特异性耐药基因与耐药性表型之间的相关性采用卡方检验和费歇尔精确检验进行分析。统计学差异使用95%置信区间(CI)和优势比(OR)展示。OR > 1,即正相关,表示某一基因型(或表型)与测得的表型(或基因型)同时出现的可能性高;而OR < 1,即负相关,则表示某一基因型(或表型)与测得的表型(或基因型)同时出现的可能性低。如果p 值低于0.05,则相关性显著。
《3. 结果》
3. 结果
《3.1. 副猪嗜血杆菌的耐药性表型》
3.1. 副猪嗜血杆菌的耐药性表型
56株副猪嗜血杆菌对25种抗菌药物的敏感性检测结果见表2。根据各抗菌药物的MIC折点,菌株对除氟喹诺酮类、泰妙菌素(TIA)、强力霉素(DOX)、氟苯尼考(FFC)以外的所有抗菌药物均表现出高度耐药。其中,对甲氧苄氨嘧啶/磺胺甲恶唑(TXT)的耐药率最高(94.6%),其次是黏菌素(CL)(91.1%)、氯霉素(CHL)(91.1%)、青霉素(85.7%)、庆大霉素(GEN)(83.9%)、林可霉素(LIN)(82.1%)、阿莫西林(AMX)(78.6%)、头孢氨苄(CFL)(71.4%)、红霉素(ERY)(69.6%)、金霉素(CTET)(67.9%)和泰乐菌素(TYL)(66.1%)。所有副猪嗜血杆菌分离株均对强力霉素(DOX)敏感。另外,所有菌株均为多重耐药菌株。其中一株分离自屠宰场猪鼻腔拭子的副猪嗜血杆菌菌株,对18种抗菌素均具有耐药性(表3)。
《表2》
表2 25种抗菌药物对副猪嗜血杆菌(H. parasuis)菌株的最低抑菌浓度(MIC, μg·mL–1 )


(续表)

Breakpoints of resistance used are indicated with vertical black lines when available. Number of strains with MICs of trimethoprim/sulfamethoxazole (TXT) = 0.15/0.008, 0.30/0.016, 0.6/0.032, 1.2/0.064, 2.4/0.125, 4.8/0.25, and 9.5/0.5 are not available. MIC50, and MIC90: the lowest concentration of AM agents capable of inhibiting the growth of 50% and 90% of strains, respectively.
a MIC of TXT = 19 µg·mL–1 /1 µg·mL–1 .
b MIC of TXT = 38 µg·mL–1 /2 µg·mL–1 .
c MIC of TXT = 76 µg·mL–1 /4 µg·mL–1 .
d MIC of TXT = 152 µg·mL–1 /8 µg·mL–1 .
e MIC of TXT = 304 µg·mL–1 /16 µg·mL–1 .
f MIC of TXT = 608 µg·mL–1 /32 µg·mL–1 .
g MIC of TXT = 1216 µg·mL–1 /64 µg·mL–1 .
《表3》
表3 副猪嗜血杆菌耐药表型和耐药基因的数量统计

《3.2. 耐药表型之间的相关性》
3.2. 耐药表型之间的相关性
接下来我们分析了16种耐药表型之间的相关性。如表4所示,几乎每一种耐药性表型与至少另一种耐药表型显著相关(p < 0.05)。相关性最强的是在泰乐菌素(TYL)和金霉素(CTET)抗性之间(OR = 93.3, p < 0.0001),其次是泰乐菌素(TYL)与红霉素(ERY)抗性之间(OR =65.6, p < 0.0001),以及阿莫西林(AMX)与青霉素(PEN)抗性之间(OR= 60.2, p < 0.0001)。另外,林可霉素(LIN)与金霉素(CTET)抗性以及头孢氨苄(CFL)与青霉素(PEN)的抗性之间有较强的相关性。
《表4》
表4 副猪嗜血杆菌耐药表型之间的相关性
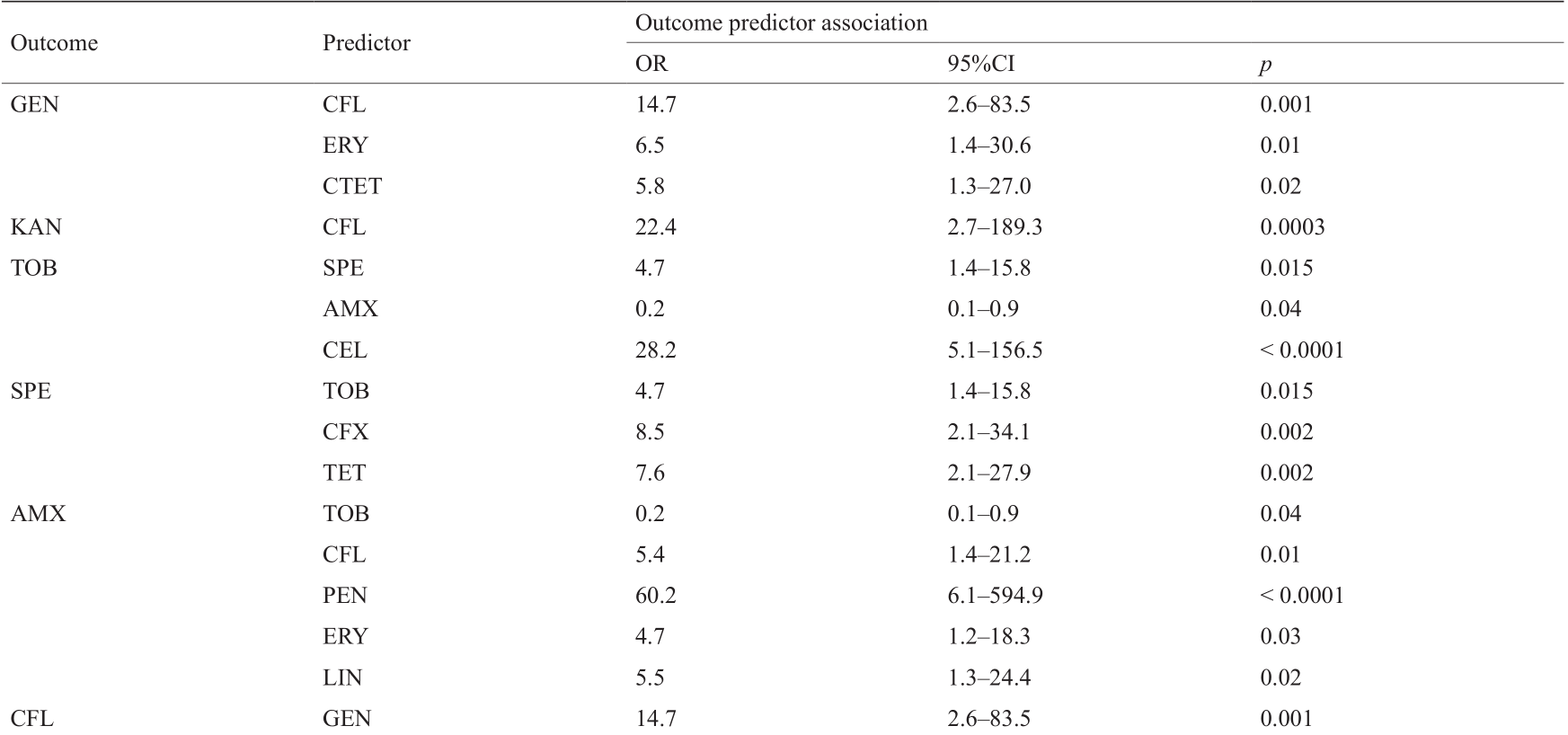


(续表)


《3.3. 副猪嗜血杆菌分离株的耐药基因》
3.3. 副猪嗜血杆菌分离株的耐药基因
表5列出了56株副猪嗜血杆菌菌株中各耐药基因的存在情况。blaTEM-1 基因检出率最高(94.6%),其次是int(76.8%)、gyrA(58.9%)和rmtD(50.0%)。parE 和flor 基因的检出率最低(均为3.6%)。然而,这些菌株中均未检测到gyrB、cfr 或tetC 基因。大多数菌株(98.2%)携带至少一种耐药基因(表3)。
《表5》
表5 副猪嗜血杆菌菌株中耐药基因的分布


(续表)
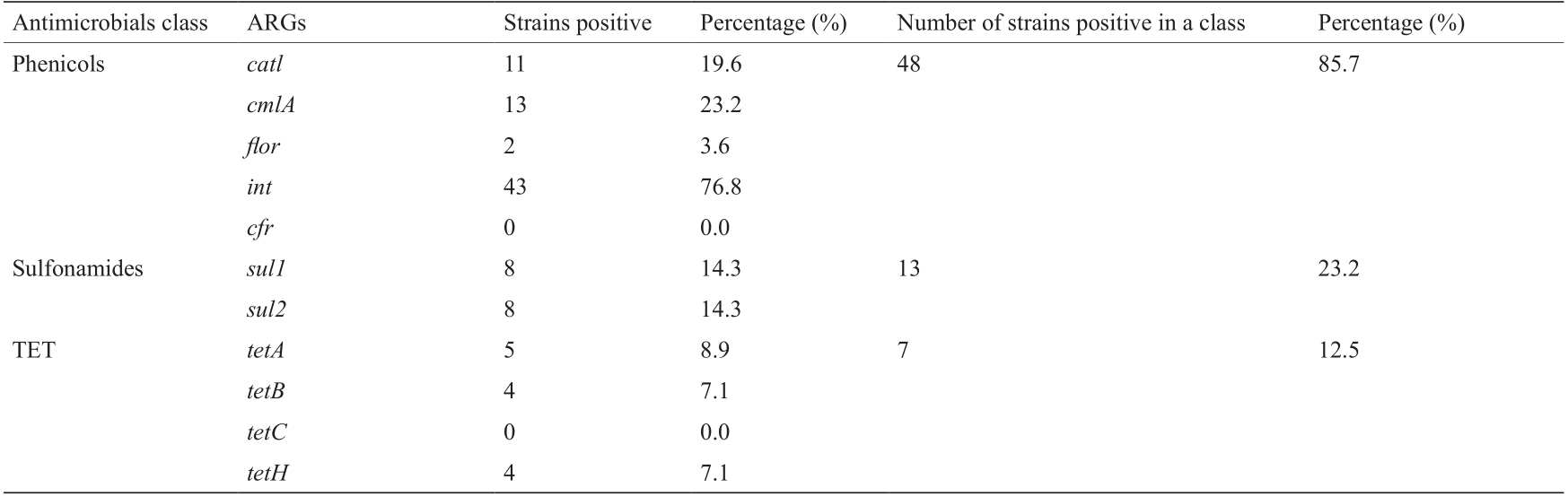
《3.4. 耐药基因之间的相关性》
3.4. 耐药基因之间的相关性
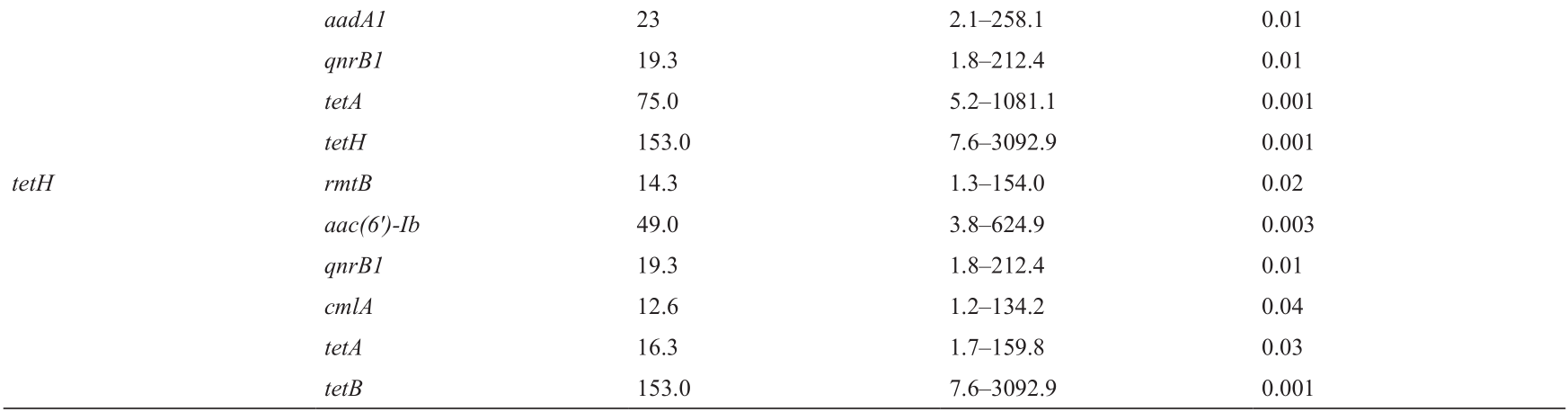
我们在以下基因对之间发现了显著的正相关性(按OR排序):tetB/tetH (OR = 153, p = 0.001)、tetA/tetB (OR =75, p = 0.001)、tetH /aac(6 ′ )-Ib (OR = 49, p = 0.001)、sulII/aac(6 ′ )-Ib (OR = 23, p = 0.003)和 (OR =23, p =0.01)(表6)。然而,amtA、blaTEM-1 、parE 和flor 与其他任何基因都无相关性。耐药基因之间的关联大部分为正相关(OR > 1),但4对耐药基因[qnrA1/gyrA, qnrB1/int, parC/int, lnu(C)/int ]之间为负相关(OR < 1)(表6)。
(OR =23, p =0.01)(表6)。然而,amtA、blaTEM-1 、parE 和flor 与其他任何基因都无相关性。耐药基因之间的关联大部分为正相关(OR > 1),但4对耐药基因[qnrA1/gyrA, qnrB1/int, parC/int, lnu(C)/int ]之间为负相关(OR < 1)(表6)。
《表6》
表6 副猪嗜血杆菌分离株中耐药基因两两之间的相关性


(续表)


《3.5. 耐药表型与基因型之间的相关性》
3.5. 耐药表型与基因型之间的相关性
耐药基因可能与遗传因素有关,使用一种特定抗菌素不仅可以使细菌产生对该药物的耐药性,还可能使细菌产生对其他抗菌素的耐药性[30]。细菌耐药表型与基因型之间的强相关性表明抗菌药物的使用选择了具有新型耐药性决定因子的细菌[31]。我们在这些副猪嗜血杆菌中发现耐药表型与基因型之间存在显著的相关性(表 7)。在47 株对庆大霉素(GEN)耐药的菌株中,70.2%的菌株携带1~7个相应的耐药基因,这一表型与rmtD 的存在呈显著正相关(OR = 10.8, p = 0.02)。在27株卡那霉素(KAN)耐药菌株中,6株(22.2%)菌中检出strA,7株(25.9%)菌中检出strB,16株(59.3%)菌中检出aadA,1株(3.7%)菌 中 检 出amtA,10株(37.0%) 菌 中 检 出rmtB,22株(81.5%)菌中检出rmtD,7株(25.9%)菌中检出aacC2[aac(3)-lic],8株(29.6%)菌中检出aadA1。然而,值得注意的是,有一株耐药菌株不携带任何耐药基因(3.7%),但具有卡那霉素抗性。卡那霉素(KAN)耐药性与aadA (OR= 19.6, p < 0.0001)、rmtD (OR = 16.9, p < 0.0001)、 aadA1 (OR = 11.8, p = 0.01)、strB和aacC2 [aac(3)-lic] (OR = 9.8, p = 0.02)、strA (OR = 8.0, p = 0.048)以及rmtB (OR = 7.9, p = 0.01)基因的存在呈显著正相关。对托布拉霉素(TOB)耐药的菌株中,大部分(17/18, 94.4%)含有相应的耐药基因,包括strB、aadA、rmtB、rmtD和aadA1,其中该耐药表型与strB (OR = 23.5, p = 0.001)和rmtB (OR = 11.7, p =0.001)基因相关性较高。在18株壮观霉素(SPE)耐药菌株中,6株(13.3%)检出了strA,8株(17.8%)检出了strB,17株(37.8%)检出了aadA,2株(4.4%)检出了amtA,11株(24.4%)检出了rmtB,6株(13.3%)检出了aacC2[aac(3)-Iic],7株(15.6%)检出了aadA1。壮观霉素(SPE)抗性与aadA (OR = 29.8, p < 0.0001)、rmtB (OR= 22.5, p < 0.0001)和rmtD (OR = 9.6, p = 0.001)基因有显著相关性。有13个菌株对头孢呋辛(CFX)耐药,这些菌株都携带blaTEM-1 ,而其中有5个菌株(38.5%)也携带blaROB-1 。相比之下,40个(40/53, 75.5%)携带blaTEM-1 和6个携带blaROB-1 的菌株中有1株未表现出对头孢呋辛(CFX)耐药。头孢呋辛耐药与blaROB-1 呈显著正相关(OR= 26.3, p = 0.002)。对泰乐菌素耐药菌株中有67.6%(25/37)的菌株含有至少一个相应的泰乐菌素耐药基因。这些菌株中,有6株(16.2%)携带erm(A),20株(54.1%)携带erm(B),11株(29.7%)携带erm(C),2株(5.4%)携带lnu(C)。泰乐菌素耐药性与erm(B) (OR = 10.0, p = 0.03)、erm(C) (OR = 7.6, p = 0.04)和lnu(C) (OR = 0.1, p = 0.005)呈现相关性。然而,泰乐菌素耐药性只与两个抗性基因[erm(B)和erm(C)] 呈正相关。对于氯霉素类药物,51株菌株对氯霉素(CHL)耐药,5株对氟苯尼考(FFC)耐药。45株(45/51, 88.2%)对氯霉素(CHL)耐药的菌株携带至少一个相应的耐药基因。氯霉素(CHL)耐药性与int (OR= 18.7, p = 0.01)以及氟苯尼考(FFC)耐药性与catl (OR =25.1, p = 0.004)、cmlA (OR = 18.7, p = 0.01)呈正相关。然而,阿莫西林(AMX)、头孢氨苄(CFL)和青霉素(PEN)的耐药性与任何耐药基因均无相关性。
表7 副猪嗜血杆菌耐药性表型和耐药基因的相关性
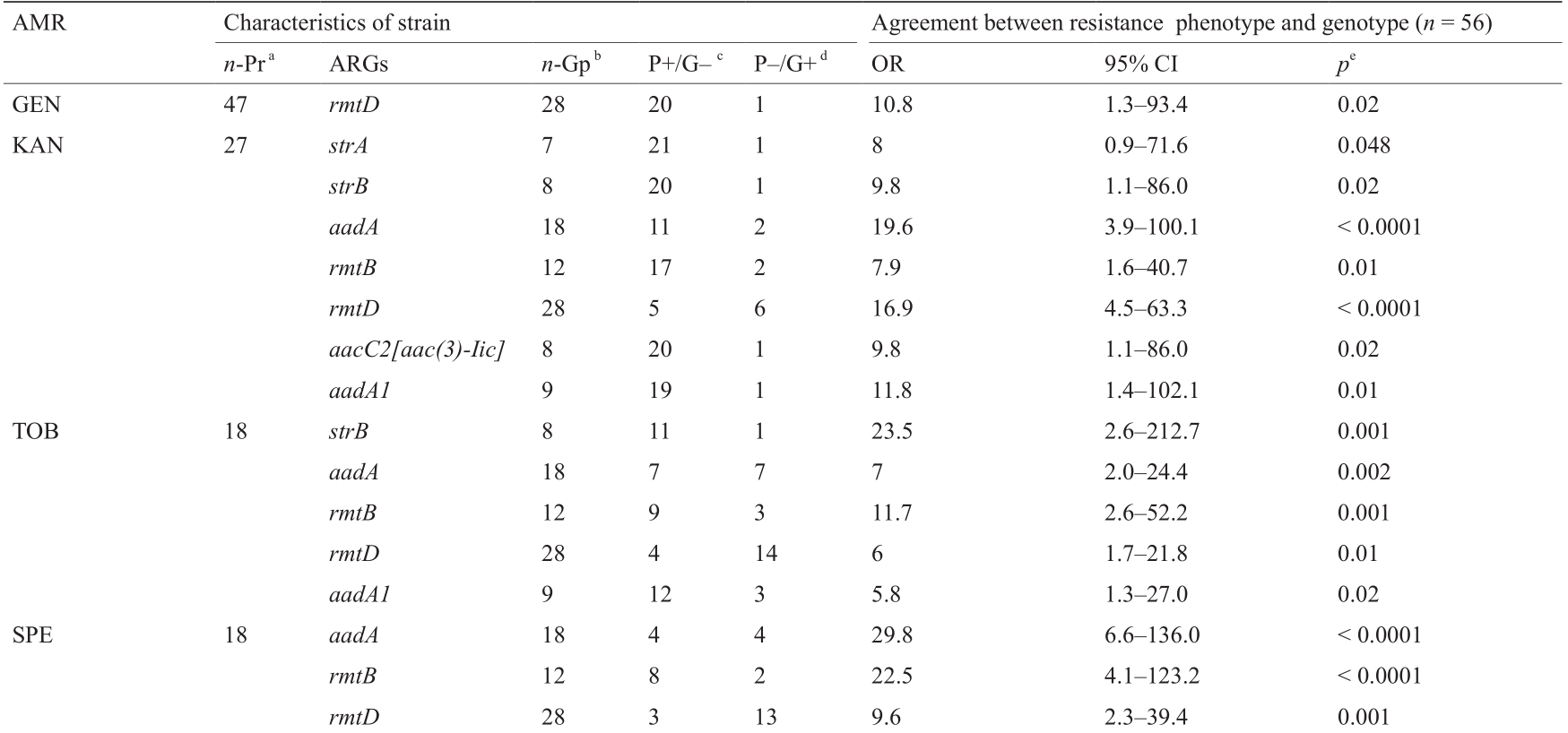

a n-Pr: number of strains expressing phenotype resistant to the indicated antimicrobial agents.
b n-Gp: number of strains carrying the indicated resistance genes.
c P+/G–: number of phenotypically resistance strains(P+)with no resistance genes(G–)for antimicrobials identified.
d P–/G+: number of phenotypically susceptible strains(P–)with one or more resistance genes(G+)for antimicrobials identified.
e Only the results for AMR phenotype that displayed an association with those genotype at a p < 0.05 are shown.
《4. 讨论》
4. 讨论
与之前的研究报道的英国、德国和丹麦的猪中分离的副猪嗜血杆菌存在较低的抗生素耐药性这一结果相反,本研究显示越南分离的副猪嗜血杆菌有很高水平的耐药性[13,15,32]。此外,相较于丹麦猪中副猪嗜血杆菌分离株对恩诺沙星和环丙沙星有高水平的耐药性[14],以及中国和西班牙的分离菌株对三种及以上抗生素(如同时对恩诺沙星、磺胺甲恶唑/甲氧苄啶以及环丙沙星耐药)高比例的耐药性[16],本研究数据显示,越南中部分离的副猪嗜血杆菌对恩诺沙星和环丙沙星都有较低的耐药性,对以上三种抗生素同时耐药的比例也同样较低。Nedbalcová和Kučerová的研究结果表明,捷克的猪中分离的副猪嗜血杆菌对氟喹诺酮类抗生素有很低的耐药性[32],这一报道与本研究结果一致。因此,我们的研究结果说明了氟喹诺酮类、泰妙菌素、氟苯尼考以及强力霉素能有效地治疗和防控越南中部地区的猪格拉瑟氏病。此外,本研究结果(表 4)对于抗生素的临床使用有指导意义。
氨基糖苷类抗生素耐药性是由编码16S RNA甲基转移酶的amtA、rmtB、rmtD基因[33],编码磷酸转移酶的strA、strB 基因[34,35]以及编码腺苷转移酶的aadA、addA1 基因[36,37]的存在所导致的。本研究结果表明副猪嗜血杆菌携带有strA、strB、aadA 和amtA 基因。我们的结果与中国的一项研究中报道的从中国的猪中分离的副猪嗜血杆菌携带抗性基因的比例rmtB (11.9%)、rmtD (0.7%)、aacC2 [aac(3)-Iic ] (4.2%)和aadA1 (20.8%)相一致,但是与澳大利亚的相关研究结果有差别[25]。94.5%的副猪嗜血杆菌携带有blaTEM-1 基因,这也解释了这些分离株对青霉素(85.7%)、阿莫西林(78.6%)和头孢氨苄(71.4%)高耐药率这一表型。由基因blaTEM-1 和balRob-1 (皆编码β -内酰胺酶)导致相应的耐药表型也在其他研究中有所报道[38–40]。这一结果与中国和其他国家的副猪嗜血杆菌耐药性研究结果相似,均表明了严重的β -内酰胺类抗生素耐药性[17,25,38]。已有研究表明,氟喹诺酮类抗生素耐药性在细菌中迅速传播和增长,因为大多数qnr 基因位于接合转移质粒的类转座子或整合子序列中[26,41]。在本研究中,虽然副猪嗜血杆菌分离株对氟喹诺酮类抗生素的耐药率较低,但它们携带了qnrA1 和qnrB1 基因,这一点不容忽视。另外,虽然在其他报道中显示副猪嗜血杆菌对大环内脂类抗生素耐药基因ermA 和ermB 的携带率较低,但是本研究结果表明越南分离株中不仅携带这两种耐药基因,而且还携带其他的大环内脂类抗生素耐药基因,如ermC 和lnuC 。这些基因通过对核糖体结合位点进行修饰导致耐药性,是细菌中最主要的对大环内酯类药物的耐药机制[42]。副猪嗜血杆分离株中出现了氟苯尼考耐药性,主要是由于携带了含有flor 基因的新型小质粒[17],这也解释了为何本研究中副猪嗜血杆菌分离株对氟苯尼考的耐药程度较低这一现象。对磺胺类抗生素的耐药性与整合子系统和接合质粒上所携带的sulI 和sulII 基因(编码二氢蝶呤合酶)相关[43]。这与本研究中副猪嗜血杆菌分离株携带有sulI 和sulII (均占14.8%)基因这一结果相一致。此外,我们研究发现副猪嗜血杆菌分离株中携带有tetA、tetB 和tetH 基因,这也解释了其对四环素类抗生素(不包括DOX)的耐药表型。在澳大利亚的相关研究也报道了编码外排泵的tetB 和tetH 基因的存在而导致对四环素类抗生素的耐药性[25,44]。四环素类抗生素对病原菌失效即是通过tetB 和tetH编码的外排泵将抗生素排除细胞所导致。
耐药基因之间有关联性已经有研究证实[45,46]。不同耐药基因关联程度的增加可能是由于其位于同一个可移动元件,如质粒、转座子或整合子上[43,47,48]。本研究结果表明,许多耐药基因之间有很强的关联性,这可能就是因为这些耐药基因存在于相同的可移动元件。这一观点与Rosengren等[31]的研究结果一致,其发现qnrB1 基因与rmtB、qnrA1、lnu(C)、catl、int、tetA、tetB 和tetH 等8个耐药基因的关联性较高。另外,sulI 和lnu(C) 相关联以及sulII 和tetA 基因相关联,它们是整合子的一部分,而且tetB 和tetH 基因相关联导致了对金霉素的高耐药率。这些结果有力地证明了,耐药基因与能够水平传播的可移动原件如质粒和转座子上的DNA有关。在我们的研究中也发现了抗生素的耐药表型与耐药基因有很强的相关性,如庆大霉素耐药性与rmtD 之间,头孢呋辛耐药性与balrob-1 之间,以及氯霉素与int 之间都有较高的相关性,这说明了这些耐药表型可能是由单一的耐药基因的存在所导致的。这一发现与之前的研究是一致的[30,31]。但有趣的是,我们发现有一些菌株有耐药表型,但不存在对应的耐药基因,有些菌株存在耐药基因,但不存在对应的耐药表型。例如,一些菌株对阿莫西林有耐药性,但不携带任何相关的抗性基因。这一结果与Rosengren等[31]的发现一致。一种可能的解释是一些耐药表型需要在许多不同的遗传因素刺激存在下才会表达,并且每个因素可能呈现一个独特的流行病学特征[23,49]。因此,在越南猪副嗜血杆菌分离株中耐药性的作用机制值得进一步研究。
《5. 总结》
5. 总结
本研究首次研究了越南中部地区猪副嗜血杆菌分离株耐药性和相关耐药基因的流行特征。这些分离株具有广泛的耐药性,而且耐药水平很高,多重耐药比例也很高。分离株中最常见的耐药基因有blaTEM-1 、int、gyrA 和rmtD 。本研究发现多种耐药基因的存在与分离株的相关耐药表型有明显的相关性。因此,要限制那些具有高耐药率的抗菌药物的使用,但是氟喹诺酮类、泰妙菌素、氟苯尼考以及强力霉素仍可用于越南格拉瑟氏病的防控。另外,本研究中揭示的耐药性和耐药基因相关性网络也将为越南制定相关政策以及临床上抗生素的使用提供指导。同时,也说明目前通过减少抗生素的使用来限制耐药性的传播可以避免对耐药基因的选择。因此,在遗传水平上评估抗生素耐药性,并分析耐药表型与耐药基因之间的相关性,对于制定耐药性防控策略是至关重要的。
《致谢》
致谢
本研究由国家重点研发计划项目(2017YFD0500201)、武汉市科技前沿项目(2018020401011300)、湖北省自然科学基金创新群体项目(2016CFA015)和中央高校基本科研业务费专项资金资助项目(2662018QD003)资助。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Chao Nguyen Van, Lijun Zhang, Tam Vu Thi Thanh, Hung Pham Hoang Son, Tuan Tran Ngoc, Qi Huang, and Rui Zhou declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




