《引 言》
引 言
生物是非常复杂的开放体系, 其内部和环境间进行着复杂的物质、能量和信息的传输和变换。随着生物的形成和进化, 生物体成为奥秘的各种个体, 它由不同层次的各种组元极其复杂和系列化地相互作用发展而成 (见图1) 。
从材料科学角度看, 可将蛋白质、糖类和脱氧核糖核酸视作自组装构成生物体的基石;将组织视同为细胞复合材料, 它由细胞和细胞外基质组成。本文将从分子和细胞水平, 结合实例探讨生物材料仿生相关的科学问题。
《1 蛋白质、糖类、DNA与材料》
1 蛋白质、糖类、DNA与材料
《1.1 蛋白质与材料相互作用》
1.1 蛋白质与材料相互作用
目前临床应用的生物医用材料植入体内时迅速为蛋白质包裹, 生物体视其为异物, 因而需研究与开发能调控生物响应的新型生物材料。这涉及蛋白质与材料的相互作用。整联蛋白为一族由各种α-和β-跨膜亚基组成的细胞表面受体, 大多数整联蛋白介导细胞对粘连蛋白的粘连。整联蛋白实质上是受体, 其一端细胞外基质 (ECM) 分子 (或其它细胞分子) 结合, 另一端和细胞本身的支架或细胞骨架相连。其联系通过一高度组织化分子聚集体 (粘着斑) 而实施。整联蛋白传输着ECM经粘着斑到细胞的信息, 且将细胞整合
《图1》
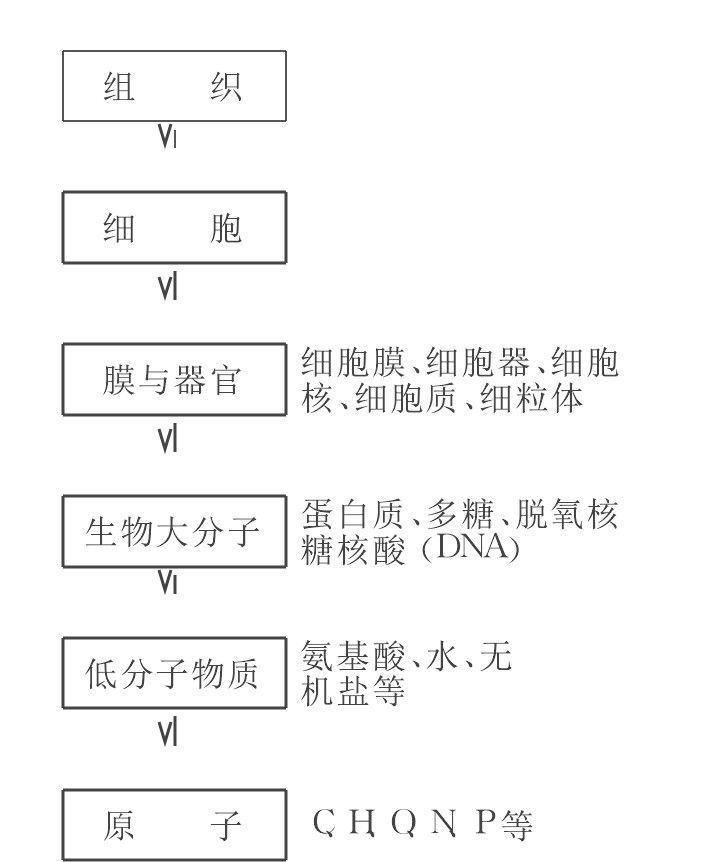
图1 生物体的阶层结构Fig.1 Schematic diagram of the framework of organism
纤维蛋白的细胞结合位置为三氨基酸序列 (精氨酸—甘氨酸—天冬氨酸 (RGD) ) , 因而可将对细胞起粘连分子作用的整联蛋白受体RGD引入生物材料诱发细胞粘连和特异功能。细胞经RGD结合于ECM后, 整联蛋白介导细胞结合与机械力均影响基因表达
材料与蛋白质相互作用研究的另一方向是抑制材料表面对蛋白质的吸附。材料界面水可防止蛋白质吸附, 如亲水性聚乙二醇在材料表面的分子构象同于生物淤积 (biofouling) 行为, 这涉及了抗血栓材料
《1.2 多糖的作用》
1.2 多糖的作用
玻璃态多糖对生物体功能发挥着重要作用。糖链的识别功能可用于构思靶向释放载体。如以N三甲基壳聚糖/四半乳糖天线性偶联物中枝链型糖链的特异细胞识别功能设计靶向肝癌细胞的DNA释放载体体系。
糖胺聚糖 (GAGs) 由二糖重复单元线性排列构成, 广泛存在于结缔组织、细胞外基质和许多细胞表面。壳聚糖则是生物合成多糖, 为甲壳质的脱乙酰化衍生物, 体内为溶菌酶降解。壳聚糖可通过化学改性形成物理与化学性能不同的壳聚糖基仿生聚合物。如可将壳聚糖与胶原的水解产物明胶复配形成聚电解质配合物作为组织工程用降解支架材料使用
《图2》

Fig.2 A SEM micrograph of bovine chondrocytes cultured in chitosan/gelatin network
《1.3 脱氧核糖核酸 (DNA) 与功能材料》
1.3 脱氧核糖核酸 (DNA) 与功能材料
DNA在体内与各种分子结合发挥其基因功能。为使DNA材料化, 首先要了解其结构、相互作用及特性;在此基础上进行化学修饰、交联、相互作用改组和合金化, 以满足特性领域的应用要求
《2 细胞—智能生物材料蓝本》
2 细胞—智能生物材料蓝本
细胞为生物体的基本单元。细胞由细胞膜界定, 其内部有许多区室, 呈现出空间不均一性。各种小胞保持其内部特异的环境, 并高效地发生各种反应。此处诸反应不仅独立产生, 而且巧妙地相互作用, 综合地维持生命活动。细胞膜及细胞内的各种结构不断地动态变化。
细胞膜和其内部许多小器官大都由蛋白质分子和脂质分子自组装形成, 即由单元聚集成较大的稳定结构, 而赋予其不能由个体预测的新特性。
生物组装的基本原理是如何使系统的能量和质量最小, 而容纳信息量最大。值得提及的是美国D.E.Ingber从保持系统力学稳定性出发, 提出生物结构的Tensegrity模型, 其张力与压力在结内分布与平衡的力学稳定体系。它们可以是短程圆盖或预应力结构。人体的206根骨构成的骨骼为Tensegrity结构。骨是承压支柱;而肌肉、肌腱和韧带承受拉伸。从微观考察发现, 蛋白质和其他关键分子亦通过Tensegrity原理在体内稳定。从介观分析细胞骨架结构亦是如此。细胞骨架由纳米尺度的微丝、微管和中间丝相互交织构建。骨架将细胞表面与细胞核联系。细胞骨架内渗有粘性流体状细胞质。细胞骨架实为保持细胞形状分子支柱的硬丝网络。
跨膜物理和力学平衡的变化可使细胞骨架结构变化。力学信号改变骨架几何形状, 影响物理固定。在骨架上的许多酶及其他物质, 它们控制细胞内蛋白质合成, 能量转变和生长, 细胞形状预示其不同的基因程序, 铺展的细胞更易分裂, 而铺展不好的细胞会激活细胞编程凋亡 (Apoptosis) 。细胞及其骨架重组似乎预示细胞行为, 由此可构思人工组织及癌症治疗新途径
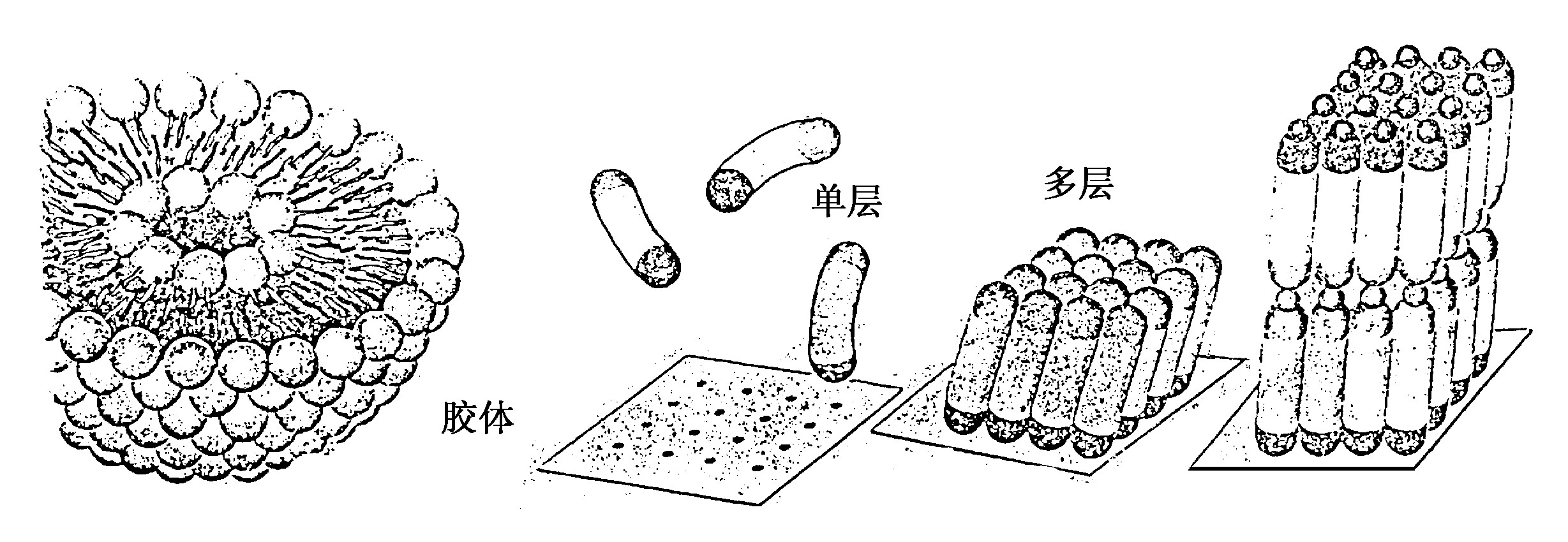
仿照细胞膜并以两亲性分子自组装形成的脂质体已在临床上用作药物释放载体。利用两端具有不同官能基团的分子, 可在材料表面组装成单层 (SAMs) , 赋于表面不同的功能, 如诱导细胞成长、构建微结构等。在单层上更可形成自组装多层 (图3) , 精确控制工程表面的特性
《3 分子识别—生物特异性材料设计》
3 分子识别—生物特异性材料设计
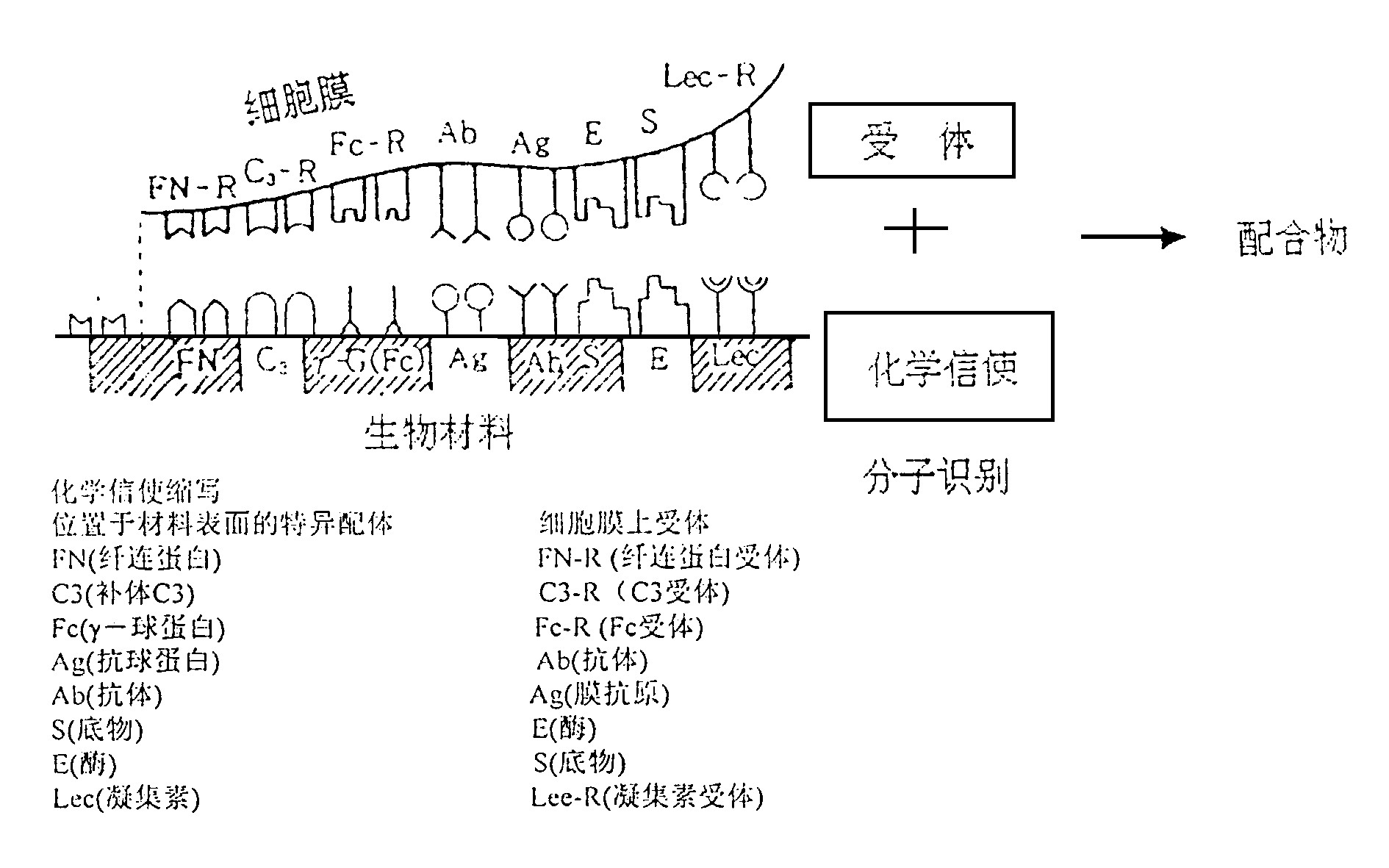
细胞负载在生物大分子体系上才能发挥其功能。此处生物大分子及高度取向和集成的细胞膜均有分子识别功能。分子识别是由生物体细胞膜表面受体与化学信使间配合物的形成而实施, 因而可将不同类型的配体如肽、寡糖和脂质体等设置于材料表面, 赋予其生物特异性 (图4)
《4 人工细胞外基质的仿生化》
4 人工细胞外基质的仿生化
细胞分泌的细胞外基质 (ECMs) 可提供细胞信息
Table 1 Biomimetic approaches of the artificial ECM
《表1》
| 原 理 | 方 法 |
| 利用糖胺聚糖和纤维状蛋白质ECMs组成物或类似物作基质 | 胶原、硫酸软骨素、透明质酸和壳聚糖等用于软组织工程;羟基磷灰石 (HA) 及磷酸三钙 (TCP) 与聚合物复合用于硬组织工程 |
| 调控基质的孔隙分布, 构建不同尺度孔隙有利于细胞长入与基因表达 | 设置仿生孔隙分布的微米至纳米的尺度孔隙 |
| 利用细胞—粘连材料表面相互作用 | 以适宜的偶联技术将细胞粘连氨基酸序列修饰基材表面 |
| 细胞—细胞相互作用 | 以软骨细胞种植密度控制软骨细胞在体内形成 |
| 细胞因子与生长因子释放 | 将能调节细胞表型的水溶性生长因子, 生长抑制剂, 血管生成因子和/或免疫抑制剂按需定位释放 |
| 力学刺激 | 以物理应力与强化传质控制形成组织的组成和结构 |
| 自组装基质的探索 | 构思智能ECM |
《5 细胞编程凋亡的调控》
5 细胞编程凋亡的调控
器官功能和发育有赖于不同细胞保持适宜平衡, 因而需要控制细胞增殖和细胞凋亡。细胞程序性凋亡是以细胞收缩、核凝聚和膜起泡为特征的细胞活性凋亡。它和细胞溶胀和破裂的坏死不同。细胞编程凋亡途径示如图5。当接收各种细胞编程凋亡信号时, 细胞激活其凋亡执行器官, 使其自杀, 并产生凋亡体, 随之它们为巨噬细胞或其他相邻细胞吞食并降解。细胞编程凋亡能清除不需要的细胞, 且以复杂的调控机理保持细胞数目和组织结构。
细胞—细胞外基质和细胞—细胞相互作用可调控多重细胞行为, 此类相互作用为整联蛋白介导。同型或异型细胞—细胞粘连亦可由整联蛋白介导。整联蛋白的连接产生胞内信号, 这些信号调控细胞粘连, 形态、分化、增殖和编程凋亡
基膜和细胞外基质为细胞赖以迁移、增殖和分化的天然基质。最近报道的一些细胞如乳房上皮细胞、支气管上皮细胞、人脐血管内皮细胞等的编程凋亡和整联蛋白介导的细胞—ECM粘连相关, 生长因子、激素和细胞因子等均可调控细胞编程凋亡;执行凋亡途径更可以基因或化学途径调控, 且需防止营养耗尽或代谢物聚集, 这些均是抑制细胞凋亡的可能途径
《6 展望》
6 展望
材料科学与生命科学学科交叉, 从生物大分子蛋白质、多糖和DNA之间相互作用阐明细胞形成, 为生物材料介导细胞行为的控制提供了依据, 更为基因工程、基因治疗、组织工程的发展创造条件。
生命科学与材料科学学科融合, 启迪人们从生命科学柔性、广阔视角思考材料科学与工程问题。以经过亿万年进化形成的生物体为极限目标, 于不同层次和水平上仿生, 才可能有效解决材料—生物体的界面接口问题, 且使材料与系统智能化和环境友好化, 使材料制备节能、省资源、高效化。
材料科学与生命科学学科融合, 涵盖了许多核心科学问题, 包括材料系统的开放;适于能量、物质和信息传输和交换;材料与生物体的相容性;材料与生物体复合体系的阶层结构与功能构建;生物大分子相互作用对细胞行为控制介导与材料设计;转基因植物与材料制备等。深信这些科学问题的研究进展, 将为材料科学发展提供新机遇, 且孕育着新理论、新材料与新技术的诞生。















 京公网安备 11010502051620号
京公网安备 11010502051620号




