《1 引言》
1 引言
硝酸铵 (AN) 在工农业生产和国防上都有着极其重要的应用。它是一种速效氮肥, 其中氮以铵态 (NH+4) 和硝酸根 (NO-3) 两种形式存在。硝酸铵也是制备多种炸药的重要原料, 与柴油、木粉等可燃剂经过简单混合后即成为爆炸制品。随着多起震惊世界的恐怖爆炸事件的发生, 农用硝酸铵的爆炸特性所带来的危害引起人们的高度重视和警惕。为强化治安确保安全, 我国政府于2002年发布了国务院52号文件, 明确将硝酸铵分为工业硝酸铵和农用硝酸铵。农用硝酸铵必须改性成不爆炸且不可还原农用硝酸铵 (non-explosive and irrestorable fertilizer-grade ammonium nitrate, 下称NEIFAN) 。大量实验证明, 提高AN的热稳定性可降低AN的爆炸性
《2 实验部分》
2 实验部分
《2.1ARC及其测试原理[6]》
2.1ARC及其测试原理[6]
ARC试验是一种评价放热性化学物质危险性的新方法, 通过ARC测试可得到有关放热反应的热力学和动力学信息。ARC仪器可保证样品在试验环境为完全绝热的条件下, 测量出样品热分解反应过程中时间—温度—压力三者的变化关系。通过建立数学模型, 可确定出放热反应的各种动力学参数。根据这些参数可以对反应对象的危险性进行精确的预测。
仪器的主体结构参见文献
ARC的主要工作原理是:将试样容器置于加速度量热仪炉体内加热, 以引发化学反应。量热仪在计算机预先设定的运行参数的控制下, 很快将温度上升到预设的初始温度, 然后按 加热—等待—搜寻的方式自动操作 (见图1) 。如果ARC控制系统发现样品反应系统的温升速率低于预设的温升速率值 (通常为0.02 ℃·min-1) , ARC将按照预先选择的循环加热幅度自行进行加热—等待—搜寻循环, 直至探测到比预设值高的温升速率。若样品反应系统的温升速率超过预先设定的温升速率, 则样品反应系统被保持在绝热状态下, 反应系统靠自热升温。
《2.2试样与测试条件》
2.2试样与测试条件
样品1为化学纯AN;样品2为NEIFAN, 样品粒度范围100~150 μm。测试样品量及测试条件如表1所示。
Table 1 Mass of samples and measuring conditions
《表1》
样品名称 | AN | NEIFAN |
样品质量/g | 0.367 | 0.504 |
样品球质量/g | 6.380 | 6.804 |
起始温度/℃ | 150 | 150 |
温升速率灵敏度/℃·min-1 | 0.02 | 0.02 |
加热幅度/℃ | 3 | 3 |
等待时间/min | 5 | 5 |
《2.3分解动力学参数计算》
2.3分解动力学参数计算
《2.3.1 活化能 (E) 》
2.3.1 活化能 (E)
根据文献
式中k为速率常数;Tf, s为最终分解温度;T0, s为初始分解温度;n为反应级数;C0为反应物质量浓度。
利用迭代原理, 反应热分解数值决定反应级数, 于是有:
由 (1) , (2) 式得:
式中k*为准速度常数。
当反应级数选取得当时, 作
《2.3.2 最大温升速率温度和到达最大温升速率时间》
2.3.2 最大温升速率温度和到达最大温升速率时间
对于简单分解反应模型, Townsend和Tou假定反应中热惰性因子的大小对放热反应机理没有影响
式 (5) 是对于低活化能物质的表达式, 对于高活化能物质, θm0, s可用下式表示
《2.3.3 不可逆温度》
2.3.3 不可逆温度
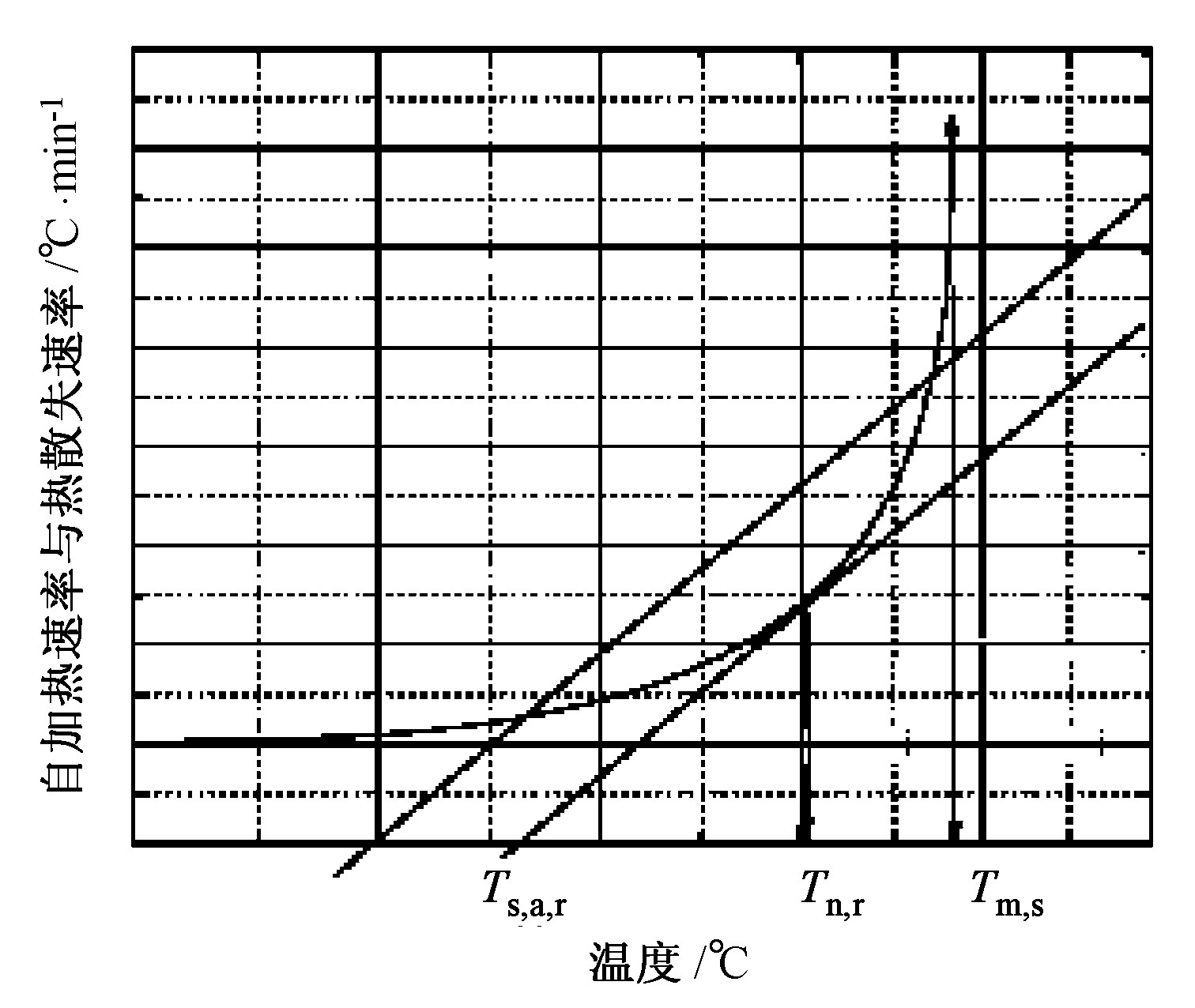
不可逆温度 (Tn, r) 是指热量产生速率按幂指数方式增加使得反应系统热量不能及时排除的最低温度。Pickard曾计算活化能为2 J/mol的含能材料的Tn, r与初始热分解温度T0, s的关系式
《2.3.4 自加速反应温度 (Ts, a, r) 》
2.3.4 自加速反应温度 (Ts, a, r)
Ts, a, r定义为在一定条件下, 不安定物质自加速反应开始时的最低环境温度。这一温度是不安定物质安全储存的最低温度, 与物质特性和储存尺寸有关。通常将特定商业包装中具有特定稳定性 (含有一定量的抑制剂) 的物料在7天内发生放热反应的最小环境温度作为自加速反应温度 (Ts, a, r)
Tm, s, Tn, r和Ts, a, r三者之间的关系如图2所示:
《2.3.5 热惰性因子ϕ对测试结果的影响[6]》
2.3.5 热惰性因子ϕ对测试结果的影响[6]
在使用绝热量热仪进行测试时, 反应产生的热量不仅要用于加热样品本身, 还要加热样品容器。于是引入热惰性因子ϕ:
式中, mb为样品容器的质量;
样品的最终温度Tf和初始温度T0之间的关系如下式:
在零级或准零级反应下, 样品的初始温升速率m0为:
样品的初始温度T0开始上升到最大温升速率所需的时间θm0为:
《3 测试结果与分析》
3 测试结果与分析
AN与NEIFAN样品的测试结果分别如图3和图4所示, 表2、表3分别给出了它们的热分解特性参数及引入惰性因子ϕ校正的特性参数, 表4给出了它们的动力学参数E和A的计算结果。
Table 2 Thermal decomposition characteristic data of AN and NEIFAN
《表2》
样品名称 | AN | NEIFAN |
m/g | 0.367 | 0.504 |
T0, s/℃ | 180.47 | 255.65 |
m0, s/℃·min-1 | 0.022 | 0.031 |
Tf, s/℃ | 287.51 | 388.12 |
ΔTad, s/℃ | 107.04 | 132.47 |
mm·s/℃·min-1 | 0.16 | 0.641 |
θm0, s/min | 1252.9 | 43.18 |
Tm, s/℃ | 273.59 | 267.65 |
Pm/MPa | 2.687 | 3.855 |
两次放热 | 180.47~219.55 | 255.65~302.07 |
温度范围/℃ | 223.38~287.51 | 372.10~388.12 |
注:m—样品质量;ΔTad, s—绝热温升;Tm, s—最大温升速率时的温度;Pm—最大反应压力
Table 3 Thermal decomposition characteristic data of AN and NEIFAN samples modifier by thermal inert factor ϕ
《表3》
样品名称 | AN | NEIFAN |
ϕ | 5.875 | 4.550 |
m/g | 0.367 | 0.504 |
T0 /℃ | 180.47 | 255.65 |
m0/℃·min-1 | 0.129 | 0.141 |
Tf, /℃ | 809.33 | 858.39 |
ΔTad/℃ | 628.86 | 602.74 |
θm0/min | 213.26 | 9.49 |
注:m—样品质量;m0—校正后的初始温升速率;Tf—校正后的最终分解温度;ΔTad—校正后的绝热温升;θm0—校正后的最大温升速率所需的时间
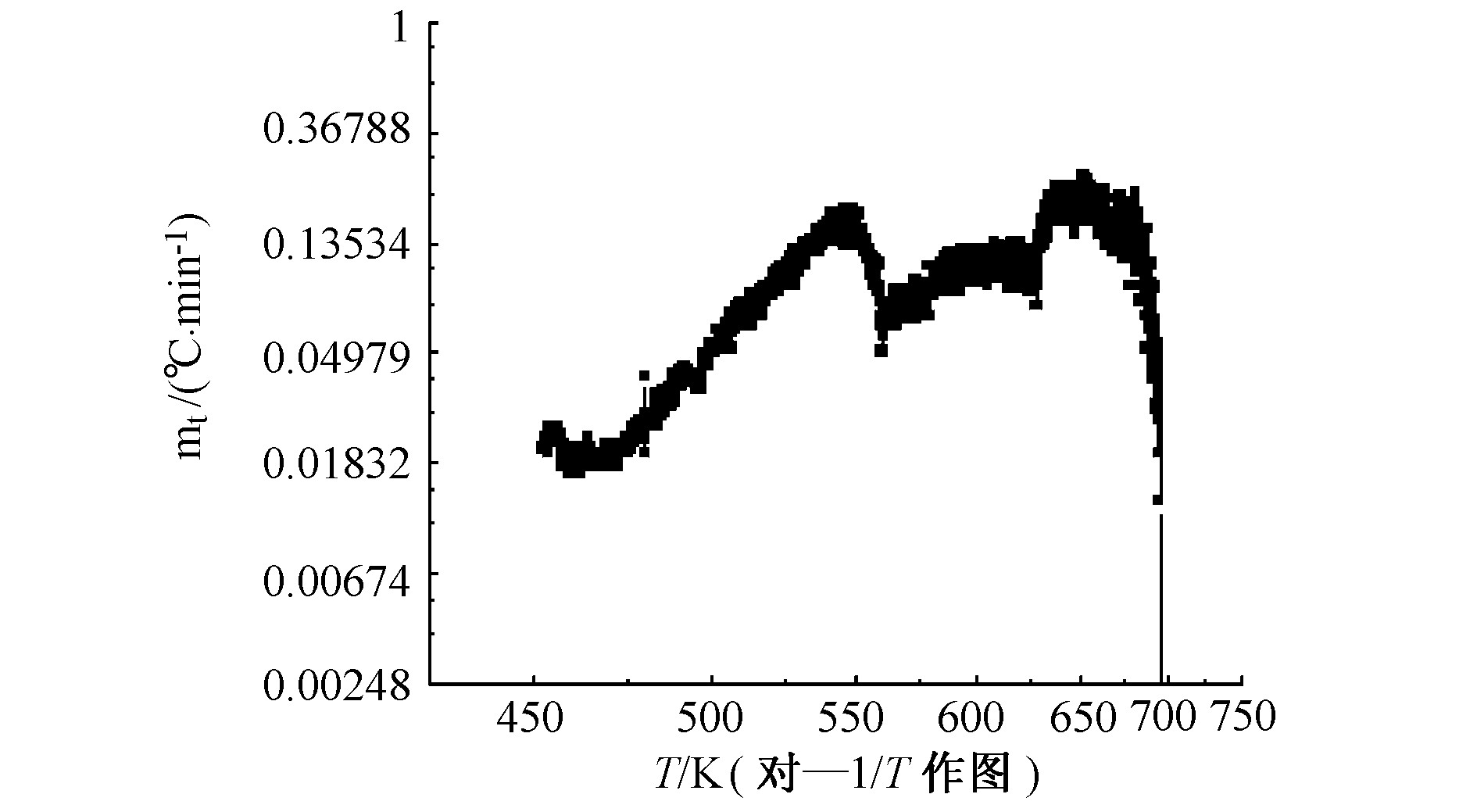
由图3、图4可知, AN在测试条件下经过了两次放热, 第一次放热在180.47~219.55 ℃, 第二次放热在223.38~287.51 ℃。说明本实验中的AN可能混入了少量杂质的缘故。另外, 在180.47~219.55 ℃时, 温升速率在0.019~0.042 ℃·min-1范围内变化, 而在223.38~287.51 ℃时, 温升速率变化范围为0.013~0.209 ℃·min-1, 说明在AN的分解过程中同时伴随有吸热过程。在第一次放热阶段, 在温度为218.57 ℃时出现最大温升速率 (mm, s) 为0.042 ℃·min-1, 反应系统最高温度 (Tf, s) 为219.55 ℃, 最大反应压力 (pm) 为0.494 MPa;而在第二次放热阶段温升速率持续增加, 当温度达到273.59 ℃时, 出现最大温升速率为0.16 ℃·min-1, 尔后温升速率又逐渐下降 (这可能是反应物消耗的缘故) , 但反应系统温度持续增加, 反应系统最高温度为287.51 ℃, 最大反应压力为2.687 MPa。
Table 4 Calculated results of kinetic parameters of sample for AN and NEIFAN
《表4》
样品 | Ea | A |
AN | 98.228 | 3.5×107 |
NEIFAN | 445.90 | 2.75×1042 |
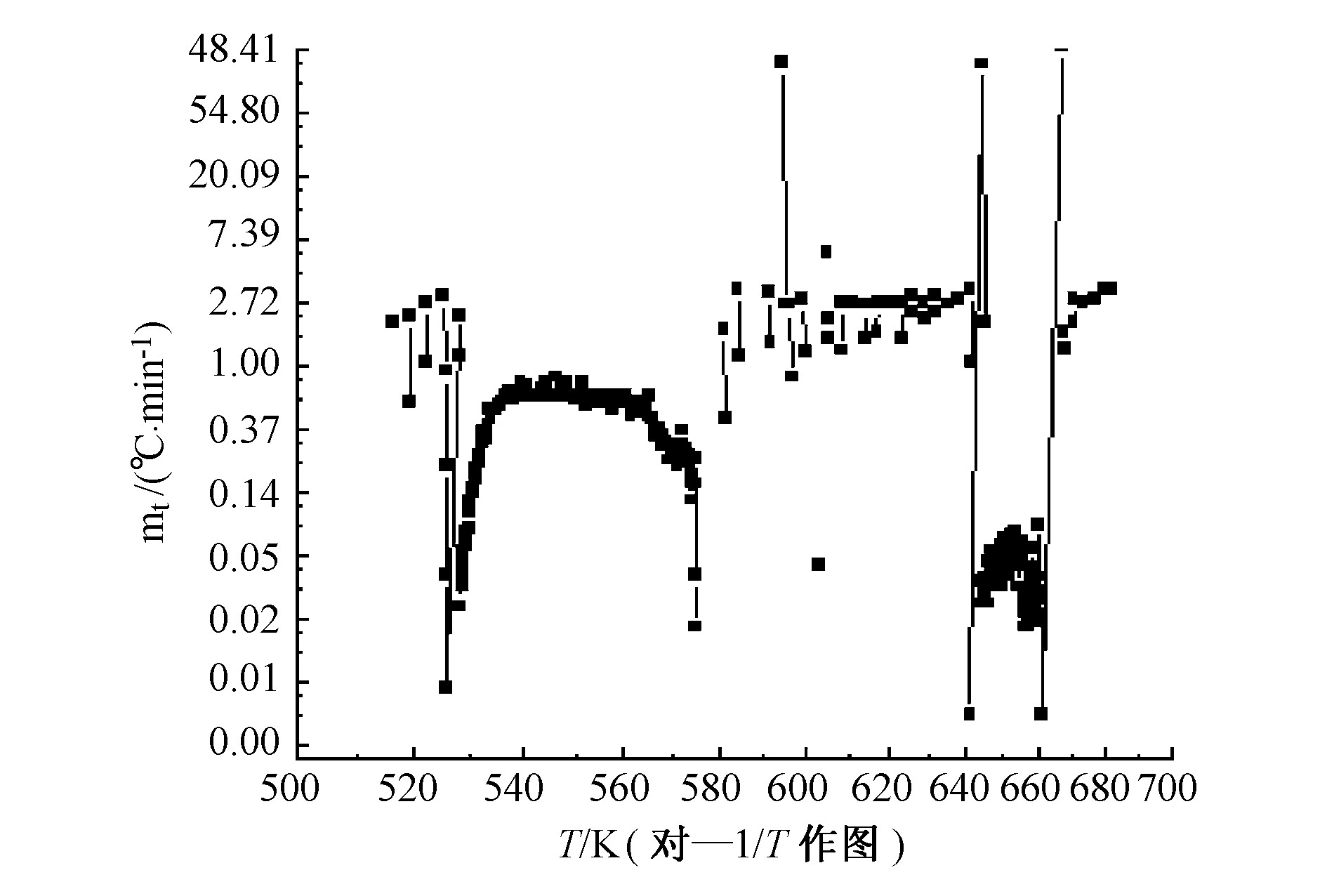
但是, 由图3、图5可知, NEIFAN在测试系统条件下的初始分解温度为255.65 ℃, 对应的温升速率为0.031 ℃·min-1。NEIFAN放热分解过程也分为两个阶段, 但可以看出, 图5比图4具有较大的不规则性, 这是由于NEIFAN中添加有不同添加剂而导致反应系统中的反应更为复杂, 不但有气体生成, 而且还有不同物质的晶型结构的变化。这种晶型的转变为吸热和放热过程的不断转化。晶形的变化有可能引起了AN感度的变化。为此, 通过对晶形变化的研究就有可能找出AN最钝感的结晶外形和结晶工艺条件, 达到降低AN爆炸性之目的。虽然如此, 但从图5中还是可以看出一般规律:NEIFAN在测试条件下的初始分解温度T0, s为255.65 ℃, 在放热反应开始后, 温升速率不断增加, 从开始放热的0.031 ℃·min-1增加到267.65 ℃时的0.641 ℃·min-1, 随后温升速率又缓慢下降到0.016 ℃·min-1 (对应的温度为302.07 ℃, 压力为3.69 MPa) , 这可能是由于NEIFAN在初始热分解过程中产生的气体可能与硝酸或二氧化氮 (在AN热分解中析出的) 反应, 硝酸或二氧化氮浓度降低, 因此AN的热分解速度减缓;第二次放热阶段大约从1 078 min开始, 此时的温度为372.1 ℃, 温升速率为0.028 ℃·min-1, 压力为3.82 MPa。在此阶段温升速率仍不断增加, 直至最大值0.058 ℃·min-1, 随后又逐渐减少, 但整个反应系统中温度、压力不断增加 (增加的幅度较小) 。
从图3、图4和图5及表2可以看出, 虽然AN和NEIFAN都经过了两次放热过程, 但是二者的初始热分解温度有较大不同, 后者的初始热分解温度 (255.65 ℃) 比前者 (180.40 ℃) 大大提高了。这也说明了NEIFAN比AN具有更好的热安定性。由表3可知, 当样品反应放出的热量全部用于加热自身时, 样品的初始放热速率、最终分解温度都提高了, 到达最大温升速率所需的时间缩短了。
NEIFAN分解时的活化能较高 (表4) , 为445.90 kJ/mol (是AN分解活化能的近5倍) , 说明NEIFAN的热稳定性大大改善, 这又从动力学角度证明了NEIFAN的自催化热分解反应受到抑制。
《4 结论》
4 结论
1) NEIFAN的初始热分解温度比AN的初始热分解温度提高近50%, 从而说明NEIFAN中的添加剂对纯硝酸铵有较好的化学钝感作用。
2) 由于NEIFAN中添加剂的化学钝感作用, 减缓了AN的自催化反应趋势。NEIFAN反应体系中的分解活化能大幅度提高, 证明了化学钝感作用的存在, 表明添加剂可能从以下两方面发生作用:添加剂与纯硝酸铵的气体分解产物发生二次反应, 使反应的自催化趋势得以缓和;添加剂与AN作用后改变了AN的分解反应历程。
3) 利用ARC测试方法可得到较准确的表征含能材料热安定性的重要参数——初始放热温度、温升速率、反应活化能、绝热最大温升速率时间。考虑到放热反应系统热惰性因子对测试结果的影响, 可计算出更可靠的表征热安定性的参数。利用这些信息可以更好地进行化学动力学和热力学方面的研究, 这对于物质的安全储存、运输、生产以及评价其热稳定性都具有重要意义。
















 京公网安备 11010502051620号
京公网安备 11010502051620号




