《1 前言》
1 前言
脑胶质瘤是发生于脑内的常见神经系统肿瘤,发病率约为 10/10 万,是学界公认的人体难治性五大肿瘤之一,也是引起人类死亡的重要原因之一[1,2] 。由于脑组织功能的重要性和脑解剖学方面的特殊性,以及脑胶质瘤肿瘤细胞学特性,目前虽然可以采用手术、放疗、化疗等方法治疗,但预后依然很差,严重危害患者的健康和生命[3],亟待开发新的治疗方法。
硼中子俘获疗法(boron neutron capture therapy,BNCT)是一种新型的二元靶向放疗方法。BNCT 是将与肿瘤有特异性亲合力的10B 化合物注入人体,经过血液循环储留于肿瘤组织内,经中子束局部照射使聚集在肿瘤组织中的10B 与热中子发生核反应,生成 7Li 与 α 粒子,这些粒子能在生物微观体积内局部授予高额能量,在细胞尺度上杀灭肿瘤组织[4] 。近年来,BNCT 治疗肿瘤的技术和相关掺硼药物的研究已取得了明显进展,为脑肿瘤的治疗带来了新的希望。文章就 BNCT 治疗脑胶质瘤和难治性垂体腺瘤的研究现状和展望综述如下。
《2 BNCT的基本原理》
2 BNCT的基本原理
1936 年,美国生物物理学家 Locher[5] 首先提出了 BNCT 的基本原理。 BNCT 是将与肿瘤有特异性亲合力的10B 化合物(掺硼药物)注入人体,由于肿瘤组织的生物学特性,掺硼药物与肿瘤有较高的亲和力,肿瘤组织摄取10B 的浓度高于正常组织,经中子束局部照射使浓集在肿瘤组织内的10B 与热中子发生核反应,生成 7Li 与 α 粒子,射程分别为 5 μm 和 9 μm(相当于一个肿瘤细胞的直径,该直径小于 10 μm)。这些粒子均属高传能线密度(linear energy transfer,LET)射线,具有能量高和射程短的特点,能在生物微观体积内局部授予高额能量,在细胞尺度上杀灭肿瘤组织(理论上几个α 粒子释放的能量足以使瘤细胞致死),而正常组织不受伤害[6] 。
《3 BNCT的优势》
3 BNCT的优势
与常规放疗方法相比,BNCT 具有以下优点:a. 治疗靶向效应好,对正常组织损伤小,全身副作用轻;b. 肿瘤局部杀伤剂量大,可达 200 cGy 以上;c. 不需增氧效应,即 α 粒子不仅可以杀死富氧细胞,同时也能杀死乏氧细胞及未增殖的 G0 期细胞; d. 产生的亚致死损伤和潜在致死损伤不可修复[7] 。
《4 BNCT 所需硼携带剂的进展》
4 BNCT 所需硼携带剂的进展
BNCT 必需具备 3 个基本条件:首先是建立专供医学使用的中子源,提供一定能量的中子束;其次是建立精确的辐射剂量测算体系;最后是合成对不同肿瘤组织有高度亲和力的硼携带剂。
在中国工程院周永茂院士的领导下,其课题组已经建立了专供医学使用的中子源———医院中子照射器(IHNI),可以提供稳定的中子束,并建立了精确的辐射剂量测算体系,正在进行临床前期的研究工作。硼携带剂的发展可以大致分为 3 个阶段。经美国食品及药物管理局(Food and Drug Administration,FDA)认证的第 2 代硼剂主要有低分子硼化合物十一氢巯基十二硼化二钠(sulfhydrylborane,BSH)和对二羟苯基丙氨酸硼(p - boronophenylalanine,BPA)。和第 1 代硼剂相比,其性能有了较大改进,毒性低,在肿瘤细胞中滞留的时间较长,对肿瘤细胞有一定的亲能力,肿瘤与正常(脑)组织中硼浓度比值(tumor/normalration , T/N),以及肿瘤与血液中硼浓度比值(tumor/bloodration , T/B)均能达到>1。但第 2 代药物仍不能满足BNCT 的基本要求,即 T/N 或 T/B 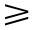 3,因此目前 BNCT 治疗脑肿瘤的效果并不十分理想。近年来,第3代硼携带剂的快速发展,为 BNCT 的治疗研究带来了新的希望。第 3 代硼携带剂的主要特点是能通过和肿瘤特异性表达的抗原或受体结合,使硼剂被肿瘤细胞靶向摄取,从而达到较高的 T/N 或 T/B 值。其中研究较为广泛的有表皮生长因子受体(epidermal growth factor receptor , EGFR)介导的和表皮生长因子(epidermal growth factor , EGF)结合的 BPA [8,9];叶酸受体(folate receptor , FR)介导的和叶酸结合的包含硼剂的脂质体和碳纳米颗粒[10,11] 。掺硼药物能通过这些受体被肿瘤细胞靶向摄取,而正常组织或血液中的硼含量相对较低,从而达到治疗所需的 T/N 或 T/B 值。结合了卟啉的硼酸盐(boronated porphyrin)具有较高的亲水性,能被胶质瘤细胞 T98G 特异性摄取,与传统的 BPA 和 BSH 相比,具有更高的对肿瘤细胞的亲和力,有望代替 BPA 和 BSH,成为一种新的硼携带剂[12,13] 。Nakamura 等[14] 还设计出和荧光标记的含硼的脂质体(luorescence - labeled closo-dodecaborane lipid , FL-SBL),注射到荷瘤小鼠体内后,结果显示,上述药物在肿瘤组织中分布较高,而不能在低氧的组织中聚集。利用 ( 18 ) F - 氟代乙酯 - 络氨酸 ( FET ) / PET能活体检测出肿瘤动物模型中肿瘤组织摄取结合了18F 的硼的浓度,这就为动态检测不同个体肿瘤吸收硼剂的特点和选取最佳 BNCT 治疗时间提供了可靠的依据[15~17] 。
3,因此目前 BNCT 治疗脑肿瘤的效果并不十分理想。近年来,第3代硼携带剂的快速发展,为 BNCT 的治疗研究带来了新的希望。第 3 代硼携带剂的主要特点是能通过和肿瘤特异性表达的抗原或受体结合,使硼剂被肿瘤细胞靶向摄取,从而达到较高的 T/N 或 T/B 值。其中研究较为广泛的有表皮生长因子受体(epidermal growth factor receptor , EGFR)介导的和表皮生长因子(epidermal growth factor , EGF)结合的 BPA [8,9];叶酸受体(folate receptor , FR)介导的和叶酸结合的包含硼剂的脂质体和碳纳米颗粒[10,11] 。掺硼药物能通过这些受体被肿瘤细胞靶向摄取,而正常组织或血液中的硼含量相对较低,从而达到治疗所需的 T/N 或 T/B 值。结合了卟啉的硼酸盐(boronated porphyrin)具有较高的亲水性,能被胶质瘤细胞 T98G 特异性摄取,与传统的 BPA 和 BSH 相比,具有更高的对肿瘤细胞的亲和力,有望代替 BPA 和 BSH,成为一种新的硼携带剂[12,13] 。Nakamura 等[14] 还设计出和荧光标记的含硼的脂质体(luorescence - labeled closo-dodecaborane lipid , FL-SBL),注射到荷瘤小鼠体内后,结果显示,上述药物在肿瘤组织中分布较高,而不能在低氧的组织中聚集。利用 ( 18 ) F - 氟代乙酯 - 络氨酸 ( FET ) / PET能活体检测出肿瘤动物模型中肿瘤组织摄取结合了18F 的硼的浓度,这就为动态检测不同个体肿瘤吸收硼剂的特点和选取最佳 BNCT 治疗时间提供了可靠的依据[15~17] 。
《5 BNCT 治疗脑胶质瘤的现状》
5 BNCT 治疗脑胶质瘤的现状
目前,BNCT 在脑胶质瘤中应用最为广泛,且取得了一定的疗效。日本学者在对胶质瘤的 BNCT 治疗研究中,能把初发多形胶质母细胞瘤患者的平均生存时间由 7. 8 个月提高到 15. 6 个月左右,两年生存率达到 25 % 左右[18];复发的胶质瘤患者经 BNCT 治疗后,平均生存时间也达到 10 个月左右[19] 。然而,由于胶质瘤肿瘤细胞中存在着肿瘤干细胞[20],这类细胞处于静息状态,吸收硼的能力很低,所以 BNCT 治疗时对这类细胞杀伤作用不大,而 BNCT 治疗后,肿瘤干细胞开始分化、增殖,这也是造成胶质瘤 BNCT 治疗后肿瘤复发的重要原因[21] 。因此胶质瘤的 BNCT 治疗效果仍不尽如人意,如何寻找更先进的靶向药物,对肿瘤干细胞进行杀伤,是提高胶质瘤疗效和防止复发的关键。
《6 BNCT 治疗难治性垂体腺瘤的展望》
6 BNCT 治疗难治性垂体腺瘤的展望
目前,BNCT 主要应用于恶性肿瘤的治疗,而应用于良性肿瘤的研究甚少。然而,对于发病率居颅内肿瘤第二位的垂体腺瘤,尤其是难治性垂体腺瘤,目前尚无有效治疗方法,将 BNCT应用于垂体腺瘤的治疗尚待进一步研究。
大部分垂体腺瘤是良性肿瘤,生长缓慢,但约 30 % ~40 % 的肿瘤呈侵袭性生长,肿瘤组织向蝶鞍上方、前方生长,侵犯下丘脑、第三脑室及/或视神经;向两侧生长,侵犯双侧海绵窦、包绕颈内动脉等重要结构;向下方、后方生长,破坏鞍底甚至斜坡骨质[22] 。对于此类肿瘤,无论经蝶窦入路手术,或经额下、翼点入路手术,均难以彻底切除,且手术后约有 20 % 的病例发生肿瘤复发。在临床上,还有部分垂体腺瘤细胞分裂增殖能力很强,Ki -67 标记指数大于 3 %,P53 免疫反应呈强阳性,同时经手术、药物治疗及放射治疗难以控制肿瘤生长,因此将此类肿瘤统称为难治性垂体腺瘤(refractory pituitary adenomas)[23] 。虽然手术、放疗、药物等治疗方法联合应用于难治性垂体腺瘤,但由于此类肿瘤具有恶性肿瘤的倾向,对上述治疗均不敏感,严重影响患者生存质量及生命[24] 。因此,难治性垂体腺瘤已经成为神经外科治疗中的一大难题。
近年来,笔者等研究发现,叶酸受体 α 亚型(folate receptor alpha , FRα)在无功能垂体腺瘤(nonfunctional pituitary adenomas,NFPA)中特异性高表达,而在其他亚型腺瘤和正常垂体组织中不表达或极低表达,且 FRα 的表达水平与肿瘤的侵袭性相关[25] 。进一步研究显示,在体外人 NFPA 原代细胞培养的基础上,给予 FR 靶向的阿霉素脂质体和非靶向阿霉素脂质体,发现靶向阿霉素脂质体对肿瘤细胞的毒性是非靶向药物毒性的 5 ~9 倍 , 结果提示 FR 介导的靶向药物对 NFPA 原代肿瘤细胞具有良好的靶向性和毒性作用,可以作为 BNCT 的靶向治疗药物。
在 BNCT 方面,目前已有多种 FR 介导的靶向掺硼药物进入基础及临床前期研究,为BNCT 通过 FR 靶向 NFPA 治疗提供了可能。Sudimack 等[26] 研制出具有 FR 靶向作用的包被了硼剂的脂质体,和 Thirumamagal 等[27] 构建的FR靶向的硼酸盐脂质体,均显示出对 FR 高表达的细胞系有较强的靶向作用。2010 年,Hwang 等[10] 成功研制出 FR 靶向的包被硼钴的碳纳米颗粒,将靶向的碳纳米颗粒加入高表达 FR 的 HeLa 细胞培养基中,细胞能靶向摄取此药,经 BNCT 后,导致 HeLa 细胞急性死亡率高达55 %,且照射后存活的细胞增殖能力受到显著抑制。基于上述研究成果,笔者等拟进行 FR 介导的 BNCT 靶向治疗 NFPA 的研究,目前正在进行 NFPA 原代肿瘤细胞靶向摄取 FR 靶向掺硼药物的研究,且取得了较好的结果。下一步将进行 NFPA 原代细胞的NCT 治疗研究和 NFPA 动物模型的研究,以期为难治性 NFPA 提供一种新的治疗方法。
《7 结语》
7 结语
BNCT 以其独特的优势在颅内肿瘤尤其是胶质瘤的治疗中发挥了重要作用,但是由于缺乏针对肿瘤细胞和干细胞亲和力较强的掺硼药物,目前 BNCT 治疗脑肿瘤的效果并不很理想。第3代靶向掺硼药物的快速发展为 BNCT 的治疗带来了新的希望。对于发病率居颅内肿瘤第二位的垂体腺瘤,尤其是难治性 NFPA,目前缺乏有效的治疗方法。能否通过 NFPA 特异性高表达的FR来靶向摄取硼携带剂,从而进行 BNCT 靶向治疗,有待进一步研究。













 京公网安备 11010502051620号
京公网安备 11010502051620号




