《1 前言》
1 前言
癌症对人类健康威胁极大,癌症病人每年新增逾百万,其中恶性肿瘤的死亡率相当高,因此,癌症的诊断和治疗已成为医学上的一大难题。传统的肿瘤治疗方法有化疗、放疗和外科手术等,尽管这些治疗方法对某些癌症取得了一些成功,但对部分恶性肿瘤(如脑胶质瘤和黑色素瘤等),上述治疗方法尚无能为力。
理想的放射治疗方法要求能选择性地杀死肿瘤细胞,而不破坏正常脑组织的结构和功能。硼中子俘获治疗(boron neutron capture therapy,BNCT)从理论上能满足上述要求,预期成为一种理想的胶质瘤等恶性难治肿瘤的治疗方法。
BNCT 兼有中子穿透力和重离子的杀伤力,能 够同时歼灭分裂和不分裂的肿瘤细胞。有自适应定位能力,对肿瘤体周边组织无明显的辐射损伤。 BNCT 几乎集中所有针对恶性肿瘤放射性治疗的优点,特别适用于治疗脑胶质瘤(glioblastoma multi-forme,GBM)[1,2] 。我国 GBM 年发病率,据推测人数在 3 万~ 6 万/年,多发于青壮年。BNCT 为许多用传统方法无法治疗的肿瘤提供了一种新的治疗方法。
目前,由周永茂院士研发、凯佰特公司投资、中国原子能科学研究院设计建造的世界首台“医院中子照射器”已达临界投入运行,为开展 BNCT 研究提供了最重要的平台。“医院中子照射器”是一种基于微型反应堆的、在细胞尺度治疗癌症的新型核技术医疗器械。虽然该装置已于 2009 年 12 月临界,但是要达到进行 BNCT 的目标仍任重道远,其中包括对该装置中子特性(中子能谱、中子通量分布)的研究、含硼药物研究、中子辐射微剂量学研究以及必要的为临床准备的医学实践等。
BNCT 方法的成功之处在于有足够的10B 到达肿瘤细胞的同时,有很少的含硼药物到达健康组织。 用适当的中子剂量照射目标组织,对肿瘤细胞产生的剂量应足够大,以使细胞中毒而又在正常组织的忍受范围之内。因此,准确地控制细胞中硼的宏观浓度在 BNCT 研究上非常重要。本实验对胶质瘤细胞对 BPA 的摄取和析出进行了相关的研究,为今后将要进行的 BNCT 细胞辐照实验提供了剂量计算的重要数据和实验依据。
《2 实验材料及方法》
2 实验材料及方法
《2.1 实验材料》
2.1 实验材料
C6(大鼠脑胶质瘤)细胞系、U251(人脑胶质瘤)细胞系均购自北京协和细胞中心(Cell Resource Center)。新生 Wistar 大鼠购自北京芳元缘养殖场。BPA 由美国俄亥俄州立大学杨伟廉教授惠赠,其结构见图 1。
《图1》
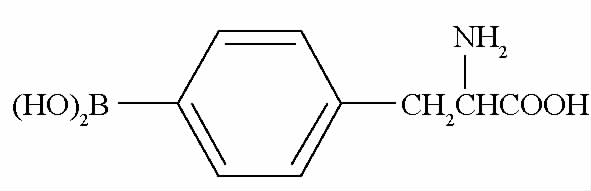
图1 BPA结构
Fig.1 BPA structure
《2.2 BPA-果糖溶液的配制》
2.2 BPA-果糖溶液的配制
取 BPA 粉末 522.7 5 mg(2. 5 mmol),果糖 450 mg(2. 5 mmol),溶于 80 mL 去离子水中,加入 少许 NaOH溶 液加速溶解。待粉末完全溶解后,加 HCl 溶液,调节溶液 pH 7. 4 左右。最后用去离子水定容 100 mL 。最终所得溶液 BPA 浓度为 2. 5 × 10-5 mol/ mL,即10B 的浓度为 2. 5 ×10-5 mol/ mL (250 μg/ mL)。将溶液通过 0.2 μm 微孔滤膜过滤除菌,以备使用。
《2.3 大鼠脑胶质细胞对 BPA 的摄取实验》
2.3 大鼠脑胶质细胞对 BPA 的摄取实验
2.3.1 大鼠胶质细胞的提取及培养
将出生 1~2 d 的新生 Wistar 大鼠脱颈处死,用 75 % 的酒精浸泡消毒后,采用无菌方法迅速取出大脑,用 Hanks 液洗涤并剔除脑膜和血管,取大脑皮质,用 0. 25 % 胰蛋白酶,37 ℃ 消化数分钟,用吸管反复吹打后过滤,离心(1000 r/min , 3min),吸去上清,加入 DMEM(dulbecco modified eagle medium)培养基制成细胞悬液。计数后按 2 ×105 mL 接种于培养皿,并加入 DMEM 培养基,在 37 ℃、5 % CO2 培养箱中培养,每 3 d 更换培养液,10 d 左右细胞铺满培养皿。
选用 2 d 的大鼠进行星形胶质细胞培养,而且培养皿没有经过多聚赖氨酸预处理(因为在没有多聚赖氨酸的情况下,神经元细胞贴壁能力非常弱),可以最大程度地减少皮质神经元的污染。
2.3.2 实验方法
向培养皿中加入不同体积的 BPA- 果糖溶液, 使 BPA 终浓度分别为 20、40、60、80、100 μg/mL 。培养 24 h 后,用胰蛋白酶消化收集细胞,离心 (1500 r/min , 5 min),弃上清,向待测样品中加入 0. 3 mL 的 70 % 高氯酸、0. 6 mL 的 30 % 双氧水和 5 μL 的磷酸,然后用磁力恒温搅拌器升温到 90 ℃左右,进行水浴加热 2 h。加入生理盐水稀释定容至 5 mL,保证稀释样品中的硼浓度大于感应耦合等离子体原子发射光谱仪(induced couple plasma-atomice mission spectroscopy,ICP-AES)的检测下限,用微孔滤膜过滤后,以未经含硼培养液孵育的样本调节零点,采用感应耦合等离子体原子发射光谱法测定溶液中硼的浓度,每组样本进行 3 次平行测量。
《2.4 U251 细胞系对 BPA 的摄取实验》
2.4 U251 细胞系对 BPA 的摄取实验
2.4.1 U251 细胞的培养
U251 细胞系为人脑胶质瘤细胞系。细胞置于 MEM 培养基中培养,其中含 15 % 胎牛血清(杭州四季青生物公司),100 Ku/L 的青霉素,100 mg/L 的链霉素。培养条件:37 ℃,5 % CO2/95 % 空气, 100 %相对湿度下生长。2 ~3 d传代一次,倒置显微镜观察细胞形态,使细胞处于未分化的对数生长期。
2.4.2 实验方法
实验过程及 ICP - AES 样本的制备方法同 2.3.2 节。
《2.5 C6 细胞系对 BPA 的摄取及析出实验》
2.5 C6 细胞系对 BPA 的摄取及析出实验
2.5.1 C6 细胞的培养
C6 细胞系为大鼠脑胶质瘤细胞系。细胞在含 5 % 胎牛血清(杭州四季青生物公司)、15 % 马血清 (奥地利 PAA 公司)、1×105 U/L 青霉素、100 mg/L 链霉素的 F10 培养基中,置于 37 ℃ 的 5 % CO2 孵箱中培养,保持饱和湿度。每 2~3 d 换液 1次,待细胞增长至 70 % 融合时,消化以 1∶3 分瓶传代。
2.5.2 C6 细胞对 BPA 的摄取实验
实验过程及 ICP-AES 样本的制备方法同 2.3.2 节。
《2.6 室温下 C6 细胞对 BPA 的析出实验》
2.6 室温下 C6 细胞对 BPA 的析出实验
将 C6 细胞培养在含 BPA 浓度分别为 20、60、 100 μg/mL 的培养基中,24 h 后,小心吸出培养液, 以 PBS 液洗涤 3 遍,然后加入不含 BPA 的培养基在
25 ℃条件下继续培养,并分别在换液后的 1、2、3 h 后,加入 0. 25 % 的胰蛋白酶在37 ℃环境中消化 1 min。加入常规培养液中止消化,将细胞悬液转移 入离心管内,反复吹打形成单个细胞悬液,计数后, 按上述方法制备样本,采用 ICP-AES 法测定溶液中硼的浓度,每组样本进行 3 次平行测量。
《2.7 不同温度下 C6 细胞对 BPA 的析出实验》
2.7 不同温度下 C6 细胞对 BPA 的析出实验
将 C6 细胞培养在含 BPA 浓度为 60 μg/mL 的培养基中,24 h 后 , 小心吸出培养液,以 PBS 液洗涤 3 遍,然后加入不含 BPA 的培养基,分别在 4、25、 37 ℃ 条件下继续培养,并分别在换液后的 1、2、3 h 后,加入 0.25 % 的胰蛋白酶在 37 ℃ 环境中消化 1 min 。加入常规培养液中止消化,将细胞悬液转移入离心管内,反复吹打形成单个细胞悬液,计数后, 按上述方法制备样本,采用 ICP-AES 法测定溶液中硼的浓度,每组样本进行 3 次平行测量。
《3 实验结果和讨论》
3 实验结果和讨论
《3.1 结果》
3.1 结果
3.1.1 3 种细胞内硼含量随培养基中硼浓度的变化
3 种细胞 ( C6 , U251 , 大鼠胶质细胞 ) 在含不同硼浓度 ( 0、20、40、80、100 μg/mL ) 的培养基中培养 24 h 后,细胞内硼含量 ( μg /107 cells ) 变化如图 2 所示。每个细胞内 10B 原子的数据见表 1。
《表1》
表1 3种细胞每个细胞内硼原子数随培养基中硼浓度的变化
Table 1 Number changes of boron atom per cell in three kinds of cells with the boron concentration of the culture medium
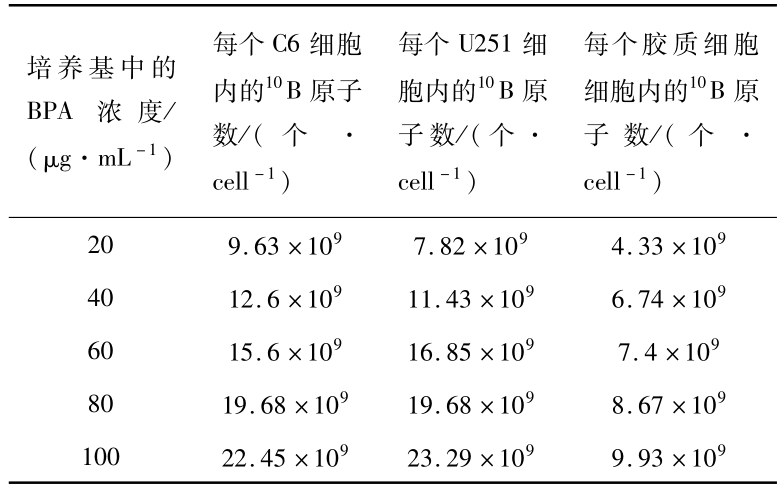
由图 2 可见,随着培养基中 BPA 浓度的增加, 3 种细胞内的10B 浓度均呈上升趋势。与两种胶质瘤细胞相比,大鼠胶质细胞内10B 浓度变化较为平缓。并且,在不同培养基 BPA 浓度的培养条件下,
两种胶质瘤细胞内的10B 浓度显著高于胶质细胞 (P<0.01),而两种胶质瘤细胞的硼浓度相互间无显著差异(P >0.05)。在培养基中 BPA浓度分别为 20、40、80、100 μg/mL 的条件下,C6 细胞内的10B 浓度与胶质细胞内的10B 浓度之比为 2. 2、1. 87、 2. 1、2. 2、2. 3;U251 细胞与胶质细胞内的10B 浓度之比为 1. 8、1. 7、2. 2、2. 2、2. 3。
《图2》
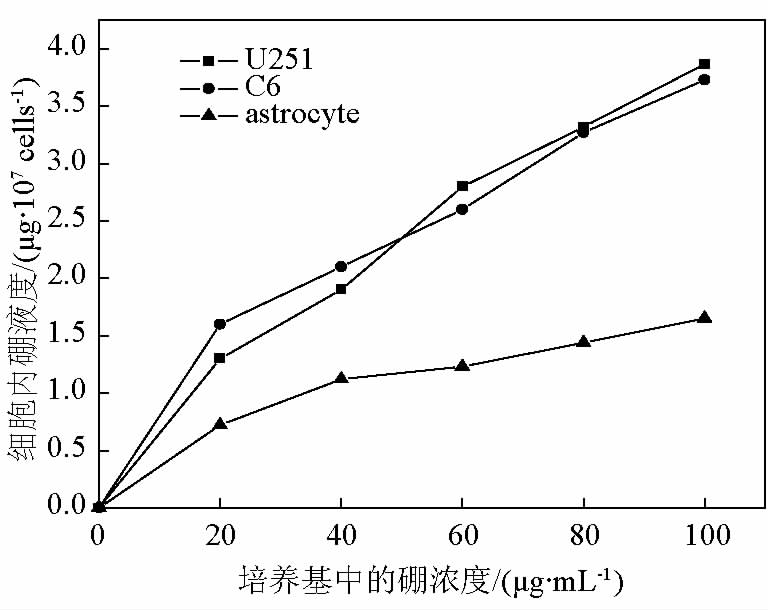
图2 3种细胞内翻含量随培养基中研浓度的变化
Fig.2 Boron content changes in three kinds of cells with the boron concentration of the culture medium
3.1.2 C6 细胞在室温下对10B 的析出
在室温(25 ℃)下,更换培养液后于不同的时间点 (1、2、3 h)检测 C6 细胞内10B 的含量 (μg/107 cells),结果分别见图 3 和表 2。
《图3》

图3 25 ℃时 C6 细胞内10B 的析出
Fig.3 10B decrease in C6 cells in 25 ℃
《表2》
表2 25 ℃时C6细胞内10B 的析出
Table 2 10B decrease in C6 cells in 25 ℃

由结果可见,C6 细胞内10B 浓度随培养时间的增加而逐渐减少。3 h 后,当培养基中的 BPA 浓度分别为 20、60、100 μg/mL 时,每个 C6 细胞内的10B 原子个数(由表中结果计算可得)为 7.1 × 109 、11.3 × 109 、15.5 × 109 个/ cell。利用指数衰减模型模拟曲线后,可得 BPA 浓度为 20、60、100 μg/mL 时,C6 细胞的10B 析出速率分别为 (0.127 ± 0.012)、 (0.115 ± 0.005)、(0.126 ± 0.005)h-1 ,并无显著性 差异,平均值为 0.123 h-1 。因此在室温(25 ℃)下, 换液后 C6 细胞内10B 浓度 C(μg/107 cells)可表示为:

式中,C0 为细胞内初始10B 浓度,可由培养基中 BPA 浓度得到;t 为换液后的时间。
3.1.3 C6 细胞在不同温度下对10B 的析出
在不同温度(4、25、37 ℃)下,更换培养液后不同时间点 (1、2、3 h)检测 C6 细胞内10B 的含量 (μg/107 cells),结果分别见表 3 和图 4。
由结果可见,更换培养液后,C6 细胞内10B 浓度随培养时间的增加而逐渐减少,并且不同温度下, 10B 析出速率不同,温度越高,速率越大。利用指数衰减模型模拟曲线后,可得温度为 4、25、37 ℃时, C6 细胞的10B 析出速率分别为(0.021 ± 0.002)、 (0.115 ± 0.005)、(0.328 ± 0.006)h-1 。并且在 37 ℃条件下,3 h后,每个 C6 细胞内10B 原子个数为 6.1 × 109 个/ cell。
《表3》
表3 不同温度下 C6 细胞内10B 的析出
Table 3 10B decrease in C6 cells in different temperatures

《图4》
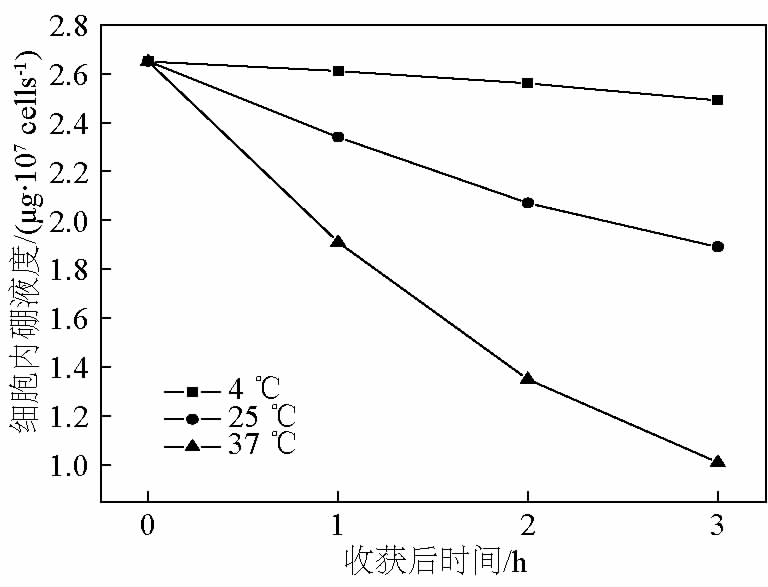
图4 不同温度下 C6 细胞内10B 的析出
Fig.4 10B decrease in C6 cells in different temperatures
《3.2 讨论》
3.2 讨论
1936 年 , Locher 首次提出 BNCT 治疗肿瘤的设想。此后,多国科学家利用不同的硼化合物和反应堆进行了一系列的实验研究。但早期的研究结果并不理想,其主要原因之一是硼化合物对肿瘤的亲和力不够强,10B 不能富集到肿瘤内。经过不懈的探索,20 世纪 80 年代后期,日本神户大学医学院的 Yutaka 及其同事合成了 BPA,将其用于动物实验取得了较理想的效果[3] 。
作为 BNCT 中使用的硼携带剂,应具备以下特点:选择性结合肿瘤细胞,最好能在瘤细胞内、尤其是细胞核内聚集;不论单独使用或与其他硼化合物结合使用,其浓度应达到每个瘤细胞内约109 个10B 原子,或每克肿瘤组织中10B 含量为20~35 μg;肿瘤与正常组织浓度比达 3∶1 ~4∶1;在照射治疗期间能在肿瘤组织中保持一定浓度;肿瘤中聚集的硼化物对人体无毒性[4] 。有实验证明,当大鼠血脑屏障未被破坏时,BPA 注射2.5 h 后的肿瘤与血液浓度比为 8.5 , 肿瘤与脑组织浓度比为 5.9 ; 当血脑屏障被破坏后,注射 2.5 h 后,肿瘤与血液 BPA 浓度比达 10.9 , 肿瘤与脑组织浓度比可达 7.5 [5] 。在实验中,于含硼培养液中培养 24 h 后 , C6 和 U251 两种胶质瘤细胞与星形胶质细胞的硼浓度比平均为 2.0 和 2.2 , 有显著性差异。虽然与文献报导的体内实验结果有些差距(这可能与肿瘤组织内某些特殊的微环境因素有关,体外实验不可能完全模拟体内的状况),但此结果仍能说明 BPA 对胶质瘤细胞的高选择性。同时,在不同浓度含硼培养基中培养 24 h 后,两种胶质瘤细胞内的硼原子数均达到 109 个;在 C6 细胞的硼析出实验中,在析出速率最快(37 ℃)的条件下,3h后,每个细胞内的硼原子数依然有109 个,表明在实验所选择的 BPA 浓度跨度(20~ 100 μg/mL),温度跨度 (4~37 ℃)和时间跨度 (1~3 h)下,BPA 达到了 BNCT 所要求的每个瘤细胞内应有 109 个 10B 原子的最低要求。
BPA 是一种酪氨酸前体类似物,其选择性作用机制尚不清楚。起初有人认为,BPA 仅通过自由扩散进入瘤细胞内,也有学者表明了它与另一种含硼药物BSH相比,主动运输在细胞吸收 BPA 的过程中起到了重要作用[6,7] 。有文献报导[3],在一定浓度的含硼培养基中,随着孵育时间的延长,C6、SHG-44 和 BT-325 三种胶质瘤细胞内 BPA 浓度逐渐增加,至 24 h 末仍有继续增加的趋势,而大鼠星形胶质细胞在孵育前 12 h 内逐渐上升 , 后 12 h 内浓度趋于稳定。这在一定程度上说明了除自由扩散外,尚有主动运输这一吸收方式的存在。BPA 可能参与处于分裂细胞、尤其是胶质瘤细胞的生命活动。实验还表明,C6、SHG-44 和 BT-325 三种胶质瘤细胞 G2/M 期与 G0/G1 期相比,硼含量均明显增高,说明有丝分裂的过程可以加速 BPA 的吸收,而主动运输也许就出现在有丝分裂过程中。同时,3种胶质瘤细胞与星形胶质细胞相比,G2/M 期浓度均有显著提高,而且星形胶质细胞最终硼浓度趋向稳定,表明胶质瘤的有丝分裂过程与正常胶质细胞的差异性决定了对 BPA 的主动运输作用。G0/G1 期的胶质瘤细胞内硼浓度与胶质细胞相比,浓度差异不如 G2/M 期明显,可能是因为这一期瘤细胞对 BPA 的吸收以自由扩散为主,而这一方式不依赖于细胞类型。并且,作为酪氨酸类似物,BPA 应由细胞的L-氨基酸转运系统运输,在细胞内部不会产生代谢变化[8] 。因此,在硼析出实验中,采用指数衰减模型模拟硼析出速率是合理的[9] 。
实验采用的两种胶质瘤细胞系中,C6 来源于大 鼠,而 U251 为人源性。两种瘤细胞的生物学特性相近,对 BPA 的吸收作用也相近,这说明了 BPA 对胶质瘤作用的广泛适用性。
本项工作为以后将要进行的 BNCT 实验提供了 建立10B 浓度-细胞存活率数学模型,以及辐照过程中的剂量计算所需的基本数据。
为了从理论上建立相似的模型,有学者用蒙特卡罗模拟方法,通过微剂量学模型来计算高 LET 射线穿过核时的径迹,以期得到细胞或亚细胞水平上的吸收剂量及其生物学效应。然而,通过这种方法很难得到一个与实验结果相符的正确结论,因为在计算过程中,细胞的形态以及硼化合物在细胞内的分布都是假设值。在实际过程中,细胞的形态以及10B 在细胞内的微观分布可能会随在照射过程中发生改变。这些因素对于 BNCT 的生物学效应的评估造成了很大的不确定性。与理论模型相反,笔者从实验结果中提取的数学模型,避免了相关的假设条件,很大程度上降低了不确定性,因而能更准确地评价硼中子俘获反应的生物学效应。
在建立此数学模型的过程中,由于是离体系统,因此细胞的外部环境一定要小心的调控,并保持恒定,特别是外界环境的温度条件,因为由硼析出实验的结果可知,温度对硼的析出速率有着较大的影响。
《4 结语》
4 结语
实验进行了不同胶质瘤细胞系对10B 的摄取及析出的实验研究,并建立了在本实验室条件下利用 ICP-AES 精确检测细胞内10B 浓度的方法。实验结果表明,含硼药物 BPA 对不同的胶质瘤细胞系 (U251 , C6)有广泛的亲和力;并得到了在不同10B 浓度和温度条件下胶质瘤细胞10B 的析出速率,表明胶质瘤细胞的10B 析出速率与温度之间存在依赖关系,即环境温度越高,析出速率越大,并建立了相应的计算细胞内10B 浓度的数学模型。本项工作为以后将要进行的 BNCT 细胞实验提供了剂量计算,以及建立10B 浓度-细胞存活率数学模型所需的基本数据。此模型避免了相关的假设条件,降低了系统的不确定性,可更准确地评价硼中子俘获反应的生 物学效应。
但是,由于 BNCT 过程包含了复杂的物理和生物学因素,因此很难对于其生物学效应做出精确的评估。可以通过增加细胞内 10B 浓度,以及中子注量的方法来增强 BNCT 过程对肿瘤细胞的杀伤效果,但这也同样增加了对正常组织细胞的危害。因此,目前优化 BNCT 最有效的方法,仍然是加强含硼化合物对肿瘤的亲和力,最大限度地将 10B 浓聚于肿瘤细胞内。














 京公网安备 11010502051620号
京公网安备 11010502051620号




