《1 引言》
1 引言
骨髓间质干细胞(mesenchymal stem cells,MSCs)最初是由 Friedenstein 等发现的一种具有贴附于塑料培养板表面的成纤维样细胞[1] ,是一种来源于骨髓的具有多向分化潜能的干细胞,不仅可以分化为成骨细胞、脂肪细胞、肌肉细胞等间质组织,还可跨越胚层界限,分化为外胚层的神经元、神经胶质细胞及内胚层的肝细胞等。 MSCs 不像胚胎干细胞那样存在伦理问题,更便于将来临床应用,1992 年 Haynesworth 等首次分离出 hMSCs 并证实有多种分化潜能,可以分化为心肌细胞、成骨细胞、成软骨细胞、脂肪细胞以及神经细胞[2] 。目前常用的方法是将来源于骨髓的细胞进行密度梯度离心,利用差速贴壁法分离纯化得到 MSCs 。MSCs 可以从骨髓获取并大量扩增,作为细胞与组织工程的种子细胞,应用前景广阔,研究其分离、纯化与鉴定方法,对于基础与临床应用具有重要意义。
《2 材料和方法》
2 材料和方法
《2.1 材料》
2.1 材料
2.1.1 实验动物 Wistar 大鼠,雄性,体重50 ~60 g,购自北京维通利华实验动物技术有限公司。
2.1.2 仪器流式细胞仪,EPICS ELITE ,美国贝克曼-库尔特公司;激光共聚焦显微镜,LSM 510 META ,德国 Zeiss 公司;CO2 培养箱,日本三洋公司;荧光显微镜,德国 Leica 公司;PCR 仪,Biometra 公司(T-Gragdient);琼脂糖电泳仪,日本 l-Mupid 公司;高速离心机,德国 Hettich 公司;细胞培养瓶、培养板,美国 Costar 公司。
2.1.3 试剂 DMEM/F12 培养基、胰蛋白酶,美国 Gibco 公司;特优级胎牛血清(FBS),美国 Hyclone 公司; EDTA 钠、肝素钠、 Percoll 分离液,美国 Sigma 公司;CD34 - PE,CD166,CD105,CD14 及 FITC 标记的二抗,美国 Santa Cruz 公司,CD45 - FITC,CD29 - PE,美国 BioLegend 公司,CD44 -FITC,英国 Serotec 公司; AMV 逆转录酶,美国 Promega 公司;Taq 酶、Trizol 试剂、dNTP,北京天为时代公司;琼脂糖,上海 YITO BIO-INSTRUMENT 有限公司。其他试剂均为分析纯;所有引物均由上海生工生物工程技术服务有限公司合成;实验中所有溶液都是由 Milli-Q 水配制而成。
《2.2 方法》
2.2 方法
2.2.1 骨髓 MSCs 的分离、原代培养与纯化扩增大鼠用 1 % 戊巴比妥钠麻醉,无菌取双下肢骨骨髓(肝素抗凝),经 Percoll 梯度分离,收集低密度云雾状细胞层, PBS 洗 2 次,加入 10 % 胎牛血清的 DMEM/F12 培养基接种于培养瓶, 37 ℃, 5 % CO2 、饱和湿度条件下常规培养, 24 h 后除去不贴壁细胞。此后每 3 天换液 1 次,形成片状克隆后开始第一次传代。之后,细胞长满瓶底2/3时即可再次传代扩增,利用差速贴壁法分离纯化 MSCs 。
2.2.2 MSCs 表面抗原的鉴定鉴定的细胞表面抗原有: CD34,CD45,CD29,CD44,CD166,CD105,CD14,前 4 个为荧光染料直标抗体,其余为间标抗体,需要接 FITC 标记的二抗,分别用直标法与间标法进行荧光标记。
1)流式细胞术
直标法:收获培养细胞,4 ℃ 200 × g 离心 5 min,用 PBS(含 1 % BSA)清洗细胞 3 次,计数细胞,调节每个样品的最小浓度约为106 个/100  ;加入荧光标记抗体 5
;加入荧光标记抗体 5  ,冰上孵育细胞30 min (避光),用 PBS 洗细胞 3 次, 200 × g 离心细胞 5 min ,用 400 ~ 500
,冰上孵育细胞30 min (避光),用 PBS 洗细胞 3 次, 200 × g 离心细胞 5 min ,用 400 ~ 500  含 1 % BSA 的 PBS 重悬细胞。
含 1 % BSA 的 PBS 重悬细胞。
间标法:细胞处理同直标法,加完一抗后用 PBS 洗细胞 3 次,然后加 5  合适稀释度的二抗, 4 ℃孵育 30 min (避光),之后步骤同上。
合适稀释度的二抗, 4 ℃孵育 30 min (避光),之后步骤同上。
标记后将细胞适度稀释后,立即用流式细胞仪检测。
2)免疫荧光化学法
直标法:细胞爬片浸入冷丙酮固定 10 min ,然后用 PBS 漂洗 3 次每次 5 min ; 4 % BSA 37 ℃湿盒封闭 30 min ;然后在玻片上滴加荧光标记抗体(1∶100 稀释),湿盒中37 ℃孵育30 min ; PBS漂洗 3 次,每次5 min ,不时振荡以洗去多余游离的荧光标记抗体。
间标法:加一抗处理后,用PBS洗细胞3次,然后加荧光标记二抗(1∶100 稀释), 37 ℃孵育30 min (避光),之后步骤同上。
标记后立即在激光共聚焦或荧光显微镜下观察拍照。
2.2.3 MSCs 表达干细胞标志基因的鉴定采用 RT—PCR 方法鉴定 3 个干细胞标志基因:nestin,nucleostemin (NST),Oct — 4 ,引物序列如下:
Oct— 4 : forward primer
5′-TGTCCGCCCGCATACGAGTTC-3′,长度 21 bp ;
reverse primer
5′-CAGGGGCCGCAGCTTACACAT-3′,长度21 bp 。
NST:forward primer
5′-GGGAAAAGCAGTGTCATTA-3′,长度 19 bp ;
reverse primer
5′-GGGATGGCAATAGTAACC-3′,长度 18 bp 。
Nesstin:forward primer
5′-CAGAACTGGACTGGAACTCG-3′,长度 20 bp ;
reverse primer
5′-GATTGGGATGGGTGAACAGG-3′,长度 20 bp 。
RT—PCR 操作步骤:
1)提取总 RNA : 107 个细胞,消化收集后室温离心(800×g,5 min),去上清,PBS 洗一次(800×g,5 min 离心);沉淀中加入 1 mL Trizol 试剂提取 RNA ,4 000×g 离心 10 min 后,将上清液分别用 200  氯仿和 500
氯仿和 500  异丙醇提取,14 000×g 离心 10 min ,弃上清,用 75 % 的乙醇洗涤沉淀,室温晾干。加入适量 DEPC-H2O 溶解, - 80 ℃保存,或者立刻进行反转录。
异丙醇提取,14 000×g 离心 10 min ,弃上清,用 75 % 的乙醇洗涤沉淀,室温晾干。加入适量 DEPC-H2O 溶解, - 80 ℃保存,或者立刻进行反转录。
2)反转录合成 cDNA :每 20  反转录体系包括:模版 RNA 1
反转录体系包括:模版 RNA 1  ,oligo(dT) 17 引物(0.5 μg/μL) 1
,oligo(dT) 17 引物(0.5 μg/μL) 1  ,5 × AMV 缓冲液 5
,5 × AMV 缓冲液 5  ,dNTP (10 mmol/L) 2.5
,dNTP (10 mmol/L) 2.5  , AMV 反转录酶 1.5
, AMV 反转录酶 1.5  ,DEPC-H2O 至终浓度 20
,DEPC-H2O 至终浓度 20  。
。
反转录条件:42 ℃放置 60 min,75 ℃放置 10 min ,终止反应至冰上冷却,可直接 PCR 或 - 80 ℃保存。
3) PCR 扩增:每 50  反应体系包括:10 × Taq 缓冲液 5
反应体系包括:10 × Taq 缓冲液 5  ,dNTP(10 mmol/L) 4
,dNTP(10 mmol/L) 4  ,Taq DNA 聚合酶 0.5
,Taq DNA 聚合酶 0.5  ,3′端引物 1
,3′端引物 1  ,5′端引物 1
,5′端引物 1  ,cDNA 模板 1
,cDNA 模板 1  , 加 H2O 至总体积 50
, 加 H2O 至总体积 50 。
。
PCR 扩增条件: a. 94 ℃变性3 min ; b. 94 ℃变性30 s ; c. 55 ℃退火30 s ; d. 72 ℃延伸1 min ; e. 30个循环; f. 72 ℃延伸10 min 。
4)琼脂糖凝胶电泳分析 PCR 结果:1.5 % 琼脂糖凝胶电泳,保持电流100 mA 电泳25 min ,结束后紫外灯下观察结果拍照。
《3 结果》
3 结果
《3.1 骨髓 MSCs 的形态特征》
3.1 骨髓 MSCs 的形态特征
MSCs 贴壁生长后,细胞完全舒展并呈现多种形态。大部分为成纤维样细胞,长梭形,带 2 ~ 3 个突起 , 细胞核较大、扁圆形;部分为扁平的不定型细胞,呈现为三角形、多边形,形态不规则,胞浆可向不同方向伸出伪足;少量呈细小梭形,两极突起如图1所示。
《3.2 免疫细胞生物学鉴定》
3.2 免疫细胞生物学鉴定
分别采用流式细胞仪、荧光显微镜和激光共聚焦显微镜鉴定细胞表面特异性抗原(CD 家族)。结果显示细胞均一性较好,细胞表面抗原 CD29,CD44,CD105,CD166 表达呈阳性,而 CD14 ,CD34,CD45 表达呈阴性如图 2,3,4 所示 。
《图 1》

图 1 MSCs 形态特征
Fig.1 Morphological character of MSCs
《图 2》
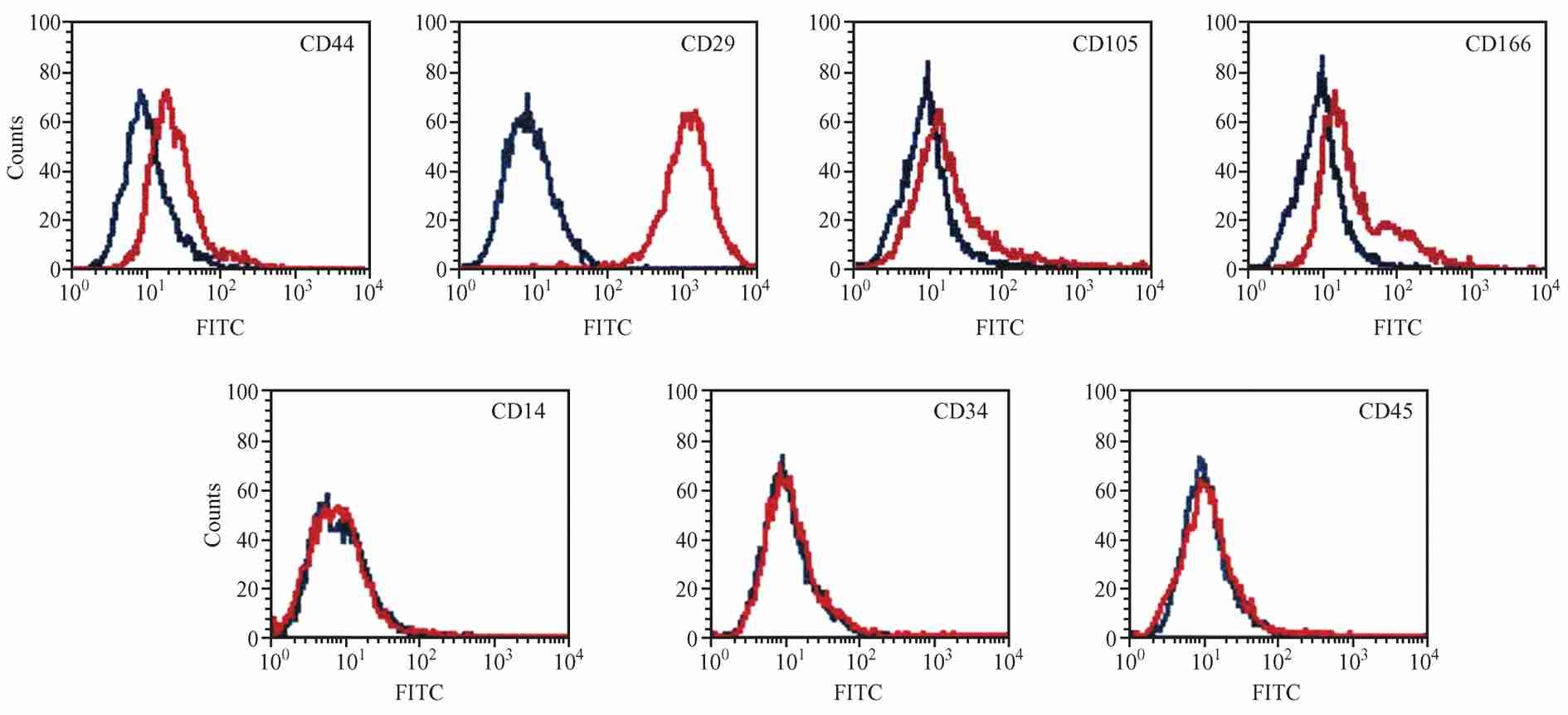
图 2 流式细胞术鉴定结果
Fig.2 The results of flow cytometry
图 3 中, A(CD29), C(CD44), E(CD105), G(CD166), I(CD14), K(CD34), M (CD45)为荧光显微镜照片,B,D,F,H,J,L,N 为相应同一视野的相差显微镜照片,细胞表面抗原 CD29 , CD44 , CD105 , CD166 表达呈阳性,而 CD14 , CD34 , CD45 表达呈阴性。其中 E,F 为细胞涂片,余为贴壁细胞(100 ×)。
图 4 中,A(CD29)、B(CD44)、C(CD105)、D(CD166),细胞被标记后荧光显示于细胞膜上(200 ×)。
《图 3》
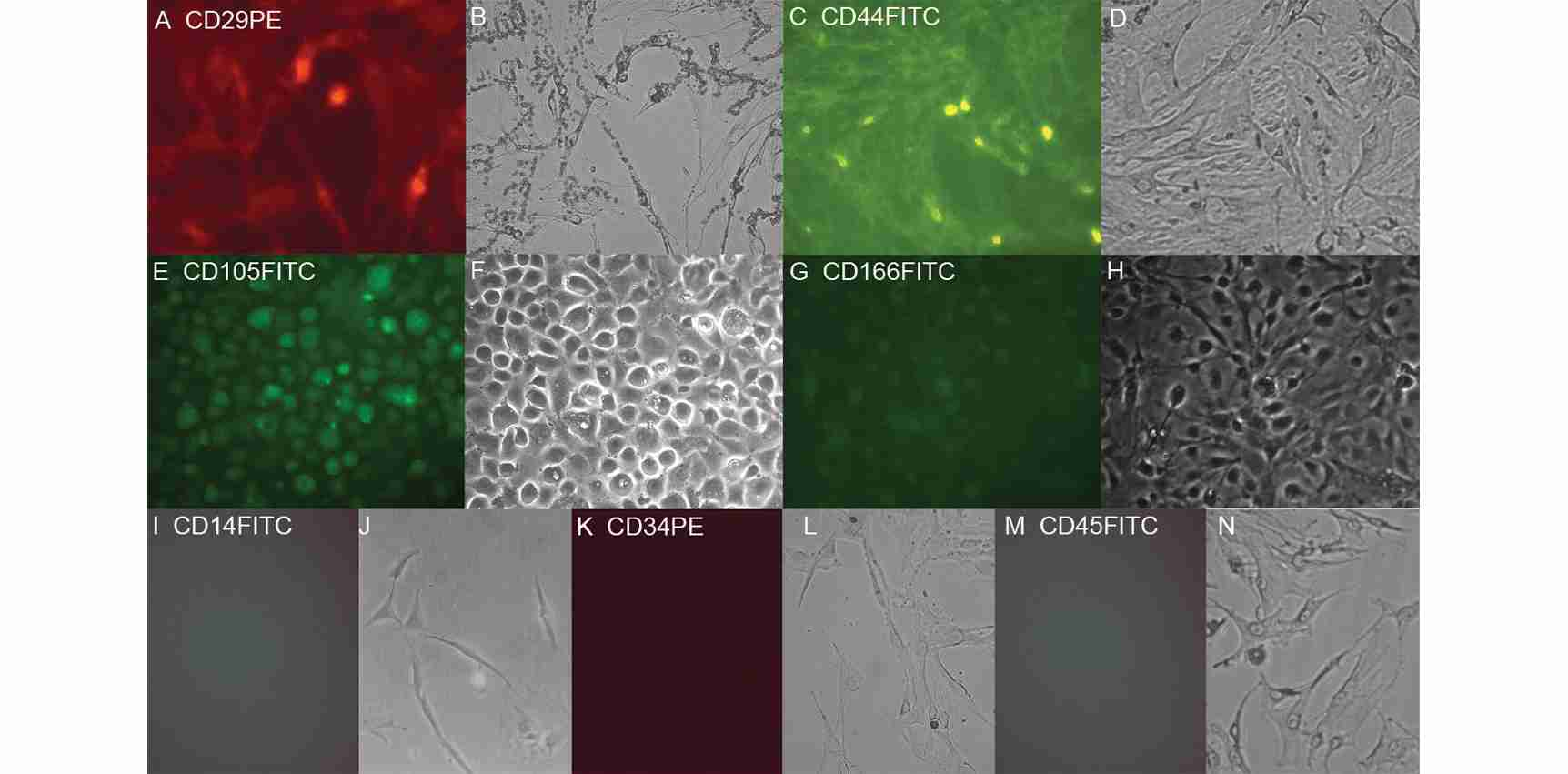
图 3 细胞免疫荧光鉴定结果
Fig.3 The results of immunofluorescence
《图 4》

图 4 激光共聚焦显微镜图
Fig.4 The results of laser confocal microscopy
《3.3 特异基因表达》
3.3 特异基因表达
采用 RT — PCR 的方法鉴定了三个基因:nestin,NST,Oct— 4 。扩增结果如图 5 所示,三个基因表达都为阳性。其中nestin 产物约400 bp ,NST 产物约 450 bp ,这两个基因电泳条带很清晰,说明高表达, Oct— 4 产物约 450 bp , 第一次电泳条带比较模糊,说明Oct — 4 弱表达。为进一步证明不是假阳性结果,以第一次 PCR 的产物为模板,其他条件不变的情况下进行第二次 PCR ,得到产物,电泳条带较第一次清晰(图 5 所示为 Oct — 4产物第二次 PCR 电泳结果),这是目标基因得到浓缩的结果,可以证明 Oct— 4 为弱表达基因。
《图 5》
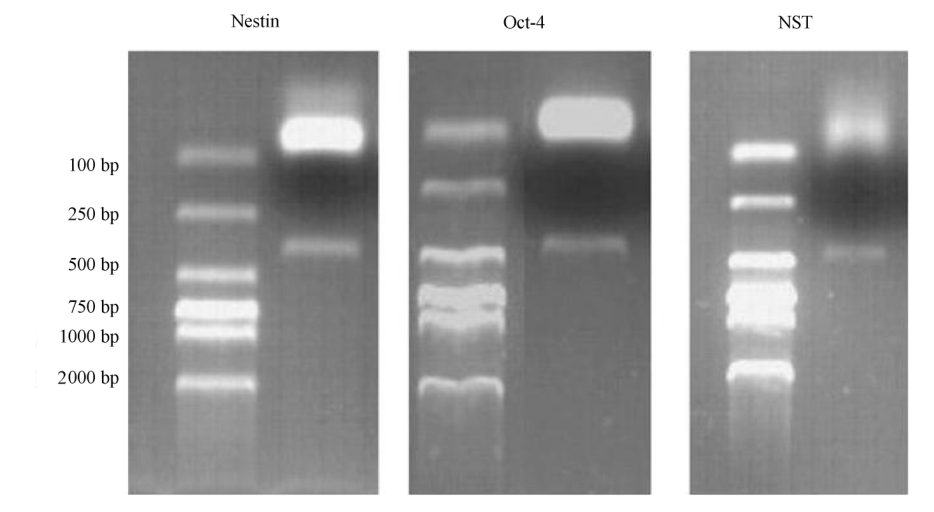
图 5 相关基因的 RT-PCR 鉴定结果
Fig.5 RT —PCR of Nestin ,Oct—4 and NST
《4 讨论》
4 讨论
MSCs 的表面标志物是通过一组 CD 表面标志来确定的,流式细胞仪的研究显示, MSCs 的表面抗原具有非专一性,它表达了间质细胞、内皮细胞和表皮细胞的表面标志。主要包括以下四类[3] :
1)粘附分子类: ALCAM(CD166 ),ICAM-1 (CD54),ICAM-2 (CD102),LFA-3(CD58),NCAM(CD56),HCAM(CD44),VCAM(CD106)等,但不表达 P-selectin(CD62P)及 PECAM-1(CD31)等。
2)生长因子和细胞因子受体:IL -1受体(CD121),IL - 3 受体(CD123),IL - 6 受体(CD126),IL - 7 受体(CD127),IFNγ受体(CDw119),TNFα受体(CD120a),FGF 受体,PDGF 受体(CD140a)等,不表达 IL-2 受体(CD25)。
3)整合素家族成员:包括 VLA -α1(CD49a),VLA - α2(CD49b),VLA-β(CD29),β4整合素(CD104)等,不表达 LFA1 -α(CD11a)、Macl (CD11b)等。
4)其他分子:如 SH2,SH3,SH4,Thy1(CD90),5'末端核苷酸酶(CD73),Endoglin(CD105)等,不表达 CD34,CD45,MHC Ⅱ类分子以及其刺激因子 B7 - 1(CD80),B7 - 2(CD86)等。鉴定的 7 个 CD 类标志物,标志物表达特征与文献报道相符。
所鉴定的三个基因 nestin,NST,Oct— 4 都是目前公认的多潜能母细胞的特异性标志基因。其中 nestin 的表达产物是一种中间丝,在早期胚胎中、神经上皮干细胞中以及发育着的骨骼肌中都有强表达;在成体组织中,仅表达于组织再生的区域,由此可以确定表达 netsin 的细胞都具有多潜能分化与自我更新能力[4] ; NST 主要在胚胎和成体干细胞以及肿瘤细胞中表达,而在成体细胞中不表达。 Tsai and McKay 发现 NST 在皮层干细胞中富集而在血清诱导分化后的细胞中则缺少[5] ,而且在胚胎干细胞和几种人类肿瘤细胞系中也存在,他们通过 RNA 干涉实验发现该基因对于维持细胞的增殖状态是必需的; Oct — 4 属于 POU 转录因子中的一员,它在全能胚胎干细胞和生殖细胞高表达,对许多胚胎发生的基因活动起到重要的调控作用,该基因的表达对于维持干细胞的自我更新和多潜能分化是非常必要的,近年来研究人员发现 Oct — 4 基因能在正常的成体干细胞中表达[6] 。实验表明,在大鼠 MSCs 中, nestin 和 NST 都为高表达基因,而 Oct— 4 为弱表达,经过二次 PCR 进一步验证, Oct — 4 是有表达的,而不是假阳性反应。
Strauer 等将人自体干细胞经冠状动脉移植到急性心肌梗死的心脏,发现心肌细胞再生,这为干细胞移植治疗心肌梗死开拓出美好的应用前景[7] 。本研究从分子生物学角度可以证明从大鼠骨髓中分离培养纯化出来的细胞是骨髓间充质干细胞,具有多潜能分化和不断自我更新的能力。通过密度梯度分离,差速贴壁法逐步纯化,是一种简单易行、易于推广使用的分离纯化方法,可为细胞与组织工程研究提供种子细胞。













 京公网安备 11010502051620号
京公网安备 11010502051620号




