《1 引言》
1 引言
近年来人们一直关注金属铀和钚的表面氧化腐蚀和抗腐蚀机理研究, 并致力于金属铀及其氧化物与活性气体分子之间的相互作用研究, 以探索能使核材料表面钝化或缓解腐蚀的有效气体环境。目前, 国外已在U-O2、U-H2O (v) 和U-O2/H2O (v) 等体系的表面氧化反应进行了较为深入的研究
有关钚的表面氧化腐蚀和抗腐蚀机理研究文献报道较少。考虑到铀和钚同属锕系元素, 其原子的外层电子结构和物理化学行为非常相似, 因此通过金属铀的表面化学系统研究, 不仅有利于提高金属铀的抗腐蚀性, 同时可预测金属钚的表面化学行为, 为进一步深入研究钚的表面化学奠定理论和实验基础。
镧系与锕系元素化合物的量子力学计算存在若干困难:外层电子结构复杂, 电子数目多;相对论效应突出, 传统的忽略相对论效应的方法已导致错误结果;f轨道的对称性与成键特性有待进一步研究。文章中用相对论有效原子实势模型 (RECP, relavtivistic effective core potential) 和MP2方法, 并采用Gaussian 94W程序, 较好地解决了用量子力学ab initio计算镧系与锕系元素化合物结构的方法。
《2 U3O8在CO/H2气氛中的表面反应研究》
2 U3O8在CO/H2气氛中的表面反应研究
铀在自然界一般是以氧化物的形式 (如UO2、UO3、U3O8等) 存在。因U3O8是标准化学物质, 首先研究其在CO和H2中的表面化学, 可为判断铀金属在CO和H2气氛中的表面化学行为提供重要的实验依据和可借鉴的研究方法。
U3O8是由UO2和UO3组成的混合价化合物, 经XPS分析表明其组成符合U
为了定性判断和佐证U3O8-CO的表面反应结果, 用气相色谱仪分析了U3O8-CO反应体系室温下放置1~8d时间内CO2含量变化。分析结果表明随着放置时间 (反应时间) 的增加, 体系中CO2量也逐渐增加。这个变化规律与XPS研究结果是一致的。
H2也为还原性气体, 当U3O8长时间置于H2气氛中, 表面虽有一定的还原效果, 但H2对U3O8表面还原能力要弱于CO。值得注意的是, U3O8在H2气氛中不发生氢化反应, 这表明铀的氧化层可以阻止氢化反应。U3O8在CO、H2气氛中的化学反应热力学计算结果肯定了表面还原反应的可行性, 并证实了氧化层的抗氢化性。
《3 铀在CO气氛中的表面反应研究》
3 铀在CO气氛中的表面反应研究
铀的清洁表面在通入CO气体后, 表面在25 ℃时也发生氧化反应, 生成UO2和UC。XPS分析表明:UO2的U4f7/2为380.4 eV;UC的U4f7/2为378.6 eV;U的U4f7/2为377.3 eV;UC的Cls为282.0 eV。铀表面氧化反应在通入~40L (1L=1.33×10-4Pa·s) CO时趋于饱和。
但铀金属即使在微量O2、H2O (v) 等条件下表面也极易氧化
《4 铀在O2、CO和CO2气氛中表面初期氧化行为的比较》
4 铀在O2、CO和CO2气氛中表面初期氧化行为的比较
图1为O2、CO和CO2在金属铀表面吸附时表面O/U原子比随气体暴露量的变化。U-O2表面氧化反应在饱和吸附 (40L) 前, O/U原子比随气体暴露量近似呈线性增长, 此为氧分子在金属表面吸附解离并形成氧化物的特征。氧饱和吸附后, 表面已形成一初始氧化物膜, 氧已不再直接在金属铀表面吸附。氧气分子只能在氧化物表面吸附解离后通过氧化物层扩散穿过氧化物-金属的界面与金属铀反应, 表面的氧化生长受扩散控制。
《图1》
![图1 金属铀表面在O2、CO和CO2吸附时
表面O/U原子比随气体暴露量的变化图[7]](/views/uploadfiles/download/GCKX200012011_017.jpg)
图1 金属铀表面在O2、CO和CO2吸附时
表面O/U原子比随气体暴露量的变化图
Fig.1 Variation O/U atomic ratio at uranium metal surface with exposure of O2, CO and CO2
CO和CO2在气体饱和吸附 (约10L) 前, O/U原子比随气体的暴露量以与U-O2表面氧化反应相近的斜率呈线性增长。此阶段气体分子在金属铀表面吸附解离成碳、氧离子并与金属铀反应生成UO与UC。由于上述离子与金属铀的反应速度很快, O/U原子比值增长取决于表面吸附活性, 也即, O/U原子比曲线斜率与气体在金属铀表面的粘附系数有关。
CO气体饱和吸附后形成表面初始钝化薄膜。该膜由UO2和UC或含氧碳化铀 (UCxO1-x) 组成, 这种含氧碳化铀物相被认为是UO和UC的固溶体, 或由于碳固溶于UO而使得UO得以在室温下稳定地存在。由于含氧碳化铀的形成进一步降低了金属铀表面的活性, 使得金属铀表面的O/U原子比约为相同吸附量O2的1/3。
暴露气体为CO2时, O/U原子比与气体暴露量关系曲线不同于CO。这可能与二者化学性质的差异有关: (1) CO2为三原子分子, 吸附解离的产物不同; (2) CO2与CO氧化性能的差异。在相同气体暴露量下, 金属铀表面氧化物含量的增长是U-O2体系反应较快, U-CO2反应次之, U-CO反应较慢。
《5 铀在H2气氛中的表面反应研究》
5 铀在H2气氛中的表面反应研究
25 ℃时, 铀的新鲜表面在通入~1000 L的H2之后, 通过对U4f峰的比较和拟合分析, 表面虽能观察到发生了氢化反应, 但不显著。随着温度的升高, 表面即可观察到发生较显著的氢化反应
图2是100 ℃和200 ℃时UO2、UH3和U与H2进气量的关系, 纵坐标为原子百分数。随着H2暴露量的增加, UO2和UH3的量递增, 相应金属铀的量递减。温度升高对U-H2体系氧化反应和氢化反应速率均有影响, 而对氢化反应的影响更大。
图3为金属铀暴露1.3×106 L H2后, 表面层沿纵向 (以溅射时间衡量) 的信息分布。暴露相同量的H2后, 200 ℃时溅射至金属铀基体需10 min, 100 ℃溅射射至金属铀基体仅需5 min, 因此200 ℃时U-H2体系的氧化反应和氢化反应速率均较100 ℃时大, UH3在表面层中所处的位置深得多, 即表面氢化反应产物UH3在温 度较高时形成的量更多。当然温度升高, 使得氧化反应速率增大, 形成的UO2层也相对较厚。在200 ℃和100 ℃时, UO2随着溅射时间的增加而减小, 而U随着溅射时间的增加而增加。
值得注意的是UH3随着溅射时间的增加, 其含量先是增加, 而后变小, 有一极大值, 这表明UH3主要分布在UO2和金属铀的过渡层之间, 也就是说金属铀发生氢化反应后的表层结构由内向外大致为:金属铀/氢化铀/氧化铀。
《图2》

Fig.2 The relationship of variation between UO2, UH3 and exposure of H2
《图3》
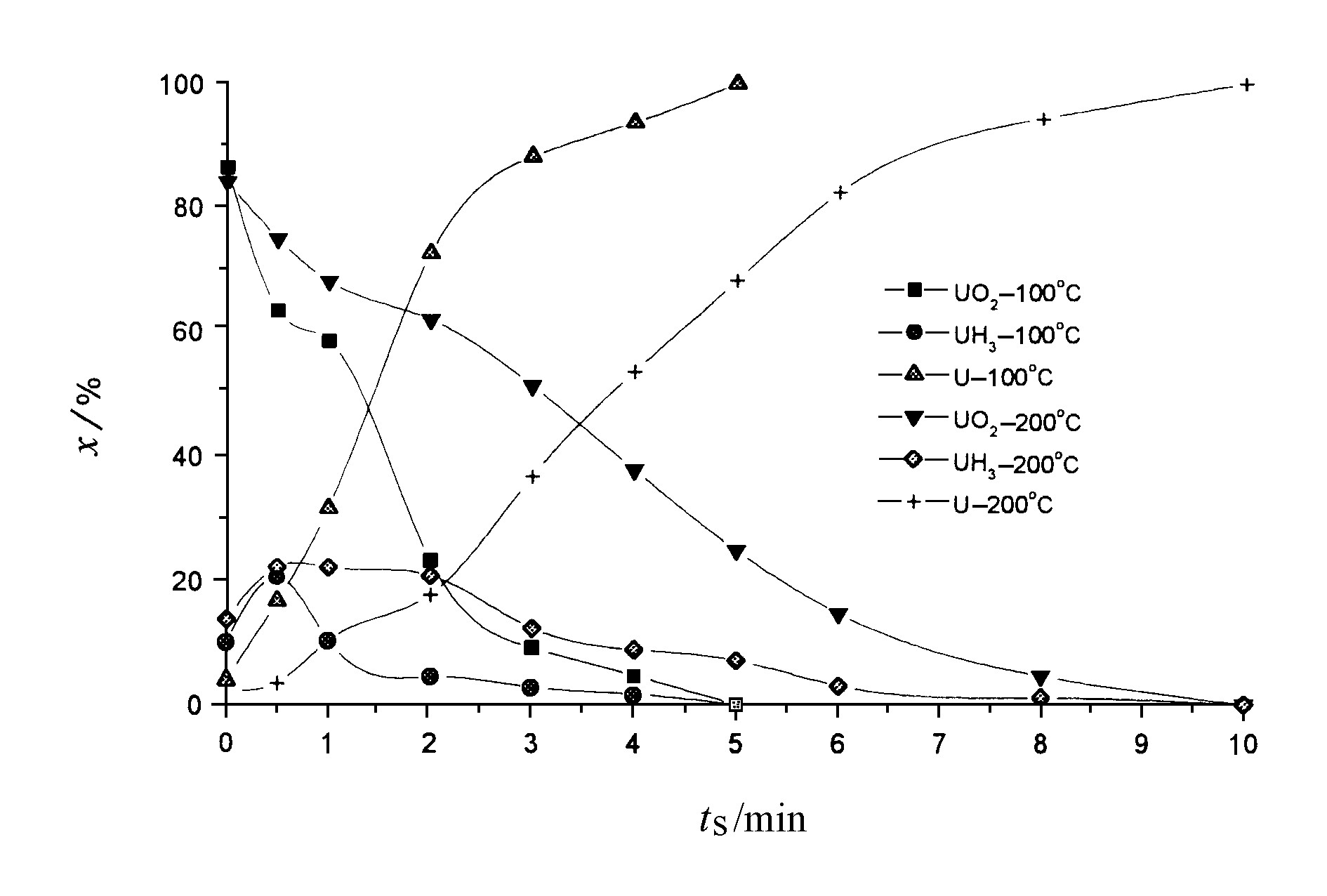
图3 铀表层氢化反应 (1.3×106L H2) 后 UH3、UO2和U与溅射时间关系图
Fig.3 Variation of UH3, UO2, U at different sputter time after hydriting reaction at surface uranium
《6 CO对铀钚金属表面抗腐蚀性的影响》
6 CO对铀钚金属表面抗腐蚀性的影响
铀金属在CO气氛中表面发生还原反应, 随着CO进气量增加, 低氧化态氧化铀 (UO2-x) 的量也随之增加, 同时表面氧化层中高氧化态氧化铀 (UO2+x) 逐渐减少 (见图4)
《图4》

图4 铀试样中UO2±x与CO进气量关系图 1-25 ℃, 2-80 ℃, 3-200 ℃; a-UO2-x, b-UO2+x
Fig.4 The relationship of UO2±x in uranium sample with different exposure of CO
H2气氛中铀金属表面在200 ℃发生氧化反应的同时也发生氢化反应, 但H2中少量CO的存在有利于抑制铀金属表面氢化反应的进行。当CO的含量增多时, 它甚至可以抑制表面氧化反应的进行 (见图5中UO2±x和UH3的变化) 。实验结果还显示铀金属在用CO气体浸泡处理后, 其表面也具有一定的抗氢化性
在一般的铀表面, H2可以进入氧化层并扩散到金属内部而发生氢化反应。但CO的存在参与了H2在表面吸附点的竞争。此外, CO作用所形成的UO2晶体能够使表面稳定、致密, 并可以阻止H2在表面氧化层的扩散。化学热力学计算结果表明, H2可以使U转化为UH3, 但不能使UO2 (UO3、U3O8) 转化为UH3, 即H2不能破坏UO2的稳定晶面。因此, H2中CO的存在可以使铀金属的表面具有抗氢化性和一定的抗氧化性。
《图5》
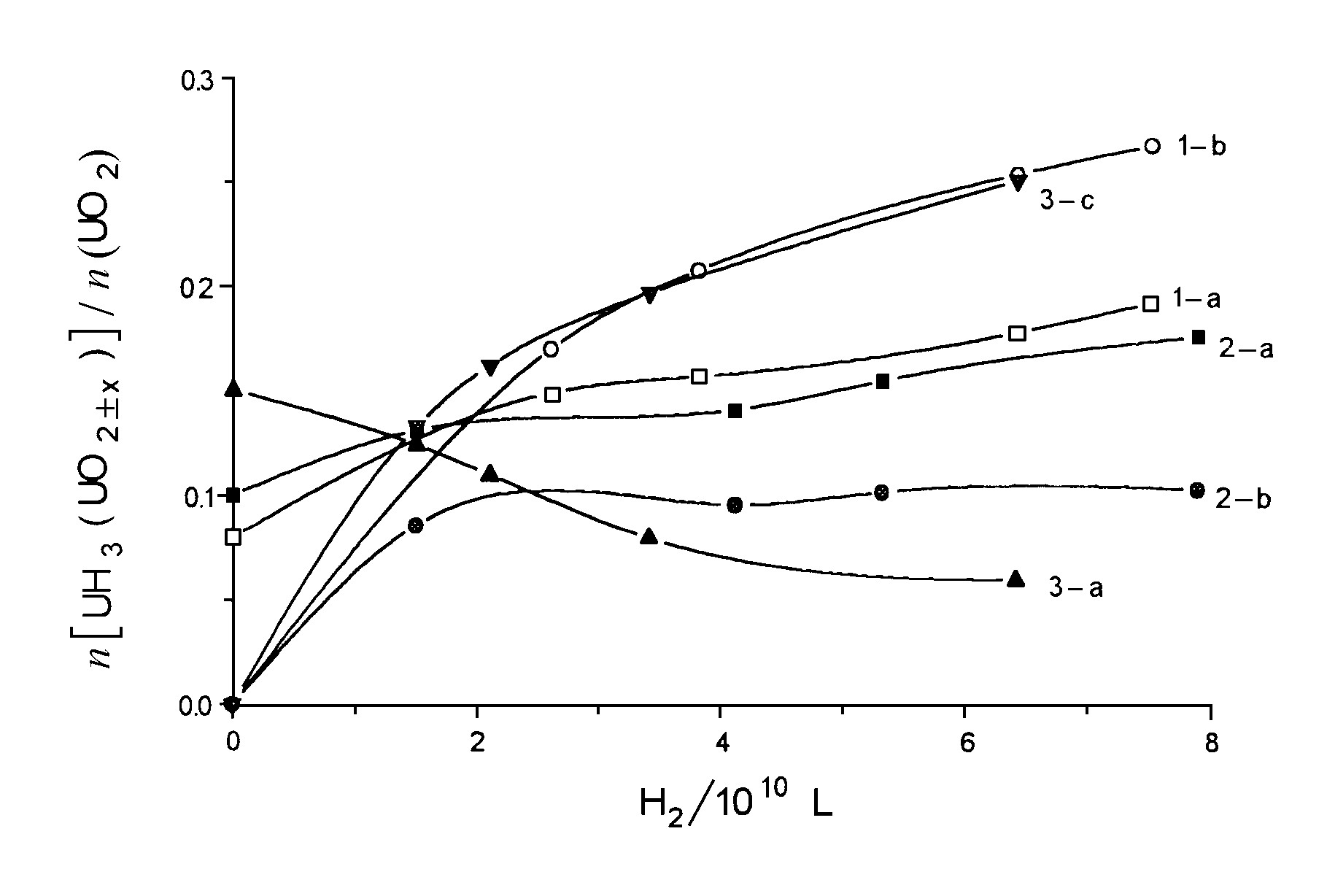
图5 H2-CO气氛中UO2±x和UH3与H2进气量关系图 1-H2, 2-H2-2%CO, 3-H2-50%CO; a-UO2+x, b-UH3, c-UO2-x
Fig.5 The relationship of UO2±x, UH3 with increasing exposure of H2 in H2-CO atmosphere
铀试样在不同相对湿度的空气中贮存氧化质量增加的实验结果如图6所示。经CO、CO2钝化后的试样, 其氧化腐蚀增量明显小于未经钝化的试样, 且CO的钝化作用效果要好于CO2。
《图6》

图6 铀试样在空气中贮存氧化增重趋势图 (a) 50~70%RH; (b) 90%RH
Fig.6 The rate of increasing oxidation of uranium in air atmosphere storoge
为了进一步验证CO对铀表面的还原作用, 用大的管状铀试样 (ϕ32×3×50 mm) 在CO气氛中贮存, 用四极质谱计分析气相成分变化。实验结果表明, 随贮存时间的增长, 由于CO还原而产生的CO2量确实也逐步增加。这进一步肯定了CO对铀试样表面的还原作用, 表明含CO的气氛有利于铀的防腐贮存。
从δ-Pu金属试样在CO气氛中的贮存压力 (见图7) 和气相分析 (见图8) 来看, 变化趋势与铀基本一致。CO2量随贮存时间的增长而逐步增加。实验结果说明CO对δ-Pu试样表面也有一定的还原作用。根据铀的表面化学相关研究结果判断, 可以认为CO气氛同样也有利于δ-Pu试样的表面防腐贮存。
《图7》
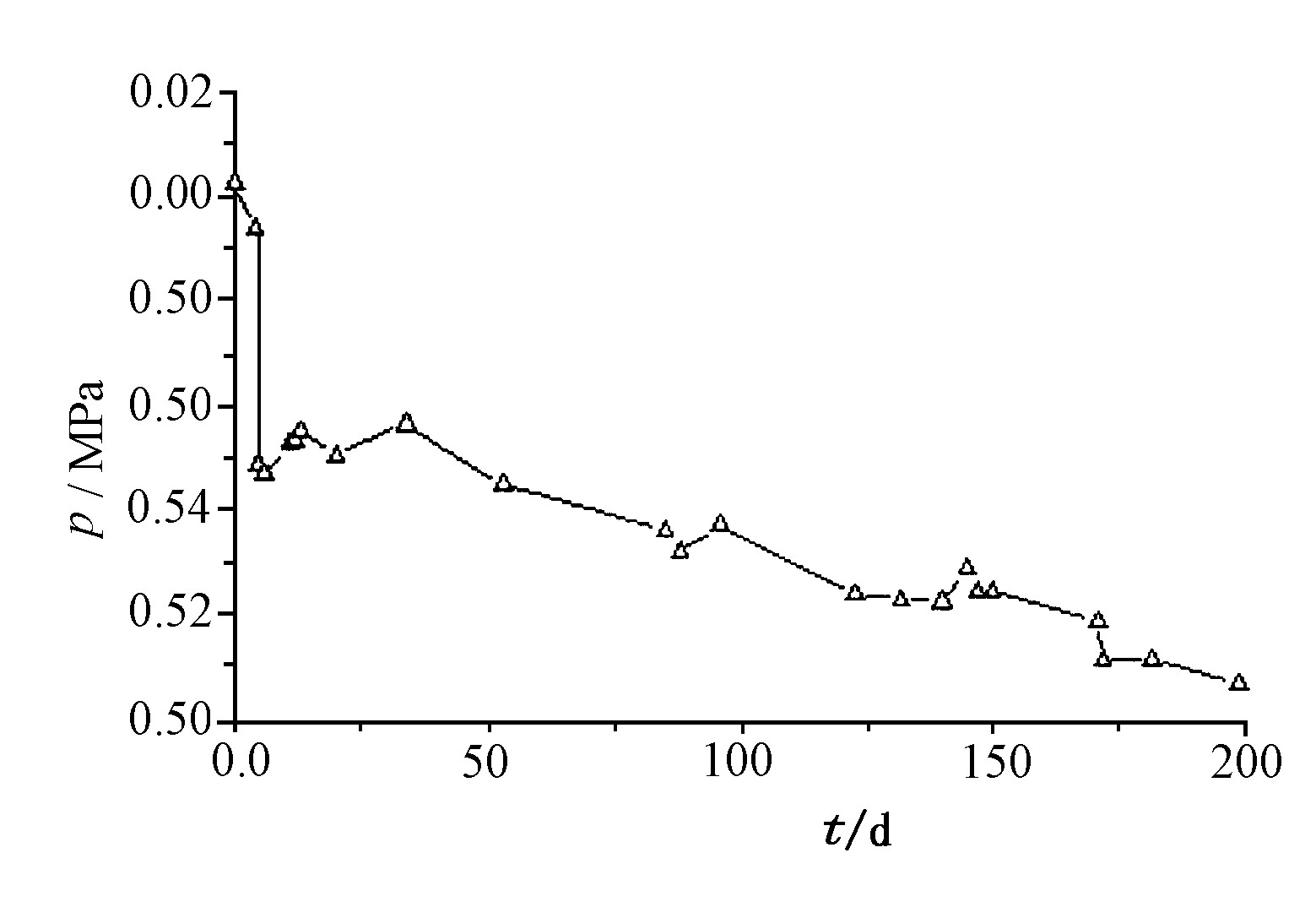
Fig.7 Variation of CO pressure with increasing storage time for δ-Pu metal sample
《图8》

Fig.8 Variation of concentration CO and CO2 with storage time for δ-Pu-CO system
但是体系中CO的量 (分压、气相浓度) 下降较快, CO2量随贮存时间的增长也增加得更多, 这与U-CO表面反应明显不同。主要原因是δ-Pu的核辐射可使CO分子键断裂, 产生游离碳和活性的氧。后者与CO又重新组合生成CO2。游离碳和活性氧在δ-Pu试样的表面也可能生成一层PuCxOy相。与UCxOy一样, PuCxOy也有延缓金属表面氧化腐蚀的作用。宏观实验的研究结果证实了CO对δ-Pu试样的表面抗氧化性。有关CO对δ-Pu试样的表面抗腐蚀性机理应做进一步的系统研究工作。
《7 金属铀钚化合物的分子结构和表面抗腐蚀性研究》
7 金属铀钚化合物的分子结构和表面抗腐蚀性研究
《7.1金属铀钚化合物的分子结构和势能函数》
7.1金属铀钚化合物的分子结构和势能函数
通常的分子结构计算软件不包括锕系元素的基函数, 应用相对论原子实势方法RECP (relativistic effetive core potential) 可以解决这个问题, 该方法使用单电子有效势来取代Hamiltonian算符中涉及原子实的电子势能项, 有效地处理了Darwin修正和质量速度 (mass-velocity) 修正, 因此是一种准确程度很高的近似方法。为了计算方便, U原子采用14个价电子 (6s27s26p66d15f3) 的相对论有效原子实势及 (5s4p3d4f) /[3s3p2d2f]收缩价基集合, 或相对论有效原子实势及 (4s4p3d4f) /[3s3p2d4f]收缩价基集合, 氧、碳、氮、氢原子采用6-311G*或6-31G*全电子基集合, 应用Gauusian 94程序对UO等进行了量子力学计算。计算中采用了MP2方法, 即在HF基础上加上二阶Moller-Plesset相关能。
双原子分子的势能函数较好的一种形式是Murrell-Sorbie势能函数:
上式为五参数的Murrell-Sorbie势能函数形式。式中De为离解能, ρ=r-re, r, re分别为核间距和平衡核间距, a1、a2、a3为参数。通过计算, 优化出平衡核间距以及不同核间距对应能量值, 在此基础上, 采用最小二乘法拟合出Murrell-Sorbie势能函数, 再进一步计算出力常数和光谱数据。有关铀化合物的分子结构、势能函数参数、光谱数据和力常数的计算结果可参见文献
Pu原子的94个电子是这样分割的, 原子实包含80个电子1s22s22p63s23p63d104s24p64d104f145s25p65d106s2和14个价电子即5f66p67s2, 文献列出了它的RECP和对应的基函数。采用Pu的RECP近似和O、H、C、N等原子的6-311G*全电子基函数, 在Born-Oppenheimer近似下, 用量子力学方法计算了上述分子基态的平衡几何结构Re和一系列单点势能值, 并用上述方程式拟合Murrell-Sorbie (M-S) 势能函数及由此计算得到的光谱数据可参见文献
就PuO分子来看, 量子力学的理论计算结果与实验数值逆向推导结果符合得相当好, 这说明所选用的RECP和对应的基函数是准确的, 在这个基础之上的量子力学计算结果是可信的。首次用量子力学计算了PuH、PuC和PuN的分子结构、势能函数和完整光谱常数, 除PuN分子有少量光谱数据外, 另外两个分子均还没有实验光谱数据公布。
《7.2铀、钚和U3O8在CO、H2气氛中表面反应的热力学平衡计算》
7.2铀、钚和U3O8在CO、H2气氛中表面反应的热力学平衡计算
根据热力学一般原理可以进行铀、钚和U3O8在CO、H2环境系统中平衡态及其反应移动方向性的研究。计算热力学函数变化所应用的基本公式是众所周知的, 相关的热力学数据和计算结果可参见文献
另外, U3O8在H2气氛中发生氢化作用产生UH3的反应△G值为正数, 即反应不可能进行。在U3O8-H2体系XPS研究中也确实未能观测到UH3的U4f峰。这表明铀的氧化物不能与H2作用而发生氢化反应。而铀在H2气氛中发生表面氢化反应的△G值为负数, 即反应是可以进行的。H2分子 (原子) 的直径较小, 可以透过破裂的氧化层进入铀金属体内与铀作用而发生氢化反应并形成UH3。该结论与实验结果
CO对高氧化态 (或高价) 氧化物的还原性, 理论计算结果得到实验的验证。另外, CO与表层氧化物反应生成UC的△G为正值, 这表明CO即使是在表面解离吸附, 碳也是透过氧化层进入金属体内才形成UC。
《8 结论和展望》
8 结论和展望
实验研究与理论计算得到的具有实际意义的结论是:CO与金属铀表面作用具有还原性, 从而使铀金属表面由不稳定且疏松的多种氧化物层变成单一稳定的氧化物表层;稳定、致密的表面使铀对O2、H2O (v) 和H2具有一定的抗腐蚀性, 因此铀在CO气氛中表面具有一定的抗氧化性和抗氢化性。这些研究结果对金属核材料的防腐蚀和表面改性以及贮存气氛的选择均具有一定的指导意义。
CO气氛也有利于δ-Pu试样的表面防腐贮存。但金属钚的表面化学系统研究尚须进一步深入。由于钚可能存在着与PuO2同时形成Pu2O3的外加复杂性, 钚 (合金) 在环境气氛中的表面氧化机理将更为复杂化。为了进一步探索钚的抗腐蚀性, 在本实验室工作基础上, 可对Pu-O2、Pu-CO/CO2和Pu-H2等体系开展较为系统的表面化学研究工作、Pu及δ-Pu合金的电化学腐蚀研究、Pu+H2O+O体系的表面反应动力学研究以及Pu-O2、H2O、H2等体系中表面化学反应的理论研究等。













 京公网安备 11010502051620号
京公网安备 11010502051620号




