《1 前言》
1 前言
精确的是1932年发现的稳定同位素,其水合物即重水(D2O)的热容,熔融热,蒸发热和熵都大于轻水,在地球上相对与氢的比例大约为 1:6 600。是变异同位素,由核反应产生,水中氚与氢的比例大约为 1∶107。分离出与氚具有重要应用价值,历来受到各国的关注。现在使用的分离方法有根据化学性质微小差异的化学交换法[1,2],根据可逆分解电压以及浓差,电阻和化学分解相对的电解法。[3](又分为联合电解-催化交换法(CECE),液相催化交换法(LPCE)和气相催化交换法(VPCE)[4] ),根据蒸汽压差的蒸馏法[5],分离 H2-D2H2 - T2 和 D2 - T2 的气相色谱法[6〜9]以及激光分离 H2-D2 – T2 法等。在 CECE 法中,包括 D2-含氚重水同位素交换笔者逐步从理论角度研究其中的热力学问题,如反应(19-1)和反应(19-2)的平衡条件以及可逆分解电压。和电解,可分解热力学和动力学问题。
《2 氢同位素水分子的量子力学计算》
2 氢同位素水分子的量子力学计算
密度泛函理论(密度泛函理论,DFT,笔者应用其 B3LYP 方法) [10]方法就是通过构造电子密度的泛函来模拟电子相关的一种近似方法,将电子能量分解动能、电子-核吸引能、Coulomb排斥能以及交换相关能 4 部分分别计算,则电子的能量可分成

式中,上标 T 表示动能,即 E T 为电子运动的动能;上标 V 表示势,即 E V 包括核与电子的吸引势和核与核的排斥势;上标 J 表示排斥势,即 E J 为电子与电子的干扰势;上标 XC,其中 X 表示交换,C 表示相关,即 E XC 为交换相关能和电子与电子相互作用的其余部分。除了核与核的替代势,每一项表示为电子密度 ρ 的函数
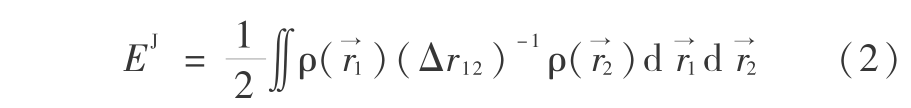
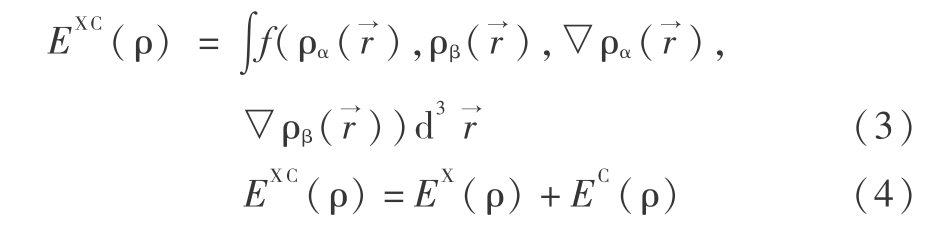
式( 3 ) 中, 和
和  分别为电子平行自旋和电子反平行自旋,式 ( 4 ) 中的 3 项替代电子密度的泛函,E X(ρ)和E C(ρ)2 项分别为交换泛函和相关泛函,均由仅与电子密度 ρ 有关的局域泛函(local functional)和与电子密度 ρ 梯度
分别为电子平行自旋和电子反平行自旋,式 ( 4 ) 中的 3 项替代电子密度的泛函,E X(ρ)和E C(ρ)2 项分别为交换泛函和相关泛函,均由仅与电子密度 ρ 有关的局域泛函(local functional)和与电子密度 ρ 梯度 有关的梯度修正泛函(gradient -corrected functional) 1988 年 Becke 等人称为了根据局域的交换泛函形式
有关的梯度修正泛函(gradient -corrected functional) 1988 年 Becke 等人称为了根据局域的交换泛函形式
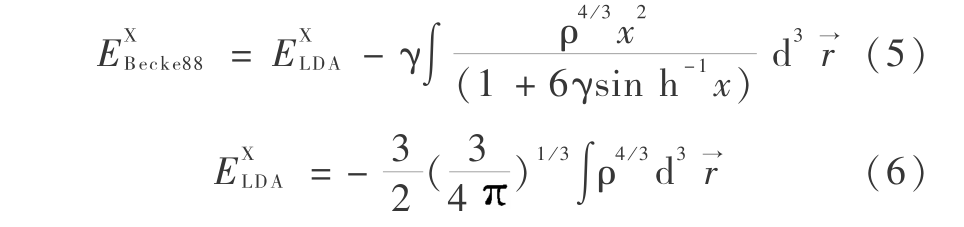
式中,LDA 表示局域密度近似,Beck88 表示非局域交换改正,密度 ρ 是 r 的函数  ,
,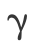 是被选择近似的惰性气体原子的交换能的参数,Becke 定义其变量 0.004 2 a.u.,即原子单位。类似地,1991 年 Perdew 和 Wang 提出了一种相关泛函的形式
是被选择近似的惰性气体原子的交换能的参数,Becke 定义其变量 0.004 2 a.u.,即原子单位。类似地,1991 年 Perdew 和 Wang 提出了一种相关泛函的形式
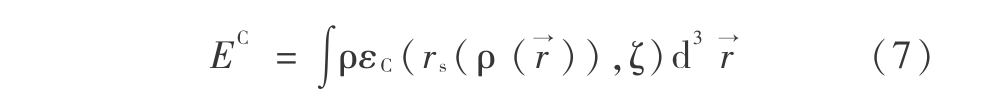
式中,

其中,rs 是密度参数 ,  是相关自旋极化。DFT 方法就是将交换泛函和相关泛函联合起来进行计算,其中 B3LYP 方法即是将包含梯度修正的贝克交换泛函和包含梯度修正的 Lee,Yang 和 Parr 相关泛函联系在一起,局域相关泛函按常规采用 Vosko,Wilk 和 Nusair(VWN)局域自旋密度处理,得到 Becke3 参数的泛函
是相关自旋极化。DFT 方法就是将交换泛函和相关泛函联合起来进行计算,其中 B3LYP 方法即是将包含梯度修正的贝克交换泛函和包含梯度修正的 Lee,Yang 和 Parr 相关泛函联系在一起,局域相关泛函按常规采用 Vosko,Wilk 和 Nusair(VWN)局域自旋密度处理,得到 Becke3 参数的泛函

笔者所用的为

通过调节参数  ,b 和 c 的值,可以优化控制交换能和相关能修正,Becke 在 G1 理论基础上对第一周期原子的原子化能、电离势、质子亲和能和原子能量进行拟合,得到参数的值分别为
,b 和 c 的值,可以优化控制交换能和相关能修正,Becke 在 G1 理论基础上对第一周期原子的原子化能、电离势、质子亲和能和原子能量进行拟合,得到参数的值分别为  = 0.20,b = 0.72 和 c = 0.81。 在 B3P86 法中,用 Perdew[11] 的梯度改正和他的 1991 年的局域相关泛函代替 Lee,Yang 和 Parr 的相关泛函
= 0.20,b = 0.72 和 c = 0.81。 在 B3P86 法中,用 Perdew[11] 的梯度改正和他的 1991 年的局域相关泛函代替 Lee,Yang 和 Parr 的相关泛函 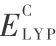 。 一般地讲,B3P86 的系统计算能量是比较低的。根据式 ( 9 ) 的泛函形式,用类似于自洽场方法(SCF)的迭代方式进行自洽的 DFT 计算。
。 一般地讲,B3P86 的系统计算能量是比较低的。根据式 ( 9 ) 的泛函形式,用类似于自洽场方法(SCF)的迭代方式进行自洽的 DFT 计算。
《表1》
表 1 量子力学方法 B3P86/6-311 ++G(3df,3pd)计算氢同位素水分子的结果
Table 1 The calculations of hydrogen -isotope water using quantum mechanical method B3P86/6-311 ++G(3df,3pd)
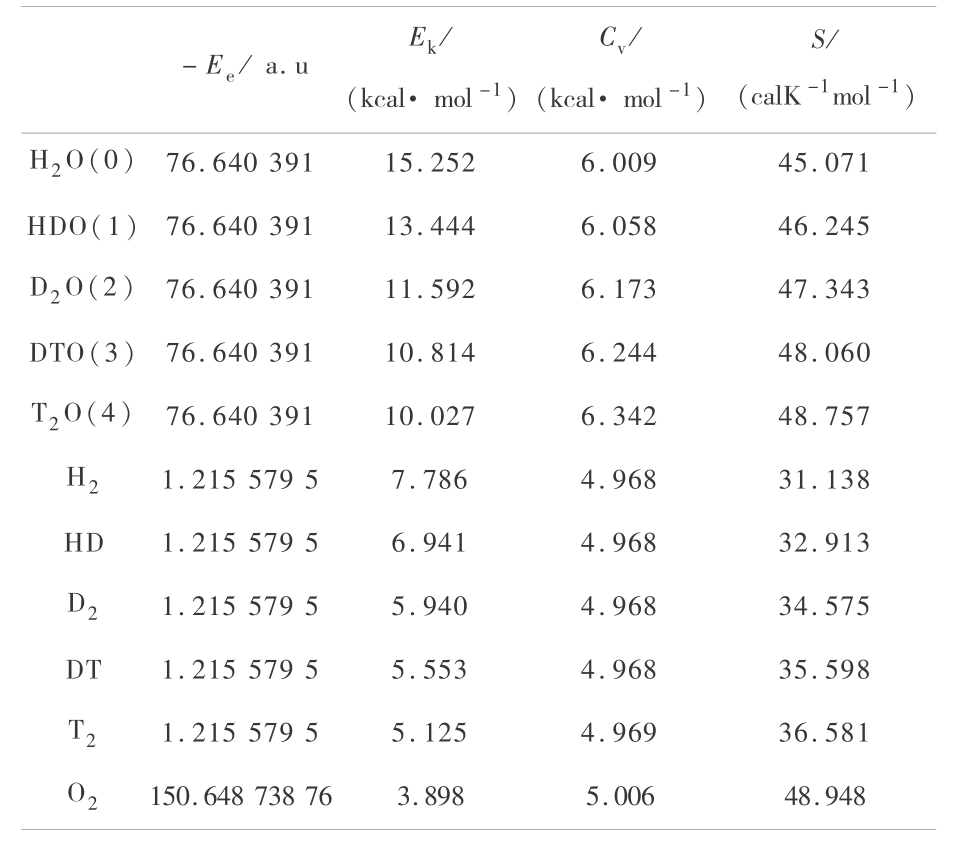
注: 1 cal = 4.2 J
《3 氢同位素水分子分解的热力学函数和分解电压》
3 氢同位素水分子分解的热力学函数和分解电压
《3.1 直接用热力学函数计算分解电动势》
3.1 直接用热力学函数计算分解电动势
氢-氧电池的可逆电动势可用热力学函数计算,因为反应
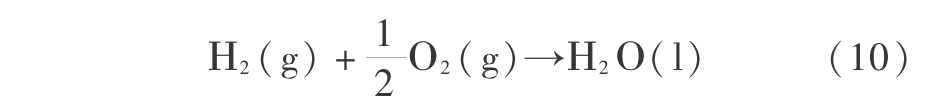
在 298 K 时的 Gibbs 函数变化 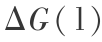 =-56.690 kcal/mol =-237.190 96 kJ/mol,所以由
=-56.690 kcal/mol =-237.190 96 kJ/mol,所以由
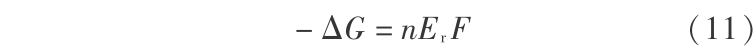
得到可逆电动势
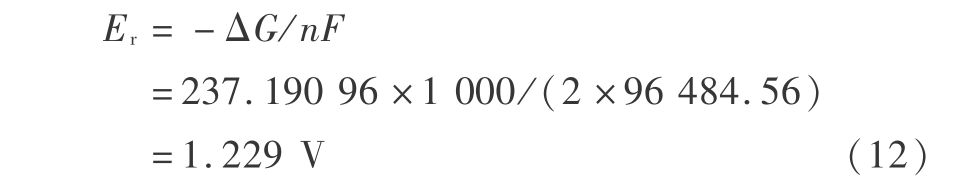
同理,因为以下反应的 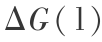 =-58.206 kcal/mol =243.533 904 kJ/mol
=-58.206 kcal/mol =243.533 904 kJ/mol

所以可逆电动势为 1.262 V。 因为宏观热力学函数是准确的,所以得到的可逆电动势也是准确的。 可逆电动势即可逆分解电压,考虑化学、电阻和浓差极化后,实际分解电压要大于可逆分解电压。
《3.2 用量子力学方法计算分解电动势》
3.2 用量子力学方法计算分解电动势
T2O,DTO 和 HDO 等的 Gibbs 函数变化 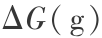 或
或 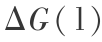 很难实际测量到,但是用量子力学和统计力学方法是可以计算的。 现举例说明。 对 T2O 在 298 K 时的 Gibbs 函数变化
很难实际测量到,但是用量子力学和统计力学方法是可以计算的。 现举例说明。 对 T2O 在 298 K 时的 Gibbs 函数变化 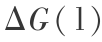 和可逆分解电压的计算可用量子力学 B3P86/6 -311 ++G(3df,3pd) 方法分 2 步进行,第 1 步是液态氚水汽化,第 2 步是汽态氚水分解,这正是电解水的过程,都是指可逆过程,现说明对第 2 步的计算。
和可逆分解电压的计算可用量子力学 B3P86/6 -311 ++G(3df,3pd) 方法分 2 步进行,第 1 步是液态氚水汽化,第 2 步是汽态氚水分解,这正是电解水的过程,都是指可逆过程,现说明对第 2 步的计算。
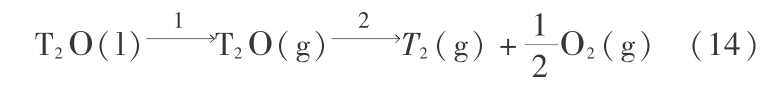
由表 1,电子能量熵变化为
由表 1,热力学核运动(平动、转动和振动)能量变化为
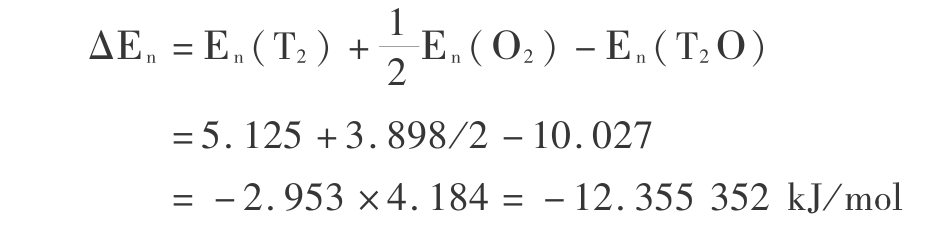
总能量变化为

则总焓的变化为
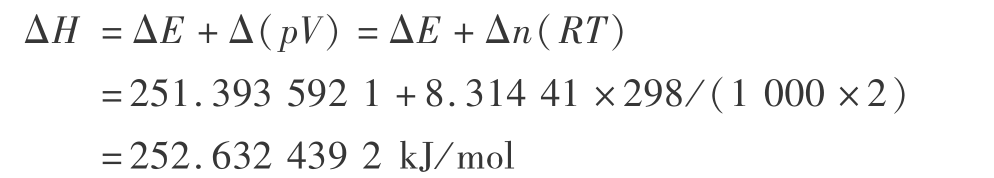
总熵的变化为
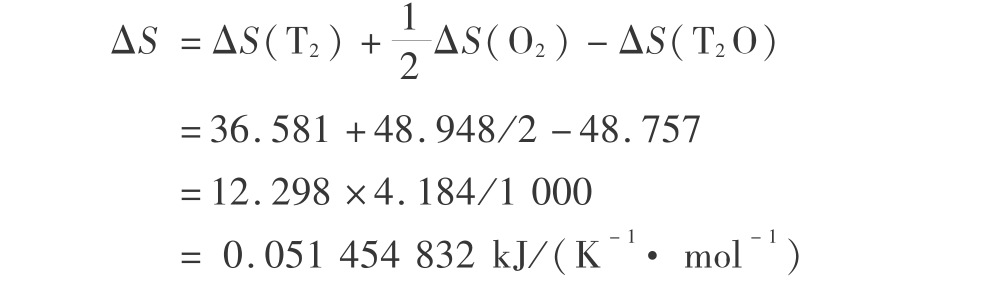
因而,气相分解的 Gibbs 函数变化 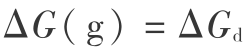 (d表示分解)为
(d表示分解)为

而在 298 K 时第 1 步液态氚水汽化的 Gibbs 函数变化 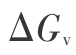 =9.211 7 kJ/mol (参见下节) (v表示汽化), 所以总 Gibbs 函数变化
=9.211 7 kJ/mol (参见下节) (v表示汽化), 所以总 Gibbs 函数变化

因为分解过程 Gibbs 函数变化为正,则氚与氧化合过程 Gibbs 函数变化为负,所以用可逆过程热力学公式,则可逆分解电压 Er 为

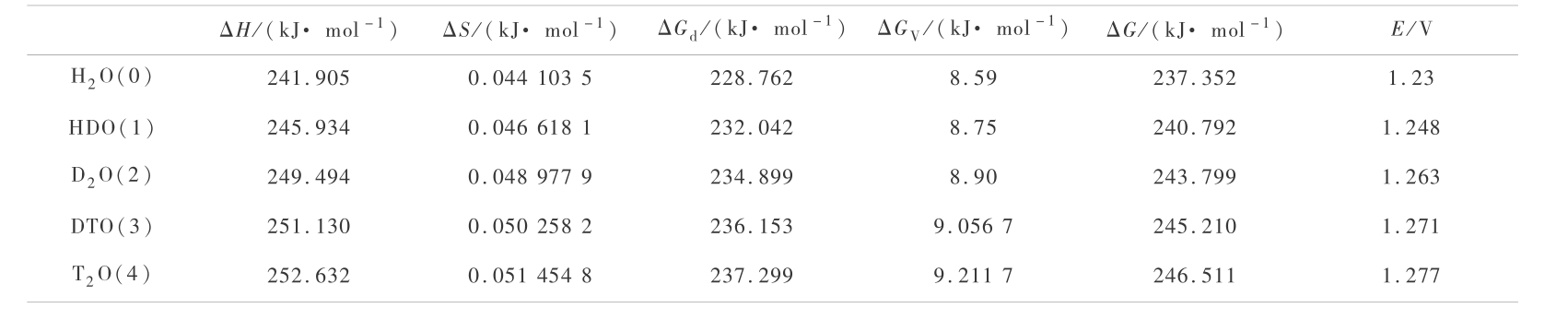
同理,氢同位素水的计算结果见表 2。
《表2》
表 2 氢同位素水分解的热力学函数变化和可逆分解电压
Table 2 Thermodymical functions and reversible decomposition voltages of hydrogen-isotope water
《3.3 氢同位素液态水汽化的 Gibbs 函数变化》
3.3 氢同位素液态水汽化的 Gibbs 函数变化
已知液态 H2O,HDO 和 D2O 在 298 K 时的汽化 Gibbs 函数变化分别为 8.59 KJ/mol[12],8.75 KJ/mol[13] 和 8.90[13] kJ/mol,并与中子数间满足线性关系。 由图 1 可得到液态 DTO 和 T2O 的汽化 Gibbs函数变化分别为 9.056 7 kJ/mol 和 9.211 7 kJ/mol。
《图1》

图 1 汽化 Gibbs 函数与中子数间的关系
Fig. 1 Vaporization Gibbs function with neutron number
《4 氢同位素水的蒸汽压与汽化热》
4 氢同位素水的蒸汽压与汽化热
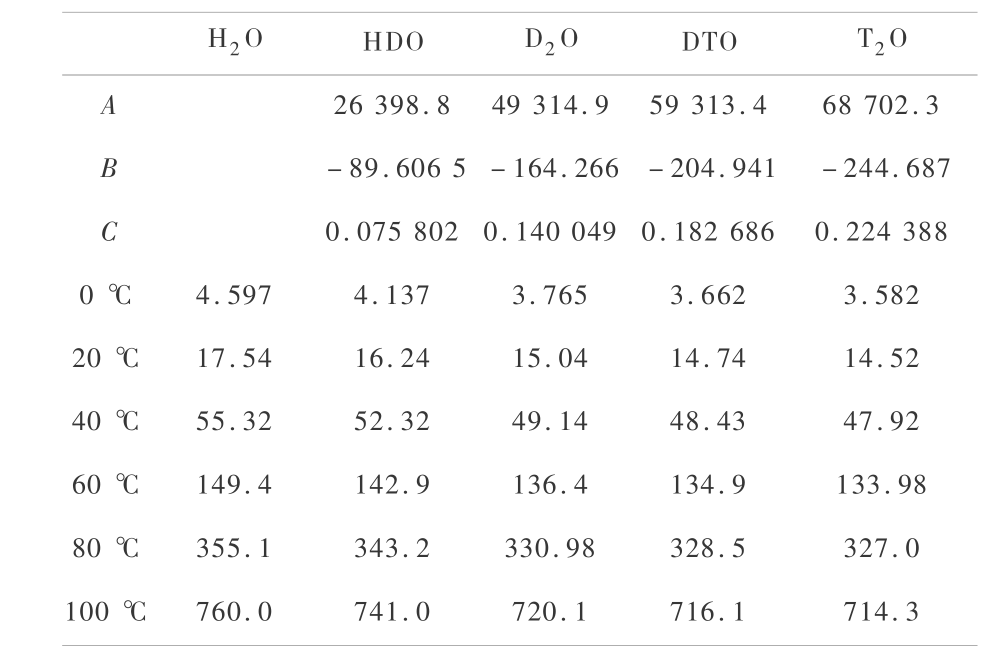
从文献[14]可知,由于氢同位素水的蒸汽压差别,根据凝聚相中蒸汽压的同位素效应,用力场方法拟合得到以下公式,并计算出液 H2O,HDO,D2O,DTO 和 T2O 在 0 ~100 ℃ 的蒸汽压(见表 3),并将蒸汽压与温度关系作图,如图 2 所示。 可以看出,氢同位素水越重,蒸汽压越低。

其中 A,B,C 为系数。
《图2》

a—  曲线;b—
曲线;b— 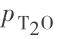 曲线 1 mmHg =133.322 Pa
曲线 1 mmHg =133.322 Pa
图 2 氢同位素水 H2O 和 T2O 的蒸汽压与温度关系
Fig. 2 The vapor pressure with temperature of H2O and T2O
《表3》
表 3 不同温度下氢同位素水的蒸汽压
Table 3 The vapor pressure with temperature of hydrogen-isotope waters
设氢同位素水的蒸汽压与温度的关系为

其中,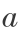 ,b,c,d 为系数。
,b,c,d 为系数。
以 H2O 为例,由表 3 可知,在不同温度下有以下方程
T =273.16 K 时,有 -3.66 086 ×10-3 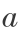 +2.436 42b +273.16c +d =0.660 77;
+2.436 42b +273.16c +d =0.660 77;
T =293.16 K 时,有 -3.411 11 ×10-3 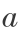 +2.467 10b +293.16c +d =1.244 03;
+2.467 10b +293.16c +d =1.244 03;
T =313.16 K 时,有 -3.193 26 ×10-3 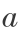 +2.495 77b +313.16c +d =1.742 88;
+2.495 77b +313.16c +d =1.742 88;
T =333.16 K 时,有 -3.001 56 ×10-3 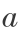 +2.522 65b +333.16c +d =2.174 35;
+2.522 65b +333.16c +d =2.174 35;
T =353.16 K 时,有 -2.831 58 ×10-3 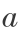 +2.547 97b +353.16c +d =2.550 35;
+2.547 97b +353.16c +d =2.550 35;
T =373.16 K 时,有 -2.679 82 ×10-3 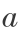 +2.571 90b +373.16c +d =2.880 81
+2.571 90b +373.16c +d =2.880 81
由最小二乘法,可以得到系数 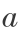 ,b,c 和 d,所以 H2O 的蒸汽压与温度的关系为
,b,c 和 d,所以 H2O 的蒸汽压与温度的关系为
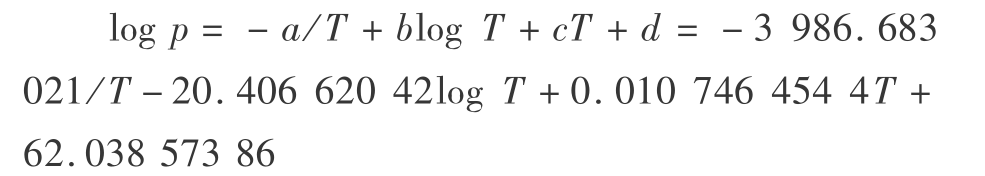
进一步由下式可得到汽化热

相似地,可得到如下氢同位素水的蒸汽压和汽化热与温度的关系。


其中  关系中的积分常数 C,可根据 H2O 和 D2O 在 T =298.16 K 时的汽化热分别为 43.994 76 kJ/mol 和 45.379 664 kJ/mol 而得到。
关系中的积分常数 C,可根据 H2O 和 D2O 在 T =298.16 K 时的汽化热分别为 43.994 76 kJ/mol 和 45.379 664 kJ/mol 而得到。
《5 氢同位素水交换反应的热力学分析》
5 氢同位素水交换反应的热力学分析
反应式
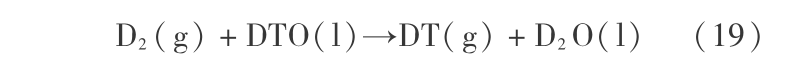
实际上要分为两步,即
第一步,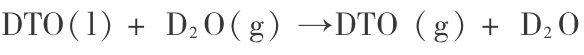

第二 步, 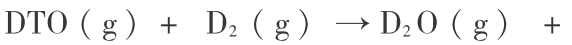

1) 对第一步反应 ( 19 -1 ) 的热力学分析。 第一步,即反应 ( 19 -1 ) 的热力学平衡条件可用化学势表示为
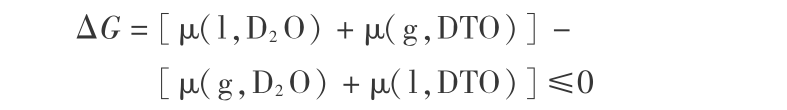
当 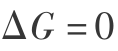 时,表示反应达到平衡;当
时,表示反应达到平衡;当 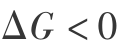 则表示反应可以自发进行。 式中气体化学势表示为
则表示反应可以自发进行。 式中气体化学势表示为
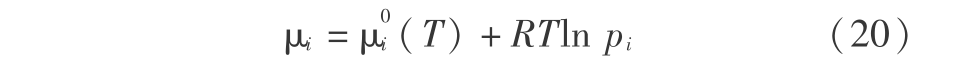
而对液体化学势表示为

通常,应该用逸度代替分压,用活度代替浓度,对反应 ( 19-1 )则可以导出
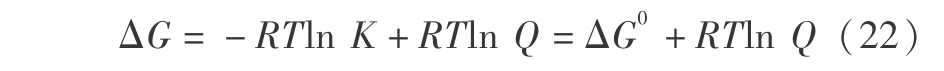
式中
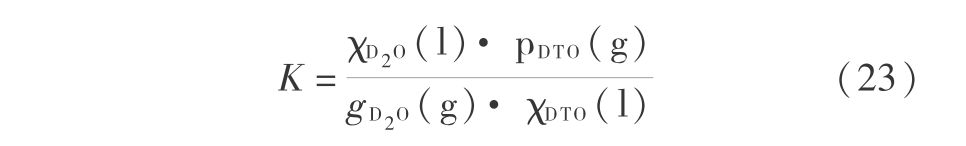
而

在式(23)和式(24) 中,K 为平衡常数,而 Q 为指定态的对应的量。T =298.16 K 时 D2O 的汽化热为 8.90 kJ/mol ,而 DTO 的汽化热为 9.056 7 kJ/mol,则 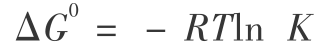 或 (9 056.7-8 900)/4.184 =-1.987 8 × 298.16 ln K 得到 T =298.16 K 时平衡常数 K 为 0.938 7。这个平衡常数不大,仅当 Q < K 时, 第一步才是可以自发进行的。 由式 ( 16 ) 计算得到 T =298.16 K 时,D2O 和 DTO 的蒸汽压分别为 20.605 89 mmHg 和 20.229 6 mmHg,则
或 (9 056.7-8 900)/4.184 =-1.987 8 × 298.16 ln K 得到 T =298.16 K 时平衡常数 K 为 0.938 7。这个平衡常数不大,仅当 Q < K 时, 第一步才是可以自发进行的。 由式 ( 16 ) 计算得到 T =298.16 K 时,D2O 和 DTO 的蒸汽压分别为 20.605 89 mmHg 和 20.229 6 mmHg,则
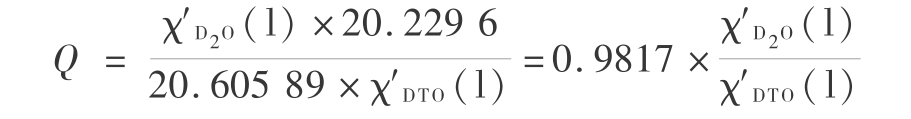
在液相中 D2O 和 DTO 的浓度比很难符合 Q < K 的要求,因此在静态反应中很难实现。 如果在流动系统中通过反应 ( 19 -2 ) 不断移去 DT ( g ),进一步移去 DTO ( g ) ,则有可能使 Q < K 符合,从而使反应 ( 19 -1 ) 自发进行。
2 ) 对第二步反应 ( 19 -2 ) 的热力学分析。 用 B3P86/6-311 ++G ( 3df,3pd ) 方法可计算相关的热力学函数,结果见表 4。
《表4》
表 4 B3P86/6-311 ++G ( 3df,3pd ) 方法计算结果
Table 4 The calculated results using method B3P86/6-311 ++G ( 3df,3pd )

以计算 T =313.16 K 时反应 DTO(V) +D2 ( g ) → D2O( V ) +DT( g ) 的  为例,其中电子能量对 DTO( g ) 和 D2O( g ) 相同,对 DT( g ) 和 D2 ( g )相同,热力学核运动(平动、转动和振动)能量变化为
为例,其中电子能量对 DTO( g ) 和 D2O( g ) 相同,对 DT( g ) 和 D2 ( g )相同,热力学核运动(平动、转动和振动)能量变化为

总熵的变化为
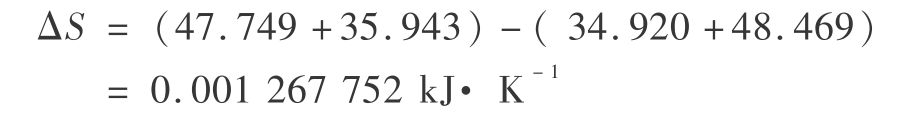
因而气相反应的 Gibbbds 函数变化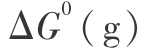

计算气相反应的 Gibbs 函数变化和平衡常数如表 5 所示,其温度和 Gibbs 函数变化关系见图 3。
《表5》
表 5 Gibbs 函数变化和平衡常数
Table 5 Gibbs functions and equilibrium constants

《图3》

a—多项式(系列 1);b—系列 1
图 3 温度和 Gibbs 函数变化关系图
Fig. 3 The variation of Gibbs functions with temperature
《6 结语》
6 结语
1) H2O(0)与 DTO(3)的可逆分解电压 Er 的相差为 0.041 V,H2O(0)与 T2O(4)的可逆分解电压E r 的相差为 0.047 V。 这样 H2O(0)应先电解出来。但是,在进一步考虑化学、电阻和浓差极化后, 实际分解电压要大于可逆分解电压。 因为氚离子的迁移率最小,可以预料 T2O 的浓差极化会大些, 电阻极化也可能会大些,关键是有待进一步研究化学极化。如果增加负极材料对气体 T2 的超电压,则有利于增加 H2O(0)与 T2O(4)的分解电压的差,即有利于分开 H2O(0)与 T2O( 4 )。 如要保留 T2O,实际的分解电压不能大 H2O 的分解电压的 0.047 V。
2) 关于 H2O 分子气相分解的 Gibbs 函数变化 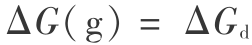 问题,在用量子力学方法计算单个分子时,必须考虑离解过程满足对称性的要求,可以证明应为[15]
问题,在用量子力学方法计算单个分子时,必须考虑离解过程满足对称性的要求,可以证明应为[15]
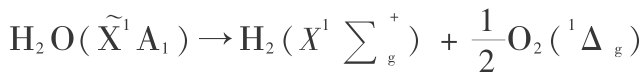 (其中,括号中字母表示电子状态)
(其中,括号中字母表示电子状态)
H2O 分子为单重基态, 即  ,而 H2 分子亦为单重基态,即
,而 H2 分子亦为单重基态,即  ,所以 O2 分子必为第一激发态,即为
,所以 O2 分子必为第一激发态,即为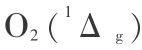 时才是单重态。 如果氧分子处于基态即
时才是单重态。 如果氧分子处于基态即  时, 那就不满足对称性的要求。 但是,分解过程的
时, 那就不满足对称性的要求。 但是,分解过程的 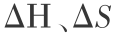 以及 Gibbs 函数变化
以及 Gibbs 函数变化 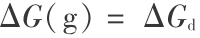 等都是宏观热力学函数,用宏观热力学原理处理就完全不同了。 因为宏观状态与微观状态的描述方法是不同的,宏观状态决定于宏观参数(如温度、压力、密度等),而微观状态决定于其对称性。氧分子宏观状态的基态应与氧分子微观状态的基态
等都是宏观热力学函数,用宏观热力学原理处理就完全不同了。 因为宏观状态与微观状态的描述方法是不同的,宏观状态决定于宏观参数(如温度、压力、密度等),而微观状态决定于其对称性。氧分子宏观状态的基态应与氧分子微观状态的基态 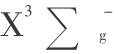 对应,所以应计算氧分子的微观状态的基态
对应,所以应计算氧分子的微观状态的基态 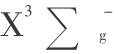 ,而不是计算氧分子的微观状态的第一激发态,即
,而不是计算氧分子的微观状态的第一激发态,即 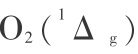 ,但是要考虑第一激发态
,但是要考虑第一激发态 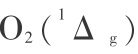 没有完全弛豫到基态
没有完全弛豫到基态 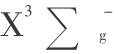 。
。
3)从热力学来讲,反应(19 -1)和反应(19-2)的平衡常数都很小,在静态反应中很难实现,如果在流动系统中,则有可能使 Q < K 符合。
4)电解分离氢同位素水的最大的难点是选择性差。 可以探索使用光催化分离的方法,因为对 H2O 的最小可能的能隙为 1.23 eV,相当于激发光为 10 080.1  ; 而对 T2O 最小可能的能隙为1.277 eV,相当于激发光为 9 709.1
; 而对 T2O 最小可能的能隙为1.277 eV,相当于激发光为 9 709.1  ,相差 371
,相差 371  。 这具有选择性,满足光催化分离的必要条件。
。 这具有选择性,满足光催化分离的必要条件。














 京公网安备 11010502051620号
京公网安备 11010502051620号




