贵金属包括钌、铑、钯、银、锇、铱、铂、金8个元素。前4个元素属周期表中第5周期, 第2过渡系;后4个元素属第6周期, 第3过渡系;按纵向分类时它们属第Ⅷ族和IB族。在许多化学、冶金和材料的专著中
笔者将收集到的可比较的物理常数按贵金属在周期表中的顺序排列, 发现有三种不同规律的变化, 并用金属键理论中的价键理论进行解释。
《1 近似倍比或近似相等关系的物理常数》
1 近似倍比或近似相等关系的物理常数
此类物理常数列入表1。为便于讨论, Ru、Rh、Pd、Ag按其原子结构填充4d电子称为4d贵金属, Os、Ir、Pt、Au称为5d贵金属。
Table 1 Some structure parameters and physical properties of precious metals
《表1》
元 素 | Ru | Rh | Pd | Ag |
原子序数 | 44 | 45 | 46 | 47 |
原子量 | 101.07 | 102.91 | 106.40 | 107.868 |
电子结构 | 4d75s1 | 4d85s1 | 4d10 | 4d105s1 |
原子半径/nm | 0.133 | 0.134 | 0.137 | 0.144 |
离子半径/nm | (Ⅳ) 0.06 | (Ⅳ) 0.065 | (Ⅳ) 0.064 | (Ⅰ) 0.126 |
克原子体积/cm3 | 8.22 | 8.29 | 8.84 | 10.3 |
密度/g·cm-3 | 12.30 | 12.42 | 12.03 | 10.49 |
比热容/J· (g·K) -1 | 0.231 | 0.247 | 0.245 | 0.234 |
摩尔热容/J (mol·K) | 24.0 | 25.1 | 26.0 | 25.4 |
晶体结构 | 六方密堆 | 面心密堆 | 面心密堆 | 面心密堆 |
《1.1原子量及原子、离子半径》
1.1原子量及原子、离子半径
5d贵金属比对应的4d贵金属原子序数各大32, 亦即原子核中的质子数多32。已知每增加一个质子约需增加两个中子才能维持核的稳定, 因此造成5d贵金属比4d贵金属原子量约大1倍。
从电子结构看出, 5d贵金属都含有14个4f电子, 4f电子对5d电子的屏蔽常数为0.94
《1.2密度、比热容和摩尔热容》
1.2密度、比热容和摩尔热容
由于原子量相差近1倍, 原子半径却近似相同, 加以金属晶体结构属六方密堆 (Ru、Os) 和面心密堆结构, 空间利用率相同, 因此5d贵金属的密度比4d贵金属高1倍。它们是周期表所有元素中密度最大的一些元素, 其中又以Os的密度最大, Os、Ir、Pt因此称重铂族, Ru、Rh、Pd称为轻铂族。
比热容是每克金属温度升高1K所需吸收的热量。温度不太高时这份热量主要是转化为晶格上原子振动的动能。每克4d贵金属含有的原子数几乎为每克5d贵金属中的2倍, 因此4d贵金属的比热容也约为5d贵金属的2倍, 具体倍数为m5d/m4d (m为原子量) 倍。对于摩尔热容量, 它消除了所含原子数的差异, 故对8个元素都非常相近。
《2 呈线性变化的物理量》
2 呈线性变化的物理量
有关物理量列入表2。
Table 2 Linearly varied physical properties of precious metals
《表2》
| 元素 | Ru | Rh | Pd | Ag |
| 熔点/℃ | 2 400 | 1 960 | 1 550 | 960.5 |
| 熔化热/kJ·mol-1 | 25.5 | 21.8 | 16.7 | 11.3 |
| 沸点/℃ | 4 900 | 4 500 | 3 980 | 2 200 |
| 气化热/kJ·mol-1 | 647.4 | 560.9 | 371.9 | 284.6 |
| 维氏硬度 (铸态) /MPa | 1 700~4 500 | 1 390 | 440 | 420 |
| 屈服强度/MPa | 350~400 | 70~100 | 50~70 | 20~25 |
| 抗拉强度 (加工态) /MPa | 5 070 | 1 400 | 420 | 380 |
| 弹性模量 (静态) /MPa | 421 800 | 324 790 | 117 400 | 75 920 |
| 切变模量/MPa | 172 000 | 153 000 | 46 100 | 29 400 |
| 压缩模量/MPa | 292 000 | 280 100 | 190 900 | 101 800 |
| 热膨胀系数/10-6·K 300Κ -1 | 5.8 | 8.5 | 12.48 | 18.9 |
| 熔点/℃ | 2 700 | 2 454 | 1 769 | 1 064.4 |
| 熔化热/kJ·mol-1 | 29.3 | 26.4 | 21.8 | 12.7 |
| 沸点/℃ | 5 500 | 5 300 | 4 590 | 2 880 |
| 气化热/kJ·mol-1 | 783.3 | 662.1 | 563.4 | 368.4 |
| 维氏硬度 (铸态) /MPa | 8 000 | 2 100~ | 630 | 330~35 |
| 屈服强度/MPa | — | 90~105 | 60~80 | 10~25 |
| 抗拉强度 (加工态) /MPa | — | 2 390 | 400 | 230 |
| 弹性模量 (静态) /MPa | 569 430 | 527 250 | 134 340 | 78 740 |
| 切变模量/MPa | 220 000 | 214 000 | 62 200 | 28 200 |
| 压缩模量/MPa | 380 000 | 378 000 | 280 800 | 174 600 |
| 热膨胀系数/10-6·K 300Κ - | 4.16 | 6.45 | 8.99 | 14 |
《2.1熔点和沸点》
2.1熔点和沸点
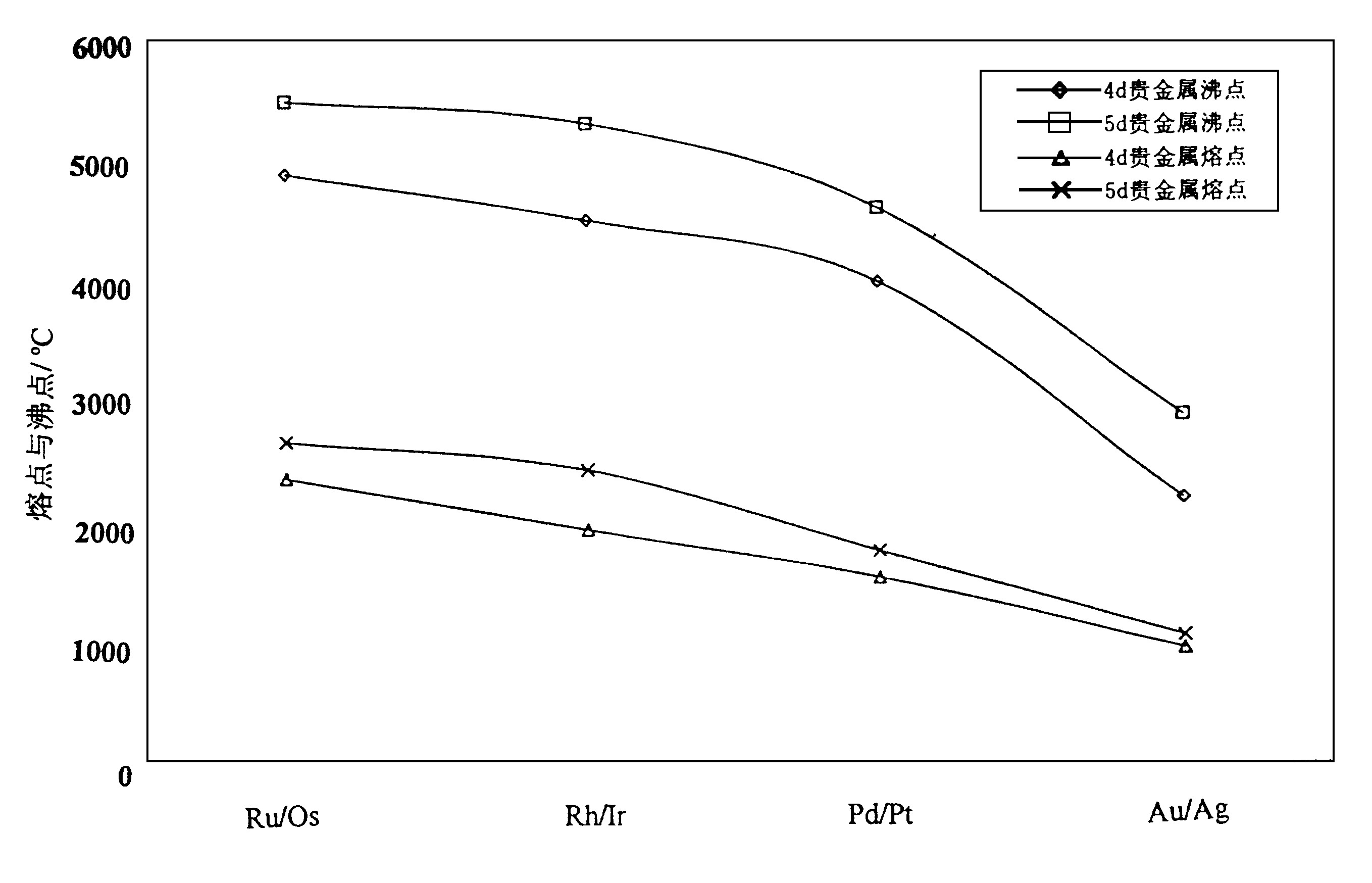
熔点、沸点的变化示如图1。从图1可以看出:
按周期表位置从左到右过渡时, 贵金属熔点、沸点都逐渐降低;柱向考察时, 5d贵金属的熔点、沸点都高于4d贵金属。
用能带理论很难解释表2中各种物理量的变化规律
Pauling从化学的观点提出的金属键理论
Engel和Brewer
1) 金属或合金的键合能取决于每个原子能够键合的未成对电子的平均数, 如果由于增加电子对键所释放的键合能能够补偿激发所需的升级能, 则具有较多未成对电子的低受激电子组态比基态电子组态更为重要。
2) 金属的晶体结构取决于键合中每一个原子的s和p轨函的平均数, 当键合中s、p电子数≤1.5时, 出现体心立方晶型 (bcc) ;1.7~2.1之间时, 出现六方密堆结构 (hcp) ;2.5~3.2范围时, 出现面心密堆结构 (ccp) ;接近于4时, 出现非金属的金刚石结构。以Na、Mg、A1为例, Na以1个3s电子成键, 此键分散在8个最近邻原子和六个次近邻原子中, 形成体心立方晶型。Mg的基态外电子结构为3s2, 先升级为低受激态3s3p, 每克原子需要264 kJ的升级能, 而两个未配对的3s、3p电子成键时, 每克原子可获得410 kJ的成键能, 两个电子对键分散在12个近邻和更远的次近邻原子中, 形成六方密堆结构。A1则需要用348 kJ/克原子的能量从基态3s23p升级到3s3p2, 以便增加成键电子数, 形成3个电子对键, 分散在12个近邻和更远的近邻原子中, 形成面心密堆结构。
Engel和Brewer没有象Pauling那样把6个铂族金属的金属价视为与Fe、Co、Ni一致。Brewer指出, 从升华热的变化和磁性来看, Fe、Co、Ni在成键时没有使用全部未配对的d电子, 而铂族元素的行为则相反。Brewer还指出, d电子对成键的贡献随元素原子序数的增大而增大。用以解释第6周期过渡元素的熔点和沸点高于第5周期过渡元素。但他给出的贵金属的成键电子数, 系按dn-1.7sp0.7组态 (n为外电子层电子总数) 计算Ru、Rh、Pd;用dn-2sp组态计算Os、Ir、Pt, 用d9.3sp0.7组态计算Cu、Ag、Au, 显然带有太大的随意性, 而且dn-1.7sp0.7组态属六方密堆晶型, 与 Rh、Pd为面心密堆结构不符, dn-2sp组态属六方密堆结构又与Pt、Ir为面心密堆结构不符。他的全部数据还过于偏低, 与Jolly
笔者认为, VIIB族的Tc (4d65s1) 和Re (5d56s2) 只需把1个d电子或s电子激发入p轨道, 即可形成未配对电子数为7的低受激态, 因此向右过渡可假定Ⅷ族3个元素激发进p轨道的电子数大于1, 并呈分数逐渐增多 (见表3) ;笔者给出的未配对电子数与Pauling值和Brewer值列入表4。
Table 3 Excited variation prior to bonding of part of the 4 d transition elements
《表3》
| 元素 | 基态电子结构 | 升级到p轨道电子数 | 低受激态 | 未配对d电子数 | 未配对sp电子数 | 晶型* | 未配对电子总数 | 熔点/℃ |
Mo | 4d55s1 | 0 | 4d55s1 | 5 | 1 | Ⅰ | 6 | 2610 |
Tc | 4d55s2 | 1 | 4d55s15p1 | 5 | 2 | Ⅱ | 7 | — |
Ru | 4d75s1 | 1.2 | 4d5.85s15p1.2 | 4.2 | 2.2 | Ⅱ | 6.4 | 2400 |
Rh | 4d85s1 | 1.5 | 4d6.55s15p1.5 | 3.5 | 2.5 | Ⅲ | 6 | 1960 |
Pd | 4d10 | 1.8** | 4d7.25s15p1.8 | 2.8 | 2.8 | Ⅲ | 5.6 | 1550 |
Ag | 4d105s1 | 2 | 4d85s15p2 | 2 | 3 | Ⅲ | 5 | 961 |
Cd | 4d105s2 | 1 | 4d105s15p1 | 0 | 2 | Ⅱ | 2 | 321 |
* 晶型Ⅰ为bcc, Ⅱ为hcp, Ⅲ为ccp;** Pd原子的基态电子结构为不规则排列, 还有一个d电子升级到s轨道
表4 Pauling, Brewer及笔者给出的未配对电子数
Table 4 Number of unpaired electrons identified by Pauling, Brewer and the auther
《表4》
元素 | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | |
晶体结构 | Ⅰ | Ⅰ | Ⅱ | Ⅱ | Ⅲ | Ⅲ | Ⅲ | Ⅱ | |
Pauling值 | 5 | 6 | 6 | 6 | 6 | 6 | 5.56 | 4.56 | |
Brewer值 | 5 | 6 | 7 | 5.4 | 4.5 | 3.4 | 2.4 | 2 | |
笔者值 | 5 | 6 | 7 | 6.4 | 6 | 5.6 | 5 | 2 | |
元素 | Ta | W | Re | Os | Ir | Pt | Au | Hg | |
晶体结构 | Ⅰ | Ⅰ | Ⅱ | Ⅱ | Ⅲ | Ⅲ | Ⅲ | ||
Pauling值 | 5 | 6 | 6 | 6 | 6 | 6 | 5.56 | 4.56 | |
Brewer值 | 5 | 6 | 7 | 6 | 5 | 4 | 2.4 | 2 | |
笔者值 | 5 | 6 | 7 | 6.4 | 6 | 5.6 | 5 | 2 |
对表3 、4讨论如下:
1) Mo成键时可直接用基态电子结构, 不需提供升级能。因此, 它的未配对电子总数虽不是最高, 但其熔点和沸点却是最高。
2) Mo在sp层中的未配对电子数仅为1个s电子, 晶型为bcc;Tc、Ru、Cd的sp电子数在1.75~2.25范围, 晶型为hcp;Rh、Pd、Ag的sp电子数在2.5~3.2范围, 晶型ccp, 完全符合Engel-Brewer第2规则。
3) 从Ru、Rh、Pd到Ag, 未配对的成键电子总数为6.4、6、5.6到5, 逐步减少, 因而熔点和沸点也呈线性逐渐下降。
4) 当过渡到Cd时, 由于全充满的4d层已明显收缩, d电子能量太低, 不可能再激发进5p轨道, 仅1个5s电子激发到5p轨道, 未配对电子总数下降到2, 其熔点也降到321℃。
5) 过渡金属从左向右过渡时, d轨道逐渐收缩, 能量逐渐下降, 因此其d电子升级到p轨道所需的激发能将逐渐增加, 此因素也引起键合能的降低, 本文在定性讨论中暂不考虑。
对于第3过渡系元素5d电子的成键力高于第2过渡系元素4d电子的原因, 可用4f电子对5d电子屏蔽不良解释
《2.2维氏硬度、抗拉强度、弹性模量及热膨胀系数的变化》
2.2维氏硬度、抗拉强度、弹性模量及热膨胀系数的变化
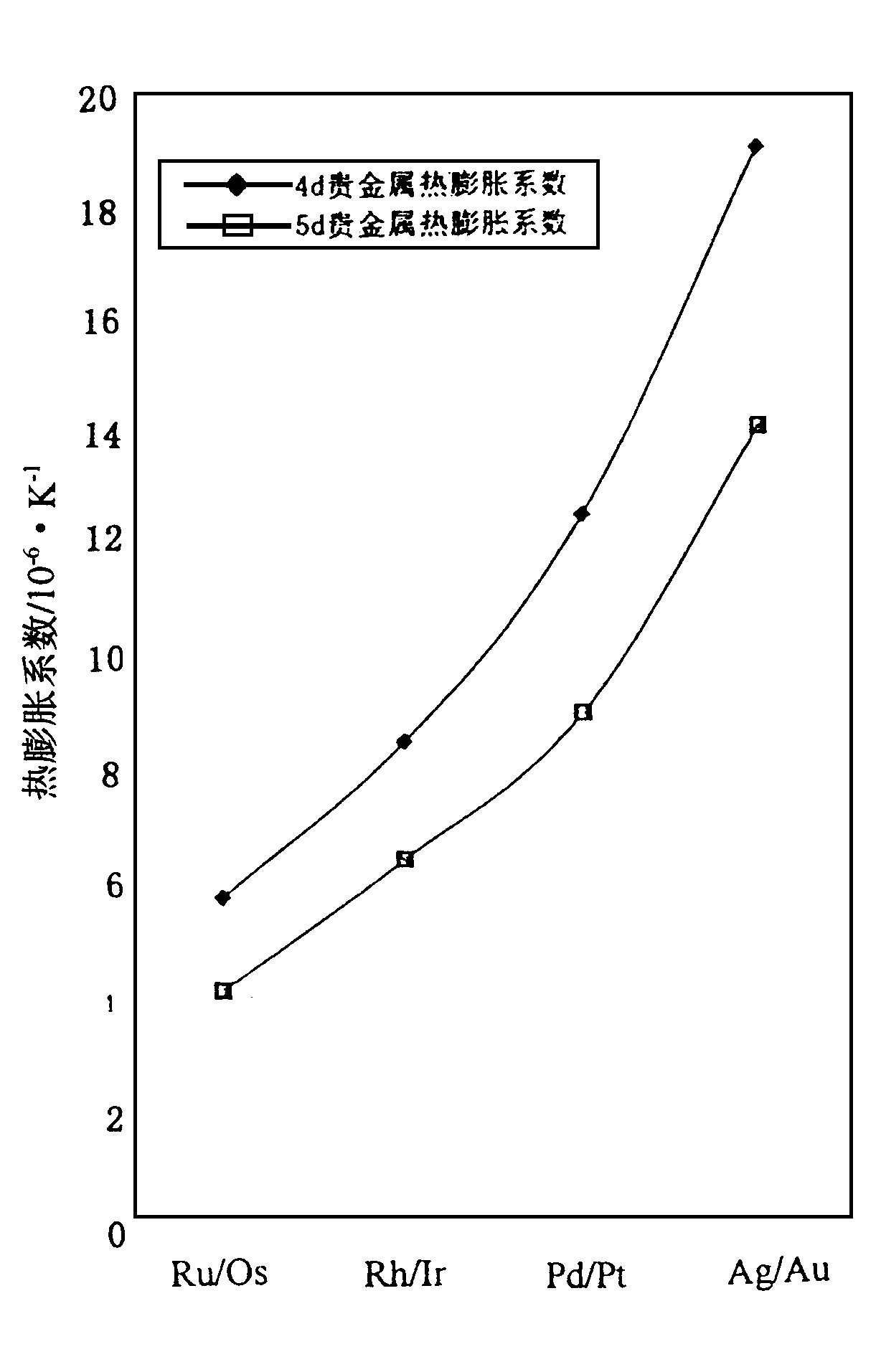
示如图2~4。图2、图3表明, 维氏硬度、抗拉强度和弹性模量的变化趋势与熔点、沸点的变化一致, 均为从左到右数值降低;从上到下数值升高。这是因为熔点高表明原子间的结合力大, 晶胞界面不易滑移, 晶格结构不易破坏, 因此硬度、抗拉强度和弹性模量都随之增大。图4热膨胀系数则因原子间结合力大时体积变化受到限制, 因此变化趋势相反。
贵金属中锇不能加工, 钌、铑、铱难加工, 铂钯有很好的延展性, 金银有最好的延展性, 都可用上述观点解释。
《3 非线性变化的物理量》
3 非线性变化的物理量
热导率和电导率的数据列入表5, 273K时的数据绘入图5。
从表5图5可知:
除Pd和Pt的热导率随温度变化不大外, 其余贵金属的热导率和电导率均随温度升高而逐渐降低, 其中电导率的降低程度更明显。这种现象可归因于温度升高时, 晶格原子的振幅加大, 电子的运动和动能的传递逐渐受阻。
横向过渡时, 从Rh、Os到Rh、Ir两种数据均略有增加;从Rh、Ir到Pd、Pt两种数据明显下降;从Pd、Pt到Ag、Au则两种数据大幅度增加。再往右到ⅡB族的Cd和Hg时, 电导率又大幅度下降。这种不规则的变化原因可能相当复杂。
Table 5 Heat conductivity and electric conductivity of precious metals
《表5》
T/K | 热导率/W· (m·K) -1 | 电导率/108· (Ω·m) -1 | |||||||
Ru* | Rh | Pd | Ag | Ru | Rh | Pd | Ag | ||
273 300 400 600 800 | 119 117 115 105 96 | 153 152 145 135 126 | 75.1 75.2 75.5 79.0 83.0 | 435 433 426 411 397 | 0.149 0.132 0.097 0.062 0.045 | 0.241 0.199 0.141 0.086 0.062 | 0.102 0.092 0.069 0.047 0.037 | 0.689 0.616 0.432 0.279 0.205 | |
| Os* | Ir | Pt | Au | Os | Ir | Pt | Au | ||
273 | 88 | 148 | 75.0 | 318 | 0.122 | 0.209 | 0.102 | 0.485 | |
300 | 87 | 147 | 74.1 | 315 | 0.094 | 0.188 | 0.092 | 0.444 | |
400 | 86 | 141 | 73.2 | 309 | 0.065 | 0.135 | 0.068 | 0.322 | |
600 | 85 | 136 | 73.0 | 296 | 0.044 | 0.089 | 0.045 | 0.206 | |
800 | - | 130 | 74.8 | 284 | 0.033 | 0.065 | 0.034 | 0.148 | |
* Ru, Os的热导率各向异性, 有垂直于C轴、平行于C轴及多晶三种数据, 表中为多晶的热导率数据
Engel理论认为, d电子能级低, 距核近, 它在短空间范围成键是定域性的键, 对金属的稳定性起决定性作用, 对金属的结构影响不大;s、p电子起着远程成键的作用, 特别是p电子方向性很强, 金属的结构主要决定于s、p电子总数。s、p电子可以离域, 形成电子气, 相当于处在能带理论中的导带。莫特 (Mott) 认为铂族金属具有较高的电阻率是因为铂族金属的d层电子不仅不参加电导, 而且对传导电子产生散射作用, 称为d-s散射
按照Engel-Brewer理论和Mott的观点, 笔者认为Ag和Au有最好的导电性可能缘于它们的s、p电子有最适宜的运动空间。与左边的Pd、Pt相比, Ag、Au的d轨道更趋收缩, 但它们在金属中的原子半径却因d到p轨道所需激发能的升高和成键电子总数的降低 (见表4) 而明显增大, 从而造成s、p电子的运动空间增大;与右边元素Cd、Hg相比, 后二者因成键电子数只有2而使原子体积过大, s、p轨道不能充分交迭, 削弱了s、p电子在金属中的共有化程度, 因而电阻增大。当然这种解释只能作为提供讨论。
纵向考察时看出, Ag的导热性和导电性明显优于Au, 两者差异较大;Pd只略优于Pt, 两种数据十分相近;Ru、Rh与Os、Ir相比, 前者也优于后者。4d贵金属与5d贵金属的这种差异可以像解释熔、沸点差异那样, 用有效核电荷增加或用“相对论性效应”使6s电子轨道收缩, 能量降低, 成键力增大, 定域性增大来解释。但Pd与Pt数据接近的原因还需进一步研究。
贵金属导电率和导热率的变化虽不呈线性, 但两者数据的涨落同步, 曲线十分类似, 表明金属导电和导热的微观机制是相同的。
《4 结语》
4 结语
4d贵金属与5d贵金属的原子量、密度、比热接近倍比关系, 原子半径、离子半径和摩尔热容则接近相等。
熔点、熔化热、沸点、气化热及力学性质的维氏硬度、屈服强度、抗拉强度、弹性模量、切变模量、压缩模量等物理量呈线性变化。从左到右过渡时, 这些物理量的数值降低, 从上到下过渡时增高。
热导率和电导率从左到右呈不规则变化, 但两种数据的涨落相同, 表明金属导热和导电的微观机制相似。还可看出原子体积的变化对两种数据有明显影响。
以金属结构理论中的价键理论为基础, 定性地讨论贵金属物理性质与原子结构的关系。指出了按Pauling的金属价概念和Engel-Brewer规则难于同时解释贵金属的熔、沸点变化及晶型结构变化。笔者提出4d、5d贵金属原子成键时, 从基态电子结构中的d轨道升级到低受激态的p轨道的电子数呈分数变化的假说, 所得结果可满意地解释晶型、熔点、沸点及力学性质等物理量的变化。
用价键理论较难解释贵金属导热、导电性的变化规律。本文只提出了一种可供讨论的意见。对这种变化规律的研究将有助于对金属导热、导电微观机制的更深入了解, 丰富和发展金属结构理论。

















 京公网安备 11010502051620号
京公网安备 11010502051620号




