近年来, 具有高比容量、长循环寿命、高倍率充放电性能和良好安全性的二次电池的发展引起了国内外有关研究者的广泛关注和重视。高性能电池决定于很多因素, 其中之一是影响电池能量密度的具有高密度的电极活性材料。目前, 高性能球形正极材料的研究引起了人们的普遍关注, 已经成为具有高能量密度的先进二次电池的最有前景的材料之一
通常, 不规则形状的粉体粒子混合时有严重的团聚和粒子桥架现象, 从而导致粒子间产生很大的空隙, 粉体流散性较差。当不规则形状的颗粒填充一特定体积的容器时, 会产生较多的空隙。相反, 当球形材料的颗粒填充同样体积的容器时, 粒子间接触面小, 产生的空隙较少, 因而, 具有较高的振实密度和很好的流散性
表面改性已经成为进一步改善正极材料性能的最有效的方法之一。而球形颗粒表面的改性也比非球形颗粒更为有效, 容易得到表面涂覆层均匀、稳定、致密和牢固的产品。并且, 球形粉体良好的分散性、流动性对于高性能电池电极片的制备是非常有益的。总之, 高密度球形正极材料的研究非常有意义并具有广泛应用前景。
《1 结晶成核过程热力学》
1 结晶成核过程热力学
处于过冷状态的液体或熔体, 由于热运动引起组成和结构上的种种起伏, 起伏形成以后, 部分粒子从高的自由焓转变为低的自由焓而形成新相, 造成系统体积自由焓ΔGv的减少。同时, 新生相和液相之间形成新的界面, 就需要做功, 造成系统界面自由焓ΔGs的增加。因此对整个系统而言, 自由焓的变化应为这两项之代数和ΔGr=ΔGv+ΔGs。当起伏小, 形成颗粒太小时, 界面面积对体积的比例大, 系统的自由焓增加, 新生相的饱和蒸气压和溶解度都大, 会蒸发或溶解而消失于母相。这种较小的不能稳定长大成新相的微核称为核胚。而随着起伏的增大, 界面对体积的比例就减小。当起伏达一定大小 (临界值) 时, 系统自由焓由正值变为负值, 这一部分起伏就有可能稳定成长出新相。这种可能稳定成长的新相称为晶核。
核化可分为均态核化 (均相成核) 和非均态核化 (非均相成核) 。均态核化在均匀介质中进行, 在整体介质中的核化可能性相同。非均态核化在异相界面发生, 如容器壁、气泡界面或附于外加物 (杂质或晶核剂) 处
《1.1均相成核热力学》
1.1均相成核热力学
对于均相成核, 从液相中形成晶核, 不仅包含了一种液固相的转变, 而且还需要形成液—固界面。假定在恒温恒压下, 从过冷液体形成的新相呈球形, 不考虑应变能时, 自由焓的变化可以写为:
式中:r为球形核胚新相区的半径;γl, s为液—固界面能 (假定没有方向性) ;ΔGr为液—固相变时, 除去界面能时单位体积自由焓的变化。
式中右边第一项代表形成液—固界面需要的能量, 始终为正值。第二项表示液—固相转变是自由焓的变化, 在液相温度以下是负值, 核胚越大, 自由焓减少越多。
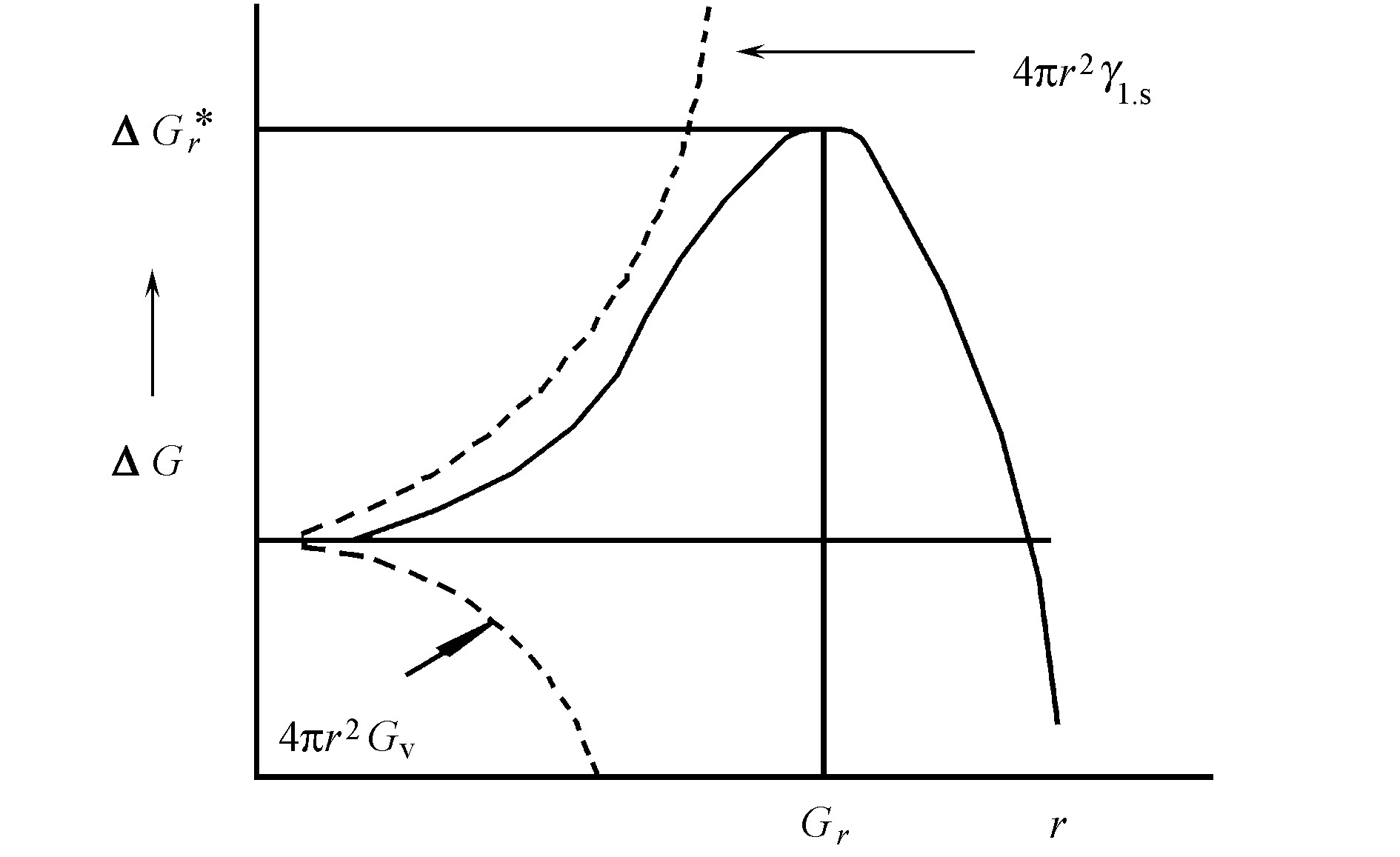
这两项与新相颗粒半径的关系曲线在图1中用虚线表示。图中实线表示系统自由焓的总变化。从图1可见, 对颗粒很小的新相区来说, 颗粒表面积对体积的比率大, 第一项占优势, 形成新相所需自由焓随着这些小颗粒的增大而增加, 总的自由焓变化是正值。对颗粒较大的新相区, 第二项占优势, 总的自由焓变化是负的, 这就存在一个临界半径r*。这个临界半径是将自由焓的变化对r微分, 并使其等于零来决定的。
这就是说, 颗粒半径比r*小的胚核是不稳定的, 因为它的尺寸减小时, 自由焓降低, 称为亚临界核胚。只有颗粒半径大于r*的超临界晶核才是稳定的, 因为晶核长大时, 自由焓减小。
由图1可知, 形成临界晶核时, 系统自由焓变化在过程中要经历极大值, 将式 (3) 代入式 (1) 求得:
《1.2非均相成核热力学分析》
1.2非均相成核热力学分析
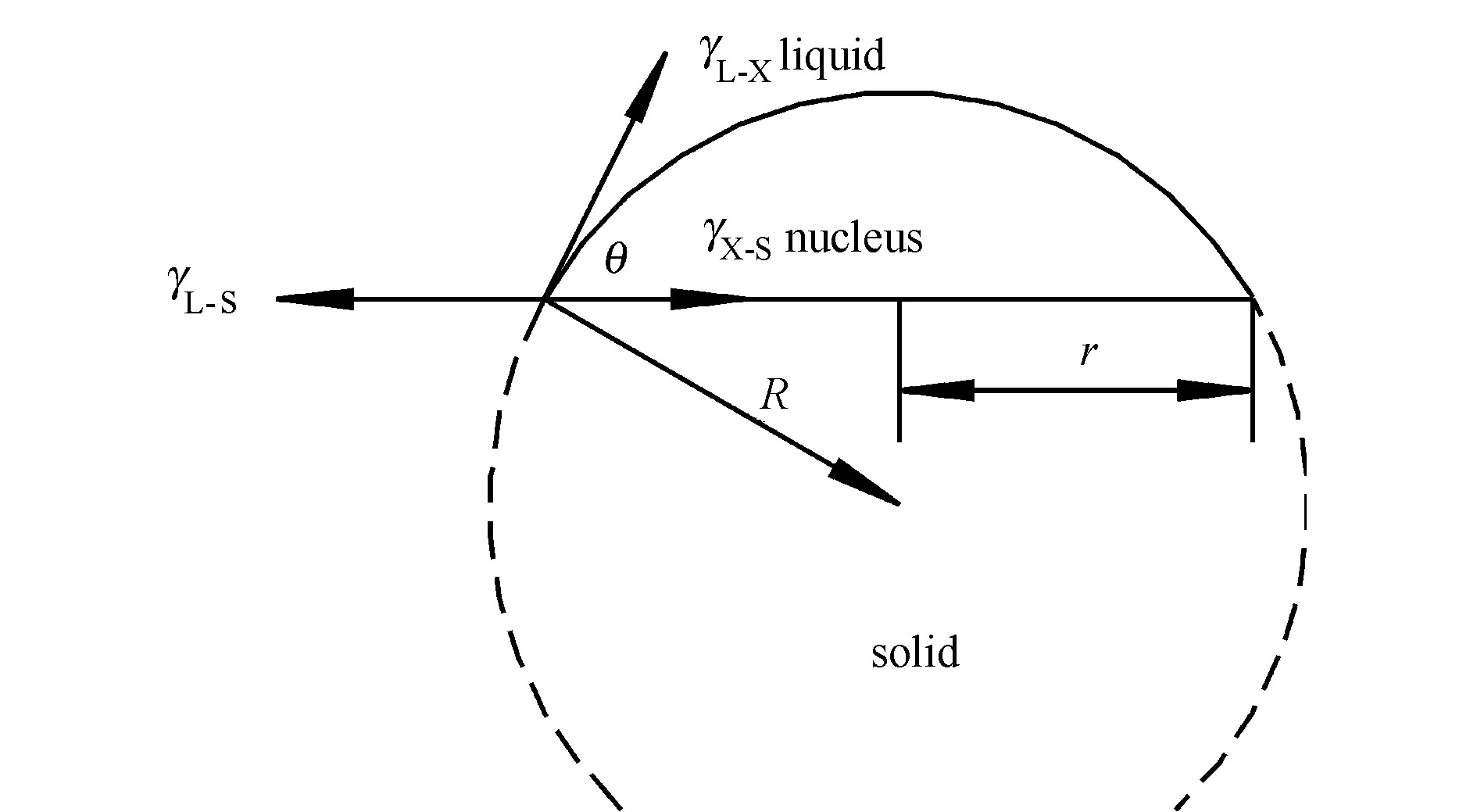
多数相变是非均态核化, 即核化在异相的容器表面、异体物质 (杂质颗粒) 上和内部气泡等处进行。如图2所示, 核是在和液体相接触的固体界面上形成的。这种促进核化的固体界面是通过表面能的作用使核化的势垒减少的。假设核的形状为球体的一部分, 其曲率半径为R, 核在固体界面上的半径为r, 液体—核 (L—X) 、核—固体 (X—S) 和液体—固体 (L—S) 的各界面能为γL—X, γX—S和γL—S, 液体—核界面的面积为AL—X, 形成这新界面的自由焓变化是:
当形成新界面L—X和X—S时, 液固界面 (L—S) 减少了πr2。假如γL—S>γX—S, 则ΔGS小于γL—XAL—X, 说明在固体上形成晶核所需的总表面能小于均匀成核所需要的能量。
接触角θ和界面的关系为:
式 (6) 代入式 (5) 得到:
晶核的体积是:
晶核的表面积是:
对非均态晶体形成时:
将式 (8) 、 (9) 代入求
同样可以求出非均态核化的核化势垒:
设
将式 (11) 与均态核化式 (4) 比较, 只是非均态核化是附上一个系数f (θ) 。当接触角θ=0 (指在有液相存在时, 固体被晶体完全润湿) , cosθ=1, f (θ) =0, ΔG*h=0, 不存在核化势垒。当θ=90°, cosθ=0, 核化势垒降低一半。当θ=180°, 不润湿, cosθ=-1, 式 (11) 为式 (4) 。
可见接触角越小的非均态核化剂, 越有利于核的生成。也就是说当晶核和核化剂有相似的原子排列时, 穿过界面有强烈的吸引力, 这将提供核化最有利条件。
《1.3相变过程的不平衡状态及亚稳区 [12]》
1.3相变过程的不平衡状态及亚稳区 [12]
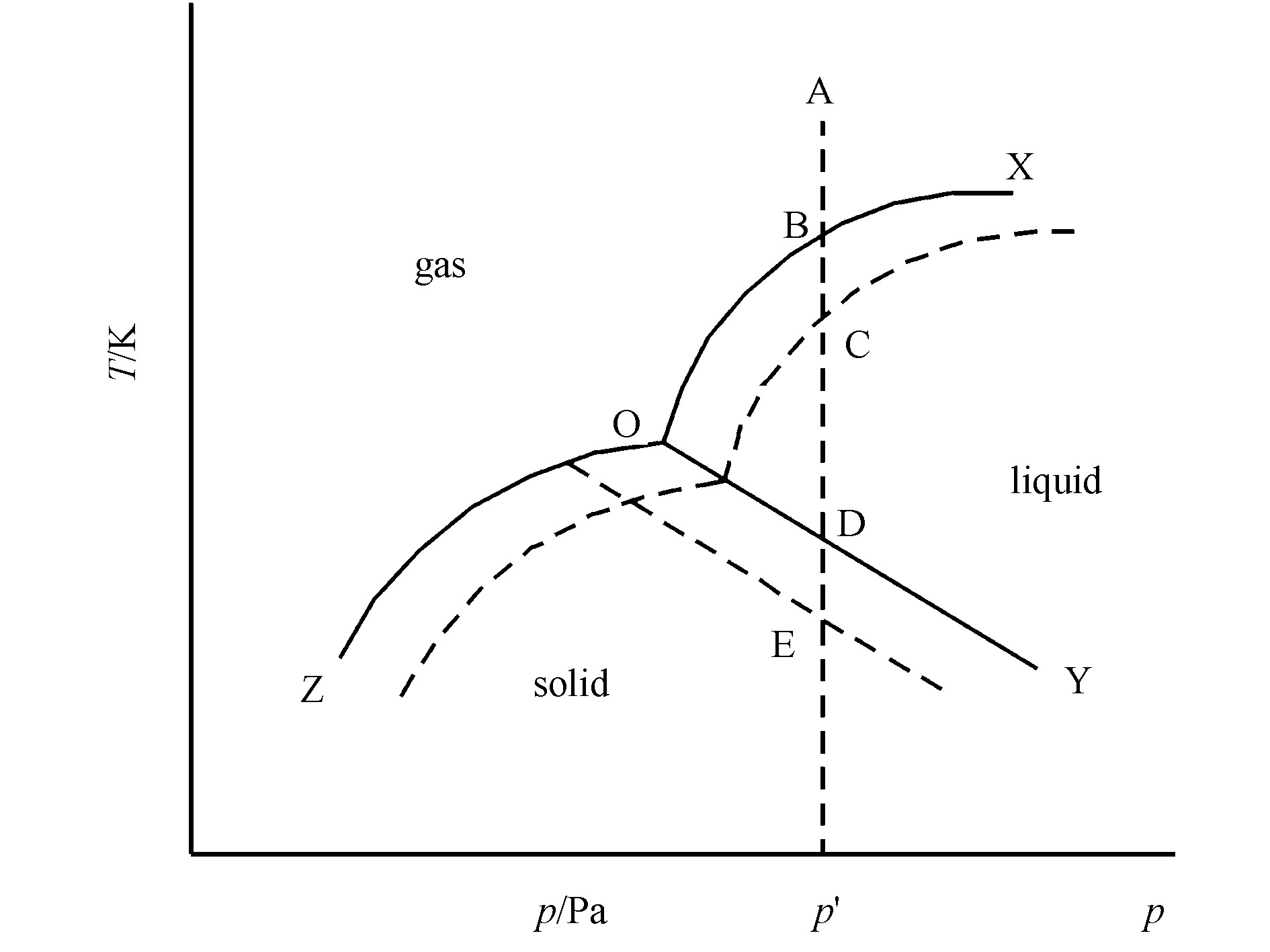
从相平衡的观点来看, 只要将物体冷却 (或者加热) 到相转变温度, 则会发生相转变而形成新相, 从图3的单元系统T-P相图中可以看到, OX线为气-液相平衡线 (界线) ;OY线为液-固相平衡线;OZ线为气-固相平衡线。当处于A状态的气相在恒压 (P') 下冷却到B点时, 达到气-液平衡温度, 开始出现液相, 直到全部气相转变为液相为止, 然后离开B点进入BD段的液相区。继续冷却到D点达到了液-固平衡温度, 开始出现固相, 直到全部转变为固相为止。然后离开D点进入DP'段的固相区。但事实上当冷却到其相变温度时, 并不会自发发生相转变, 也不会产生新相, 而要冷却到比相变温度更低的某一温度才能发生相转变。例如处于A状态的气相冷却到B时, 并不凝结出液相, 而要冷却到比B的温度低ΔTb的C点时, 才凝结出液相。同时, 理论上当冷却到D点时应析出固相, 但这时也并不自发析出, 而要达到比结晶温度低ΔTm的E点时, 才能析出晶相。这种在理论上应发生相转变而实际上不能发生相转变的区域, 称为亚稳区。在亚稳区内, 旧相能以亚稳状态存在, 而新相还不能生成。这是由于当一个新相形成时, 它是以一微小液滴或微小晶粒出现。由于颗粒很小, 因此其饱和蒸气压和溶解度都远高于平面状态的蒸气压和溶解度。在相平衡温度下, 这些微粒还未达到饱和而重新蒸发和溶解。
由此可见, 亚稳区具有不平衡的特征, 在亚稳区内, 物系不能自发产生新相, 要产生新相, 必然要越过亚稳区。在亚稳区内, 虽然不能自发形成新相, 但是当有外来的杂质存在下, 或者在外界的能量影响下, 也有可能在亚稳区内形成新相。
相变过程的推动力是过程前后自由焓的差值
从热力学知道, 在恒温可逆不作有用功时, dG=Vdp。对理想气体来说
当过饱和蒸气压力为p的气相凝聚成液相或固相 (其平衡蒸气压为pe) 时, 有:
要使相变自动进行, 须ΔG<0, 即p>pe, 也就是说气相要有过饱和蒸气压, 才能使得凝聚自发进行, 即与饱和蒸气压的蒸气压力差为过程推动力。
在液→固相变过程中, 过饱和浓度为相变过程的推动力, 同浓度C代替压力p, 则 (15) 式可以写成:
其中:Ce—饱和溶液浓度;C—过饱和溶液浓度。
对于难溶金属氢氧化物M (OH) n, 其饱和溶液浓度Ce=KSP/[OH]n, 并且Ce值可以通过OH-粒子浓度来改变。即浓度为饱和的溶液, 可以通过增大溶液的pH, 使其变为过饱和溶液。设初始饱和溶液pH值为pHi, 变为过饱和溶液的pH值为pHe, 则有:
对于具有相同核化势垒的均相成核和非均相成核, 设溶液的pH值分别由pHi增大为pHer和pHeh时, 可以分别通过均相成核与非均相成核形成新相, 即:
由于f (θ) 为<1的系数, 故通过非均相成核比均相成核形成新相所需过饱和浓度要小。说明可以通过控制溶液的pH值来控制球形颗粒的继续长大, 而不是生成新的颗粒。
《2 控制结晶设备与工艺》
2 控制结晶设备与工艺
笔者以球形Ni (OH) 2的制备来说明控制结晶工艺制备球形材料的设备与工艺过程。
典型的制备球形颗粒的控制结晶工艺是球形Ni (OH) 2制备工艺
为了获得密度较高的球形或类球形颗粒Ni (OH) 2产品, 就必须对Ni (OH) 2结晶过程进行有效控制。我们称为“控制结晶法"。其特点就是严格控制母液的酸度, 通过加入络合剂控制Ni2+离子的活度, 采用合适的搅拌强度和反应温度等综合控制整个结晶过程。最终实现对晶体的成核速度和长大速度的有效控制。从母液中连续分离出的Ni (OH) 2粒子在经过晶核形成、晶粒长大、团聚、融合等一系列过程后转变成高密度球形微米级产品。
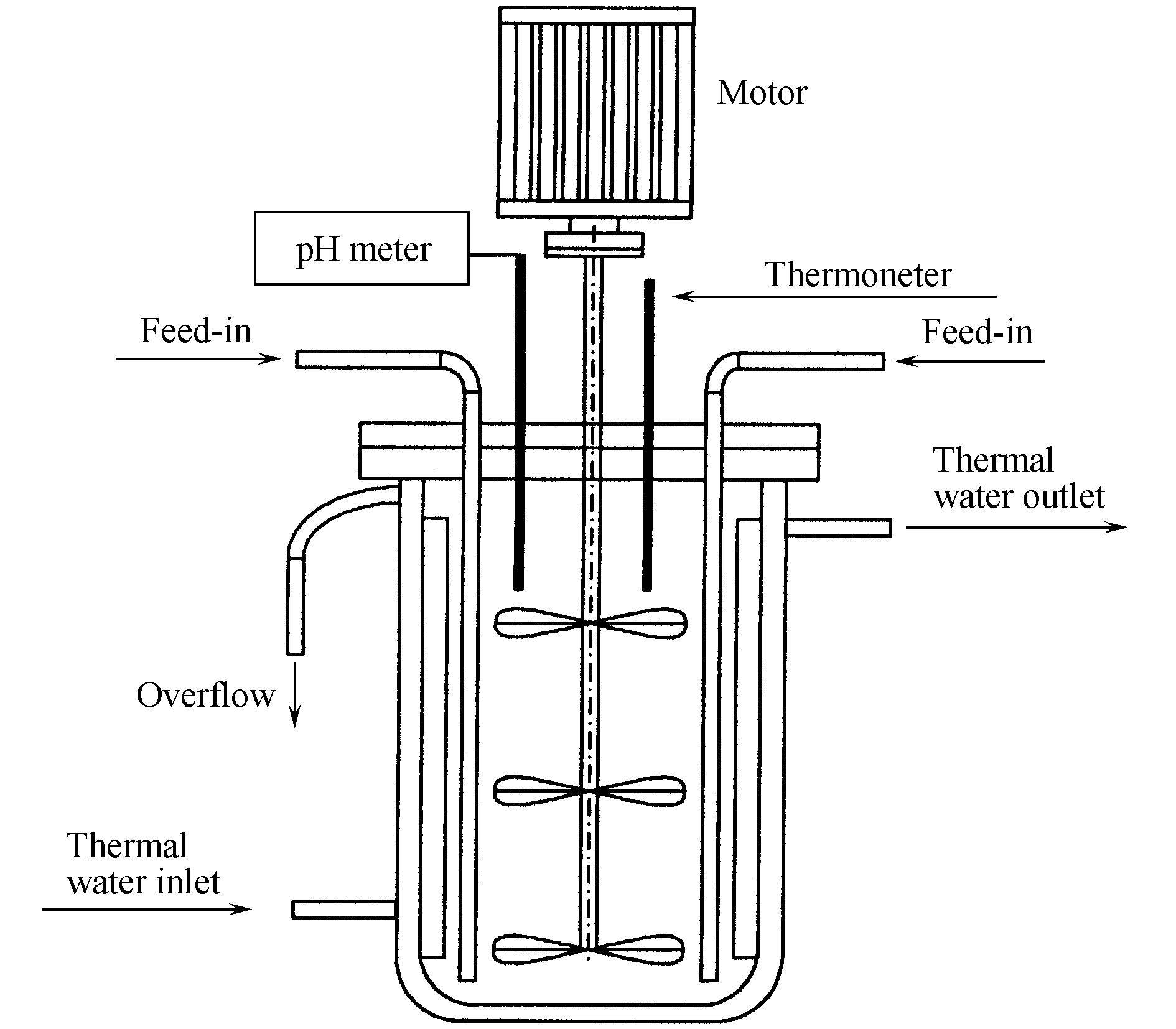
用于控制结晶法过程的主反应器是自行设计制备的, 如图4所示
高密度球形Ni (OH) 2的制备工艺对于其他球形正极材料的制备来说具有典型意义
其次, 反应器搅拌能量输入对产品性能也有较大影响, 是控制结晶法制备球形Ni (OH) 2的另一个重要控制因素。搅拌能量输入定义为:Q= (P-P0) t/V= (P-P0) /r。其中:Q是搅拌能量输入 (W·h/L) ;P是电机操作功率 (W) ;P0电机空载功率 (W) ;t是反应的平均停留时间 (h) ;V是反应器中母液的体积 (L) ;r是溶液的总流速 (L/h) 。
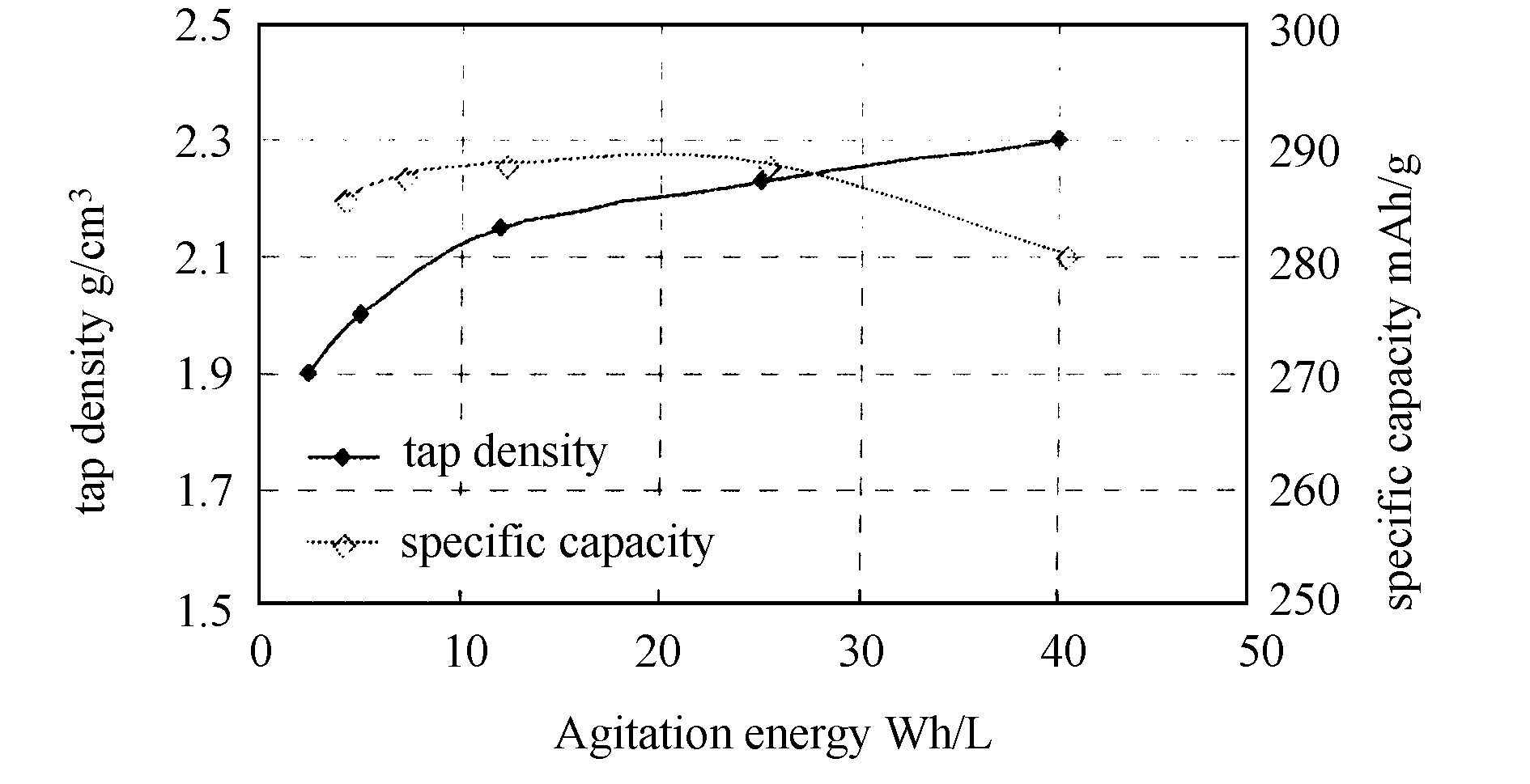
搅拌能量对振实密度和比容量的影响如图6所示。从图中可看出, 搅拌能量越高, 振实密度越高。比容量随搅拌能量的变化也有一个峰值, 当搅拌能量超过一定值时, 比容量反而下降。因此, 搅拌能量也应该优化到一个合适的值。另外, 溶液浓度、母液的反应温度、Ni2+离子混合络合剂的选择等也是制备具有优良性能的高密度球形Ni (OH) 2的重要因素。
溶液浓度、络合剂、进料速率、搅拌强度、反应温度以及母液反应的pH值等是控制结晶法工艺优化产品性能的主要因素。
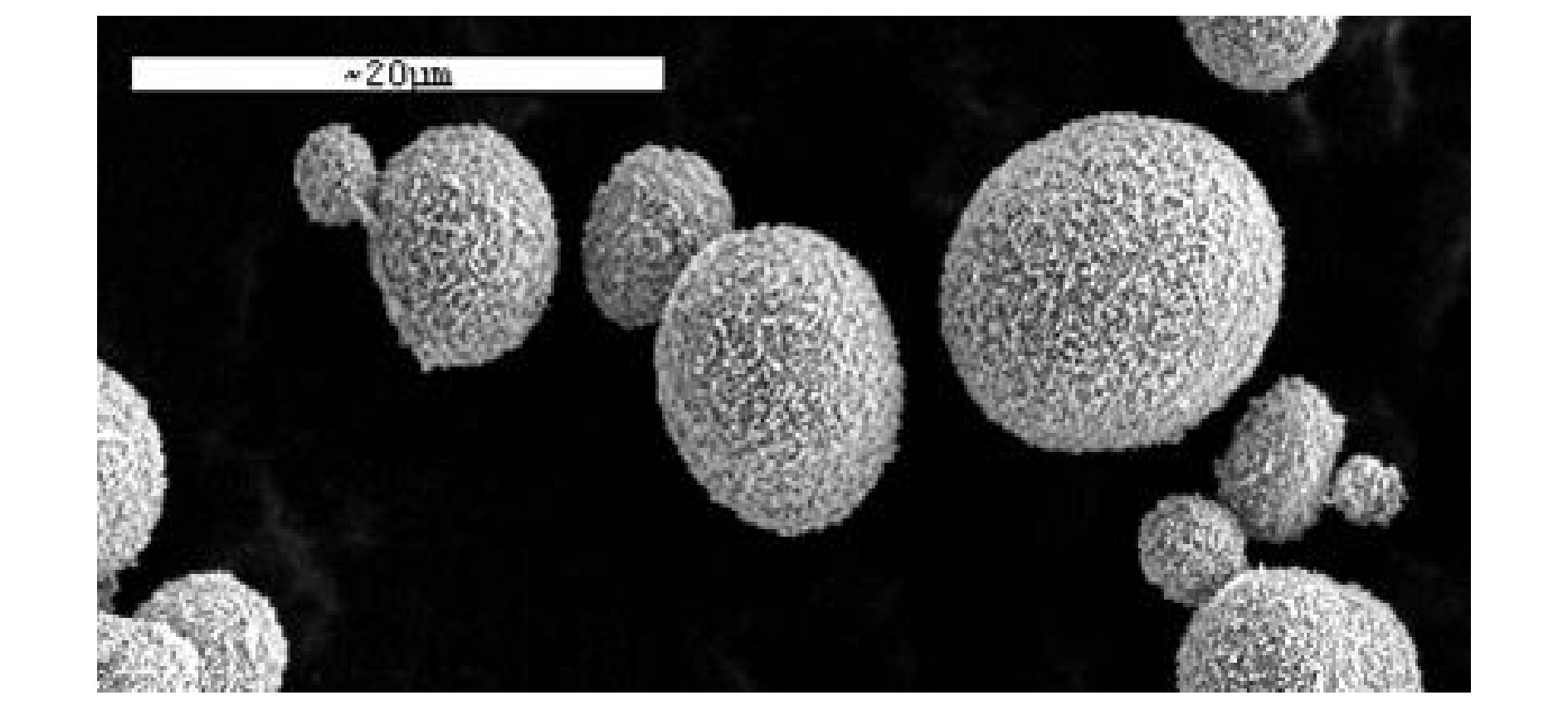
利用控制结晶法优化工艺制备的Ni (OH) 2产品, 其振实密度高达2.3 g/cm3, 比容量超过289 mAh/g。所制备粒子的形貌如图7所示, 可以看出粒子是球形的, 且分布均匀, 流散性良好。
电极材料的改性方法之一是掺杂元素。控制结晶工艺的掺杂过程较为简单, 只要在结晶过程中加入含掺杂元素的盐, 使之与主元素一起共沉淀, 就能完成掺杂过程, 有时需要用络合剂来调节共沉淀过程。例如, Ni (OH) 2掺杂锌的控制结晶法制备过程如下
电极材料改性的另一方法是颗粒表面包覆。球形Ni (OH) 2的表面包覆工艺如下
《3 其他球形高密度电池材料的制备》
3 其他球形高密度电池材料的制备
LiCoO2的制备可以通过Co (OH) 2前驱体与锂盐高温固相反应来实现
由于钴的成本高, 以镍取代部分钴可以节约成本。用共沉淀的方法, 利用控制结晶工艺, 首先制备镍钴共沉淀的球形Ni0.8Co0.2 (OH) 2前驱体, 将得到的球形Ni0.8Co0.2 (OH) 2粉体与LiOH·H2O混合均匀, 在氧气气氛中烧结可得到球形LiNi0.8Co0.2O2粉体
尖晶石LiMn2O4也可以通过控制结晶工艺制备出球形颗粒
《4 结语》
4 结语
采用控制结晶法制备的球形Ni (OH) 2, LiCoO2, LiCo0.2Ni0.8O2和LiMn2O4等材料及它们的改性产品均具有高密度、良好的电化学性能等特点。控制结晶法制备球形高密度电池正极材料具有许多优点:制备过程温度较低, 烧结时间短, 易于材料进一步改性, 成本较低, 所制备的产品具有良好的分散性和流动性。控制结晶工艺是制备先进二次电池高性能正极材料非常有效和具有广泛应用前景的制备方法。















 京公网安备 11010502051620号
京公网安备 11010502051620号




