《1 前言》
1 前言
可游动微纳米机器人,由于其体积小和可游动性,在不同领域中有较大应用前景。在生物和医学领域,它们可用于微创于术、细胞操作和分析以及靶向治疗[1]。在环境领域,它们可用于污染治理和毒性检测,特别是在对人类有危险或者空间太小而人类无法进入的环境下[2] 。在微流体领域,它们可用在微流控芯片系统中对微小物体和化学物质进行操纵及运输 [3] 。
《1.1 在低雷诺数流体中游动》
1.1 在低雷诺数流体中游动
当机器人的尺寸下降到微米( 10-6 m)或纳米级(10-9 m)时,机器人的惯性力小得可忽略不计,液体的阻力起主导作用。微纳米机器人须采用与大型机器人不同的驱动方法才能在液体中推进。在流体力学中,通常采用雷诺数(Re) 来表征流体的流动状态。雷诺数是一个无量纲数。当物体在流体中运动时,雷诺数定义为物体所受的惯性力和站滞力的比值(见式( 1 ) ) 。
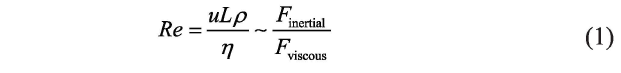
式( 1)中, u 和L 分别是物体的运动速度和特征长度; p 和 η 分别是流体的密度和黏度。
当雷诺数低时,要么液体新性很高,要么物体移动速度很慢,要么物体尺寸很小 [4]。可游动微纳米机器人和大多数微生物一样在雷诺数低于10-4 环境中游动。在低雷诺数环境下,流体流动可认为是可逆的。因此,往复运动,比如简单的来回摆动,几乎产生不了净位移。1977 年, Purcell 在《Life at low Reynolds number 》中指出,在低雷诺数环境中,物体须采用非往复运动来产生净位移,并提出了他的“scallop theorem" [5] 。下面采用理论上的三链结构机器人来帮助理解这个定理(图1 )。结构中的两个链接点提供了两个自由度( DOF ),这使机器人可进行一系列的构型运动。图1(a)中,机器人经过一轮ABCDA 的构型非往复运动后产生了净位移。而图1(b)中,构型ABCBA 是往复运动,一轮运动后不会产生净位移 [3]。Purcell 的“scallop theorem”揭示了设计微纳米游动机器人的基本要求:游动机器人须采用非往复运动以产生净位移。
《图1》
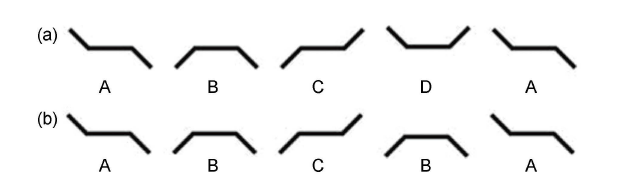
图1. Purcell 提出的带两个链接点的游动机器人。(a)游动机器人进行一轮ABCDA 的构型运动后产生了净位移,(b)构型ABCBA 是往复运动,一轮运动后不会产生净位移。转载自 [3]。
《1.2 仿生方法》
1.2 仿生方法
受到大自然启发,科学家和工程师已经建造了很多有用的机器。在微观尺度下,研究人员从可游动的微生物身上获得灵感,制造了微纳米游动机器。19 世纪末, 研究发现所有可游动微生物采用鞭毛或纤毛来推进。1973年,生物学家Berg 发现微生物, 如大肠杆菌(E. coli),通过旋转体表的分子马达使鞭毛呈螺旋形转动,从而保证它们能在不同液体中游动(图2) [6] 。
《图2》
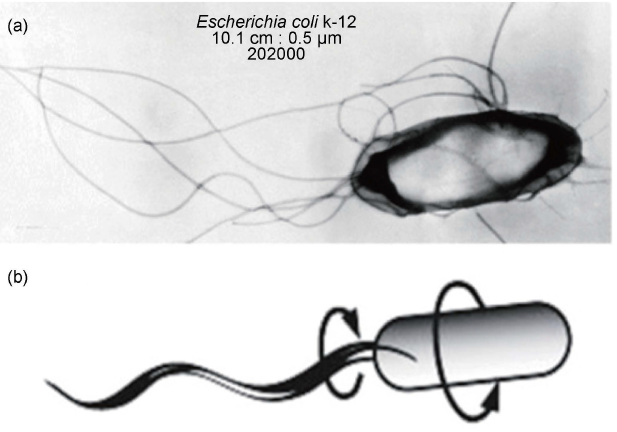
图2. 大肠杆菌及莫游动方式。(a)大肠杆菌的光学图像[7]; (b) 大肠杆菌通过鞭毛的螺旋形旋转来游动[8]。
螺旋形磁控微纳米机器人的发明受到大肠杆菌游动的启发。在旋转的磁场中,螺旋形机器人可将自身的旋转运动转化为平移运动,促使它们在液体中推进。它们可在低强度旋转磁场( < 10 mT )的驱动下,在低雷诺数流体中实现三维( 30 )游动。磁控螺旋形微纳米机器人集合了磁场驱动和螺旋推进的优点。由于低强度磁场对细胞和组织无害,磁控螺旋形微纳米机器人被认为是在生物医学应用尤其是活体应用中最具前景的工具之一[4, 9, 10] 。
《1.3 磁控螺旋形微纳米机器人的历史》
1.3 磁控螺旋形微纳米机器人的历史
1996 年, Honda 等提出微型机器人可采用螺旋形游动机制在低雷诺数环境下游动,并制造了第一个厘米尺寸的磁控螺旋形机器人原型。这个原型由一块侈钻磁铁( 1 mm× l mm× l mm )和附着在磁铁上的螺旋铜线构成(图3(a)) 。它可在旋转磁场的驱动下,在高茹度硅油中游动。由此,证实了螺旋形游动机制适用于低雷诺数环境 [11]。2005 年,他们制造了体积更小的螺旋形机器人,总长缩减到了5.55 mm。这种毫米尺寸的机器人可在狭窄流道中拖动金属丝,并改变金属丝的运动方向。他们认为,螺旋形微型机器人应用在血管中引导医用导管方面有很大潜力 [12] 。
2007 年,苏黎世联邦理工学院发明了第一个微米级磁控螺旋形机器人原型,称为人造细菌鞭毛( ABF )。这个机器人由一个直径为3 μm 的软磁性“ 头部”和30-40 μm 长的螺旋状“尾巴”组成(图3(b)) [13] 。它们在去离子水中的游动特性得到了表征[18] 。2009 年,第一个纳米级磁控螺旋形机器人用斜角人射沉积法制造成功(图3(c))。在旋转磁场驱动下,这种纳米机器人可在水中游动[14]。随后研究显示, ABF 可在液体中操纵微型物体(图3(d))[3] 。
《图3》

图3. 磁控螺旋形微纳米机器人。(a)第一个厘米尺寸的磁控螺旋形机器人原型,转载自[11]; (b)第一个微米尺寸的磁控螺旋机器人原型,改编自[13]; (c)第一个纳米尺寸螺旋机器人,转载自[14];(d) 流体操纵,改编自[3]]; (e) 3D 激光直写制备的磁控螺旋形微型机器人,改编自[15];(f) 无细胞毒性; (g)由植物螺旋导管制成的螺旋微米结构,改编自[16]; (h)纳米螺旋机器人在血液中游动,转载自[17]。
2012 年, 30 激光直写技术被用来制造新一代ABF(图3(e)) [15] 。具爪ABF 可以用来30 运输微米球体[15] 。随后, ABFs 在各向异性站性流体中的游动特性得到表征[19] 。细胞毒性测试显示, 3 天内它们对小鼠肌肉细胞没有表现出毒性(图3(f)[20] 。
2013 年,研究者以植物的木质部螺旋导管为模板制造了磁控螺旋微米结构(图3(g))。这种制备方法简单且成本低[16] 。20 14 年,研究人员利用电沉积方法大规模生产纳米级螺旋结构[21] 。螺旋形纳米机器人实现了在站弹性流体[22]和人体血液中游动(图3(h)) [17] 。
《2 磁控螺旋形微纳米机器人的制造》
2 磁控螺旋形微纳米机器人的制造
磁控螺旋形微纳米机器人至少由两部分组成:螺旋躯体和磁性物质。螺旋躯体用来模仿细菌鞭毛的螺旋推进动作,当螺旋躯体沿其长轴转动时可将旋转运动转化为平移运动。磁性物质保证整个结构能跟随外部旋转磁场转动。这里把文献中的制造方法归纳为四类:卷曲法、斜角入射沉积法、激光直写法和模板辅助法(图4)。
《图4》

图4. 磁控螺旋形微纳米机器人的制备。(a)卷曲法; (b)斜角入射沉积法;(c)激光直写法,(a~c)改编自[9];(d)模板辅助法,改编自[16]。
卷曲法: 2007 年,第一个微米级磁控螺旋形机器人,ABF ,是由卷曲法制成的(图4(a)),也称自卷技术问。ABF 总长30 ~ 40 阳,由半导体材料(锢嫁碑)制成的螺旋“尾巴”和磁性镇“头部”组成(图3(b))。制备方法基于传统的薄膜沉积和单晶薄膜生长技术。通过控制沉积参数,如膜厚、带状结构的宽度或者带状结构与晶状结构间的方向,可以精细地调节带状结构的卷曲度。之后,在卷曲的螺旋结构一端连接小块的镇片, ABF 就制成了。它们的直径约为3 μm、长度从10 μm 到100 μm不等。除半导体薄膜能卷曲外,双层脂膜软质材料也可卷成螺旋微米结构。磁控螺旋形脂质微米机器人采用元电极电镀法在卷曲成螺旋的脂质微米结构上沉积磁性材料CoNiReP 而制成[23]。
斜角人射沉积法: 2009 年, Ghosh 等采用斜角人射沉积法批量制备成纳米尺度的螺旋形机器人[14]。首先,将球状颗粒密集地排列在基体上,采用斜角入射沉积可在颗粒上生长纳米柱状结构。通过连续地旋转基体,柱状结构会转变为螺旋状(图4(b))。这些螺旋结构直径为200 ~ 300 nm ,长度为1 ~ 2 μm (图3(c))。最后,沉积磁性材料钻在纳米螺旋体的一侧。
激光直写法: 2012 年, Toto町等采用激光直写法搭配电子束沉积法制备了以高分子材料为基础的ABF[15]。激光直写法是3D 激光打印技术的一种,它可用来制备任意形状的3D 微米结构。首先,将光感肢平铺在玻璃基片上,玻璃基片可在压电陶瓷工作台的控制下进行3D 移动。当激光束聚集在光感胶中时,仅在激光束的焦点处激发双光子聚合反应[24]。当激光束的焦点沿螺旋路径移动时,会在光感胶中形成螺旋形的结构,洗去未聚合的光感胶,螺旋微米结构就形成了(图4(c))。然后,采用电子束蒸镀法在整个螺旋结构表面沉积一层磁性物质(图3(e))。其他研究者采用将磁性纳米颗粒镶嵌在聚合物内部来制作磁性螺旋微米结构[25]。另外,基于激光直写法,研究者制备出以钻镰材料作为“头部”及聚合毗咯作为“尾巴”的复合型磁控螺旋微米结构[26]。
模板辅助法: 2013 年, Gao 等采用维管植物作为螺旋的模板来制造螺旋形微米机器人[16]。很多维管植物的木质部中有螺旋形微米导管,直径在10 ~ 60μm 不等。首先,从植物中剥离出这些导管。然后,在结构表面沉积镰/铁双层纳米薄膜。最后,将沉积后的微米结构切割成短螺旋机器人(图4(d)和图3(g))。这些机器人的几何形状可由不同植物中导管的固有形状来控制。这种方法价格低而且可实现批量生产[16]。2014 年,同一课题组报道了另一种模板辅助法可用来批量生产纳米磁性螺旋体[21]。采用孔径为100 ~ 400 nm 的多孔氧化铝膜作为模板,通过电沉积法在模板的孔洞内生长钮/铜纳米线。然后,化学刻蚀去除纳米线上的铜形成螺旋形的钮线。最后,在钮线上沉积磁性镍层。
《3 磁控螺旋形微纳米机器人的运动控制》
3 磁控螺旋形微纳米机器人的运动控制
磁控螺旋形微纳米机器人可以在旋转磁场控制下进行3D 游动。本节采用激光直写法(图3(e))制备的ABF来解释磁控螺旋形微纳米机器人的运动控制。这些ABFs由高分子的螺旋躯体以及沉积在体表的镰/铁双层组成。
《3.1 ABF 的磁力驱动》
3.1 ABF 的磁力驱动
磁力驱动的基本原理是运用磁力和/或磁矩来移动磁性物体。当一磁体处于外部磁场中时,其受到的磁力FM和磁矩TM 可由式。)和式(3)得出:
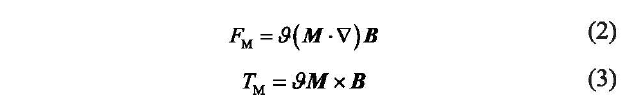
式(2)和(3)中,  是磁体的体积;
是磁体的体积; 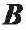 是外磁场的磁通密度;
是外磁场的磁通密度;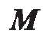 是磁体的磁化强度。对于硬磁材料,物体的磁化强度不受外磁场的影响。对于软磁材料,磁化强度取决于外磁场和磁体的几何结构。
是磁体的磁化强度。对于硬磁材料,物体的磁化强度不受外磁场的影响。对于软磁材料,磁化强度取决于外磁场和磁体的几何结构。
ABF 表层有软磁材料镰。当ABF 处于均匀磁场中时,磁场梯度 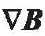 为零,软磁的ABF 被磁化。磁矩TM使 ABF 和外磁场方向对齐。当
为零,软磁的ABF 被磁化。磁矩TM使 ABF 和外磁场方向对齐。当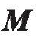 和
和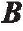 方向相同时,磁矩TM 为零。只要
方向相同时,磁矩TM 为零。只要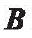 不改变, ABF 会保持不动。假设一个ABF 的磁化方向垂直于它的螺旋长轴。将其放在XYZ的三维坐标系中(图5(a)),当施加一个延X轴反方向的均匀磁场时(图5(a)) , ABF 上产生磁矩(见式。))。磁矩使
不改变, ABF 会保持不动。假设一个ABF 的磁化方向垂直于它的螺旋长轴。将其放在XYZ的三维坐标系中(图5(a)),当施加一个延X轴反方向的均匀磁场时(图5(a)) , ABF 上产生磁矩(见式。))。磁矩使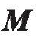 与
与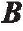 对齐,然后磁矩变为零。图5仙, c)显示了在E平面和E平面上ABF 与磁场方向对齐。当磁场在xz 平面上旋转一定角度时(图5(c)),就在ABF 上产生新的磁矩, ABF 会再次和磁场
对齐,然后磁矩变为零。图5仙, c)显示了在E平面和E平面上ABF 与磁场方向对齐。当磁场在xz 平面上旋转一定角度时(图5(c)),就在ABF 上产生新的磁矩, ABF 会再次和磁场 对齐,它会沿螺旋长轴转动一定角度(图5(a)中Y轴)。当磁场在
对齐,它会沿螺旋长轴转动一定角度(图5(a)中Y轴)。当磁场在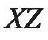 平面上不断旋转时, ABF 就会绕着螺旋轴不断旋转。螺旋体旋转产生净位移,使ABF 向前推进。当磁场旋转轴的方向在XY平面上改变时(图地) ) , ABF 的运动方向在横坐标平面上随之改变。当磁场旋转轴的方向在YZ 平面上改变时, ABF 游出横坐标平面,从而进行3D 运动。总之,ABF 在旋转磁场中向前推进。通过改变磁场旋转轴的方向,可以在3D 空间上实现对ABF 的元线操控。通常,Helmholtz 线圈[3]被用来产生旋转磁场。
平面上不断旋转时, ABF 就会绕着螺旋轴不断旋转。螺旋体旋转产生净位移,使ABF 向前推进。当磁场旋转轴的方向在XY平面上改变时(图地) ) , ABF 的运动方向在横坐标平面上随之改变。当磁场旋转轴的方向在YZ 平面上改变时, ABF 游出横坐标平面,从而进行3D 运动。总之,ABF 在旋转磁场中向前推进。通过改变磁场旋转轴的方向,可以在3D 空间上实现对ABF 的元线操控。通常,Helmholtz 线圈[3]被用来产生旋转磁场。
《图5》
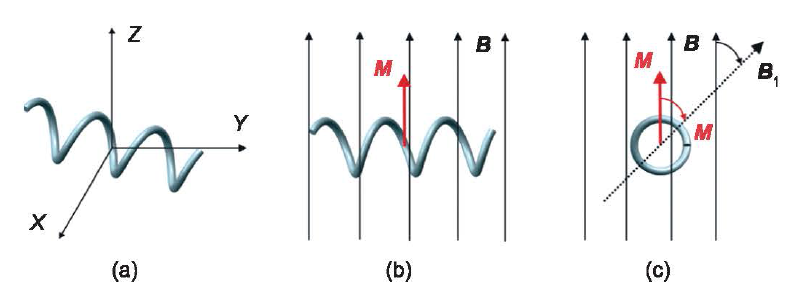
图5. 均匀旋转磁场下ABF 的运动控制。(a) XYZ 坐标系中的ABF,ABF 在(b) XY 平面和(c) XZ 平面和磁场方向对齐。
《3.2 ABF 的游动特性》
3.2 ABF 的游动特性
图6 显示了ABF 的游动速度和磁场的旋转频率间的关系。外部磁场强度为3mT。这个ABF 拥有IP-L 高分子材料螺旋躯体和镇/铁薄层( 50nm/nm ),其总长度为16 μm,直径为5 μm。游动实验在去离子水中进行,ABF 在清洁硅片抛光面上游动。
《图6》
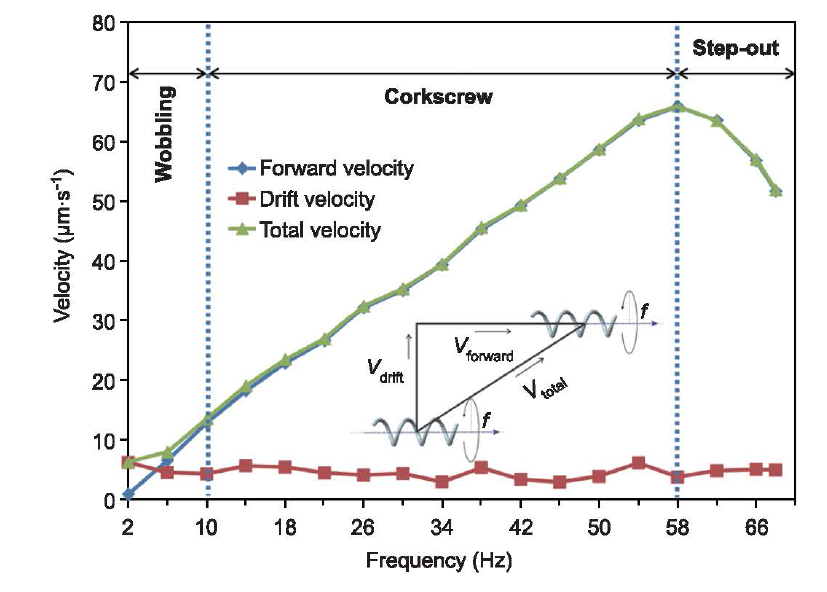
图6.ABF 的游动特性。游动曲线可分为三部分:摇晃、螺旋推进和跳出区域。嵌入图像显示了向前速度(Vforward),漂移速度(Vdrift)和总速度(Vtotal)。
ABF 显示出由频率决定的游动特性,游动曲线可分为3 部分:摇晃,螺旋推进和跳出部分(图6 )。在摇晃区间, ABF 在低频率(<10 Hz )下驱动,向前移动的同时绕着螺旋轴晃动。当频率增加时, ABF 不再摇晃,转为平稳地螺旋推进,其游动速度直线上升直到最大值。ABF 达到最大速度的输人频率称为跳出频率。当输入频率继续增大时, ABF 进入游出区域。在这个区域,随着频率的增大, ABF 游动速度急剧下降。ABF 在硅片表面游动,由于表面效应的影响,它同时具有垂直于螺旋轴的漂移速度。ABF 的总速度是向前速度和漂移速度的总和(图6 )。只要ABF 在表面附近游动,其漂移速度就一直存在。然而,在螺旋推进区域和部分跳出区域,漂移速度和向前速度相比几乎可以忽略,图6 中向前速度曲线覆盖总速度曲线证实了这点。
《4 磁控螺旋形微型机器人的功能化及其生物医学应用》
4 磁控螺旋形微型机器人的功能化及其生物医学应用
磁控螺旋形微纳米机器人可在封闭或开放的流体环境中,通过直接推动[15, 27]和非接触的方法( ABF 旋转时会搅动周围液体)来操纵或运输微米甚至更小的物体[3]。但是,生物医学应用,包括给药和无线传感,要求进一步使这些机器人表面功能化,使其能携带特定化学物质,如化学药物分子。Qiu等用三类脂质纳米级给药系统(二棕榈酷磷脂酷胆碱( DPPC )基脂质体[28], DOTAP/DOPE 脂质体[29]和脂质复合物[30])成功实现了对ABF 的表面功能化。这些功能化的ABF 可在低强度磁场( < 10 mT )的驱动下,实现无线遥感、单细胞级别的靶向给药(图7(a))。携带热敏DPPC 基脂质体的ABF 能够搭载亲水和疏水药物,并可通过提高温度来释放钙黄绿素(药物模型)。结果显示,钙黄绿素在39 ℃时很快释放,在41 ℃时释放率达到73%± 15% (图7(b)) [28]。携带阳离子脂质体DOTAP/DOPE 的ABF 可通过直接与细胞接触,给体外培养的小鼠肌肉细胞提供亲水的钙黄绿素药物模型[29]。最近研究发现,装载DNA 脂质体的ABF 能够把目标基因运送给体外培养的人类胚胎肾脏细胞。与ABF 接触的细胞成功地被携带的DNA 转染,并表达出金星蛋白质编码(图7(c)) [30]。最新结果显示,群体的ABF 可以在小鼠体内被活体追踪,同时可磁控游动[31]。
《图7》

图7. 功能化ABF 可用于靶向给药。(a)单细胞靶向给药,转载自[30];(b)钙黄绿素从DPPC/MSPC 功能化的ABF 释放,改编自[28];(c) ABF 靶向基因定投, 1)荧光影像, 2)透射光影像, 3)两个影像的重叠和放大,转载自[30]。
《5 结语和展望》
5 结语和展望
受到细菌如大肠杆菌鞭毛推进方式的启发,磁控螺旋形微纳米机器人可以在低强度旋转磁场( < 10 mT )驱动下,在低雷诺数环境中实现亚微米精度的30 游动。它们在生物医学应用方面有很大的潜力,如微创手术、细胞操作和分析以及靶向治疗。但是,在实现其生物医学应用过程中仍存在很多挑战。
首先,磁控螺旋形微纳米机器人体外及体内的生物相容性还有待研究。另外,当完成活体任务后,如何最好地把它们从人体内取出是一个新挑战。一种方法是将其引导到一个区域,然后采用微创手术取出。也许最好的办法是使其可生物降解或可生物吸收,这要求我们采用新型的生物相容和生物可降解材料,如一些可生物降解的水凝胶。
第二,在生物和医疗环境中,体液中的成分比去离子水复杂得多,里面含有多种蛋白质和大分子。为了实现生物医学应用,需要对磁控螺旋形微纳米机器人进一步功能化,以改善其在异质蒙古性环境中的游动能力。
最后,磁控螺旋形微纳米机器人的控制和转向是通过于动改变磁场来调节的。自动化控制可用来提高它们的控制精度和智能化。同时,研究采用多个微纳米机器人的协同合作来实现更为复杂的功能。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Famin Qiu and Bradley J. Nelson declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




