1. 引言
在临床前科研和临床实践中,成像已经成为一种前所未有的强力工具。在肿瘤学领域过去的15年中,成像技术及其应用在数量上显著增长[1–4]。但其中最大的突破性进展很可能就是光学分子影像(OMI)的新发展。随着光学多模成像、契伦科夫荧光成像和术中光学影像导航技术在近期的巨大进步,肿瘤诊断和治疗干预的灵敏度和精准度已经被推到一个全新的水平。对某些肿瘤学上曾经无法给出确切答案的重要问题,科研人员和临床医生现在已经站到了找到解决之道的边缘。我们如何将传统离体化验测定的发现转移到基于影像的无创性活体检测?是否有可能获取精确和量化的三维细胞或亚细胞水平的生物信息(如肿瘤组织的受体密度)?我们如何更精准地划分肿瘤边界并引导切除肿瘤?我们能够在术前和术中突破常规成像方法对微小肿瘤病灶的有效检测极限吗?我们怎样才能将临床前光学分子影像技术转化到临床应用中,以达到更好的肿瘤治疗效果?
本文重点围绕三类技术介绍了光学分子影像的近期研究进展,即光学多模成像、契伦科夫荧光成像和光学影像手术导航。针对这些新技术,笔者兼顾广度和深度,综述了前沿的光学成像仪器、光学断层成像模型和重建算法,以及具有前景的、智能运用多模分子探针的光学成像策略。此外,笔者还展示了光学分子影像在生物医学研究和近期临床转化上最新的具体应用和活体成像实例。
《2. 活体光学多模分子成像》2. 活体光学多模分子成像
不同的成像模态具有固有的优势和缺点,而且它们之间具有互补性。例如,放射性核素成像具有很好的分子靶标灵敏度,但其空间分辨率很有限;而计算机断层成像(CT)和磁共振成像(MRI)可以提供很高的空间分辨率,但是它们对分子水平信息的探测灵敏度不高[5]。平面光学成像采用了摄影原理,是捕捉从活体光学报道
分子中发射的可见光和近红外光的最简单技术[6–8]。这种平面技术可以提供很好的浅表分辨率(成像对象体表的分辨率)、高灵敏度和高成像通量,并且在操作上非常易于应用在临床前研究中[9]。但是它具有两个重要的缺陷。缺陷一:由于探测到的活体表面光通量的分布和信号强度以及活体内的光源,也就是光学分子探针在体内的空间分布和区域浓度具有非线性关系,该二维平面技术难以实现活体定量成像[10];缺陷二:由于光子在成像动物组织和器官内显著的散射和吸收效应,该技术只能进行相对较浅深度的成像[11]。这些缼陷使得该技术的应用被限制在定性的浅层观测上。尽管人们尝试研发了多种不同的算法以运用平面光学图像来进行断层重建,但这些方法均不可避免地引入了对采集数据的大量错误解读,除非非线性效应问题被明确地修正或解决[9]。因此,将二维光学成像和其他成像模态融合以弥补这些缺陷,同时增强它的固有优势,是发展光学分子影像并充分利用其潜力的一大趋势[12]。
《2.1. 从二维定性到三维定量成像》2.1. 从二维定性到三维定量成像
对光学分子探针的生物分布进行断层重建的尝试可以追溯到20世纪90年代早期。为了在空间上解决血液动力研究或细胞器浓度研究中内在组织对比度的问题,研究人员提出了第一个理论框架[13–16]。可见和近红外光子(波长从650nm到950nm)在生物组织中是高度散射的,在1mm内的传播中就开始了漫射[17]。但是由于在这个光谱段的光子被组织吸收的概率很低[18,19],一部分光依然可以穿过几厘米的软组织并到达小动物的皮肤表面,这一光谱段也被称为第一近红外光窗(NIR-I)[20,21]。对于波长短于650nm的光,血液(富氧或缺氧)和皮肤具有高吸收性;对于波长长于950nm的光,水和脂质则表现出高吸收率。在最新的光学多模断层成像(OMT)中,小动物体表的散射光斑图案由光电探测器或各种光电耦合器(CCD)相机从一个或多个角度进行采集。同时,动物的解剖结构信息被CT或MRI采集(图1),作为先验信息以帮助光学重建。基于不同类型的光学分子探针,这种三维无创的小动物全身成像技术被细分为三个类别:激发荧光分子断层成像(FMT,运用激发荧光探针和外部激发光源)[22,23],生物自发荧光断层成像(BLT,运用报道基因和荧光素底物,无外部激发光源)[24,25],以及契伦科夫荧光断层成像(CLT,运用放射性核素探针,无外部激发光源)[26,27]。由于第三维度的增加、多模态影像信息的融合以及具有细胞和亚细胞生理过程特异性的光学分子探针的运用,OMT具有克服常规平面光学成像技术第一缺陷的能力,并且可以在细胞和分子水平上提供更精准和更鲁棒的定量化成像。
《图1》

图 1. 多种光学多模断层成像(OMT)硬件系统实例。(a) 和 (b) 分别为由 Vasilis Ntziachristos研究组研发的 FMT-CT 融合成像系统的示意图和内部构造图,转载自参考文献 [28, 29];光学和CT 两个子系统相互垂直正交。在成像过程中,小鼠躺于旋转支架的中心,两个子系统绕其旋转 采集数据。(c)~(e) 为 Brian Pogue 研究组研发的 FMT-MRI 融合成像系统,转载自参考文献 [30]。(c) 为临床用于激发荧光成像的 MRI 耦合 16 通道光学成像系统的示意图。(d) 为佩戴了 MRI 线圈和光纤束的成像小鼠躺在临床 3 T 的磁共振系统中的照片。(e) 为光学子系统放置于 MRI 设备间 隔壁的控制间内的照片。( f ) 和 (g) 为田捷研究组研发的光学-CT-MRI 三模融合成像系统。系统设 计示意图 ( f ) 表明光学和 CT 子系统被安装在旋转框架上,立方体形的 MRI 子系统 (1 T 永磁体 ) 被安装在旋转框架和小动物平移台之间。因为该系统仍处于研发阶段,MRI 子系统的最终位置可能与初始设计有所不同,如图 (g) 所示。
多模成像方法的硬件系统设置会根据生物医学应用或研究小组的不同而有所不同(图1),如图1(a)和(b)中的光学-CT融合成像系统,图1(c)~(e)中的光学-MRI融合成像系统和图1(f)和(g)所示的光学-CT-MRI三模融合成像系统。但无论是哪套系统,都有两个通用因素会显著影响断层成像的效果。第一,研究合适的数学成像模型来描述光子在组织中的传播十分关键,也就是通称的前向问题;第二,研发有效的断层重建算法也同等重要,也就是通称的逆向问题[9,10]。
OMT前向问题对应的典型方法是假设成像对象的光学特性为整体均匀一致的,然后寻找光学扩散方程的数值解或解析解[31–33]。为了进一步提高精度,针对不同的组织和器官,研究人员提出了基于辐射传输方程的近似求解、融合了光能传递原则的扩散方程求解或高阶球面谐波近似的不同的前向模型。此外,人们还假设活体小动物组织和器官的光学特性为异质而非均一的[10,34,35]。光学成像模型正在朝着更精准的方向演变,同时为了适应活体应用,相应的计算量增加也被控制在可接受的范围内。
由于组织中光子的高散射效应,OMT的系统矩阵是病态的,而逆向的三维重建也是不适定的[36]。与单模态光学断层成像相比,OMT可以利用从其他成像模态获取的先验信息或引导信息来最小化这些问题。此外,多种多样的正则化方法,如Tikhonov正则化[37]、稀疏正则化[38]、全变分正则化[39]以及重加权L2和L1正则化[40,41],可以被用来实现计算上的快速和鲁棒重建。这些方法可以与快速解析式或数值解法结合使用,从而进一步加快重建的速度[42,43]。总而言之,由于应用复杂的多模成像系统必然导致数据获取量的增加,对快速和鲁棒的逆向重建算法的迫切需求也会相应持续。
随着硬件系统、光学成像模型和断层重建算法的快速发展,OMT已经变得越来越实用和易于实施。在过去的十年间,OMT技术领域已经从初期的数学仿真或人造模型研究发展到了小动物活体应用研究。世界上多个先驱性的科研团队在小动物肿瘤模型上展开了广泛而又各具特色的生物医学成像研究。在此,为了展示多模融合FMT和BLT技术的优越性,笔者总结了该领域最新的突破性进展。因为CLT的相关细节将会单独在第3节中进行描述,其活体成像应用便不在本节中进行介绍,以免重复。
Vasilis Ntziachristos团队成功实现了高精度的FMTCT融合技术,并应用于皮下4T1肿瘤小鼠模型、Aga2成骨不全症小鼠模型、Kras肺癌小鼠模型和胰腺导管腺癌小鼠模型的分子成像上,如图2(a)所示[28,29]。活体成像的结果分别与单模态FMT和单模态CT进行了对比,并通过小鼠尸体冰冻切片的平面荧光图像和组织学数据分析进行了全面验证。这项研究生动地展示了OMT相较于单模态的FMT或CT和平面的光学二维成像可以提供更加精准的肿瘤病灶三维信息。
《图2》
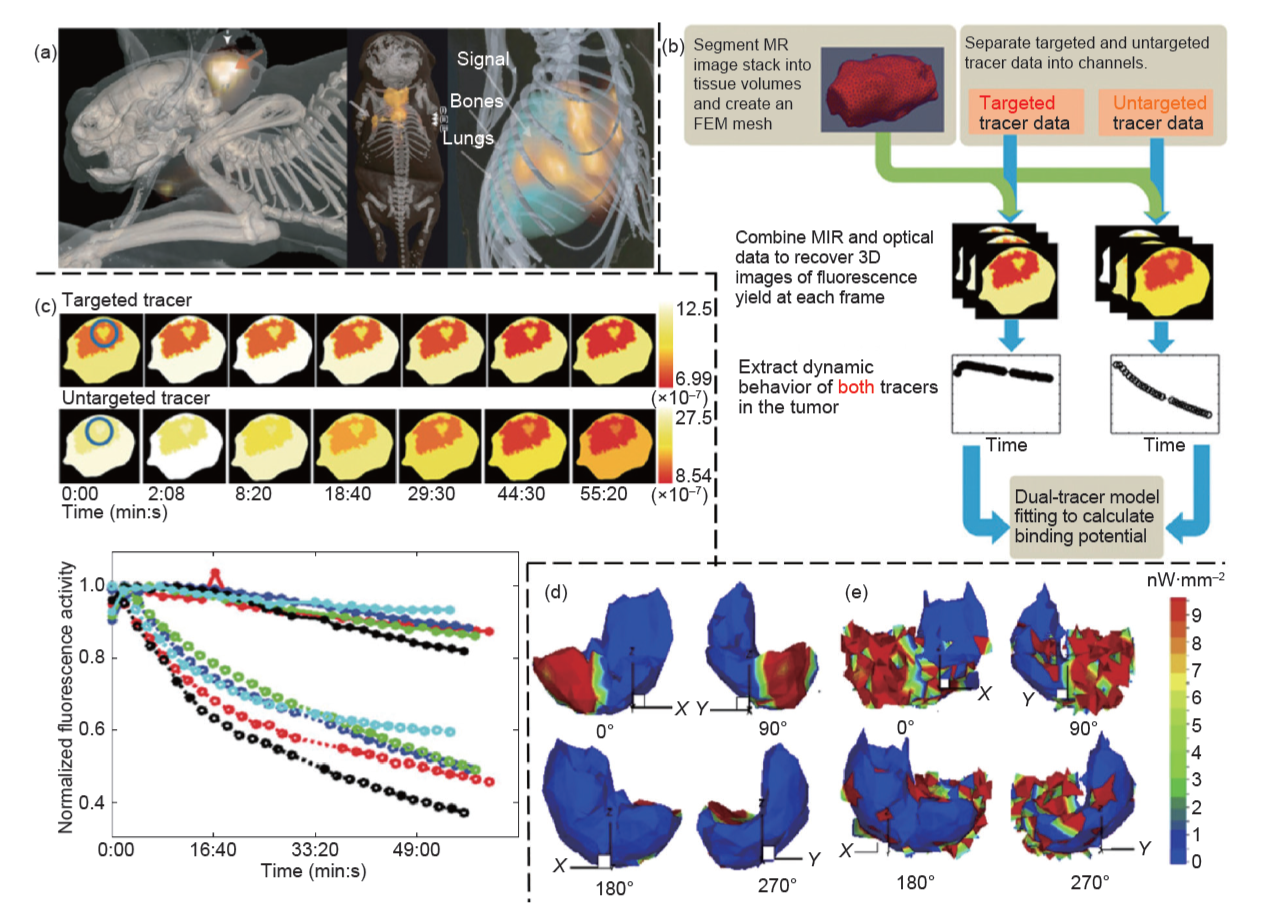
图 2. 光学多模断层成像(OMT)的无创活体成像应用。(a) 应用 FMT-CT 融合成像技术,对皮下 4T1 肿瘤小鼠模型、Aga2 成骨不全症小鼠模型、 Kras 肺癌小鼠模型进行三维图像重建,转载自参考文献 [28]。(b) 通过动态双探针 FMT-MRI 成像进行受体束缚势的重现,转载自参考文献 [44]。 (c) 小鼠脑胶质瘤动态双探针 FMT-MRI 成像:前两行分别是应用靶向性和非靶向性探针的时间序列冠状图像,显示了激发荧光的活动;下方的点状 图显示了所有动物的肿瘤内部应用靶向性 (● 实线 ) 和非靶向性 (○ 虚线 ) 探针的荧光活动随时间的变化,该图展示出两种明显不同的趋势,转载自 参考文献 [44]。运用 BLT-CT 技术,对使用新型抗肿瘤药物后的小鼠进行 (d) 肝脏重建成像和 (e) 经盐水处理后作为对比的肝成像;图像对比表明 药物与盐水相比具有显著的高抗肿瘤功效,转载自参考文献 [45]。
白净团队和BrianPogue团队分别独立研发了FMTCT和FMT-MRI融合成像技术用来进行动态激发荧光分子成像,均为肿瘤研究中有力的新型四维成像工具。这两种技术对无创性研究靶向受体的药物递送和肿瘤的发展过程具有特殊优势。这两个团队运用他们的OMT技术成功报道了不同光学分子探针在血液和肿瘤动物模型中的受体结合动力学[46–49]。此外,BrianPogue团队应用该技术同时表征了U251脑肿瘤小鼠模型中两种光学探针的肿瘤摄取动力学特征。一种探针靶向目标受体,而另一种探针作为非靶向性的参照,如图2(b)和(c)所示。然后利用一种双探针房室模型分析了这些动态数据,最终实现了可用于肿瘤组织内结合靶向治疗药物的受体密度的精确量化[44]。BrianPogue团队也将相似的双光学探针成像技术应用于精准量化乳腺癌小鼠模型的淋巴结肿瘤负荷上。这一无创成像技术达到了能够有效探测大约200个乳腺癌转移细胞的极限灵敏度(很可能比常规的淋巴结活检还要灵敏)[50]。
不同于上述研究,田捷团队研发了BLT-CT技术进行活体成像,并将之应用在新型抗肿瘤药物的疗效评估中[45,51]。在活体二维自发荧光成像(BLI)或三维BLT成像中,生物体(如肿瘤细胞、免疫细胞、细菌或基因)被一种编码了某种可产生发光酶(荧光素酶)的报道基因所标记。在氧气和其他因素(如ATP、Mg)存在的情况下,酶将特殊的底物(荧光素)转化为光[52–54]。在活体动物中自发光光子的传播也是一种散射过程,这与激发荧光光子传播相似。但是,由于BLT不使用外部光源,实现具有实用性的BLT活体成像比多模FMT成像更加困难。尽管由于没有固有噪声的影响,生物自发光成像的肿瘤和正常组织的对比度更好,但是在缺少了激发光源和探测器组对的情况下,断层重建问题在数学上变得更复杂。
通过综合多角度成像信息(从0°到360°)与更加精确定义的组织特异性先验信息,田捷团队显著改进了BLT的逆向重建成像性能[10]。他们最新的研究表明,运用先进的逆向重建算法,该技术可以对原位肝癌肿瘤小鼠模型进行精准的三维成像,并对新设计的治疗药物或其他治疗手段的抗肿瘤功效进行了定量化观测,且无需牺牲荷瘤小鼠,如图2(d)和(e)所示[45,51]。
《2.2. 面向更深的成像深度》2.2. 面向更深的成像深度
除了上述关于OMT的技术研发和生物医学应用,也有其他研究团队通过多个分离的成像系统来分别获取光学分子图像和其他单模态图像,然后将这些图像进行后期融合以获取更好的灵敏度和精准度。这种多模态的分子成像策略通常包括多模态分子探针的运用,并且避免了研发复杂的多模融合成像系统。一些近期的研究成果甚至在某种程度上克服了常规平面光学成像的第二缺陷,实现了更好的成像深度。
SanjivS. Gambhir 团队设计了一个独特的三模态(MRI–光声–拉曼)成像纳米探针[55]。由于光声成像(PAI)更好的组织穿透性和光学拉曼成像更好的空间分辨率,该三模态成像策略可以实现无创的精准脑肿瘤边界划分,如图3(a)和(b)所示,以及更精准的(微米级)术中图像导航肿瘤切除,如图3(c)~(e)所示。在该团队自制的成像系统中,该探针在活体小鼠上的探测灵敏度达到了至少皮摩尔级别。该光学多模成像技术所具有的这些优越性能在更精确和更灵敏的脑肿瘤成像及其手术切除方面展示了前所未有的巨大应用前景。
《图3》

图 3. 脑肿瘤的活体三模融合成像探测和术中拉曼成像引导的手术切除。(a) 注射三模态分子探针后,三种模态的二维图片显示出清晰的肿瘤区域。 (b) 三维透视渲染的 MRI 图像与分割出的肿瘤病灶 ( 红色,最上图 );三维光声 ( 绿色 ) 与 MRI 的融合图片 ( 中间图 );从 MRI 上分割的肿瘤和光声 的融合图片 ( 最下图 )。(c) 麻醉状态下的活体荷瘤小鼠正在进行开颅手术。肿瘤以四分之一的面积被一步步切除。(d) 在切除的每一步都进行了术 中的拉曼成像,直到通过目测整个肿瘤都被切除。粗略地切除肿瘤后,在创伤面上发现了几个微小的拉曼信号焦点。(e) 针对这些微小焦点切片的 组织学分析显示这一位置有渗透性肿瘤病灶,在周边脑组织中形成了手指状的突出物。拉曼显微图像显示 ( 最右侧图片 ),在这些突出物中观察到 一个拉曼信号。转载自参考文献 [55]。
在Gambhir团队的研究中,PAI是克服光学成像深度限制的关键。由于独特地运用了光声效应,这种新型混合成像技术与常规激发荧光成像和生物自发光成像相比具有更好的组织穿透性[56]。它使用了纳秒级的脉冲激光束而不是连续波来激发感兴趣目标(生物分子或分子探针),从而引起区域的热效应并导致热弹性膨胀。这种短暂的热弹性组织膨胀产生的高频率压力波可以被超声换能器所探测[57]。因此,PAI融合了光学激发和声学探测的优势。因为声波在生物组织中比光的散射系数更低,所以PAI比常规光学成像方法的成像深度更深,如图3(a)和(b)所示,即超声的运用突破了光学散射的限制。PAI的最新进展已经显示出其在生物和临床应用中的强大成像能力。近些年,Lihong Wang和Vasilis Ntziachristos的团队已经分别研发出多种PAI的成像设备,并拓展了这些设备的应用[59,60]。他们的努力很有可能加速OMI在肿瘤诊断中从临床前研究到临床应用的转化(如乳腺癌和皮肤癌的诊断)。
除了光声成像,为了克服光学成像的深度限制,应用第二近红外光窗(NIR-II,1000~1400nm)的技术也取得了进展。与NRI-I相比,NIRII在激发荧光成像上具有更好的组织穿透深度(散射效应相对较弱)和更高的信噪比(自体荧光较弱)[20]。然而,实现具有实用性的NIR-II活体成像的关键在于合成具有很好生物相容性和高亮度的NIR-II探针以及运用在这个更长的波段内具有高量子效率的CCD相机。Hongjie Dai的团队报道了将具有生物相容性的单壁碳纳米管(SWNTs)作为NIR-II的成像造影剂应用在正常和缺血性股动脉的血流速度成像上[61]。在这个研究中,利用一种混合光学成像系统,砷化铟镓(InGaAs)相机和传统的硅(Si)相机被分别应用于NIR-II和NRI-I成像上,如图4(a)所示。通过对两种近红外光窗的成像性能的对比,该研究展示出运用NIR-II获取更深层组织信息的显著优越性,如图4(b)和(c)所示。该团队还应用高量子产率的合成聚合物作为荧光造影剂,对小鼠深层组织动脉血流进行了快速成像,视频速度达到了>25fps(每秒帧数),如图4(d)~(f)所示[62]。此外,该团队还报道了透过头皮对小鼠大脑内血管的血液灌注进行无创和动态成像。成像深度比常规方法深2mm,且成像速度达到5.3fps。
《图4》
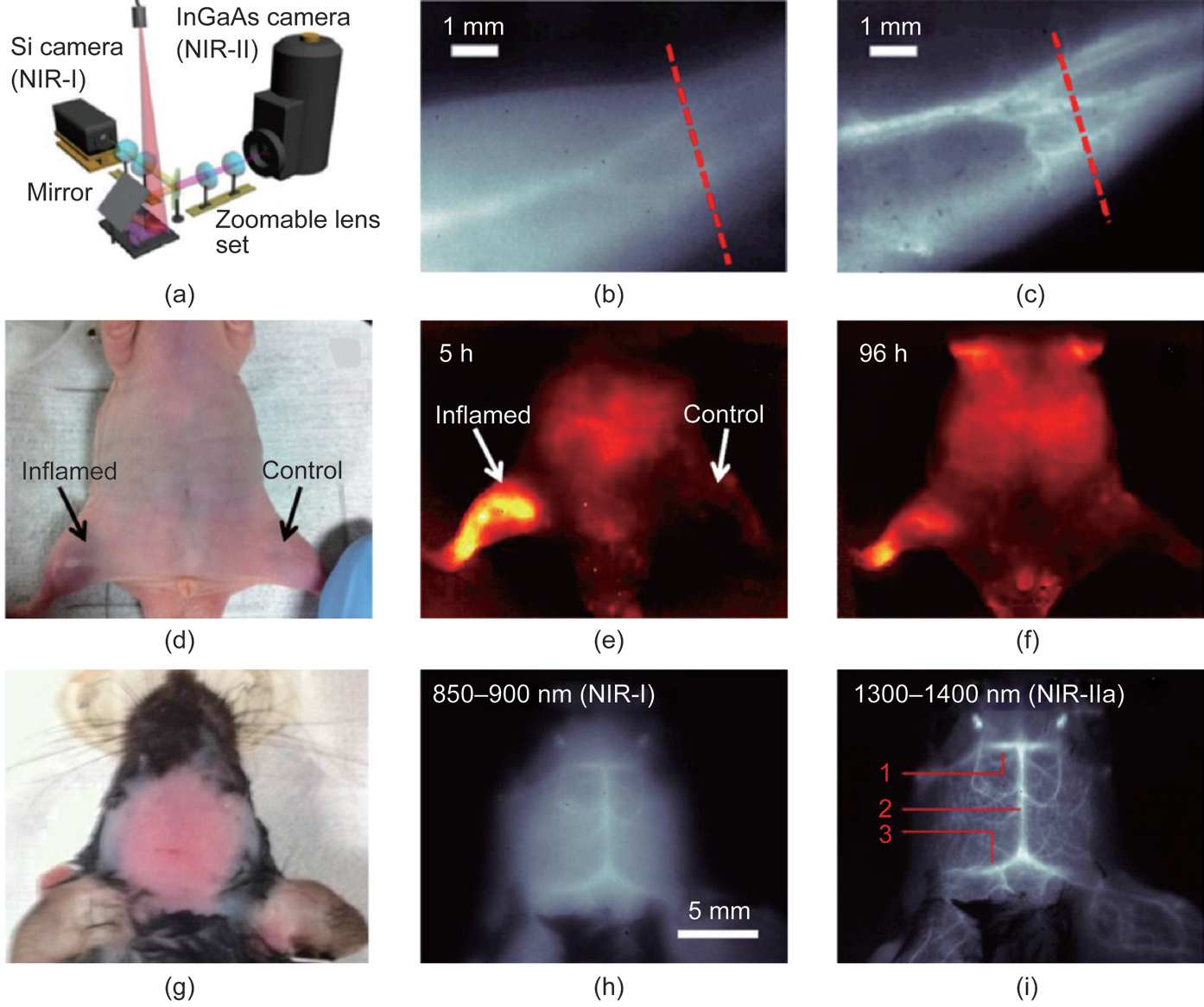
图 4. NIR-II 和 NIR-I 成像对比。(a) NIR-I 和 NIR-II 并发光学成像的系统设置原理图,其中应用了 Si 相机和 InGaAs 相机。小鼠血管的 (b) NIR-I 激发荧光图像和 (c) NIR-II 激发荧光图像。(a)~(c) 转载自参考文献 [61]。(d) 应用 pDA-PEG 对局部血流量再分配进行成像;白光图片显示出小鼠 的右后支 ( 观察者的左侧 ) 经过了 5 h 的加热后引发了炎症。(e),( f ) 在引发炎症后的不同时间 点,对小鼠炎症区域进行的 NIR-II 激发荧光成像。(d)~( f ) 转载自参考文献 [62]。(g) 应用 SWNTIRDye800 对小鼠大脑进行不同近红外波段的活体光学成像。(h),(i) 对同一只小鼠的头部进行了 NIR-I (850~900 nm) 和 NIR-II (1300~1400 nm) 波段的成像。在图 (i) 中,大脑下静脉、上矢状窦 和横窦分别用数字 1、2 和 3 进行了标注。(g)~(i) 转载自参考文献 [63]。
光学多模分子成像的最近进展体现在科技的多个层面,包括光学分子探针,特别是纳米尺度的探针。巨大的发展体现在多种多样的纳米材料被修饰并用在活体OMI上,如聚合物[64,65]、脂质体、胶团[66]、金属纳米颗粒(金、银、钛和量子点)[67–69]、无机颗粒(上转换或下转换)[70–72]和碳结构(纳米管和纳米钻石)[73,74]。许多团队致力于合成新型分子探针,以使分子探针具有更好光学特性并可以应用在多靶点和多模态成像上,从而提高整体成像的灵敏度和精准度。但是尽管纳米探针在临床前应用上有很多显著成果(如超灵敏原发性胃癌和淋巴转移成像[72]、超灵敏多路复用诊断[69]等),并且基于OMI的纳米科技的未来看起来很有前景,然而在过去的十年中,基于OMI的纳米技术在临床转化的进度上依然慢于人们的预期。主要的问题在于纳米尺度的成像造影剂在人体系统内的代谢速率和毒性,这仍然在阻止这些探针在临床实践上的应用。据我们所知,Doxils、Abraxanes和Feridexs是仅有的三种通过食品药品管理局(FDA)批准并应用于临床的纳米成像探针。这三种探针都构造简单,且不具备肿瘤特异性。但是,新出现的CLI和术中激发荧光影像导航手术技术,通过应用临床批准的放射性核素探针和适应手术室的成像系统,可能加速OMI的临床转化。
《3. 契伦科夫荧光成像》3. 契伦科夫荧光成像
核素衰变发出带电粒子(通常是正电子或者电子),当带电粒子运动速度超过介质中的光速时,就会产生契伦科夫荧光。作为新兴的光学分子影像模态,契伦科夫荧光成像(CLI)的研究与生物自发光或荧光的平面成像及断层成像相比都要晚得多。与同样使用核素探针的核医学成像方法相比,CLI具有作为光学成像的几个独特优势:高通量、成本低和更高的表面分辨率[75]。而且,FDA批准的各种核素探针也照亮了CLI临床应用的前景[76–79],这也是CLI在临床转化方面具有的独特优势。然而,微弱的契伦科夫荧光主要分布在蓝紫光波段,大大限制了其组织穿透能力。因此,提高CLI成像灵敏度需要大幅度增强信号和改进成像技术。
与正电子反射成像(PET)相比,由于存在随着组织深度变深信号明显变弱、需要对背景严格避光和缺乏额外信息等限制,CLI的优势并不明显。为了增强CLI的信号强度,且与PET形成优势互补,研究者探索了核素内源双重激发成像(REFI)[80]、契伦科夫二次激发荧光成像(SCIFI)[75]、契伦科夫辐射能量转移(CRET)[81–86]、放射发光成像(RLI)[87–91]、放射性同位素能量转移(RET)[92]和契伦科夫增强荧光成像(ECLI)[93,94]等改进CLI的方法。
64Cu掺杂的自发光纳米颗粒(NPs),如金纳米笼[89]、纳米簇[84,92]、CdSe/ZnS[83,93]和CuInS/ZnS量子点(QD)[83]等,将契伦科夫辐射移至更长的波段。掺杂Eu3+、Tb3+、Er3+和Yb3+的稀土纳米荧光材料本身可以作为多模态探针并且能够增强光学成像的信噪比[87,88,90,92,94]。其中,田捷团队探索了利用氧化铕纳米颗粒将γ辐射与契伦科夫荧光同时转化为近红外荧光的核素内源双重激发成像[80],该技术结合了核医学成像与光学分子影像的优势,可以实现高灵敏检测早期肿瘤与转移灶(图5)。
《图5》

图 5. 活体微小肿瘤病灶早期检测不同模态的对比。(a) 肿瘤细胞皮下注射 65 h 后,白光图像上微小肿瘤病灶的位置 ( 红色箭头标示 )。(b) BLI 验证 微小肿瘤病灶的位置。(c) 对应截面冠状位 PET 扫描呈现假阴性。(d),(e) 无论是否使用 620 nm 滤光片,CLI ( 右侧小鼠 ) 都无法检测到肿瘤 ( 黑 色箭头位置 ),但是 REFI ( 左侧小鼠 ) 则可以检测到肿瘤 ( 红色箭头 )。( f ) 使用非靶向性的 QD620 的激发荧光分子成像 (FMI) 中显示多个疑似病灶, 使用靶向性的 RJ2-DG750 的 FMI 高估了肿瘤的范围。两种探针激发荧光成像的信噪比均低于 REFI。转载自参考文献 [53]。
2010年,Liu等通过用核素探针作为光源在体激发基质胶中的量子点演示了多谱段深度组织成像,并且提示了其靶向成像前景[82]。三种发射波长的量子点发出的荧光可以使用对应的滤波片区分开以获取各个通道的信息。2013年,Thorek等[75]提出了新的CLI模式——SCIFI成像,通过契伦科夫辐射转换成生物特异的荧光实现可激活成像。他们通过使用靶向乳腺癌标志物HER2/neu的89Zr-DFO-trastuzumab(曲妥珠单抗)激发靶向整合素αvβ3的cRGD-QD605实现了高信号背景比肿瘤标志物多参数成像。SCIFI信号表明了肿瘤细胞标志物HER2/neu和αvβ3的共同表达。他们还通过偶联羧基荧光素(FAM)标记短肽的金纳米颗粒(AuNP)实现了基质金属蛋白酶-2(MMP-2)酶活性的活体成像。在MMP-2阳性表达的肿瘤微环境中,序列为IPVSLRSG的短肽可以被特异地剪切。AuNP具有荧光淬灭作用,连接AuNP和FAM的短肽被特异剪切后两者分离,因此SCIFI信号表明了活体MMP-2的酶活性,成像结果与离体定量WesternBlotting检测实验结果一致。
从Robertson等[95]最先使用Xenogen IVIS(IVIS100/200, Caliper Life Sciences, Alameda, CA, USA)探测到正电子发射核素发出的荧光信号开始,在核素成像各模态中CLI一直以低成本成像技术为特色。为突破契伦科夫光强散射导致的穿透深度限制并提高CLI的灵敏度,Kothapalli等[96]提出契伦科夫光可以通过各种临床使用的内窥镜和传统光纤传输,并搭建了契伦科夫光纤成像系统(图6(a))。他们将CCD相机对准6mm光纤束(图6(b)),成功检测到了活度低至1μCi的18F-FDG发出的信号(图6(c))。契伦科夫内窥成像继续发展,Liu等[97]搭建了如图7所示的契伦科夫内窥成像系统(CLE)。CCD相机(Turbo 640-Z; Stanford Photonics Inc., PaloAlto, CA, USA)与108mm长的光纤束耦合(图7(a)),光纤末端与微距镜头(Cinegon,F/1.4, 焦距为12mm; Schneider, Rueil Malmaison, France)耦合(图7(b))。
《图6》
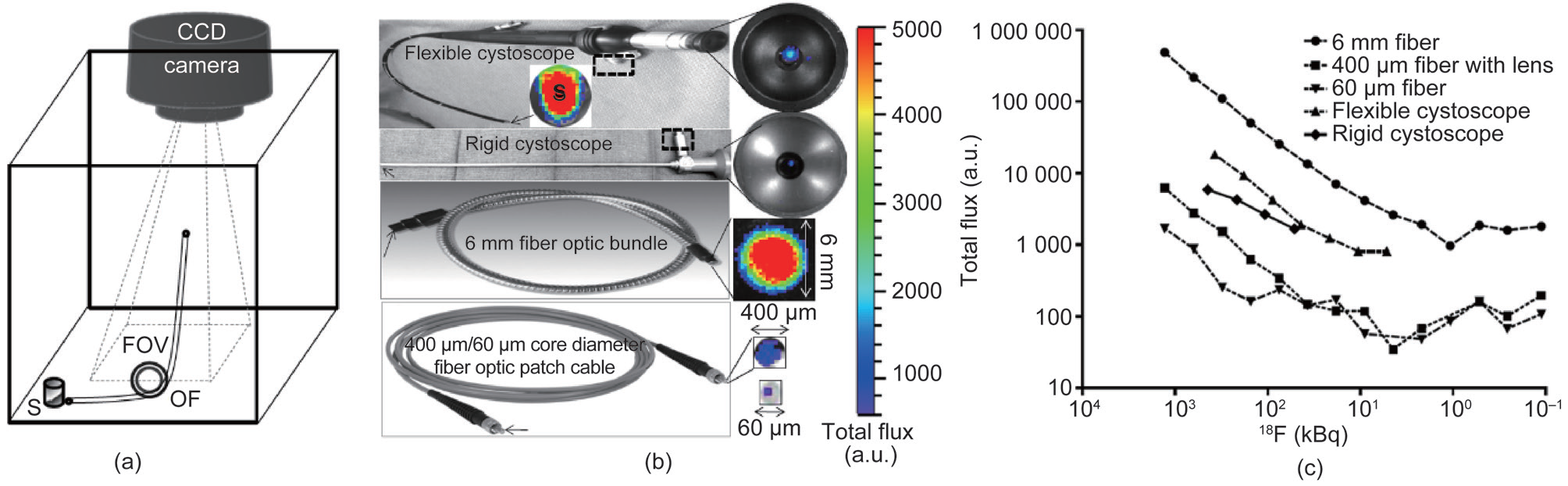
图 6. (a) IVIS-200 Spectrum 成像系统被改造成可与不同光纤或内窥镜 (OF) 联合对仿体样本或预先注射 18F-FDG 的受试动物进行成像。成像物体 S 放置在 IVIS-200 Spectrum 成像系统矩形视野 (FOV) 之外。OF 的输入端靠近成像物体 S,OF 输出端朝向 CCD 相机并放置在 CCD 相机的焦平面上。 (b) 使用不同的光纤与内窥镜,曝光时间为 1 min,对仿体样本 (0.2 mL PCR 管中盛有 10 μL 磷酸盐缓冲液 (PBS),含有 10 μCi 18F-FDG) 进行成像。 所有子图中箭头标示出的对应器材的末端与仿体样本的距离均小于 1 mm。(c) 不同光纤与内窥镜的探测极限。不同光纤检测到的荧光信号表示为 1 min 曝光时间下 18F-FDG 的浓度。转载自参考文献 [96]。
《图7》

图 7. 基于光纤的内窥镜与腹腔镜 CLI 原型系统。(a) 接有微距镜头的光 纤耦合到 (b) 增强 CCD。(c) 尾静脉注射了 37 MBq (1 mCi) 18F-FDG 的 C6 胶质瘤荷瘤小鼠。小鼠分别使用商业化的光学 IVIS 系统与耦合光纤 的系统进行成像。肿瘤组织由红色线框标出。左侧为白光图像,右侧为 荧光融合图像。(d) 小鼠经过手术切除肿瘤组织后,分别使用商业化的 光学 IVIS 系统与耦合光纤的系统进行成像。左侧为白光图像,右侧为 荧光融合图像。转载自参考文献 [97]。
Holland等[98]和Thorek等[99]演示了基于CLI的手术导航系统。Holland等使用89Zr-DFO-trastuzumab靶向HER2/neu高表达的BT-474皮下肿瘤并在CLI导航下切除了BT-474肿瘤。Thorek等演示了利用CLI辅助切除前哨淋巴结[99]。Liu等[97]用活体成像实验证明了CLE导航切除肿瘤组织的可行性(图7(c),(d))。随着成像灵敏度和空间分辨率的进一步提高,我们相信不久的将来会出现契伦科夫内窥成像系统的临床应用。
CLI与CLE仅对到达表面经过散射与衰减的契伦科夫光进行成像,因此随着核素探针光源深度的增加其精确度进一步降低。2010年,两组研究者分别独立地研制出契伦科夫荧光断层成像系统(CLT)。Li等[100]使用商业化光学成像系统(Caliper IVIS 100)检测契伦科夫荧光,利用小动物PET扫描(micro-PET II scanner)验证核素探针的分布,并利用小动物CT扫描(Inveon,SiemensPreclinicalSolutions)获取解剖参照数据。如图8所示,利用两侧的反射镜,CCD相机可以同时捕捉从上表面和两个侧面发出的光子。Hu等[101]使用双模态ZKKS-Direct3D分子影像系统进行三维重建,对植入的放射性光源进行定位。该系统包括科学的液冷背照式CCD相机 (Princeton Instruments PIXIS 2048B, Roper Scientific, Trenton, NJ, USA) 和使用微焦斑X射线源 (Oxford Instruments Series5000 Apogee, CA, USA) 的小动物CT系统。CLT与单光子发射计算机断层成像(SPECT)结果对比显示重建距离误差为毫米级[101]。麻醉的小鼠被固定在转台上的成像支架上。
《图8》

图 8. (a) Li 等搭建的契伦科夫光学采集系统示意图。(b) 仿体实验采集 到的契伦科夫荧光信号。(c) 活体实验架构与从两侧采集到的契伦科夫 荧光信号。转载自参考文献 [100]。
早期的CLT重建方法使用辐射传输方程(RTE)描述光子传输问题。假设小鼠是匀质的,建模时整体光学参数设置为相同数值(图9)[100]。Hu等[101]引入CT数据作为先验信息建立非匀质模型。如图10所示,非匀质模型成功融合了CT与光学数据,提高了重建精确度。Spinelli等[102]引入多光谱信息重建核素探针,该方法不仅提高了重建精度,还简化了采集设备。上述方法均采用散射方程以近似RTE。在频谱的短波段(如蓝色波段)散射方程精度下降。而契伦科夫辐射发出的大部分光子集中在蓝色波段,而且光强与波长平方成反比。这使得散射方程非常不适合用于CLT重建。因此,Zhong等[103]使用RTE的三阶简化球谐函数近似对契伦科夫光子传输进行建模(图11)。进一步的研究致力于缩短重建时间[104]。
《图9》

图 9. 重建的契伦科夫断层成像与小动物 CT 的融合图像。(a) 冠状位切 片显示出膀胱与心脏。(b) 经过肿瘤的矢状位切片。(c),(d) 对应的小动 物 PET/CT 融合图像。转载自参考文献 [100]。
《图10》

图 10. 植入了 600 μCi Na131I 放射性光源的小鼠中光源分布的 CLT 重建图。(a) 非匀质与 (b) 匀 质小鼠模型中重建后光源分布的三维渲染结果。(c) 矢状位重建光源 ( 红色三角 ) 与小动物 CT 切 片上实际光源 ( 黑色圆圈中 ) 的叠加结果。转载自参考文献 [101]。
《图11》
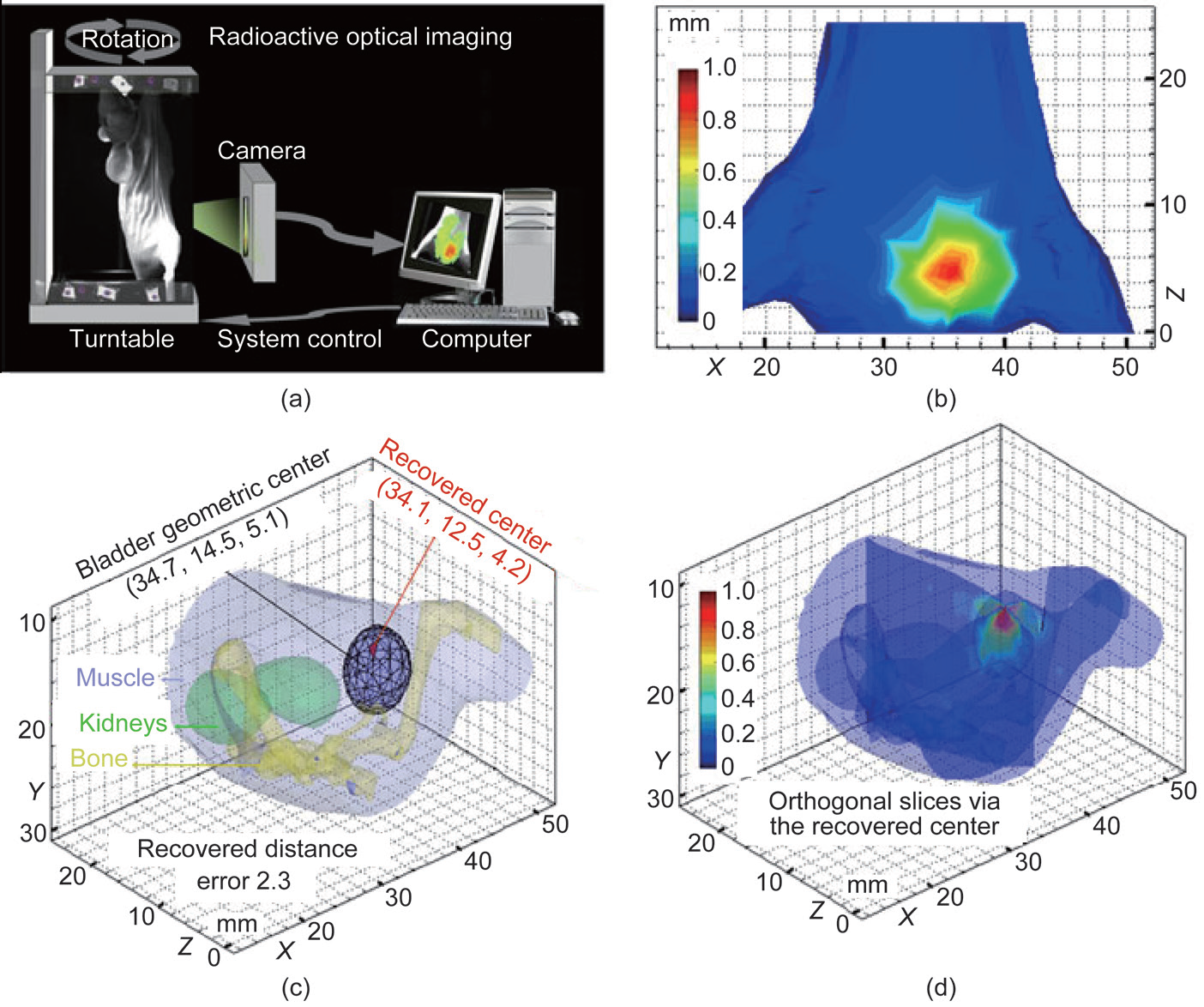
图 11. 采用有限元 SP3 近似的全域 CLT 在注射了 18F-FDG 小鼠的活体应用。(a) CLT 系统结构 示意图。虽然转台旋转了 360°,但只有一面发出的契伦科夫光子能够被相机探测到。(b) 分布 在膀胱附近的光学信号。(c) 作为 SP3 模型的输入,小鼠被分割为四面体网格,包含 3555 个结 点,38 115 个三角形和 18 690 个四面体。重建出的光源光强最大值分布在膀胱中,最大光强为 4.4 × 10–12 W·mm–3。(d) 经过重建中心的正交切片。转载自参考文献 [103]。
《4. 光学分子影像肿瘤靶向手术导航系统》
4. 光学分子影像肿瘤靶向手术导航系统
现有的医学影像系统在术前诊断和术后评估中发挥了重要的作用。然而目前的术中成像技术主要还是依靠外科医生的眼睛和手来实现。随着精准医学需求的不断提升,更加灵敏和精准的术中医学影像技术成为临床医生及肿瘤患者的迫切需求。常规的医学成像技术如CT、MRI和PET能够对5mm以上的肿瘤进行成像,对小于5mm的早期微小肿瘤的精准成像逐渐成为近年来研究的热点和挑战性问题[105]。新兴的光学分子影像技术在肿瘤早期成像方面显示出很大的优势。激发荧光分子成像(FMI)技术作为光学分子影像技术的一个重要分支,已经被应用到了很多临床外科手术中,如卵巢癌[106]、早期食管癌诊断[107]和前哨淋巴结探测[108]。对于复杂手术来说,应用FMI技术具有三个方面的优势:①对早期微小肿瘤病灶的检测具有很高的灵敏度和特异性;②在切除病变组织的过程中可以实时监测切除效果,引导实现精准手术;③对于医生和患者来说,由于没有接触和辐射,对传统手术过程没有影响。目前的临床研究已经证实,采用FMI技术能够对早期微小肿瘤组织进行高灵敏且精确的导航切除。
为了实现高灵敏度成像和精确成像,并满足临床要求,新的成像设备必须满足如下三个重要特征:①多光谱成像,包括可见光、组织特异性荧光和融合图像;②最优的近红外荧光成像采集系统和匹配且均匀的激发光源;③便于外科医生操作。在光学成像中,探测深度一直是主要难点。为了在手术中获取高的信背比图像,通常使用第一红外光窗的光谱,在此谱段,光的吸收和散射相对较低,并且不被肉眼所见[109]。目前,一些基于荧光成像的实验室和商业化系统已实现临床应用[110–123]。特别是一些里程碑式的研究,如精确的肿瘤成像和神经损伤保护手术,均旨在提高术中成像的精度[124,125]。
目前基于FMI技术的系统如图12所示。基于手术应用,这些系统可以分为开放式手术系统和内窥式FMI系统。而且不同类型的FMI系统在不同方面具有不同的优势。
《图12》

图 12. 术中激发荧光分子成像(FMI)系统。(a) Novadaq 公司的 SPY ™系统。(b) Artemis ™系统。 (c) Hamamatsu 公司的 Photodynamic Eye (PDE ™ ) 成像系统。(d) Fluoptics 的 Fluobeam® 系统。 (e) FLARE ™成像系统。(f) 多光谱 FMI 系统。(g) 光学分子影像手术导航系统 [126]。
《4.1. 用于开放手术的术中荧光分子系统》
4.1. 用于开放手术的术中荧光分子系统
多光谱术中FMI系统具有图像获取和处理的优势。FLARE™成像系统由哈佛大学医学院放射科Fran-gioni实验室研发(www.frangionilab.org)。该系统采用近红外通道和白光通道同时获取图像。三个CCD相机用户获取不同光谱下的图像:近红外通道1获取大于800nm的光,近红外通道2获取700~800nm的光,白光通道用于获取光谱范围在400~650nm的光。激发光设计分为两个部分:40000lux卤素灯的白光光源和LED近红外光源(670nm处为4mW·cm–2,760nm处为11mW·cm–2)。对于成像结果来说,不同的近红外光图像通过添加红色和绿色伪彩色,同时融合到白光图像上去,形成区分。为了达到实时成像的目的,FLARE和miniFLARE系统图像的帧率约为15fps。这个研究系统已经被应用到许多临床应用中,如肿瘤手术和前哨淋巴结成像等[115,127–130]。
由德国慕尼黑工业大学研发的多光谱FMI系统 (http://www.helmholtz-muenchen.de) 与FLARE系统类似,具有对激发光衰减进行图像处理的优势,并且已经应用到了人体卵巢癌手术中[106,131–134]。由中国科学院分子影像重点实验室研发的FMI系统 (http://www.3dmed.net/) 具有操作便捷的优势。为了保证从两个相机中获取到的图像进行快速和精准的融合,该系统利用特征点算法提高图像结果的精度[135]。该系统已经成功应用于临床乳腺癌前哨淋巴结活检和肝癌肿瘤探测中。
由于术中FMI系统旨在帮助外科医生进行精准手术,许多商业化产品都要考虑便捷性设计。Novadaq技术公司 (www.novadaq.com) 研发的SPY™系统是FDA认证的第一种FMI产品。该系统已经展示了其在血管搭桥手术中的应用。最近,SPY™系统利用荧光显像剂吲哚菁绿(ICG)在62例乳腺癌病例上实现了术中评估乳腺癌根治术效果[136]。Hamamatsu公司的Photodynamic Eye (PDE™)产品也通过了FDA认证,并用于临床应用中,包括乳腺癌前哨淋巴结探测[137,138]和肝肿瘤手术[139]。该手持式系统能够发出760nm的近红外光,并利用单CCD相机探测反射的荧光。但由于LED光能的限制,其图像质量还需进一步提高以更好地适应后续的术中应用。另一种手持式设备是Fluoptics公司 (www.fluoptics.com) 生产的Fluobeam®系统,与PDE™设备功能类似,也被应用到了临床试验中。此外,Artemis™系统能够同时显示荧光和白光的融合图像,并用于神经手术[140,141]。由于神经损伤会产生重大影响,神经保护是大多数手术中的一个重要问题。通过使用荧光探针,近红外荧光成像能够提供高分辨率、高灵敏度的实时成像结果,引导医生避免神经损伤[142,143]。
《4.2. 用于内窥手术的术中分子影像导航系统》
4.2. 用于内窥手术的术中分子影像导航系统
近年来,内窥镜和腹腔镜成像系统已经广泛应用于介入式微创手术中,并可以用于解决光学探测深度问题[144]。目前常用的商业内窥镜系统采用400~700nm的可见光光谱进行成像。因此,医生只能通过经验对病变组织和正常组织的细微差别和对比度实施手术操作。为了更灵敏地探测早期微小肿瘤,提高治疗效果,许多内窥技术如图像增强内窥镜技术、内窥显微技术和近红外荧光内窥技术被用于提高诊断精确性。由于近红外内窥技术在术中高信背比成像中的优势,目前一些研究将近红外内窥FMI系统设计用于术中图像引导手术。
对于一个全新的成像领域,如何设计高灵敏近红外内窥成像光路以同时获取白光和荧光图像限制了大多数荧光内窥系统的发展。一个可靠的近红外荧光内窥成像系统应该平衡灵敏性、采集效率、光耦合效率和激发光能量等因素。Glatz等使用光子倍增CCD(EMCCD)相机来增强探测的灵敏性,提高肿瘤组织和正常组织的对比度,并评估系统区分肿瘤边界的能力[145]。Venugopal等报道了通过设计一个独特的光学路径来同时获取彩色和近红外荧光图像。这个基于双CCD的内窥镜成像系统将白光和近红外荧光双光源相融合,实现了单手操作和实时术中成像的配准[146]。此外,前哨淋巴结实验的动物成像验证了该系统的可行性。
《图13》
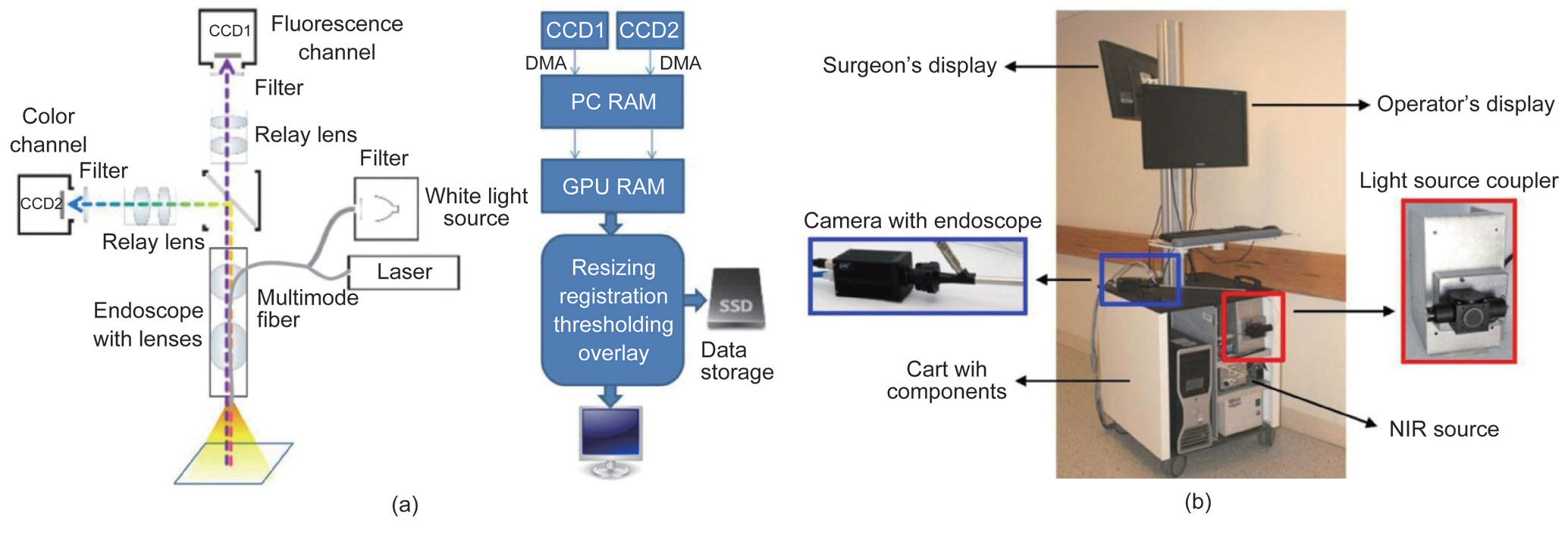
图 13. 内窥 FMI 系统。(a) 系统硬件及软件设计框图 [145]; (b) 临床使用的双通道内窥成像系统 [146]。
为了临床转化目的,Hide等[147]采用近红外内窥镜系统成像了复发性海绵窦皮样囊肿以确认颈内动脉的通畅。这个近红外内窥系统具有实时成像的优势,并且能够高信背比地成像病变组织。Plante等[148]报道了利用内窥FMI系统进行宫颈癌和子宫内膜癌前哨淋巴结探测。探测结果显示,在近红外FMI系统的帮助下,前哨淋巴结的探测能够达到96%的整体效率。Pan等[149]采用荧光成像系统、共聚焦显微内镜和蓝光膀胱镜,结合荧光标记的CD47抗体作为分子显像剂,用于精确诊断人体膀胱肿瘤。结果显示该方法可以实现82.9%的灵敏性和90.5%的特异性,提高了膀胱癌诊断和切除的彻底性。总体来说,采用FMI成像技术的术中手术导航系统能够扩展外科医生的“视野”范围,使他们能够精确区分病变与正常组织,对许多重要的生物和临床应用能够提高手术灵敏性和精确性,具有重要的应用价值[150]。
《5. 未来展望》
5. 未来展望
在过去的十年,越来越多的科研人员和临床医生认识到精准医学和个体化肿瘤治疗的关键在于从分子和细胞水平上对肿瘤生物学的基础性理解,因此在活体OMI及其临床转化领域投入巨大并取得了显著突破。也正是由于这种强烈动机,许多新的光学成像系统、算法、造影剂和报道分子被应用于肿瘤研究、新疗法研发和临床病人护理中。
光学多模成像已经将分子过程和事件的活体观测由粗略的平面定量方式推进到了三维定量技术上。光学分子探针的小动物全身分布,靶向特异性和药物代谢动力学,以及肿瘤细胞对治疗干预的反应,全都可以在一个未受损伤的宿主环境下被精确、动态地成像出来。重要的生物学信息,如肿瘤标志物表达、可用报道分子密度和淋巴结肿瘤负担等,这些在过去只能通过分析随机提取自活组织检查或肿瘤组织切除的组织标本而获得的信息,现在可以在活体上以前所未有的精准度和灵敏度实现定量化分析。
CLI为成像临床批准的放射性核素探针提供了一个全新的、基于光学技术的应用途径,并由此展现了许多优势。在多数激发荧光探针被限制在临床前应用的情况下,这一技术具有加速OMI临床转化的巨大潜力。将核素和光学成像这两种灵敏度最高的成像模态进行融合,可能打破现有早期肿瘤活体成像的灵敏度极限,并可能提供一个在更早阶段观察肿瘤发展的新方法。
OMI的临床转化比起初的预期要慢。这背后的原因很多也很复杂,但是其中最大的困难在于绝大多数光学分子探针的管制性障碍。然而,成像系统和成像策略已经以探索FDA批准的光学造影剂(如吲哚菁绿)在临床上的深层应用潜力为切入点,不断向前迈进。术中激发荧光图像引导的手术技术已经在临床试验中被广泛接受。这一技术在肿瘤边界划分和微小肿瘤病灶或残留的高灵敏检测上具有令人信服的精准度。OMI比治疗性药物的市场利润率要低的过时观念正在逐步发生改变。
随着OMI技术在近期的发展,我们有理由相信越来越多尚未验证的生物医学假说将会由更强大的成像技术来探索,在肿瘤学上新的重量级成果将会通过成像观测被发现。使用更精准和更灵敏的OMI技术已经让研究者们对癌症的分子过程和事件有了更深入和全面的理解,而这些理解很可能会继续激发OMI在下个十年的更快发展。这些新技术的临床转化会继续并加速。把这些新的光学成像技术应用于人类的医疗保健将从根本上改善肿瘤诊疗现状。在分子影像的时代中,光学技术在促进高精度和高灵敏度的肿瘤诊断和个体化治疗的发展方面具有巨大的前景,这也是精准医学的终极目标之一。
《Compliance with ethics guidelines 》
Compliance with ethics guidelines
Kun Wang, Chongwei Chi, Zhenhua Hu, Muhan Liu, Hui Hui, Wenting Shang, Dong Peng, Shuang Zhang, Jinzuo Ye, Haixiao Liu, and Jie Tian declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




